我国农田重金属污染日趋严重,原国土资源部于2015年6月发布的《中国耕地地球化学报告》调查表明,我国重金属污染或超标的耕地面积为759.1万hm2,占调查耕地面积的8.22%。耕地污染严重威胁农产品的安全,以“镉米”为代表的污染食品给人体健康、区域经济发展和社会稳定造成了巨大冲击。目前,污染水稻的重金属有铅(Pb)、镉(Cd)、汞(Hg)和铜(Cu)等,其中Pb和Cd是最主要的重金属污染物[1]。如何解决土壤重金属污染,尤其大面积的农田土壤重金属污染,是一个十分严峻且棘手的问题。植物修复具有成本低、来源广等特点,尤其适用于低浓度重金属污染土壤的修复[2]。在植物修复中,超富集植物如东南景天等经济价值较低,且种植推广困难。利用经济作物对重金属污染农田进行绿色修复,可以在收获经济作物的同时治理污染土壤,同时满足环境效益、经济效益和社会效益[3-5]。因此,种植非食用或非饲用的经济作物成为重金属污染地区产业结构调整的基本方向。
黄麻(Corchorus capsularis L.)为椴树科黄麻属一年生草本植物,在我国南方有广泛种植,具有生物量大、生长速度快等特点,其纤维具有较高的经济价值。研究表明,黄麻是一种潜在的修复土壤轻、中度Cd污染的植物材料[6]。黄麻的产品主要涉及韧皮纤维,不进入食物链,有一定的经济效益,是一种比较理想的重金属污染耕地修复作物。与其他重金属超富集植物相比,黄麻在重金属污染耕地修复中有以下优势:第一,农民种植黄麻的经验丰富,为实现重金属污染耕地边修复边利用的战略打下良好的技术基础;第二,经长期种植以及品种选育,黄麻对南方的高温、多雨天气和渍水稻田环境已基本适应;第三,黄麻对重金属有较强的耐受性,在一定程度的污染环境下,植株可以正常生长[7],同时,黄麻的生物产量很高,干物质最高产量在25 t·hm-2以上[8],是针叶木材的3~4倍,其CO2吸收率是森林的4倍[9];第四,黄麻制成的粉末对废水中的Cr、Cd、Pb、Ni和Cu等重金属具有很好的吸附性能,可在水体重金属污染修复领域发挥重要作用[10],是重金属植物修复后再利用的适宜材料。
研究发现,黄麻对Cd具有较强的富集和转运能力,高浓度的Cd胁迫(100 mg·kg-1)下,黄麻植株地上部Cd含量可达232.46 mg·kg-1[8]。黄麻植株中Cd的积累特性为根>叶(籽粒)>茎秆[11]。有机酸和EGTA等螯合剂可以促进黄麻光合色素的合成,进而增加黄麻的干物质积累[12]。然而,目前关于黄麻对重金属污染农田修复的研究多集中在盆栽试验,而针对重金属污染大田的试验研究较少。另外,目前对于黄麻植株中的各个器官,尤其是韧皮部的重金属积累状况尚不清楚。本研究采用3个在生产上大面积种植的黄麻品种,研究其在中度Cd污染农田中的生物量和Cd累积及Cd在其植株体内的富集和转移特征,为利用黄麻进行重金属污染农田的大面积修复及后续的安全再利用提供理论和实践基础。
1 材料与方法 1.1 试验设计试验选用生产上大面积使用的3个黄麻品种,分别为连红黄麻、闽侯红皮和黄麻179,所选材料均为本课题组保存。
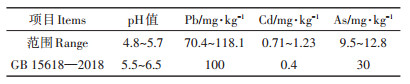
参试品种于2017年5月种植于湖南省株洲县渌口镇花园村重金属污染农田,播种前在试验区采用五点取样法取0~20 cm剖面土样进行Pb、Cd和As的测定,测定结果见表 1。根据2018年发布的《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)[13],确定该农田属于中度Cd污染农田。试验采用随机区组排列,3次重复,小区面积2 m×3 m,行距为0.4 m。播种量按照各品种的发芽率以40株·m2进行计算。田间栽培按照大田常规措施进行。
|
|
表 1 供试重金属污染农田的相关重金属元素含量 Table 1 Heavy metal concentrations in the tested paddy soil |
2017年10月收获,每小区随机选取10株均匀一致的植株,测定其株高、茎粗和皮厚。然后将6个植株器官(根部、韧皮部、木质部、叶柄、叶和蒴果)进行分离。其中根部用铡刀分离,用自来水冲洗至表面无泥土和杂质,然后再用去离子水反复冲洗3~5次,用吸水纸将样品表面水分吸干。韧皮部(麻皮)进行人工剥取,收集茎秆剥皮后的木质部(麻骨),叶柄和叶用剪刀分离,蒴果手工摘取。分离后的各器官分别放入纸袋中,于105 ℃烘箱中杀青30 min,75 ℃下烘干至恒质量,称质量后用不锈钢粉碎机粉碎备用。
土壤pH值测定:称取过100目筛的土样20 g,放入50 mL的烧杯中,加入去离子水20 mL,以玻棒搅拌1 min,使水土充分混合,静置30 min后用pHS-3C复合电极测定pH值。
土壤和植物样品中重金属元素测定:土壤样品风干后磨细过2 mm网筛备用。称取0.5 g土壤样品采用HCl-HNO3-HF·H2O-HClO4全消解的方法,用原子吸收分光光度计(Z2310,Hitachi,日本)进行Cd和Pb含量的测定。As含量的测定采用3HCl·HNO3消解,用原子吸收光谱仪(AFS-8230,Titan,中国)测定[14]。植物样品采用HNO3-HClO4消解,植物样品中的Cd元素采用石墨炉原子吸收分光光度法(Z2000,Hitachi,日本)测定。土壤样品和植物样品分别以GB/T 17141 —1997和GB/T 5009.15—2003为内标控制分析质量。
富集系数(Bioconcentration factor,BCF)是植物体内的重金属含量与土壤中相应重金属含量的比值,反映植物从土壤中吸收重金属的能力。其计算公式为:
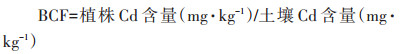
|
转移系数(Transportation factor,TF)是植物地上部重金属含量和植物地下部重金属含量的比值,反映植物吸收重金属后从根部转移到地上部的能力。其计算公式为:

|
本试验以黄麻植株地上部5个器官(韧皮部、木质部、叶柄、叶和蒴果)的干质量为权重计算植株地上部的Cd含量加权平均值,以此作为黄麻植株地上部的平均Cd含量,从而计算黄麻地上部的转移系数。器官间的转移系数计算公式为:

|
试验数据采用Microsoft Excel 2013进行处理,计算平均值和标准差,用IBM SPSS Statistics V 21.0数据处理软件进行统计分析,用Duncan法检验各处理平均值在0.05水平的差异性。
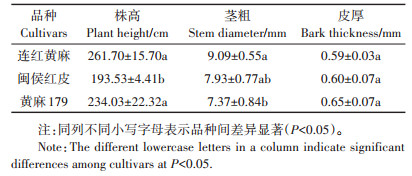
2 结果与分析 2.1 Cd污染农田中黄麻的农艺性状和生物量积累在Cd污染农田种植的3个黄麻品种中,连红黄麻的株高和茎粗最大,其株高显著大于闽侯红皮,茎粗显著大于黄麻179。3个黄麻品种的韧皮皮厚介于0.59~0.65 mm,三者间无显著差异(表 2)。
|
|
表 2 3个供试黄麻品种在Cd污染农田中的农艺表现 Table 2 Agronomic performance of the tested jute cultivars planting in Cd contaminated paddy soil |
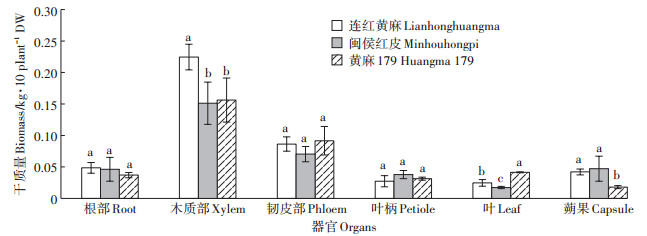
3个黄麻品种植株不同器官的生物量见图 1,木质部、叶和蒴果的生物量在3个黄麻品种间存在显著差异,其他器官的生物量积累在3个黄麻品种间均无显著差异。在6个不同的植株器官中,黄麻木质部的生物量最高,介于0.15~0.22 kg·10株-1,韧皮部次之,介于0.07~0.09 kg·10株-1,其他4个器官的生物量积累均在0.05 kg·10株-1以下。3个黄麻品种叶的生物量积累差异较大,其中黄麻179最高,为0.04 kg·10株-1,闽侯红皮最低,为0.02 kg·10株-1。
|
不同小写字母表示品种间差异显著(P<0.05) The different lowercase letters indicate significant differences among cultivars at P < 0.05 图 1 供试黄麻品种6个不同植株器官的生物量 Figure 1 Biomass of 6 plant organs in the tested jute cultivars |
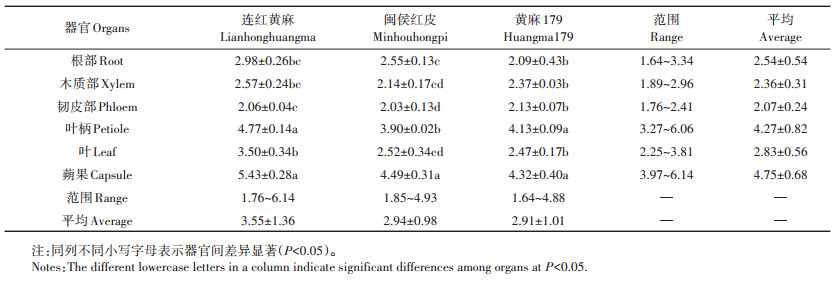
以品种为A因素,植株器官为B因素进行双因素随机区组设计方差分析。由表 3可知,3个黄麻品种间和6个植株器官间的Cd含量均呈极显著差异,而品种和器官的互作间差异不显著。
|
|
表 3 供试黄麻品种6个植株器官Cd含量的方差分析 Table 3 Variance analysis of Cd concentration in 6 plant organs of the tested jute cultivars |
6个植株器官的Cd含量测定结果见表 4。从不同的植株器官来看,3个品种的植株Cd含量均为蒴果和叶柄最高,且与其他器官的Cd含量差异显著。蒴果的Cd含量为3.97~6.14 mg·kg-1,平均为4.75 mg· kg-1,叶柄次之,介于3.27~6.06 mg·kg-1,平均为4.27 mg·kg-1。其他器官的Cd含量平均值从高到低依次为叶>根部>木质部>韧皮部。从不同的黄麻品种来看,连红黄麻的所有植株器官Cd含量平均值最高为3.55 mg·kg-1。
|
|
表 4 供试黄麻品种6个植株器官中的Cd含量(mg·kg-1) Table 4 Cd concentration in 6 plant organs of the test jute cultivars(mg·kg-1) |
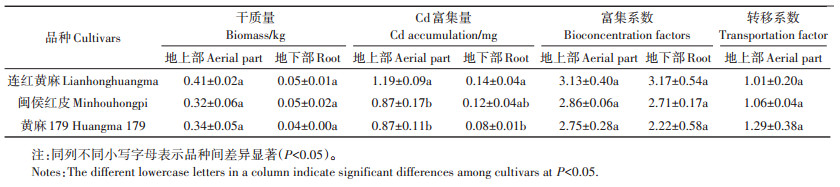
由表 5可知,3个黄麻品种地上部和地下部的干质量均无显著差异,地上部的干质量是地下部的6.4~ 8.5倍。连红黄麻的地上部和地下部Cd富集量在3个品种中均为最高,其中地上部Cd富集量显著大于闽侯红皮和黄麻179,地下部Cd富集量显著高于黄麻179。富集系数和转移系数在3个黄麻品种之间均无显著差异,其中连红黄麻地上部和地下部的富集系数最高,均在3以上。这3个黄麻品种的地上部转移系数均大于1,说明黄麻对重金属Cd有较好的转移能力。
|
|
表 5 供试黄麻品种对重金属Cd的富集和转移特征 Table 5 The characteristics of Cd accumulation and transportation of the test jute cultivars |
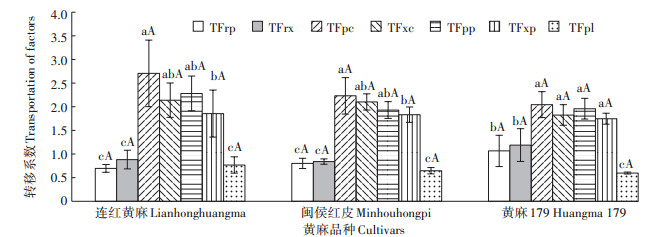
3个黄麻品种植株地上部器官间的转移系数见图 2。各器官的转移系数在黄麻品种间的差异均不显著,均为韧皮部/蒴果的转移系数最高,木质部/蒴果、韧皮部/叶柄和木质部/叶柄的转移系数次之,根部/韧皮部、根部/木质部和叶柄/叶的转移系数最小。说明Cd在黄麻植株中从木质部和韧皮部到叶柄和蒴果的转运能力较强,从根部到木质部和韧皮部以及从叶柄到叶的转运能力较弱。
|
不同小写字母表示器官间差异显著(P<0.05)。不同大写字母表示品种间差异显著(P<0.05)。TFrp表示根到韧皮部的转移系数;TFrx表示根到木质部的转移系数;TFpc表示韧皮部到蒴果的转移系数;TFxc表示木质部到蒴果的转移系数;TFpp表示韧皮部到叶柄的转移系数;TFxp表示木质部到叶柄的转移系数;TFpl表示叶柄到叶的转移系数 The different lowercase letters indicate significant differences among organs at P < 0.05.The different uppercase letters indicate significant differences among cultivars at P < 0.05.TFrp represents transportation factor of root to phloem; TFrx represents transportation factor of root to xylem; TFpc represents Transportation factor of phloem to capsule; TFxc represents transportation factor of xylem to capsule; TFpp represents transportation factor of phloem to petiole; TFxp represents transportation factor of xylem to petiole; TFpl represents transportation factor of petiole to leaf 图 2 供试黄麻品种6个不同植株器官对重金属Cd的转运特征 Figure 2 The characteristics of Cd transportation in six plant organs of the test jute cultivars |
根据黄麻植株不同器官干质量和Cd含量计算的黄麻品种每公顷重金属Cd提取量见图 3。3个黄麻品种的提取量为37.8~53.3 g·hm-2,其中连红黄麻的提取量显著高于闽侯红皮和黄麻179。在大面积的中度Cd污染农田植物修复应用中,连红黄麻可作为候选的作物进行替代种植。

|
不同小写字母表示品种间差异显著(P<0.05) The different lowercase letters indicate significant differences among cultivars at P < 0.05 图 3 供试黄麻品种种植于Cd重度污染农田中的Cd富集量 Figure 3 Assessment of Cd uptake of the test jute cultivars planting in Cd contaminate paddy soil |
从黄麻植株体6个器官的提取量来看,木质部提取的Cd最多,占植株提取Cd总量的33.11%~42.99%。连红黄麻和闽侯红皮的蒴果提取量仅次于木质部,分别占总提取量的17.06%和21.57%,根部、韧皮部和叶柄的提取量占比为9.28%~14.83%,叶的提取量最小,仅占这2个品种植株总提取量的6.46%和4.47%。而在黄麻179中,韧皮部占总提取量的20.28%,其他器官占比均在15%以下。
3 讨论研究结果表明,3种黄麻品种中6个植株器官的Cd含量存在显著差异,说明在黄麻植株中不同器官对重金属Cd的累积存在基因型差异,这与前人的研究结果一致[15]。在土壤植物修复中影响土壤重金属去除率的因素除了植株的重金属含量,还有植物的干物质积累量[16]。所以在使用黄麻进行大面积的农田土壤植物修复前应先对黄麻品种进行筛选,选出富集能力较高且生物量大的黄麻品种应用于生产实践中。
前人的研究发现在低浓度的Cd污染土壤中(0.5 mg·kg-1),黄麻植株体内Cd的分布规律为根>叶(籽粒)>茎秆[15]。在土壤螯合剂处理下植株体内Cd含量从大到小依次为叶>茎>根,Cd积累从根为主转变为以地上部为主[10]。在高浓度的Cd(100 mg·kg-1)胁迫下,黄麻各器官Cd含量表现为茎>根>叶,且在茎中表现为茎上部>茎中部>茎下部[7]。本研究检测了种植在中度Cd污染农田中的黄麻植株6个器官的Cd含量,发现其富集规律为蒴果≥叶柄>叶≥根部≥木质部≥韧皮部,蒴果和叶柄的Cd含量显著高于其他器官。对黄麻植株地上部器官Cd转运能力的研究发现,Cd从韧皮部和木质部到叶柄和蒴果的转运能力高于从根部到韧皮部和木质部的转运能力。前人关于重金属在植物体内分布的研究中发现,韧皮部是Cd从植物地下部到地上部转运的重要器官,也是Cd在籽粒和果实富集的基础[17]。韧皮部对重金属元素的转运尤为重要,在对低积累Cd水稻的研究中发现水稻籽粒中的Cd可能先经过木质部运输到韧皮部,再通过韧皮部转运到水稻籽粒中[18]。结合前人研究结果可推断,黄麻韧皮部的Cd富集和转运能力随基质中Cd含量的升高而逐渐增强。本研究在中度Cd污染农田中黄麻韧皮部的Cd含量在地上部器官中最小,介于1.76~2.41 mg·kg-1,说明韧皮部虽然对Cd的转运能力较强,但与其他器官相比其自身的Cd含量较低。黄麻属于韧皮纤维经济作物,其韧皮部的Cd含量直接影响到脱胶后纤维的Cd含量,如能在脱胶过程中增加重金属提取工艺流程,将脱胶液中的Cd元素去除并回收,则可实现黄麻修复后的安全再利用。
迄今为止,红麻、黄麻、工业大麻和亚麻等一年生韧皮纤维作物均被作为土壤植物修复的研究对象进行了修复潜力的研究和评估[15, 19-23]。针对黄麻的研究表明,在高浓度的Cd处理下,黄麻植株地上部Cd富集量最高可达3.83 mg·株-1,是一种潜在的土壤Cd污染修复材料。针对亚麻的研究表明,在中度Cd污染土壤中种植亚麻每公顷可清除最高50 g的Cd,工业大麻对Cd的富集量低于亚麻[22]。本研究通过对黄麻各个植株器官的干质量和Cd含量测定,再对其进行Cd的提取量统计,发现黄麻对Cd的提取量最高可达53.3 g·hm-2,其富集能力和亚麻相似。黄麻与亚麻相比更适应我国南方的气候和土壤条件,因此可以作为南方地区重金属污染土壤的植物修复材料加以利用。
朱凰榕等[24]在不同Cd污染程度的土壤中种植超富集植物东南景天(Sedum alfredii),发现在轻度Cd污染(0.53 mg·kg-1)土壤中,东南景天对Cd的提取量为40 g·hm-2,在中度Cd污染(1.55 mg·kg-1)土壤中,东南景天对Cd的提取量为341 g·hm-2。宋波等[25]在Cd含量为0.71 mg·kg-1的土壤中种植籽粒苋(Amaranthus hypochondriacus L.),发现其对Cd的提取量为13~ 39 g·hm-2。和这些超富集植物相比,黄麻对中度Cd污染土壤中的Cd提取量比东南景天低,连红黄麻的每公顷总提取量比籽粒苋高。在重度Cd污染土壤(25.6~29.7 mg·kg-1)中种植商陆(Phytolacca acinosa Roxb.),其植株Cd含量达到8.1~12.1 mg·kg-1[26]。本研究在中度Cd污染土壤中黄麻植株体内Cd含量最高为5.4 mg·kg-1,关于黄麻在重度Cd污染土壤中的提取潜力还有待于进一步研究。与上述超富集植物相比,黄麻的经济利用价值较高。本研究中,不同品种的黄麻木质部和韧皮部富集的Cd占植株总提取量的47%~59%,这为黄麻修复后的安全再利用创造了有利条件,如麻骨可以做污水处理的吸附剂,麻皮做工业建筑板材等。
4 结论(1)在中度Cd污染农田中种植不同品种的黄麻,其地上部对Cd的转移系数均大于1;Cd含量在品种间和植株器官间均表现出显著差异。
(2)在供试的3个黄麻品种中,连红黄麻的植株平均Cd含量和提取量均为最高,可以作为土壤修复的候选植物材料。
(3)在黄麻地上部的5个器官中,木质部和韧皮部对Cd的转运能力较高且干物质积累量最大,可以对其进行后续的安全再利用。
| [1] |
尚二萍, 许尔琪, 张红旗, 等. 中国粮食主产区耕地土壤重金属时空变化与污染源分析[J]. 环境科学, 2018, 39(10): 4670-4683. SHANG Er-ping, XU Er-qi, ZHANG Hong-qi, et al. Spatial-temporal trends and pollution source analysis for heavy metal contamination of cultivated soils in five major grain producing regions of China[J]. Environmental Science, 2018, 39(10): 4670-4683. |
| [2] |
Ali H, Khan E, Sajad M A. Phytoremediation of heavy metals:Concepts and applications[J]. Chemosphere, 2013, 91(7): 869-881. DOI:10.1016/j.chemosphere.2013.01.075 |
| [3] |
聂亚平, 王晓维, 万进荣, 等. 几种重金属(Pb、Zn、Cd、Cu)的超富集植物种类及增强植物修复措施研究进展[J]. 生态科学, 2016, 35(2): 174-182. NIE Ya-ping, WANG Xiao-wei, WAN Jin-rong, et al. Research progress on heavy metal(Pb, Zn, Cd, Cu)hyperaccumulating plants and strengthening measures of phytoremediation[J]. Ecological Science, 2016, 35(2): 174-182. |
| [4] |
刘伟, 张永波, 贾亚敏. 重金属污染农田植物修复及强化措施研究进展[J]. 环境工程, 2019, 37(5): 29-44. LIU Wei, ZHANG Yong-bo, JIA Ya-min. Reasearch progress of phytoremediation and strengthening measures for heavy metals contaminated farmland[J]. Environmental Engineering, 2019, 37(5): 29-44. |
| [5] |
王玉富, 郭媛, 汤清明, 等. 亚麻修复土壤重金属污染土壤的研究与应用[J]. 作物研究, 2015, 29(5): 443-447. WANG Yu-fu, GUO Yuan, TANG Qing-ming, et al. Study progress in flax remediation of soil contaminated by heavy metal and its application prospect[J]. Crop Research, 2015, 29(5): 443-447. |
| [6] |
董袁媛, 孙竹, 杨洋, 等. 镉胁迫对黄麻光合作用及镉积累的影响[J]. 核农学报, 2017, 31(8): 1640-1646. DONG Yuan-yuan, SUN Zhu, YANG Yang, et al. Effects of cadmium of photosynthesis and Cd accumulation of Corchorus capsularis L.[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(8): 1640-1646. |
| [7] |
孙竹.黄麻(Corchorus capsularis L.)对Cd的富集特征及生理响应研究[D].成都: 四川农业大学, 2015. SUN Zhu. Accumulation characteristics and physiological response of cadmium in Corchorus capsularis L.[D]. Chengdu: Sichuan Agricultural University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016052078.htm |
| [8] |
王玉富. 黄麻、红麻在重金属污染耕地修复中的应用研究进展[J]. 湖南农业科学, 2015(8): 49-52. WANG Yu-fu. Review of jute and kenaf application in remediation of arable lands contaminated by heavy metals[J]. Hunan Agricultural Science, 2015(8): 49-52. |
| [9] |
陶爱芬, 张晓琛, 祁建民. 红麻综合利用研究进展与产业化前景[J]. 中国麻业科学, 2007, 29(1): 1-5. TAO Ai-fen, ZHANG Xiao-chen, QI Jian-min. Research progress and industrialization prospect of comprehensive utilization on kenaf[J]. Plant Fiber Science in China, 2007, 29(1): 1-5. DOI:10.3969/j.issn.1671-3532.2007.01.001 |
| [10] |
李楠.长果黄麻对重金属Cr (Ⅵ)的生物吸附研究及高效专用种质筛选[D].北京: 中国农业科学院, 2014. LI Nan. Study on property and germplasm screening of efficient and special for heavy metal Cr(Ⅵ)biosorption of jute(Corchorus Olitorius L.)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326516.htm |
| [11] |
陈军.黄麻/红麻作物对土壤重金属的吸收和积累特性研究[D].南宁: 广西大学, 2013. CHEN Jun. Study on the absorption and accumulation characteristics of heavy metals by jute and kenaf[D]. Nanning: Guangxi University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10593-1013372627.htm |
| [12] |
夏涓文, 徐小逊, 卢欣, 等. EGTA与有机酸联合施用对黄麻修复Cd污染土壤的影响[J]. 农业环境科学学报, 2019, 38(2): 333-341. XIA Juan-wen, XÜ Xiao-xun, LU Xin, et al. Effect of combined application of EGTA and organic acid on remediation of Cd-contaminated soil by Corchorus capsularis L.[J]. Journal of Agro-Environment Science, 2019, 38(2): 333-341. |
| [13] |
中华人民共和国生态环境部.土壤环境质量农用地土壤污染风险管控标准(试行) GB 15618-2018[S].北京: 中国环境科学出版社, 2018. Ministry of Ecology and Environment of PRC. Soil environmental quality Risk control standard for soil contamination of agricultural land GB 15618-2018[S]. Beijing: China Environmental Science Press, 2018. |
| [14] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 1999. BAO Shi -dan. Soil and agricultural chemistry analysis[M]. Beijing: China Agriculture Press, 1999. |
| [15] |
陈军, 莫良玉, 阮莉, 等. 不同黄、红麻对土壤重金属的积累和分布特性研究[J]. 广东农业科学, 2012, 39(10): 25-28. CHEN Jun, MO Liang -yu, RUAN Li, et al. Study on the absorption and accumulation characteristics of heavy metals by different hemp and jute[J]. Guangdong Agricultural Sciences, 2012, 39(10): 25-28. DOI:10.3969/j.issn.1004-874X.2012.10.009 |
| [16] |
Sumiahadi A, Acar R. A review of phytoremediation technology: Heavy metals uptake by plants[C]. IOP Conference Series: Earth and Environmental Science, 2018. http://iopscience.iop.org/article/10.1088/1755-1315/142/1/012023
|
| [17] |
Page V, Feller U. Heavy metals in crop plants:Transport and redistribution processes on the whole plant level[J]. Agronomy, 2015, 5(3): 447-463. DOI:10.3390/agronomy5030447 |
| [18] |
Satoru I, Yasuhiro I, Masato I, et al. Ion-beam irradiation, gene identification, and marker-assisted breeding in the development of lowcadmium rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(47): 19166-19171. DOI:10.1073/pnas.1211132109 |
| [19] |
杨煜曦, 卢欢亮, 战树顺, 等. 利用红麻复垦多金属污染酸化土壤[J]. 应用生态学报, 2013, 24(3): 832-838. YANG Yu-xi, LU Huan-liang, ZHAN Shu-shun, et al. Using kenaf (Hibiscus cannabinus) to reclaim multi-metal contaminated acidic soil[J]. Chinese Journal of Applied Ecology, 2013, 24(3): 832-838. |
| [20] |
陈燕玫, 柏珺, 杨煜曦, 等. 植物根际促生菌辅助红麻修复铅污染土壤[J]. 农业环境科学学报, 2013, 32(11): 2159-2167. CHEN Yan-mei, BAI Jun, YANG Yu-xi, et al. Phytoremediation of Pb polluted soil by kenaf with assistance of plant growth promoting rhizobectrium(PGPR)[J]. Journal of Agro-Environment Science, 2013, 32(11): 2159-2167. DOI:10.11654/jaes.2013.11.009 |
| [21] |
Angelova V, Ivanova R, Delibaltova V, et al. Bio-accumulation and distribution of heavy metals in fiber crops(flax, cotton and hemp)[J]. Industrial Crops and Products, 2004, 19(3): 197-205. DOI:10.1016/j.indcrop.2003.10.001 |
| [22] |
Bjelková M, Genčurová V, Griga M. Accumulation of cadmium by flax and linseed cultivars in field-simulated conditions:A potential for phytoremediation of Cd-contaminated soils[J]. Industrial Crops and Products, 2011, 33(3): 761-774. DOI:10.1016/j.indcrop.2011.01.020 |
| [23] |
Griga M, Bjelková M. Flax(Linum usitatissimum L.)and hemp(Cannabis sativa L.)as fiber crops for phytoextraction of heavy metals: Biological, agro-technological and economical point of view[M]//Plantbased Remediation Processes. Berlin: Springer Berlin Heidelberg, 2013: 201-203.
|
| [24] |
朱凰榕, 周良华, 阳峰, 等. 两种景天修复Cd/Zn污染土壤效果的比较[J]. 生态环境学报, 2019, 28(2): 403-410. ZHU Huang-rong, ZHOU Liang-hua, YANG Feng, et al. Phytoremediation effects and contrast of Sedum alfredii and Sedum plumbizincicola on Cd/Zn contaminated soil[J]. Ecology and Environmental Sciences, 2019, 28(2): 403-410. |
| [25] |
宋波, 张云霞, 田美玲, 等. 应用籽粒苋修复镉污染农田土壤的潜力[J]. 环境工程学报, 2019, 13(7): 1711-1719. SONG Bo, ZHANG Yun-xia, TIAN Mei-ling, et al. Potential for cadmium contaminated farmland remediation with Amaranthus hypochondriacus L.[J]. Chinese Journal of Environmental Engineering, 2019, 13(7): 1711-1719. |
| [26] |
McBride M B, Zhou Y. Cadmium and zinc bioaccumulation by Phytolacca americana from hydroponic media and contaminated soils[J]. International Journal of Phytoremediation. DOI:10.1080/15226514.2019.1612849 |
 2019, Vol. 38
2019, Vol. 38