2. 中国农业科学院农业环境与可持续发展研究所, 北京 100081
2. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences, Beijing 100081, China
金属铬(Chromium)被人类开发利用多年,其化合物分为有益的和有害的,其中铬(Ⅲ)是哺乳类动物必需的微量元素[1],铬的开采和冶炼及铬盐的制造和电镀、金属加工、制革、油漆、颜料、印染等行业排出的废水中含有大量的铬(Ⅵ),火山喷发和岩石的风化等自然活动也会造成铬的排放,因此水体及土壤环境中铬长期存在,导致严重的环境污染,并影响人类健康[2-4]。含铬(Ⅵ)污水通常采用的净化技术包括沉淀法、膜过滤法、胺溶剂萃取法、离子交换法、吸附法、电沉积法和其他各种生物工艺[2-4],净化方法的选择要依据污水的特性和其他经济社会因素,包括污水中铬(Ⅵ)的浓度,污水的pH、温度、流速、BOD,污水排放标准等[3]。在众多方法中,相对经济和方便的吸附法大量应用于化学和加工工业污水的处理[2-4],生物(活性)炭吸附法是其中较经济的处理技术,尤其是吸附低浓度污染物[3]。生物(活性)炭具有多孔性结构、较大比表面积、可变灵敏的界面特性等特点,其被广泛应用于水体污染物去除[5-7]和用作催化剂及其载体[7-8]。
我国每年的农业生产活动都产生大量的农作物秸秆,可见,开发高效利用农作物秸秆的新途径是生态文明建设和绿色发展的必然举措。近年来,利用碳元素含量高及无机物含量低的低成本原材料热裂解制备生物炭受到了广泛关注[7],生成的生物炭大量地应用于农业和环境试验研究[9]。但由秸秆直接热裂解形成的秸秆炭对阴离子的吸附能力很小[10],因其表面含有大量的负电荷[11],水体中易与阴离子产生静电互斥。
有研究表明,氧化铁对磷酸根和砷酸根等含氧阴离子具有高亲和力和选择吸附性[12-14],但粉末状的氧化铁水体中不易分离[14]。为发挥氧化铁的吸附作用,众多研究将其引入吸附剂的孔隙中[10, 12, 14-16],既提高了吸附剂吸附能力也易于分离。将氧化铁引入秸秆炭的孔隙中后,改性秸秆炭对阴离子的吸附性能增强[10],其磷(PO43--P)吸附能力显著高于原状秸秆炭。而含有铬(Ⅵ)的重铬酸根离子(Cr2O72-)作为一种含氧阴离子,是危险的水体无机污染物。是否也能通过引入氧化铁,增强秸秆炭对铬(Ⅵ)的吸附能力,还需要进一步研究。因此,本研究的目的是应用FeCl3溶液制备改性秸秆炭,以增强秸秆炭的吸附铬(Ⅵ)性能,并获得铬吸附能力最强时的改性炭制备条件(秸秆炭化温度和铁添加量)。
响应面实验方法(Response surface methodology)集合了数学与统计学原理,是用来对受多个独立变量影响的问题(响应值)进行建模和分析,并确定回归模型方程和最优工艺条件,其是在多元线性回归的基础上主动收集并获得较好回归性质的一种实验设计方法[17-19],其能利用较少的实验次数确定最优工艺条件,因此该方法能减少化学试剂、能源等的使用[18]。鉴于响应面实验方法的应用便利性,在改性炭制备过程中,应用该实验方法,获得了对铬(Ⅵ)吸附性能最强时的改性炭制备条件,将此时制备的改性炭(以最优改性炭表示)用于水体中铬(Ⅵ)的吸附去除,为作物秸秆高效利用提供新途径。
1 材料与方法 1.1 改性炭制备方法将自然干燥、纯净的小麦秸秆截成1 cm左右小段,置于加盖瓷坩埚中,放入电阻炉中,升温(50 ℃· min-1)至预定温度保持100 min,之后关闭电阻炉加热程序,降温(20 ℃·min-1)至100 ℃以下拿出,粉碎取 < 1 mm的秸秆炭备用,标记为WB(Wheat straw biochar);而后采用文献[10, 20]所介绍的方法制备改性炭:将WB加入到FeCl3溶液中,搅拌混合均匀,调节溶液pH=7,静置1 h后过滤数次,最后于烘箱中75 ℃干燥,即得改性炭。
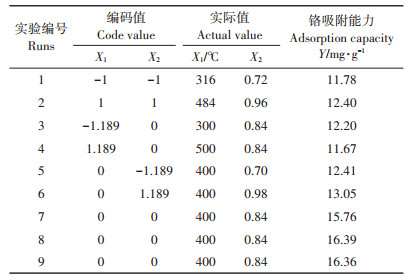
1.2 改性炭吸附性能优化根据SAS 9.2数据分析系统,采用Small Composite Hartley Method实验方法。设置炭化温度和铁(Fe3+)与炭质量比两个因素,设计二因素五水平响应面实验,共9个试验,其中6个为析因试验,3个为中心点试验,用以估计实验误差和再现性[19],并以改性炭对铬的吸附量为响应值。
首先利用单因素实验,即炭化温度和铁炭质量比对吸附量的影响,以确定因素的水平值。在质量比为0.45时,炭化温度为300、400、500、600 ℃和700 ℃;炭化温度为400 ℃,质量比为0、0.14、0.45、0.70、0.84、0.98。选择对铬吸附量大的实验点为中心点水平值,通过等式(1)计算铬吸附量。
最终得到吸附性能优化的改性炭记为BF-Cr,同温度下的秸秆炭,记为WB-Cr。
1.3 两种秸秆炭(BF-Cr和WB-Cr)的表征(1)全水分、灰分、挥发分及固定碳含量测定。将样品放入预热至102~105 ℃烘箱中2 h,取出于干燥器内冷却至室温称量,全水分含量W(%)为干燥前后样品质量差占样品质量的百分数;将样品置于已在800 ℃下烧至恒质量的无盖瓷坩埚内,送入电阻炉中800 ℃下灼烧2 h,取出空气中冷却5 min,于干燥器内冷却至室温称质量,灰分含量A(%)为灼烧残留物占样品质量的百分数;将样品置于已在850 ℃下烧至恒质量的瓷坩埚内,加盖送入温度预热至850 ℃的高温电阻炉内,立即封闭炉门,继续7 min(3 min内炉温恢复至850 ℃),取出空气中冷却5 min,放入干燥器内冷却至室温称质量,挥发分含量V(%)为加热前后样品的质量差占样品质量的百分数;固定碳含量(%)= 100-W-A-V。
(2)元素C、H、O、N含量通过元素分析仪测定(Elementar analysensysteme GmbH,Hanau,Germany);元素Fe含量采用邻菲罗啉比色法测定,波长为530 nm。
(3)BET比表面积及孔径分布采用全自动物理化学吸附仪测定分析(TriStar II 3020,Micromeritics,USA)。
(4)采用Hitachi S-4800(Hitachi,Japan)扫描电镜(SEM)来观察表面形态。
(5)红外光谱图利用FTIR光谱仪(VERTEX 70 Bruker,Germany)扫描定性。
(6)采用AXS D8 Focus型X射线衍射仪(Bruker AXS Inc.,Madison,USA)分析晶型结构。
1.4 最优改性炭(BF-Cr)吸附性能 1.4.1 铬吸附量的计算改性炭0.1 g加入到体积为30 mL的K2Cr2O7溶液中,溶液pH=5,室温下(25±2 ℃)振荡3 h后过滤,采用二苯碳酰二肼比色法测定溶液剩余铬浓度,波长为540 nm,重复3次。通过下式计算吸附量(以纯铬计,下同):
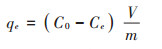
|
(1) |
式中:qe为铬吸附量,mg·g-1;C0为初始浓度,mg·L-1;Ce为吸附平衡时浓度,mg·L-1;V为溶液体积,L;m为炭用量,g。
1.4.2 不同条件下BF-Cr对铬的吸附性能不同条件下,BF-Cr对铬的吸附能力通过公式(1)计算。
调节初始溶液铬浓度分别为40、50、70、100、120、150、170 mg·L-1和200 mg·L-1,测定初始铬浓度不同时,BF-Cr对铬的吸附能力;
铬浓度为70 mg·L-1的K2Cr2O7溶液中,分别在混合振荡10、25、50、100、150、180、220 min和260 min后,测定BF-Cr铬吸附能力随时间的变化;
铬浓度为70 mg·L-1的K2Cr2O7溶液中,首先应用HCl或NaOH溶液调节初始pH为3~11,随后加入BF-Cr,混合振荡测定其不同溶液pH下的铬吸附能力;
铬浓度为100 mg·L-1的K2Cr2O7溶液中,BF-Cr炭添加量为0.03~0.5 g,测定BF-Cr铬吸附能力随炭添加量增加的变化,并计算铬去除率。
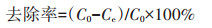
|
利用Langmuir和Freundlich吸附方程,即公式(2)和(3)来拟合不同铬浓度时BF-Cr吸附量数据。
Langmuir吸附方程[21]的直线形式为:
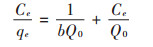
|
(2) |
式中:b为吸附平衡常数,L·mg-1;Q0为Langmuir理论最大吸附量,mg·g-1。
Freundlich吸附方程[21]的直线形式为:
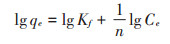
|
(3) |
式中,Kf和n是Freundlich常数,代表吸附剂的吸附能力和吸附强度。
1.4.4 动力学方程采用动力学方程拟合不同吸附时间时BF-Cr吸附量数据,研究吸附过程中的控制机制。主要有:
准一级动力学(Pseudo First-Order)方程[21],其直线形式为:
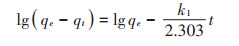
|
(4) |
式中:qe和qt为在平衡时刻和t时刻吸附剂的吸附量,mg·g-1;k1为准一级模型的吸附平衡速率常数,min-1;t为反应时间,min;初始吸附速率h01=k1qe[22]。
准二级动力学(Pseudo Second-order)方程[21],其直线形式为:
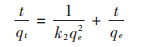
|
(5) |
其中,k2为准二级模型的吸附平衡速率常数,g·mg-1· min-1;初始吸附速率h02=k2qe2[22]。
颗粒内扩散(Intra-particle diffusion)方程[21],其直线形式为:
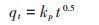
|
(6) |
式中:kp为颗粒内扩散速率常数,mg·g-1·min-0.5;t为反应时间,min。
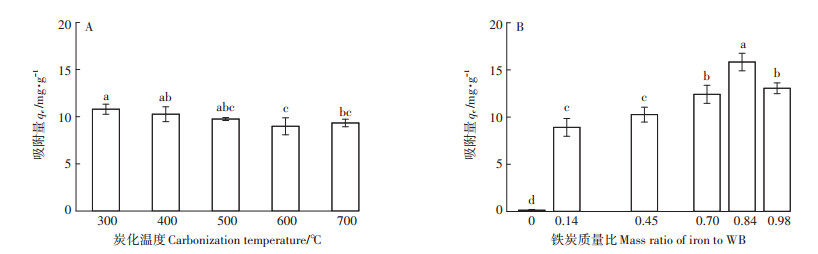
2 结果与讨论 2.1 改性炭的吸附性能优化 2.1.1 炭化温度及质量比对铬吸附能力的影响随炭化温度的升高,改性炭吸附量先显著下降后少量增加(图 1A),300 ℃及400 ℃时的吸附量显著大于600 ℃时(P < 0.05),300、400 ℃及500 ℃间无显著差异。有研究表明生物质所含半纤维素、纤维素及木质素在300~400 ℃左右开始分解,500 ℃以上生物炭结构稳定[23-24],且比表面积和微孔体积等随之增加,孔隙结构发育完全。氧化铁填充堵塞了一部分改性炭的孔隙,造成改性炭孔径体积的减小,导致吸附量先下降;当炭化温度为700 ℃时的吸附量又有所增加,可能是此时发育完全的孔隙足以抵消氧化铁的堵塞作用。
|
不同小写字母表示处理间差异显著(LSD P < 0.05) The different lowercase letters indicate significant difference among treatments(LSD P < 0.05) 图 1 炭化温度(A)和铁炭质量比(B)对改性炭吸附铬的影响 Figure 1 Effect of carbonization temperature(A)and massratio of iron to WB(B)on chromium adsorption capacity of modified biochars |
随质量比的增大,吸附量先增大后减小,在质量比为0.84时吸附量最大(图 1B),显著大于其他质量比条件下的吸附量(P < 0.05)。当氧化铁引入更多时,改性炭吸附量反而随之下降,可能是大量氧化铁堵塞改性炭的孔隙,导致吸附量减小。
2.1.2 最优改性炭制备条件的确定由图 1可知,在温度300、400、500 ℃和质量比0.84时的改性炭铬吸附能力显著大于其他条件下,为寻求最优制备条件,选择温度400 ℃和质量比0.84为中心点水平值,设计二因素五水平响应面实验,以温度(X1)、质量比(X2)为因素,响应值(Y)为改性炭铬吸附量,实验因素水平的编码值和实际值,以及实验设计的结果见表 1。可以看出,在初始溶液铬浓度为50 mg·L-1时,改性炭吸附能力在11.67~16.39 mg·g-1之间。
|
|
表 1 实验设计和结果 Table 1 The experiment design and results |
运用SAS9.2软件的响应面回归过程对表 1进行数据分析,建立二次回归模型,拟合的二元二次方程为:
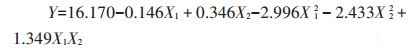
|
(7) |
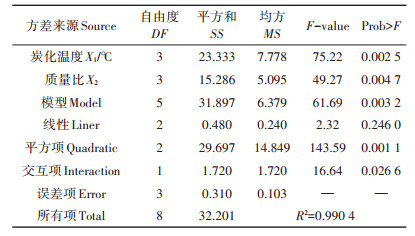
表 2列出了该回归模型方差分析的结果。回归模型P=0.003 2,极显著;同时模型R2=0.990 4,表明方程与实际情况拟合很好,可用该模型分析和预测改性炭的制备条件。
|
|
表 2 回归模型方差分析结果 Table 2 Analysis of variance for regression model |
图 2为改性炭吸附铬实验的响应面图。可以看出,图中存在极大值点。根据回归分析,该极大值点的编码值:X1为-0.007 427;X2为0.057 805,预测最大值为16.18,即炭化温度400 ℃,铁炭质量比0.85,预测最大铬吸附量为16.18 mg·g-1。经过实验验证,BF-Cr的铬吸附量为(15.83±0.93)mg·g-1,远大于WB-Cr的吸附量(0.13±0.08)mg·g-1,且与预测值吻合,其产率(最终样品量占秸秆量的百分数)为110.70%,大于同温度下WB的产率(40.11%),说明本实验所确定的实验方案设计合理,有较好的应用性。
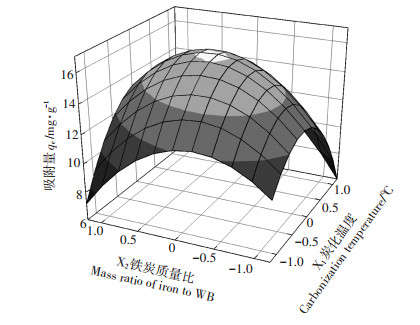
|
图 2 改性炭吸附铬实验的响应面 Figure 2 Response surface plot of the chromium adsorption capacity of BF-Cr |
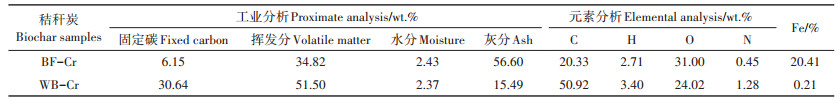
BF-Cr中Fe和O元素含量都大于WB-Cr的含量,说明在BF-Cr中存在大量的铁氧化物,而且其灰分含量增多(表 3)。正是该铁氧化物的存在,导致BF-Cr对铬的吸附量大于WB-Cr。
|
|
表 3 BF-Cr和WB的工业分析与元素分析 Table 3 Proximate and elemental analysis of BF-Cr and WB |
BF-Cr和WB-Cr对N2吸附-解吸等温线及孔径大小分布如图 3所示。根据IUPAC,BF-Cr的吸附等温线类型介于Ⅰ与Ⅳ型之间,且其中有一条属于E类回线(H2类型)的脱附滞后,反映BF-Cr中含有大量的“墨水瓶”形状的孔隙[25]。
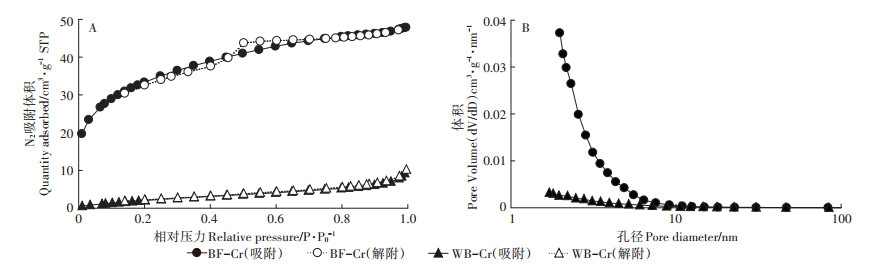
|
图 3 BF-Cr和WB-Cr对N2吸附-解吸等温线(A)及孔径大小分布(B) Figure 3 N2 adsorption and desorption isotherms(A)and pore size distribution (B)of BF-Cr and WB-Cr |
由图 3可知,BF-Cr对N2吸附量以及孔径体积都大于WB-Cr,且其BET比表面积(119.80 m2·g-1)也远大于WB-Cr的BET比表面积(9.47 m2·g-1)。该结果说明秸秆炭经改性后形成更多更完全的孔隙结构,吸附性能得到提升,这也导致溶液中BF-Cr对铬的吸附量大于WB-Cr(图 2和图 1)。
改性后,BF-Cr孔径体积和BET比表面积增大,而Yu等[15]利用Mn(NO3)2和Fe(NO3)3溶液改性颗粒活性炭,改性后其比表面积减小,结果不同的主要原因是本文中最优改性炭的炭化温度为400 ℃,未改性前其孔隙结构发育不完全[23-24],经改性后,其形成更多孔隙结构,导致孔径体积和比表面积增大,而文献[15]中的活性炭孔隙由于氧化锰(铁)的填充堵塞,造成比表面积减小。虽然孔径体积和比表面积的表现各不相同,但吸附剂改性后的吸附性能显著增强。
2.2.3 电镜(SEM)分析WB-Cr表面比较光滑(图 4A),而BF-Cr表面较粗糙,含有一些附着物(图 4B),说明经FeCl3溶液改性后,铁氧化物沉淀在BF-Cr的表面或孔隙中,这与元素分析结果一致。造成BF-Cr孔径体积的增大,该结果导致BF-Cr对N2吸附-解吸等温线介于Ⅰ与Ⅳ型之间。

|
图 4 WB-Cr(A)和BF-Cr(B)的扫描电镜图(×2000倍) Figure 4 SEM images of WB-Cr (A)and BF-Cr (B) (×2000 times) |
两种秸秆炭的红外光谱图形如图 5所示。在波数为3400 cm-1附近的为羟基基团[22],波数为1600 cm-1附近为羰基基团的伸缩振动。波数1100 cm-1附近为C-OH的伸缩振动和-OH的弯曲振动。
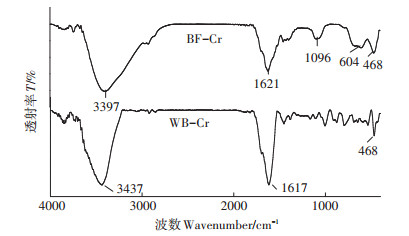
|
图 5 两种秸秆炭的红外光谱图 Figure 5 FTIR spectra of WB-Cr and BF-Cr |
两种炭在波数468 cm-1下有吸收峰,该波数下为Si-O基团的弯曲振动[26-27],也为BF-Cr中的Fe-O伸缩振动,其是赤铁矿(α-Fe2O3)的特征峰[28]。另外,BF-Cr在波数为604 cm-1下出现吸收峰,该吸收峰是Fe-O基团的弯曲振动[29-30],其是磁赤铁矿(γ-Fe2O3)的特征峰[29]。该结果说明BF-Cr含有大量的氧化铁。
2.2.5 X-射线衍射(XRD)分析两种秸秆炭的XRD图形如图 6所示。WB-Cr的XRD衍射图出现数个衍射峰,2θ分别为28.61°、40.58°、50.45°、66.62°等,主要是硅、钙、钠元素的化合物,这是由于秸秆在炭化前未清洗,导致炭化后WBCr中仍然含有少量硅、钙、钠等元素的化合物。BFCr的XRD衍射图在2θ=33.18°和62.87°处出现赤铁矿成分(Fe2O3)的衍射峰,在2θ=35°附近出现的衍射峰,说明BF-Cr中存在针铁矿(β-FeOOH,2θ=35.20°)、磁铁矿(Fe3O4,2θ =35.45°)和磁赤铁矿(γ-Fe2O3,2θ= 35.68°)成分[31-32]。由于氯离子和水分子间的相互作用,三氯化铁溶液易形成针铁矿(β-FeOOH)[33],进而部分脱水变成氧化铁。
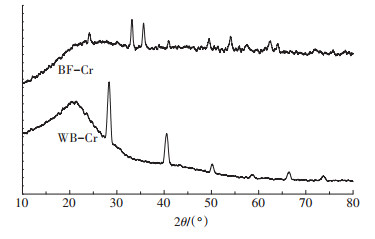
|
图 6 两种秸秆炭的X-射线衍射图 Figure 6 XRD pattern of WB-Cr and BF-Cr |
随着初始浓度C0的增大,BF-Cr对铬吸附量随之快速增大(图 7A);C0较低时,吸附量迅速上升,C0继续增大,吸附量增加幅度减小;当C0为150~200 mg·L-1范围时,铬吸附量在30 mg·g-1上下,达到吸附饱和。
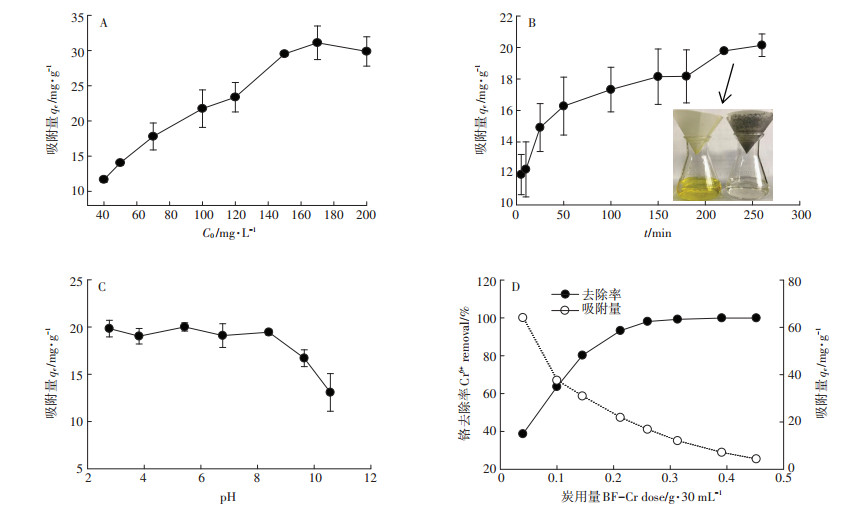
|
图 7 初始铬浓度(A)、吸附时间(B)、pH(C)和炭用量(D)对BF-Cr铬吸附能力的影响 Figure 7 Effect of initial concentration(A), contact time (B), pH (C)and BF-Cr dose (D)on the chromium adsorption capacity of BF-Cr |
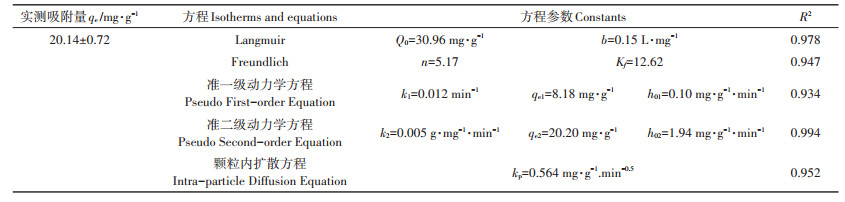
通过等式(2)和(3)拟合图 7A实验数据,Langmuir和Freundlich方程吸附等温线如图 8所示,参数由表 4列出。BF-Cr吸附铬的Langmuir方程R2大于Freundlich方程,因此Langmuir方程对吸附铬实验的拟合性更好。通过Langmuir吸附方程可以得出BFCr对铬的理论最大吸附量Q0为30.96 mg·g-1。
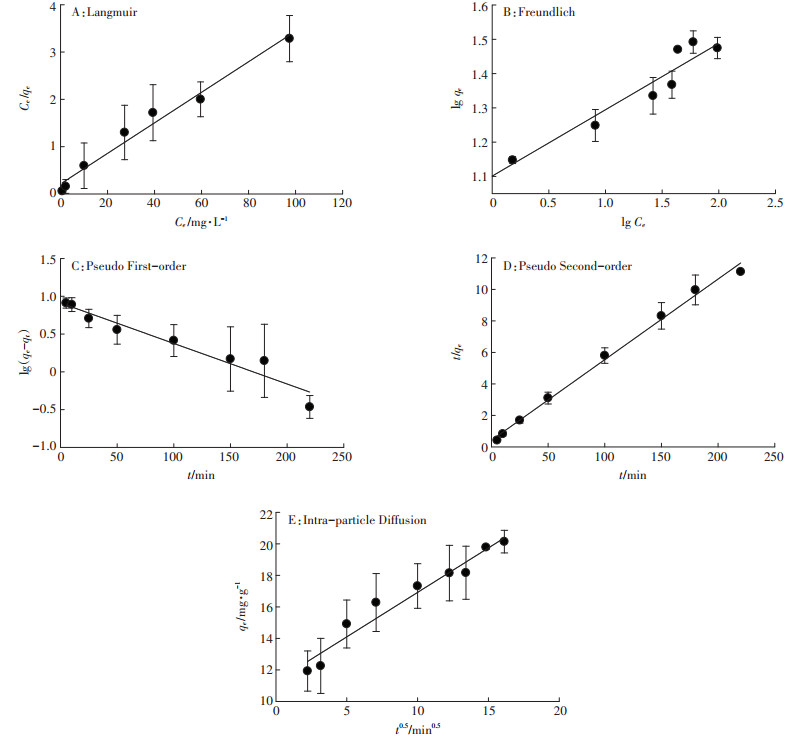
|
图 8 BF-Cr吸附铬的等温线和动力学方程曲线 Figure 8 The isotherms and kinetic equations for chromium adsorption by BF-Cr |
|
|
表 4 BF-Cr吸附铬的方程参数 Table 4 Constants of isotherms and kinetic equations for chromium adsorption by BF-Cr |
随着吸附时间的延长,BF-Cr对铬的吸附量逐渐增加,呈直线快速增长,逐渐趋向稳定,最终吸附达到平衡(图 7B)。主要由于初始时改性炭表面有大量的吸附位,但随着吸附的进行,吸附位减少,导致吸附量增长缓慢,达到平衡。通过公式(4)、(5)和(6)拟合图 7B实验数据,方程曲线如图 8所示,参数由表 4列出。
BF-Cr吸附铬的准二级动力学平衡吸附量估算值与实验值非常接近,并且准二级动力学模型的相关系数R2值大于准一级动力学方程的R2值,表明BF-Cr吸附铬反应符合准二级动力学模型,该吸附过程倾向化学吸附[34];并且初始吸附速率h02大于初始吸附速率h01(表 4)。BF-Cr吸附铬的颗粒内扩散线性方程没有过原点,并且曲线有一个拐点(图 8E),因此吸附过程分为吸附剂周围流体界膜中吸附质的迁移(外扩散)过程和颗粒内扩散过程为速率控制步骤[21]的平缓吸附过程。
2.3.3 溶液pH的影响在重铬酸钾溶液中,当溶液pH < 6.5条件下,铬主要以重铬酸根(Cr2O72-)形式存在;而pH>6.5条件下则以铬酸根(CrO42-)形式存在[1]。BF-Cr随溶液pH的增大,其对铬的吸附量随之减小(图 7C),该结果说明BF-Cr易于吸附重铬酸根离子,也由于溶液pH值影响BF-Cr表面电荷,在pH值较低时,H+离子使吸附剂表面的负电荷基团减少,正电荷基团增多[35],导致铬吸附量大于pH值较高时。
2.3.4 BF-Cr用量的影响BF-Cr添加量不同,对溶液中的铬去除率不同,此时吸附量也不同(图 7D);随着用量的增加,铬的去除率逐渐增大,最终去除率为99%以上,而此时吸附量逐渐减小。
2.3.5 BF-Cr吸附铬(Ⅵ)的作用方式铁氧化物被称为“活性”氧化铁,是最活跃的铁的形态,尤其是在土壤中[36]。自然界中存在的多种氧化铁能通过铁盐在实验室内制备,包括赤铁矿、针铁矿等,但由于制备条件不同,产品的结构、比表面积等也不同[33]。本文利用FeCl3溶液将氧化铁引入秸秆炭孔隙中,导致表面比较粗糙,改性炭孔隙中的氧化铁有针铁矿、赤铁矿和磁铁矿成分。
溶液中Fe3+易形成八面体复合物并发生水解作用(反应式8),因此改性炭BF-Cr溶液中易形成类似复合物,也发生类似水解反应(反应式9),其中C-Fe为BF-Cr中炭与氧化铁间的表面络合物[10]。
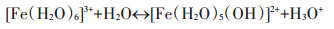
|
(8) |
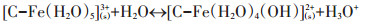
|
(9) |
因此,改性炭BF-Cr可能通过以下两种作用方式,对溶液中铬(Ⅵ)达到吸附去除的效果。第一种方式是通过形成内层配合物,将铬(Ⅵ)固定在改性炭表面,反应式如10~12,该种方式占主导地位。
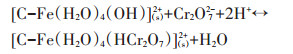
|
(10) |
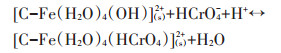
|
(11) |
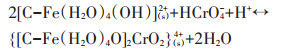
|
(12) |
第二种方式是通过静电引力的作用形成外层配合物,反应式如13~16式。

|
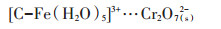
|
(13) |
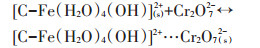
|
(14) |
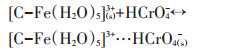
|
(15) |
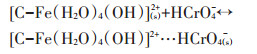
|
(16) |
改性炭BF-Cr的吸附能力高于未改性秸秆炭,铬(Ⅵ)去除率达到99%以上。这与前人研究一致:在最佳的浓度、温度、用量、pH值等条件下,ZnCl2溶液活化制备的花生壳活性炭和甘蔗渣活性炭对水体中铬(Ⅵ)的去除率分别达到99%和87%以上[2, 4];利用FeCl3溶液改性后的泥炭对铬(Ⅵ)的去除率也大于未改性泥炭(从小于3%提高至25%)[37]。有研究表明:应用罗望子木[3]、秸秆[38]、柳条[38]、桉树锯末[39]等原材料制备的生物(活性)炭吸附去除水体中的铬(Ⅵ)时,Langmuir方程对吸附实验的拟合性好于Freundlich方程,最大吸附量分别为28.02、24.60、23.60 mg· g-1和13.15 mg·g-1。Ouma等[40]制备的氧化铁松果粉末复合材料对铬(Ⅵ)的Langmuir最大吸附量为18.42 mg·g-1。Rajput等[41]的研究表明,自制的磁铁矿(Fe3O4)对铬(Ⅵ)的Langmuir最大吸附量为34.87 mg· g-1。本文中BF-Cr对铬(Ⅵ)的Langmuir最大吸附量达到30.96 mg·g-1。可见,BF-Cr的吸附量高于生物(活性)炭的吸附量,较氧化铁的吸附量低,但其成本较低,且应用更便利,水体中也易分离。因此,BF-Cr可用于水体中铬(Ⅵ)的吸附去除,这也为高效利用作物秸秆提供新途径。
3 结论(1)应用FeCl3溶液改性秸秆炭后,其吸附铬(Ⅵ)性能显著增强,并通过响应面实验方法确定了吸附能力最强时的制备条件,即炭化温度400 ℃和铁(Fe3+)与炭质量比为0.85。
(2)最优改性炭中Fe元素含量(20.41%)、孔径体积和BET比表面积(119.80 m2·g-1)都大于未改性秸秆炭;其对N2的吸附等温线类型介于Ⅰ与Ⅳ型之间,且存在属于E类回线(H2类型)的脱附滞后,表明其含有大量“墨水瓶”形状的孔隙,该孔隙中含有多种氧化铁成分。
(3)最优改性炭对铬(Ⅵ)的Langmuir最大吸附量为30.96 mg·g-1;吸附过程符合准二级动力学模型;随溶液pH的增大,吸附量随之减小;随炭用量的增加,溶液中铬(Ⅵ)去除率最终为99%以上,可用于水体中铬(Ⅵ)的吸附去除。
| [1] |
Mohan D, Pittman J C U. Activated carbons and low cost adsorbents for remediation of tri-and hexavalent chromium from water[J]. Journal of Hazardous Materials, 2006, 137(2): 762-811. DOI:10.1016/j.jhazmat.2006.06.060 |
| [2] |
王恩萱. 花生壳活性炭对六价铬的吸附[J]. 环境科学导刊, 2010, 29(A01): 67-71. WANG En-xuan. Adsorption of chromium(Ⅵ)by peanut shell activated carbon[J]. Environmental Science Survey, 2010, 29(A01): 67-71. |
| [3] |
Acharya J, Sahu J N, Sahoo B K, et al. Removal of chromium(Ⅵ)from wastewater by activated carbon developed from Tamarind wood activated with zinc chloride[J]. Chemical Engineering Journal, 2009, 150(1): 25-39. DOI:10.1016/j.cej.2008.11.035 |
| [4] |
Cronje K J, Chetty K, Carsky M, et al. Optimization of chromium(Ⅵ) sorption potential using developed activated carbon from sugarcane bagasse with chemical activation by zinc chloride[J]. Desalination, 2011, 275(1): 276-284. |
| [5] |
缪清清, 韩永和, 钱庆荣. 植物源活性炭的制备及其应用研究进展[J]. 应用化工, 2013, 41(12): 2156-2159. MIAO Qing-qing, HAN Yong-he, QIAN Qing-rong. Research process in preparation and application of plant-based activated carbon[J]. Applied Chemical Industry, 2013, 41(12): 2156-2159. |
| [6] |
Dias J M, Alvim-Ferraz M, Almeida M F, et al. Waste materials for activated carbon preparation and its use in aqueous-phase treatment:A review[J]. Journal of Environmental Management, 2007, 85(4): 833-846. DOI:10.1016/j.jenvman.2007.07.031 |
| [7] |
Ioannidou O, Zabaniotou A. Agricultural residues as precursors for activated carbon production:A review[J]. Renewable and Sustainable Energy Reviews, 2007, 11(9): 1966-2005. DOI:10.1016/j.rser.2006.03.013 |
| [8] |
司崇殿, 郭庆杰. 活性炭活化机理与再生研究进展[J]. 中国粉体技术, 2008, 14(5): 48-52. SI Chong-dian, GUO Qing-jie. Progress research on activation mechanism and regeneration of activated carbon[J]. China Powder Science and Technology, 2008, 14(5): 48-52. DOI:10.3969/j.issn.1008-5548.2008.05.013 |
| [9] |
刘晓雨, 卞荣军, 陆海飞, 等. 生物质炭与土壤可持续管理:从土壤问题到生物质产业[J]. 中国科学院院刊, 2018, 33(2): 184-190. LIU Xiao-yu, BIAN Rong-jun, LU Hai-fei., et al. Biochar for sustainable soil management:Biomass technology and industry from soil perspectives[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(2): 184-190. |
| [10] |
Li J, Lv G, Bai W, et al. Modification and use of biochar from wheat straw(Triticum aestivum L.)for nitrate and phosphate removal from water[J]. Desalination and Water Treatment, 2016, 57(10): 4681-4693. |
| [11] |
Lehmann J. Bio-energy in the black[J]. Frontiers in Ecology and the Environment, 2007, 5(7): 381-387. DOI:10.1890/1540-9295(2007)5[381:BITB]2.0.CO;2 |
| [12] |
Chen W, Parette R, Zou J, et al. Arsenic removal by iron-modified activated carbon[J]. Water Research, 2007, 41: 1851-1858. DOI:10.1016/j.watres.2007.01.052 |
| [13] |
Zach-Maor A, Semiat R, Shemer H. Synthesis, performance, and modeling of immobilized nano-sized magnetite layer for phosphate removal[J]. Journal of Colloid and Interface Science, 2011, 357(2): 440-446. DOI:10.1016/j.jcis.2011.01.021 |
| [14] |
Zhang Q L, Lin Y C, Chen X, et al. A method for preparing ferric activated carbon composites adsorbents to remove arsenic from drinking water[J]. Journal of Hazardous Materials, 2007, 148(3): 671-678. DOI:10.1016/j.jhazmat.2007.03.026 |
| [15] |
Yu M R, Chang Y Y, Yang J K. Application of activated carbon impregnated with metal oxides to the treatment of multi-contaminants[J]. Environmental Technology, 2012, 33(14): 1553-1559. DOI:10.1080/09593330.2011.635710 |
| [16] |
Zhang N, Lin L S, Gang D. Adsorptive selenite removal from water using iron-coated GAC adsorbents[J]. Water Research, 2008, 42: 3809-3816. DOI:10.1016/j.watres.2008.07.025 |
| [17] |
周鑫, 孙海龙, 张泽乾. 响应面法在污水处理工艺优化中的应用[J]. 化学研究与应用, 2017, 29(6): 753-760. ZHOU Xin, SUN Hai-long, ZHANG Ze-qian. Application of process optimization of wastewater treatment using response surface methodology[J]. Chemical Research and Application, 2017, 29(6): 753-760. DOI:10.3969/j.issn.1004-1656.2017.06.001 |
| [18] |
Alam Z, Muyibi S A, Toramae J. Statistical optimization of adsorption processes for removal of 2, 4-dichlorophenol by activated carbon derived from oil palm empty fruit bunches[J]. Journal of Environmental Sciences, 2007, 19(6): 674-677. DOI:10.1016/S1001-0742(07)60113-2 |
| [19] |
Sahu J N, Acharya J, Meikap B C. Optimization of production conditions for activated carbons from Tamarind wood by zinc chloride using response surface methodology[J]. Bioresource Technology, 2010, 101(6): 1974-1982. DOI:10.1016/j.biortech.2009.10.031 |
| [20] |
李际会, 吕国华, 白文波, 等. 改性生物炭的吸附作用及其对土壤硝态氮和有效磷淋失的影响[J]. 中国农业气象, 2012, 33(2): 220-225. LI Ji-hui, LÜ Guo-hua, BAI Wen-bo., et al. Effect of modified biochar on soil nitrate nitrogen and available phosphorus leaching[J]. Chinese Journal of Agrometeorology, 2012, 33(2): 220-225. |
| [21] |
Demiral H, Gündüzoğlu G. Removal of nitrate from aqueous solutions by activated carbon prepared from sugar beet bagasse[J]. Bioresource Technology, 2010, 101(6): 1675-1680. DOI:10.1016/j.biortech.2009.09.087 |
| [22] |
Cazetta A L, Vargas A M M, Nogami E M, et al. NaOH-activated carbon of high surface area produced from coconut shell:Kinetics and equilibrium studies from the methylene blue adsorption[J]. Chemical Engineering Journal, 2011, 174(1): 117-125. DOI:10.1016/j.cej.2011.08.058 |
| [23] |
Hassan A F, Youssef A M. Preparation and characterization of microporous NaOH-activated carbons from hydrofluoric acid leached rice husk and its application for lead(Ⅱ)adsorption[J]. Carbon Letters, 2014, 15(1): 57-66. |
| [24] |
Yang R, Liu G, Xu X, et al. Surface texture, chemistry and adsorption properties of acid blue 9 of hemp(Cannabis sativa L.)bast-based activated carbon fibers prepared by phosphoric acid activation[J]. Biomass and Bioenergy, 2011, 35(1): 437-445. |
| [25] |
陈永. 多孔材料制备与表征[M]. 合肥: 中国科学技术大学出版社, 2012. CHEN Yong. Preparation and characterization of porous materials[M]. Hefei: University of Science and Technology of China Press, 2012. |
| [26] |
Liou T H, Wu S J. Characteristics of microporous/mesoporous carbons prepared from rice husk under base-and acid-treated conditions[J]. Journal of Hazardous Materials, 2009, 171(1): 693-703. |
| [27] |
Liu Y, Zhao X, Li J, et al. Characterization of bio-char from pyrolysis of wheat straw and its evaluation on methylene blue adsorption[J]. Desalination and Water Treatment, 2012, 46(1/2/3): 115-123. |
| [28] |
Namduri H, Nasrazadani S. Quantitative analysis of iron oxides using Fourier transform infrared spectrophotometry[J]. Corrosion Science, 2008, 50(9): 2493-2497. DOI:10.1016/j.corsci.2008.06.034 |
| [29] |
田宝珍, 汤鸿霄. 聚合铁的红外光谱和电导特征[J]. 环境化学, 1990(6): 70-76. TIAN Bao-zhen, TANG Hong-xiao. Infrared spectra and electrical conductivity of polymeric Fe(Ⅲ)species[J]. Environmental Chemistry, 1990(6): 70-76. |
| [30] |
Schwertmann U, Cornell R M. The iron oxides[M]. New York, WileyVCH Verlag GmbH & Co, 2003.
|
| [31] |
Shi L N, Zhang X, Chen Z L. Removal of Chromium(Ⅵ)from wastewater using bentonite-supported nanoscale zero-valent iron[J]. Water Research, 2011, 45(2): 886-892. DOI:10.1016/j.watres.2010.09.025 |
| [32] |
Ge X, Ma Y, Song X, et al. β-FeOOH nanorods/carbon foam-based hierarchically porous monolith for highly effective arsenic removal[J]. ACS Applied Materials & Interfaces, 2017, 9(15): 13480-13490. |
| [33] |
Streat M, Hellgardt K, Newton N L R. Hydrous ferric oxide as an adsorbent in water treatment:Part 1. Preparation and physical characterization[J]. Process Safety and Environmental Protection, 2008, 86(1): 1-9. DOI:10.1016/j.psep.2007.10.007 |
| [34] |
乔晨, 马建超, 李彦威, 等. Fe3O4@SiO2@CS/PAA的制备及其对Cr (Ⅵ)吸附性能的研究[J]. 太原理工大学学报, 2017, 48(2): 149-155. QIAO Chen, MA Jian-chao, LI Yan-wei, et al. Prepartion of Fe3O4@SiO2@CS/PAA and its application in absorbing Cr(Ⅵ)from wastewater[J]. Journal of Taiyuan University of Technology, 2017, 48(2): 149-155. |
| [35] |
Öztürk N, Bektaş T E. Nitrate removal from aqueous solution by adsorption onto various materials[J]. Journal of Hazardous Materials, 2004, 112(1): 155-162. |
| [36] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2005. BAO Shi-dan. Soil agricultural chemistry analysis[M]. Beijing: China Agriculture Press, 2005. |
| [37] |
Kasiuliene A, Carabante I, Bhattacharya P, et al. Removal of metal (oid)s from contaminated water using iron-coated peat sorbent[J]. Chemosphere, 2018, 198: 290-296. DOI:10.1016/j.chemosphere.2018.01.139 |
| [38] |
Aleksandra Tytłak, Oleszczuk P, Dobrowolski R. Sorption and desorption of Cr(Ⅵ)ions from water by biochars in different environmental conditions[J]. Environmental Science and Pollution Research, 2015, 22(8): 5985-5994. DOI:10.1007/s11356-014-3752-4 |
| [39] |
Chen C, Zhao P, Li Z, et al. Adsorption behavior of chromium(Ⅵ)on activated carbon from eucalyptus sawdust prepared by microwave-assisted activation with ZnCl2[J]. Desalination and Water Treatment, 2016, 57(27): 12572-12584. DOI:10.1080/19443994.2015.1049960 |
| [40] |
Ouma I L A, Naidoo E B, Ofomaja A E. Iron oxide nanoparticles stabilized by lignocellulosic waste as green adsorbent for Cr(Ⅵ)removal from wastewater[J]. European Physical Journal Applied Physics, 2017, 79: 30401. DOI:10.1051/epjap/2017160406 |
| [41] |
Rajput S, Pittman C U, Mohan D. Magnetic magnetite (Fe3O4)nanoparticle synthesis and applications for lead(Pb2+)and chromium(Cr6+) removal from water[J]. Journal of Colloid and Interface Science, 2015, 468: 334-346. |
 2019, Vol. 38
2019, Vol. 38