2. 安徽省农业科学院农业工程研究所, 合肥 230031
2. Institute of Agricultural Engineering, Anhui Academy of Agricultural Science, Hefei 230031, China
氯氰菊酯(Cypermethrin,CPM),是继有机磷、有机氯等农药之后发展起来的一类新型杀虫剂,被广泛应用于棉花、蔬菜、大豆和甜菜等作物害虫的防治[1]。顺式氯氰菊酯(α-CPM)和高效氯氰菊酯(β-CPM)具有杀虫谱广、杀虫效率高、生产成本低和工艺简单等优点,是拟除虫菊酯类杀虫剂中应用范围广、使用量大的菊酯类农药[2-3]。
CPM环境稳定性强,不易被光和空气降解。世界卫生组织将CPM定性为中等毒性,欧盟规定水产品中CPM最高残留量为50 μg·kg-1[4]。Kumari等[5]在印度的棉花-小麦和水稻-小麦轮作田地和甘蔗地检测到CPM残留量为1~35 µg·kg-1。宋国春等[6]研究发现青花菜中CPM残留量为0.160~0.397 mg·kg-1。余正萍[7]测定出CPM在四川黄瓜山果园摘取的黄桃、名豪超市购买的梨和永川重百超市购买的苹果残留量为0.009 0~0.017 9 mg·L-1。CPM残留可通过食物链进入人体,危害人体健康[8]。
CPM已被美国环境保护局(U. S. Environmental Protection Agency,USEPA)认定为可疑致癌物[9]。有研究显示,CPM暴露可诱导机体的生殖毒性[4]。Un⁃ deger等[10]研究表明200 g·L-1的CPM显著增加人体淋巴细胞DNA损伤。马萍等[11]研究发现β-CPM(≥20 mg·kg-1)造成小鼠神经细胞DNA和脑组织氧化损伤,且有剂量效应。阮秦莉等[12]研究发现将L4期野生型秀丽隐杆线虫暴露于8.0 mg·L-1的CPM 48 h后产卵数目明显降低。Wang等[13]研究表明哺乳期小鼠母体暴露于6.25 mg·kg-1的CPM可导致雄性子代睾丸发育和精子发生长期损害。目前,CPM对机体生殖损伤的相关作用机理鲜有报道,尤其关于CPM作用于机体生殖毒性损伤信号传导途径的研究几乎尚未涉及。基于此,本文以秀丽隐杆线虫作为实验动物,以线虫生殖细胞凋亡、产卵量和卵孵化率作为生物检测终点,开展两种常用氯氰菊酯α-CPM和β-CPM作用于机体的生殖毒性效应,并探索生殖损伤发生的信号转导通路,探讨相关作用机理,为评估α-CPM和β-CPM暴露的健康危害性提供理论研究数据。
1 材料和方法 1.1 线虫品系与培养N2 Brisitol野生型。
ced-3(mt1522)、ced-4(mt2547),属于caspase缺失,缺乏生理性细胞凋亡和遗传性诱导的生殖细胞凋亡。
cep-1(jr1279),为p53基因突变,具有生理性细胞凋亡。
hus-1(ws2277)为DNA损伤响应基因突变,具有生理性的生殖细胞凋亡,但缺乏诱导辐射的细胞凋亡和生殖细胞周期停滞。
lin45(mh575)、mek-2(mt8666)、mpk(mh37)均为ERK MAPK信号转导途径的成员。
mkk(cz4213)、jnk(vc8)、jkk(ku2)、mek-1(fk141)均为JNK MAPK信号转导途径的成员。
nsy-1(au3)、sek-1(au1)、pmk(ku25)均为p38 MAPK信号转导途径的成员。
以上所有线虫品系均由美国NIH资助的国际线虫种质中心(CGC)赠送。将线虫培养于含有大肠杆菌OP50的NGM平板固体培养基(Nematode Growth Medium)上,20 ℃恒温培养[14]。按照Donkin等[15]的方法同步化,获得大量L4期线虫。
1.2 主要试剂α - CPM(顺式氯氰菊酯标准品):CAS NO:[67375-30],产品货号:ZDR-C11890100,中文名:alpha-氯氰菊酯,英文名:alpha-Cypermethrin,规格:0.1 g。分子量为416.30,难溶于水,在醇类、酮类和取代芳烃类有机溶剂中溶解>450 g·L-1。
β - CPM(高效氯氰菊酯标准品):CAS NO:[72204-43],产品货号:ZDR-C11890200,中文名:beta-氯氰菊酯,英文名:beta-Cypermethrin,规格:0.1 g。分子量为416.30,难溶于水,在醇类、酮类和取代芳烃类有机溶剂中溶解>450 g·L-1。
1.3 实验方法 1.3.1 CPM毒性暴露试验CPM杀虫剂难溶于水,易溶于有机溶剂。实验以纯丙酮溶液作为溶剂,将CPM配制成0.1 g·mL-1的母液。暴露溶液由母液以K-medium为溶剂梯度稀释至0.005、0.05、0.2、0.8、3.2 mg·L-1浓度,以Kmedium溶液作对照。将L4期线虫接入到不同浓度CPM溶液的Costar 12孔组织培养板,加入2% E. coli OP50浓缩菌作为食物,配制成1 mL的培养液,置于20 ℃恒温摇床,在24 h后将处理后的线虫取出进行进一步分析。
文章应用线虫生殖细胞死亡、产卵量和卵孵化率作为生物检测终点,研究α-CPM和β-CPM暴露对机体生殖发育的影响。将同步化的L4期线虫或早期成虫暴露于0.005、0.05、0.2、0.8、3.2 mg·L-1的α-CPM和β-CPM染毒培养24 h后,统计其生殖腺的死亡细胞数目、产卵量和卵孵化率。各对照组、暴露组的测定数目为15~20条线虫。
0.005、0.05、0.2、0.8、3.2 mg·L-1的CPM处理液中的丙酮浓度分别为:0.025、0.25、1、4、16 μL·mL-1,与K-medium对照相比均未出现显著性差异(图 1),所以以丙酮为溶剂的CPM处理液中丙酮的浓度不影响线虫生殖细胞凋亡的评价结果。
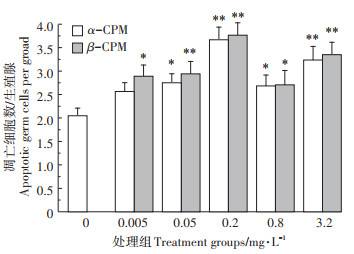
|
*表示与对照相比具有显著性差异,P < 0.05;**表示极显著差异,P < 0.01。下同 *represents statistical significance(P < 0.05)as indicated; ** represents extremely significant difference(P < 0.01). The same below 图 1 丙酮暴露诱导的线虫生殖细胞死亡 Figure 1 Acetone induced germ cells death in C.elegans |
所有数据均应用IBM SPSS Statistics 19.0分析,以平均值±标准差的形式表示,以Turkey多重比较检验不同浓度的α-CPM和β-CPM暴露对秀丽隐杆线虫生殖发育的影响。利用双尾t检验同一品系线虫α-CPM和β-CPM不同暴露浓度所导致的细胞凋亡、产卵量和卵孵化率的差异性。
2 结果与分析 2.1 α-CPM和β-CPM暴露诱导线虫的生殖细胞死亡图 2结果显示,暴露于α-CPM的线虫生殖细胞死亡数目在0.005~0.2 mg·L-1范围内呈递增趋势,在0.05 mg·L-1已表现出显著性差异(P < 0.05),并于0.2 mg·L-1达到最大值,而当α-CPM浓度增加至0.2~3.2 mg·L-1范围时,线虫生殖细胞死亡数目与0.2 mg·L-1暴露组相比呈先减少后增加的趋势,且与对照相比均出现显著性差异。暴露于β-CPM的线虫生殖细胞死亡数目的变化趋势与α-CPM基本一致。正常生长发育的线虫,其生殖腺有丝分裂区的细胞排列紧致有序,细胞核大小均匀,而随着α-CPM和β-CPM暴露浓度的增加,这种有序的结构逐渐被破坏,且细胞数量明显减少(图 3)。暴露于β-CPM的线虫生殖细胞死亡数目与对照相比出现显著性差异的浓度为0.005 mg·L-1。这一结果说明,以线虫生殖细胞凋亡为检测终点时,β-CPM暴露诱导显著性生殖细胞死亡的浓度低于α-CPM,即β-CPM暴露对机体造成的生殖毒性较α-CPM大。
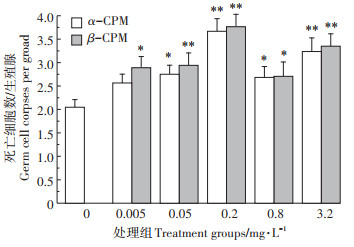
|
图 2 α-CPM和β-CPM诱导的线虫生殖细胞死亡 Figure 2 α-CPM and β-CPM induced germ cells death in C.elegans |
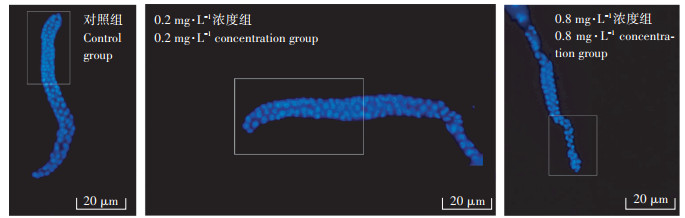
|
矩形所示区域为性腺的有丝分裂区 The area indicated by rectangle was mitotic cells 图 3 CPM暴露诱导的线虫生殖腺有丝分裂细胞减少 Figure 3 Decreased mitotic germline cells induced by CPM exposure in C. elegans |
较低浓度的α-CPM和β-CPM暴露均诱导线虫发生显著的生殖细胞凋亡,并于0.2 mg·L-1暴露浓度达到最大值,故在之后探究相关作用机理中,均选用0.2 mg·L-1作为供试浓度。
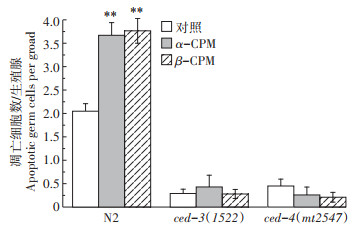
2.2 α-CPM和β-CPM暴露诱导的线虫生殖细胞死亡依赖核心凋亡途径线虫中,ced-3和ced-4是生殖细胞凋亡的核心调控基因,为明确α-CPM和β-CPM暴露诱导线虫生殖细胞死亡是细胞坏死还是程序性的细胞凋亡,凋亡的细胞呈亮黄色,是DNA片断化的一个重要标志,而未凋亡的细胞呈现均匀的浅绿色(图 4),将ced-3和ced-4基因缺陷型的线虫品系ced-3(mt1522)和ced-4(mt2547)暴露于0.2 mg·L-1的α-CPM和β-CPM进行染毒处理。图 5结果显示,暴露于0.2 mg·L-1的α-CPM和β-CPM的ced-3(mt1522)和ced-4(mt2547)线虫,其单个生殖腺臂的生殖细胞死亡数目与对照相比无显著性差异,而以0.2 mg·L-1的α-CPM和β-CPM处理的野生型N2线虫品系,其单个生殖腺臂的细胞死亡数目从对照的2.05±0.17分别增加至3.67±0.27和3.76±0.27(P < 0.01)。由于ced-3和ced-4基因是细胞凋亡所必需的,而α-CPM和β-CPM暴露不能使ced-3(mt1522)和ced-4(mt2547)基因缺陷型品系的AO阳性细胞数目增加,表明在野生型N2线虫品系上所检测的AO阳性细胞是凋亡细胞(图 5,P>0.05)。且ced-3突变品系线虫为caspase基因突变,缺乏caspase途径会抑制生理性的生殖细胞凋亡,表明α-CPM和β-CPM诱导的生殖细胞死亡是依赖于ced-3和ced-4基因调控的细胞凋亡。
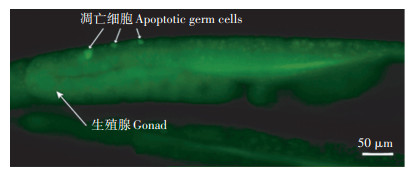
|
箭头所指细胞为AO阳性细胞,即凋亡的细胞 Apoptotic cells were stained brilliant yellow by acridine orange, which were indicated with white arrows 图 4 CPM诱导的线虫细胞凋亡 Figure 4 CPM-induced germline apoptosis in C. elegans |
|
0.2 mg·L-1处理组 0.2 mg·L-1Treatment groups 图 5 α-CPM和β-CPM诱导的线虫生殖细胞死亡依赖ced-3和ced-4基因的表达 Figure 5 α-CPM and β-CPM-induced germ cell death dependent of ced-3 and ced-4 genes in C. elegans |
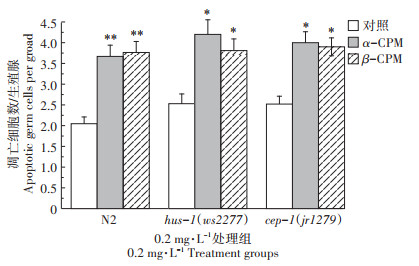
为研究α-CPM和β-CPM诱导的生殖细胞凋亡的途径,将基因缺陷型品系cep-1(jr1279)暴露于0.2 mg·L-1的α-CPM和β-CPM进行染毒处理,24 h后测定其生殖细胞凋亡数目。图 6结果显示,暴露于0.2 mg·L-1的α-CPM和β-CPM的cep-1(jr1279)线虫品系,其生殖细胞凋亡细胞数目从对照的2.52±0.19分别增加至4.00±0.27和3.90±0.22,其增长趋势与α-CPM和β-CPM染毒处理的野生型N2基本一致(P < 0.05),这一研究结果说明,cep-1基因的功能缺失不影响α-CPM和β-CPM诱导的线虫生殖细胞凋亡,即α-CPM和β-CPM诱导的线虫生殖细胞凋亡不依赖于cep-1的表达。
|
0.2 mg·L-1处理组 0.2 mg·L-1 Treatment groups 图 6 DNA损伤检测点蛋白HUS-1和响应基因cep-1在α-CPM和β-CPM诱导的生殖细胞凋亡中的作用 Figure 6 Roles of checkpoint protein HUS-1 and DDR gene cep-1 in α-CPM and β-CPM-induced germ cell apoptosis |
为了研究hus-1基因是否参与调节α-CPM和β-CPM诱导的生殖细胞凋亡,将基因缺陷型品系hus-1(ws2277)暴露于0.2 mg·L-1的α-CPM和β-CPM进行染毒处理,24 h后线虫生殖细胞凋亡数目显著增加(P < 0.01),图 6结果显示,hus-1基因未参与α-CPM和β-CPM诱导的生殖细胞凋亡。综合上述研究结果说明,α-CPM和β-CPM诱导的线虫生殖细胞凋亡不依赖DNA损伤信号通路。
2.4 MAPK信号转导途径在α-CPM和β-CPM诱导的生殖细胞凋亡中的作用丝裂原活化蛋白激酶(mitogen-actived protein kinase,MAPK)是真核生物信号传递网络中的重要途径之一,在基因表达调控和细胞质功能活动中发挥关键作用。MAPK有3个主要家族:ERK、JNK和p38 MAPK。文章探索了MAPK信号转导通路在α-CPM和β-CPM诱导的生殖细胞凋亡中的作用。
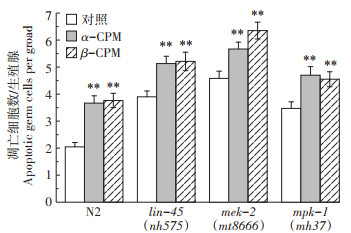
2.4.1 α-CPM和β-CPM诱导的线虫生殖细胞凋亡不依赖ERK MAPK信号转导途径在C. elegans中,ERK信号转导途径成员有lin-45(MAPKKK),mek-2(MAPKK)和mpk-1(MAPK)。将基因敲除的线虫品系lin-45(mh575)、mek-2(mt8666)以及mpk-1(mh37)分别暴露于0.2 mg·L-1的α-CPM和β-CPM进行染毒处理,图 7结果显示,lin-45(mh575)、mek-2(mt8666)以及mpk-1(mh37)的生理性细胞凋亡数目分别为3.90±0.22、4.58±0.27、3.47± 0.25,暴露于0.2 mg·L-1的α-CPM染毒培养24 h后,其细胞凋亡数目分别为5.13 ± 0.27、5.67 ± 0.25、4.70 ± 0.32,相对值分别为1.23、1.09、1.23,均出现显著性差异(P < 0.01);暴露于0.2 mg·L-1的β-CPM染毒培养24 h后,其细胞凋亡数目分别为5.21±0.34、6.35±0.31、4.55±0.28,相对值分别为1.31、1.77、1.08,与未处理的自身对照相比亦出现显著性差异(P < 0.01)。比较暴露于α-CPM和β-CPM的野生型N2与lin-45(mh575)、mek-2(mt8666)以及mpk-1(mh37)的相对值发现,lin-45(mh575)、mek-2(mt8666)以及mpk-1(mh37)增加的幅度基本与野生型N2一致,说明ERK信号转导途径相关基因的突变并未阻止α-CPM和β-CPM诱导的生殖细胞凋亡,也就是说ERK MAPK信号转导途径不是α-CPM和β-CPM诱导线虫生殖细胞凋亡的主要信号转导通路。
|
ERK MAPK信号转导通路,CPM 0.2 mg·L-1 ERK MAPK signaling pathway, CPM 0.2 mg·L-1 图 7 ERK MAPK信号转导途径在α-CPM和β-CPM诱导的线虫生殖细胞凋亡中的作用 Figure 7 Roles of ERK MAPK signaling pathways in α-CPM and β-CPM-induced germ cell apoptosis |
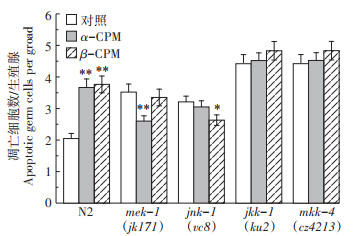
在C. elegans中,JKK-1属于JNK MAPK,MKK-4则是其激活蛋白。MKK-4在线虫中有2个同源蛋白,分别为JKK-1和MEK-1。这些基因的缺失会使C. elegans对环境的胁迫敏感,如重金属暴露和饥饿。将基因缺陷型品系mek-1(fk171)、jnk-1(vc8)、jkk-1(ku2)和mkk-4(cz4213)暴露于0.2 mg·L-1的α-CPM和β-CPM染毒处理24 h后观察其生殖细胞的凋亡数目。图 8结果显示,mek-1(fk171)、jnk-1(vc8)、jkk-1(ku2)和mkk-4(cz4213)品系中生殖细胞凋亡数目分别为3.52±0.26、3.21±0.18、4.42±0.29个和4.42±0.29个,暴露于0.2 mg·L-1的α-CPM染毒培养24 h后,其细胞凋亡数目分别为2.60±0.17、3.05±0.20、4.52±0.25个和4.52±0.25个,jnk-1(vc8)、jkk-1(ku2)和mkk-4(cz4213)品系线虫与自身未处理对照相比均未达到显著性差异(P>0.05);暴露于0.2 mg·L-1的β-CPM染毒培养24 h后,mek-1(fk171)、jnk-1(vc8)、jkk-1(ku2)和mkk-4(cz4213)品系中生殖细胞凋亡数目分别为3.35±0.26、2.63±0.17、4.83±0.29个和4.83±0.29个,mek-1(fk171)、jkk-1(ku2)和mkk-4(cz4213)与自身未处理对照相比均未达到显著性差异(P>0.05)。上述研究结果表明,JNK信号转导途径是α-CPM和β-CPM诱导生殖细胞凋亡所需要的。
|
JNK MAPK信号转导通路,CPM 0.2 mg·L-1 JNK MAPK signaling pathway, CPM 0.2 mg·L-1 图 8 JNK MAPK信号转导途径在α-CPM和β-CPM诱导的线虫生殖细胞凋亡中的作用 Figure 8 Roles of ERK MAPK signaling pathways in α-CPM and β-CPM-induced germ cell apoptosis |
在C. elegans中,nsy-1编码MAPKKK、SEK-1是MAPKK家族,以及PMK-1是p38 MAPK家族成员之一。将基因敲除品系nsy-1(au3)、sek-1(au1)和pmk(ku25)暴露于0.2 mg·L-1的a-CPM和β-CPM染毒培养24 h,图 9结果显示,暴露于0.2 mg·L-1的α-CPM的nsy-1(au3)和sek-1(au1)线虫品系,其生殖细胞凋亡数目分别由2.62±0.26和2.75±0.19上升至3.89±0.29和3.48±0.29(P < 0.05),而在pmk(ku25)品系中,其生殖细胞凋亡数目显著降低(P < 0.05);暴露于β-CPM的nsy-1(au3)、sek-1(au1)和pmk(ku25)的生殖细胞凋亡数目变化趋势与α-CPM基本一致。综合上述研究结果说明,nsy-1和sek-1基因的缺失不影响a-CPM和β-CPM诱导的生殖细胞凋亡,而pmk基因的功能缺失减少了a-CPM和β-CPM诱导的生殖细胞凋亡数目,该研究结果表明,a-CPM和β-CPM诱导的线虫生殖细胞凋亡部分依赖p38 MAPK信号转导途径。
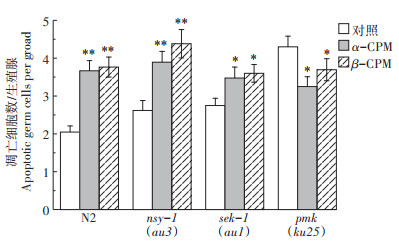
|
p38 MAPK信号转导通路,CPM 0.2 mg·L-1 p38 MAPK signaling pathway, CPM 0.2 mg·L-1 图 9 p38 MAPK信号转导途径在α-CPM和β-CPM诱导的线虫生殖细胞凋亡中的作用 Figure 9 Roles of p38 MAPK signaling pathways in α-CPM and β-CPM-induced germ cell apoptosis |
当前已有研究结果显示,CPM暴露可诱导小鼠细胞周期阻滞及DNA损伤,且在接触CPM的农民的淋巴细胞中发现了遗传毒性效应。而本文以生殖细胞凋亡为生物检测终点的结果显示,α-CPM和β-CPM诱导的生殖细胞凋亡不依赖DNA损伤信号通路,为了明确α-CPM和β-CPM暴露是否引起机体的DNA损伤效应,研究了α-CPM和β-CPM暴露对线虫的产卵量和卵孵化率的影响。
线虫成虫体内卵的数目及产卵量代表线虫生育后代的能力,是线虫生殖发育的一个至关重要的指标。将同步化的L4期或早期成虫暴露于0.05、0.2、0.8、3.2 mg·L-1的α-CPM和β-CPM染毒培养24 h后,统计其产卵数目和卵孵化率。图 10A结果显示,暴露于α-CPM的线虫产卵量在0.05~3.2 mg·L-1范围内呈递减趋势(P < 0.01),具有剂量效应。暴露于β-CPM的线虫产卵量的变化趋势与α-CPM基本一致(P < 0.01)。图 10B结果显示,暴露于α-CPM的线虫卵孵化率在0.05~3.2 mg·L-1范围内呈递减趋势(P < 0.05),具有剂量效应。暴露于β-CPM的线虫卵孵化率的变化趋势与α-CPM基本一致(P < 0.01)。比较野生型N2 α-CPM和β-CPM产卵量和卵孵化率的相对值发现,β-CPM暴露诱导线虫产卵量和卵孵化率的下降幅度较α-CPM大,且在0.05 mg·L-1的β-CPM的线虫卵孵化率已表现出极显著性差异(P < 0.01)。上述结果说明,α-CPM和β-CPM的暴露诱导线虫生殖腺受损,意味着造成机体的DNA损伤,提示它对线虫生殖细胞可能具有遗传毒性作用,β-CPM暴露对机体造成的生殖毒性较α-CPM大,与凋亡实验结果一致。α-CPM和β-CPM暴露诱导线虫DNA损伤的具体作用机理是未来研究的主要方向。

|
图 10 不同浓度α-CPM和β-CPM对线虫产卵量和卵孵化率的影响 Figure 10 The effect of different concentration α-CPM and β-CPM on brood size and hatching rate in C.elegans |
文献显示,线虫生殖细胞凋亡对外界环境压力非常敏感,已被应用于重金属、辐射等环境健康的评价[16]。线虫的子代数目和卵孵化率反映其繁殖能力,亦是机体响应环境胁迫引起生殖损伤的重要指标。本文以线虫的生殖细胞凋亡、产卵量和卵孵化率作为生物检测终点,0.05 mg·L-1的α-CPM和β-CPM暴露均诱导线虫发生显著的生殖细胞凋亡,在0.005~0.2 mg·L-1范围内较对照组呈递增趋势,暴露于0.8 mg·L-1的α-CPM和β-CPM的线虫生殖细胞死亡数目低于暴露于0.2 mg·L-1浓度组,而在0.8~3.2 mg·L-1范围内较0.8 mg·L-1浓度组呈递增趋势。线虫生殖细胞死亡数目取决于生殖腺有丝分裂区的细胞数量,并随着线虫生殖腺有丝分裂区细胞数的减少而减少[17],暴露于0.2~0.8 mg·L-1范围内的线虫,其生殖细胞凋亡与0.2 mg·L-1浓度组相比呈减少趋势可能与α-CPM和β- CPM暴露诱导的有丝分裂生殖细胞数量减少有关[18]。
在C. elegans中,CEP-1是哺乳动物肿瘤抑制基因p53的同源蛋白,具有促进DNA损伤引起的细胞凋亡的功能[19]。在遗传损伤条件下,线虫生殖细胞凋亡需要DNA损伤响应cep-1的表达[20]。HUS-1是一个9:1:1的复合体,编码了DNA损伤检测点蛋白,是DNA损伤的感受因子[21]。检测点基因突变阻止了由DNA损伤引起的凋亡,而不影响生理性生殖细胞凋亡。而本文进一步研究发现,DNA损伤不是α-CPM和β-CPM暴露诱导线虫生殖细胞凋亡的关键信号通路。而除了DNA依赖性的细胞凋亡途径,环境胁迫还可诱导线虫中非遗传损伤的凋亡信号通路。丝裂原活化蛋白激酶(mitogen-actived protein kinase,MAPK)是真核生物信号传递网络中的重要途径之一,属于丝氨酸/酸酸蛋白激酶,可被多种刺激所活化[22]。MAPK有3个主要家族:ERK、JNK和p38 MAPK,在C. elegans均可找到其同源蛋白,因此,C. elegans亦含有3条主要的MAPK信号转导途径,ERK、JNK和p38 MAPK[23-24]。结果显示α-CPM和β-CPM暴露诱导的线虫生殖细胞凋亡依赖JNK MAPK信号转导途径,部分依赖p38 MAPK信号转导途径,而不依赖ERK MAPK信号转导途径,与低浓度全氟辛烷磺酰基钾盐(PFOS)处理的线虫作用机理相似[25]。
产卵孵化的结果显示暴露于0.05、0.2、0.8、3.2 mg L-1的α-CPM和β-CPM的线虫产生后代的数目减少和卵孵化率降低,意味着造成DNA损伤,对生殖细胞具有潜在的基因毒性作用,与阮秦莉等[12]研究结论相一致,具体的作用机理是未来研究的主要方向。线虫的性腺可能是α-CPM和β-CPM的靶器官,造成线虫生殖系统发育和功能异常,并能通过母体影响子代的发育[26]。其中暴露于β-CPM的产卵量和卵孵化率下降幅度较大,在一定程度上说明β-CPM的生殖毒性更强,与凋亡实验结果一致。本文研究结果可以为α-CPM和β-CPM系统地评估生态风险提供依据。
4 结论(1)α-CPM和β-CPM暴露诱导线虫发生显著的生殖细胞凋亡,且β-CPM生殖毒性较α-CPM大。
(2)α-CPM和β-CPM暴露诱导的线虫生殖细胞凋亡依赖JNK MAPK信号转导途径,部分依赖p38 MAPK信号转导途径。
(3)α-CPM和β-CPM暴露诱导线虫产卵量显著减少和孵化率显著降低,且β-CPM生殖毒性较α-CPM大。
| [1] |
孙小静, 马利民, 龚本涛. 氯氰菊酯在土壤环境中的存在行为及分析研究进展[J]. 农药, 2010, 49(1): 16-18, 28. SUN Xiao-jing, MA Li-min, GONG Ben-tao. The research for existence, behavior and analysis of cypermethrin in soil environment[J]. Pesticide, 2010, 49(1): 16-18, 28. DOI:10.3969/j.issn.1006-0413.2010.01.004 |
| [2] |
范志金, 刘丰茂, 钱传范. 氯氰菊酯的名称和组成及其光学异构体[J]. 农药科学与管理, 1999, 20(2): 9-11, 17. FAN Zhi-jin, LIU Feng-mao, QIAN Chuan-fan. The name and composition of cypermethrin and its optical isomers[J]. Pesticide Science and Management, 1999, 20(2): 9-11, 17. |
| [3] |
Allinson G, Zhang P, Bui A, et al. Pesticide and trace metal occurrence and aquatic benchmark exceedances in surface waters and sediments of urban wetlands and retention ponds in Melbourne, Australia[J]. Springer Berlin Heidelberg, 2015, 22(13): 10214-10226. |
| [4] |
覃东立, 白淑艳, 汤施展, 等. 氯氰菊酯毒性评价研究[J]. 农药科学与管理, 2014, 35(3): 28-32. QIN Dong-li, BAI Shu-yan, TANG Shi-zhan, et al. Toxic assessment of cypermethrin[J]. Pesticide Science and Management, 2014, 35(3): 28-32. DOI:10.3969/j.issn.1002-5480.2014.03.008 |
| [5] |
Kumari B, Madan V K, Kathpal T S. Status of insecticide contamination of soil and water in Haryana, India[J]. Environmental Monitoring and Assessment, 2008, 136(1/2/3): 239-244. DOI:10.1007/s10661-007-9679-1 |
| [6] |
宋国春, 李瑞娟, 刘同金, 等. 氯氰菊酯在青花菜和土壤中的残留及安全性评价[J]. 浙江农业科学, 2018, 59(1): 40-43. SONG Guo-chun, LI Rui-juan, LIU Tong-jin, et al. Residues and safety evaluation of cypermethrin in broccoli and soil[J]. Zhejiang Nongye Kexue, 2018, 59(1): 40-43. DOI:10.3969/j.issn.0258-4069.2018.01.008 |
| [7] |
余正萍. 水果中氯氰菊酯残留量的测定[J]. 化学工程与装备, 2009(11): 152-153. YU Zheng-ping. Determination of cypermethrin residues in fruits[J]. Chemical Engineering & Equipment, 2009(11): 152-153. |
| [8] |
汪文杰, 鲁厚清. 氯氟氰菊酯中毒二例[J]. 中国劳动卫生职业病, 2016, 34(1): 31. WANG Wen-jie, LU Hou-qing. Two cases of cyhalothrin poisoning[J]. Chinese Occupational Health Occupational Disease, 2016, 34(1): 31. |
| [9] |
申志刚.五种手性农药在动物体内的选择性代谢行为研究[D].北京: 中国农业大学, 2014. SHEN Zhi-gang. Stereoselective behavior of chiral pesticides in animals[D]. Beijing: China Agricultural University, 2014. |
| [10] |
Undeger U, Başaran N. Effects of pesticides on human peripheral lymphocytes in vitro:Induction of DNA damage[J]. Springer-Verlag, 2005, 79(3): 169-176. DOI:10.1007/s00204-004-0616-6 |
| [11] |
马萍, 丁书茂, 秦龙娟, 等. 农药高效氯氰菊酯对小鼠肾细胞氧化损伤的研究[J]. 华中师范大学学报, 2011, 45(4): 621-624. MA Ping, DING Shu-mao, QIN Long-juan, et al. Study on the oxidative damage of mouse kidney cells induced by pesticide beta-cypermethrin[J]. Journal Platform of Central China Normal University, 2011, 45(4): 621-624. |
| [12] |
阮秦莉, 居静娟, 李云晖, 等. 氯氰菊酯对模式动物秀丽隐杆线虫生殖能力的损伤作用[J]. 癌变·畸变·突变, 2012, 24(2): 136-140. RUAN Qin-li, JU Jing-juan, LI Yun-hui, et al. Reduction of reproductive capacity of model organism Caenorhabditi-s elegans induced by cypermethrin exposure[J]. Carcinogenesis, Teratogenesis & Mutagensis, 2012, 24(2): 136-140. DOI:10.3969/j.issn.1004-616x.2012.02.013 |
| [13] |
Wang H, Wang S F, Ning H, et al. Maternal cypermethrin exposure during lactation impairs testicular development and spermatogenesis in male mouse offspring[J]. Environmental Toxicology, 2011, 26(4): 382-394. DOI:10.1002/tox.20566 |
| [14] |
Brenner S. The genetics of Caenorhabditis elegans[J]. Genetics, 1974, 77(1): 71-94. |
| [15] |
Donkin S G, Williams P L. Influences of development stage, salts and food presence on various end points using Caenorhabditis elegans for aquatic toxicity testing[J]. Environ Toxicol Chem, 1995, 14(12): 2139-2147. DOI:10.1002/etc.5620141218 |
| [16] |
Dikic D, Mojsovic-Cuic A, Cupor I, et al. Carbendazim combined with imazalil or cypermethrin potentiate DNA damage in hepatocytes of mice[J]. Human & Experimental Toxicology, 2012, 31(5): 492-505. |
| [17] |
Gartner A, Boag P R, Blackwell T K. Germline survival and apoptosis[J]. Wormbook, 2008, 1-20. DOI:10.1895/wormbook.1.142.1 |
| [18] |
Guo X Y, Li Q Q, Shi J, et al. Perfluorooctane sulfonate exposure causes gonadal developmental toxicity in Caenorhabditis elegans through ROS-induced DNA damage[J]. Chemosphere, 2016, 155: 115-126. DOI:10.1016/j.chemosphere.2016.04.046 |
| [19] |
Adams J M, Cory S. The Bcl-2 protein family:Arbiters of cell survival[J]. American Society for the Advancement of Science, 1998, 281(5381): 1322-1326. DOI:10.1126/science.281.5381.1322 |
| [20] |
Derry W B. Caenorhabditis elegans p53:Role in apoptosis, meiosis, and stress resistance[J]. Science, 2001, 294(5542): 591-595. DOI:10.1126/science.1065486 |
| [21] |
Hofmann E R, Milstein S, Boulton S J, et al. Caenorhabditis elegans HUS-1 is a DNA damage checkpoint protein required for genome stability and EGL-1-mediated apoptosis[J]. Curr Biol, 2002, 12(22): 1908-1918. DOI:10.1016/S0960-9822(02)01262-9 |
| [22] |
郭肖颖, 王磊, 王斌, 等.铁矿区水环境样品对秀丽隐杆线虫的毒性研究[J]. 2015, 10(6): 219-228. GUO Xiao-ying, WANG Lei, WANG Bin, et al. A study on toxicity of water sample from iron mine area on Caenorhabditis elegans[J]. Asian Journal of Ecotoxicology, 2015, 10(6): 219-228. |
| [23] |
Soignet S L, Maslak P, Wang Z G, et al. Complete remission after treatment of acute promyelocytic leukemia with arsenic trioxide-NEJM[J]. The New England Journal of Medicine, 1998, 339(19): 1341-1348. DOI:10.1056/NEJM199811053391901 |
| [24] |
Sakaguchi A, Matsumoto K, Hisamoto N. Roles of MAP kinase cascades in Caenorhabditis elegans[J]. Biochem, 2004, 136(1): 7-11. DOI:10.1093/jb/mvh097 |
| [25] |
郭肖颖.全氟辛烷磺酸诱发线虫的生长、生殖发育毒性效应及相关作用机理[D].合肥: 中国科学院合肥物质科学研究院, 2014. GUO Xiao-ying. The toxicity of growth and germ line development induced by perfluoroctane sulfonates in Caenorhabdites elegans[D]. Hefei: Hefei Institutes of Physical Science, Chinese Academy of Sciences, 2014. |
| [26] |
Forbes V E, Steve R, Chiara A, et al. Predicting impacts of chemicals from organisms to ecosystem service delivery:A case study of endocrine disruptor effects on trout[J]. Science of the Total Environment, 2019, 649: 949-959. DOI:10.1016/j.scitotenv.2018.08.344 |
 2019, Vol. 38
2019, Vol. 38


