玉米秸秆作为普遍存在的农业固体废弃物,是研究腐殖化的原材料的重点对象,而其作为木质纤维素材料有着可再生且成本低的优势。玉米秸秆的分解及有效转化在全球碳循环中起着重要作用。而腐殖物质(Humus substances,HS)是腐殖化过程的最终产物,秸秆好氧堆肥的腐殖化过程与土壤腐殖化过程相近,是最典型的腐殖化过程[1]。作为一种环境友好型技术,堆肥也是农业残留物处理的最佳方法之一,可以实现高效的生物转化[2],是农业副产品可持续管理的重要解决方案[3]。
土壤HS具有不同于其形成前体的化学组成与结构特征的“特异性” [4],是经腐殖化作用形成的、具有特异性的、多相分布的类高分子化合物[5]。在最为广泛认可的Schulten等[6]提出的模型中,土壤胡敏酸(Humic acid,HA)是由长链脂族结构链接多个芳香环而形成,在芳香环和脂族侧链上还存在许多由羟基和羧基所构成的活性官能团组[7]。但与长期腐殖化的土壤相比,堆肥腐殖化的水平是较低的,相较于土壤中“成熟”的胡敏酸,秸秆堆肥中的类胡敏酸相对“稚嫩” [8-9],但其中含有大量含氧基团,如羧基、酚羟基、醇羟基、甲氧基和醌基等[10]。在类胡敏酸的分析中,Genevini等[11]曾提出类胡敏酸通常分为类胡敏酸(Humic acid-like,HAL)和核心类胡敏酸(Core-humic acid-like,cHAL)2种。cHAL相比HAL是去除了脂类物质后得到的胡敏酸。关于腐殖质的形成过程,比较盛行的是多酚理论,即土壤有机质首先经微生物作用,分解为简单的有机化合物,例如保留原来芳香结构的多元酚类,成为腐殖质组成的结构单元,在酶的作用下,将多元酚氧化为醌[12],醌与含氮化合物等缩合成为腐殖质。许多学者曾对此进行试验,发现真菌可以有效将木质素与纤维素降解转化,并进一步形成醌型化合物[13]。
玉米秸秆主要由纤维素、半纤维素、木质素构成,上述三种成分之间存在各种化学键,共同构成植物细胞壁,最终变为难降解物质[14]。通常在秸秆堆肥过程中,真菌对上述三种成分都有较为强力的分解作用,对玉米秸秆的矿化分解起着重要作用。在土壤有机质中,真菌作为K策略的微生物主要分解难降解的有机质,而细菌作为r策略微生物更喜欢利用活性有机质[15]。微生物的死亡残体、代谢产物(如胞外酶、胞外多聚物等)或残留物(如几丁质、肽聚糖等)也均属于较难分解的有机质[16],植物残体可以这些形式彻底被转化为土壤有机质。真菌的生物体因更难分解而对土壤的有机库贡献更高。故使用真菌进行模拟腐殖化,对达到植物残体的利用效益最大化更加值得研究。木霉菌是有益真菌,可以促进有机废物利用,且对环境无危害性[17]。里氏木霉(Trichoderma reesei)具有出色的木质纤维素酶的生产能力[18-19]。如果选用里氏木霉这种对玉米秸秆分解矿化表现卓越的真菌,进行腐殖化培养,腐殖化进程是否能够被高效促进?其培养产物类腐殖质(Humic-like substances, HLS)的碱提取物——类胡敏酸的结构特征与土壤胡敏酸有着怎样的差异呢?是否同样具有特异性?
针对上述疑问,本研究选择了对玉米秸秆的木质纤维素综合利用能力较强的真菌:里氏木霉(Trichoderma reesei),通过固体好氧发酵的方式进行为期30 d的腐殖化培养,在培养的0、15、30 d采样观察研究。通过元素组成、红外光谱及差热手段进行分析真菌利用玉米秸秆得到的类腐殖质的碱提取物——类胡敏酸,与土壤的胡敏酸的结构进行比较。以期为阐明真菌培养玉米秸秆得到的HAL的结构特异性以及真菌能否高效促进腐殖化进程提供理论依据。
1 材料与方法 1.1 供试材料 1.1.1 玉米秸秆样品概况采样地点:吉林农业大学试验田玉米连作耕地(43°48′ 43.57″ N,125°23′ 38.50″ E)。采样地点属于北温带大陆性半湿润季风性气候,春秋干旱多风,夏短多雨,冬长寒冷。温度最高月份为7月,平均23 ℃,年均温度为4.8 ℃,年均日照时间为2678 h,年均降水量为618 mm,多集中在7、8月。采样地点的土壤为半湿温半淋溶土亚纲黑土类,也就是所谓的黏淀湿润软土(Argiudolls),含碳量为12.31 g·kg-1,C/N为9.84,于2017年10月4日采集土壤样品,且研究对比所用的土壤HA由该土壤制备。
采样的玉米秸秆植株品种为中金368(采购来源为北京金粒粒金种子有限公司),玉米种子于2017年4月底播种,10月初收获,基本性质为:秸秆有机碳376.4 g·kg-1,全氮为7.44 g·kg-1,全磷7.7 g·kg-1,全钾4.5 g·kg-1,C/N为61.8。实验用玉米秸秆于2017年10月4日采集,然后自然晾干并粉碎至0.5 cm。
1.1.2 供试微生物及微生物菌液的制备里氏木霉(T. reesei)MCG77购买于ATCC(American Type Cilture Collection)。
首先制取菌丝,将里氏木霉接种在固体斜面试管中,内含30 mL培养基。培养基采用马铃薯葡萄糖琼脂培养基(PDA)。将接种好的试管放在28 ℃的培养箱中培养72 h,即制备成功,得到成熟菌丝。向试管中加入2 mL无菌水,振荡2 min,制取菌液,将上述液体转移到灭菌试管中。通过血球计数板计数,计算浓度并稀释,制成孢子浓度为1×107个·mL-1的孢子悬液,最后将菌液加入至PDA液体培养基中,以1:10的比例接种,在温度30 ℃,转速为100 r·min-1的振荡培养箱中振荡培养6 d,得到含有孢团菌丝体的菌液。
PDA培养基:马铃薯(去皮)200 g·L-1,煮沸30 min并过滤,葡萄糖:20 g·L-1,琼脂:20 g·L-1。
PDA液体培养基:马铃薯(去皮)200 g·L-1,煮沸30 min并过滤,葡萄糖:20 g·L-1。
1.2 试验设计 1.2.1 腐殖化培养培养组:将25 g秸秆粉末加入到三角瓶中后密封。置于灭菌锅中进行灭菌处理,参数设定:温度121 ℃,时间40 min。经过灭菌处理后,待温度下降至30 ℃开始加入菌液和无机矿物盐培养液(菌液10 mL、无机盐62.5 mL),用无菌透气性封口膜封口(能够保证空气交换且不会有外界粉尘进入),置于恒温振荡摇床上进行好氧发酵培养。
对照组:以灭菌后加入无机盐、不添加菌液的处理作为空白对照CK。
试验采用G-G 17三角瓶,容积为500 mL。
恒温振荡摇床设定参数:温度30 ℃;转速180 r· min-1(以达到充分振荡通气的目的)。
无机盐培养液含有:(NH2)2CO 4.2 g·L-1,(NH4)2SO4 19.6 g·L-1,CaCl2 0.028 g·L-1,KH2PO4 28 g·L-1,MgSO4 4.2 g·L-1,FeSO4·7H2O 0.07 g·L-1,MnSO4 0.021 g·L-1,ZnSO4 0.019 g·L-1,CoCl2 4.2 g·L-1,酵母膏7 g·L-1,pH=5。
1.2.2 样品采集将腐殖化培养时间设置为0、15、30 d,共3组,每组时间设3个重复。
到培养时间后,分别将样品取出,在55 ℃条件下干燥、粉碎并混匀,全部过0.25 mm筛后备用。
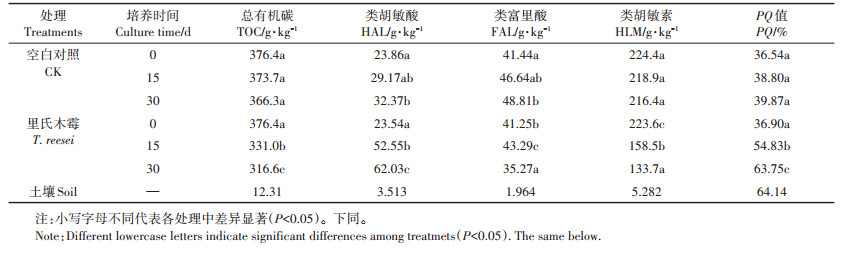
1.3 测定项目与方法 1.3.1 类腐殖质的提取分组参照土壤腐殖质组成修改法[20],从玉米秸秆培养样品中提取类富里酸(FAL)、类胡敏酸(HAL)和类胡敏素(HLM)。通过重铬酸钾氧化法[21]对玉米秸秆的总有机碳含量(TOC)及各组分的含碳量进行测定,并计算HAL的相对含量以及其在类腐殖质中所占比例(PQ值)。
HAL组分相对含量为该组分的有机碳含量占玉米秸秆TOC的百分比:
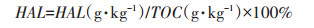
|
PQ值的计算公式:
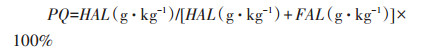
|
比较所用的土壤腐殖质提取分组方法同上。
1.3.2 类胡敏酸的提取与纯化腐殖化产物HLS中的碱提取物HAL:提取纯化根据国际腐殖质协会推荐方法操作[22],具体步骤为:将烘干后的秸秆样品称量2.5 g加入离心管中,加入1 mol·L-1 HCl溶液静置1 h后用浓度为0.1 mol·L-1的HCl调节固液比为1:10。在25 ℃室温条件下振荡离心管6次,每次约10 min,然后低速离心弃上清液,在离心管中加入0.1 mol·L-1NaOH溶液至固液比为1: 10,用1 mol·L-1NaOH调节pH为13~14,立即向离心管中充大约30 s N2并密封。在25 ℃室温下振荡,1次·h-1,12次后静置过夜。静置过夜后低速离心保留上清液HLE(Humus-like extracted),以上碱提取过程重复3次。用6 mol·L-1HCl将HLE调节至pH为1~2,静置过夜后低速离心沉淀即为HAL。用较少量的0.1 mol·L-1KOH溶解沉淀,加入KCl使K离子浓度达到0.3 mol·L-1,静置1 h后高速离心去除悬浮物,用6 mol·L-1 HCl调节pH=1.0,静置12~16 h,高速离心弃上清液得到沉淀为HAL,用0.1 mol·L-1 HCl与0.3 mol· L-1 HF混合溶液酸洗HAL,次日经高速离心弃掉上清液,上述混合酸洗过程共重复3次。酸洗完成后,将离心管中沉淀电渗析至无Cl-(AgNO3检测),经旋转蒸发,冻干,得到最终纯化的HAL干样品。
比较所用的土壤HA的提取纯化方法同上。
1.3.3 结构特征分析测定方法元素组成:采用德产Vario ELIII型元素分析仪测定,在C/H/N模式下进行测量,用差热分析中计算出的水分和灰分对数据进行校正,其中C、H、N元素含量为实测值,O+S元素含量采用差减法计算。
热稳定性:采用日本岛津TA-60型热重分析仪测定,称取样品量为5~7 mg,在60 mL·min-1的空气流量条件下,以15 ℃ · min-1的升温速率由35 ℃升至700 ℃。使用仪器自带软件来进行差热分析(Differential Thermal Analysis,DTA)和热重分析(Thermo Gravimetric Analysis,TG或TGA)。
红外光谱:采用KBr压片法,在美国Nicolet AV- 360傅里叶变换红外光谱仪上进行测定,波数范围为4000~500 cm-1,分辨率为4 cm-1,扫描次数为6,图谱采用Omnic Version 8.2软件包分析,对红外谱图的特征吸收峰进行峰面积计算,并对相对应的特征基团进行半定量分析。
1.4 数据处理使用Excel 2017进行数据处理,SPSS 22.0用作试验后结果的统计分析和差异显著性检验,用Origin 8.6绘制图谱。
2 结果与分析 2.1 不同培养时间HAL的外观及含量变化通过图 1对于HAL的外观观察,可以发现秸秆中提取的HAL是深棕色的,土壤中提取的HA是黑色的,二者在颜色上有很大差异。但无论是T. reesei处理还是CK,HAL的颜色均会随着腐殖化培养时间的增加而变深,而T. reesei处理在30 d的颜色比同期CK处理的颜色要更深,与土壤HA更加相近。

|
图片下方文字为每个样品所对应的门赛尔土壤比色卡颜色标记 The text below the image is the color number of the Munsell Soil Color Charts for each sample 图 1 土壤HA与不同培养时间下HAL的外观比较 Figure 1 Comparison of the appearance between the HAL in different culture times and soil HA |
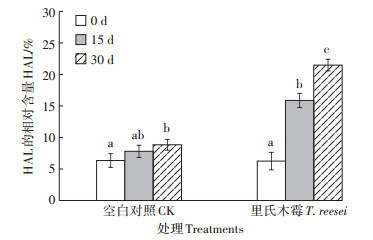
在30 d的腐殖化过程中2种处理的TOC呈下降趋势,T. reesei处理差异显著,HLM的下降是引起TOC下降的主要因素。通过表 1和图 2均可以发现2种处理的HAL的相对含量均随着腐殖化时间的增加而提高,T. reesei处理差异显著。在0 d时,类腐殖质组分中FAL有机碳含量高而HAL有机碳含量低;但在15 d时,T. reesei处理的HAL有机碳含量已超越了同期的FAL;30 d时T. reesei处理的HAL有机碳含量与CK相比增幅更大且差异显著,其HAL的相对含量在30 d高达21.49%,是CK处理2倍左右,其PQ值在此时也是CK处理的近2倍,非常接近土壤的PQ值。但土壤HA的相对含量为28.54%,仍高于HAL的相对含量很多。
|
|
表 1 里氏木霉对玉米秸秆类腐殖质组分有机碳含量的影响 Table 1 Effect of T. reesei of corn straw on composition and PQ value of soil humus |
|
不同小写字母代表处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant differences among treatments (P < 0.05). The same below 图 2 里氏木霉处理下不同培养间的HAL相对含量 Figure 2 Relative contents of HAL under T. reesei treatment in different culture time |
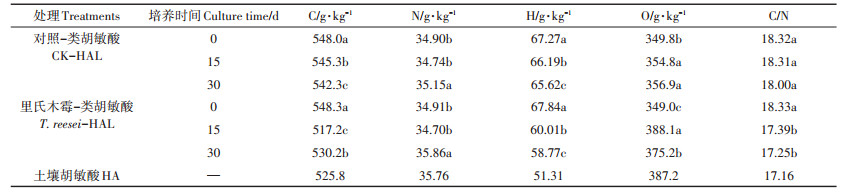
表 2为不同时间下里氏木霉对HAL元素组成的影响情况。HAL在腐殖化期间呈现C高O低的状态,C元素占HAL元素组成的50%以上。2种处理的HAL的C/N在培养一开始均在18.3左右,随着腐殖化时间的增加均呈现不同程度的下降趋势,T. reesei处理的下降幅度大于CK处理,并在30 d时接近土壤HA的C/N比值;2种处理的HAL在30 d内H元素均下降,O元素均增高,T. reesei处理的变化幅度更大。
|
|
表 2 不同培养时间下里氏木霉对HAL元素组成的影响 Table 2 Effect of T. reesei on the elemental composition of HAL in different culture time |
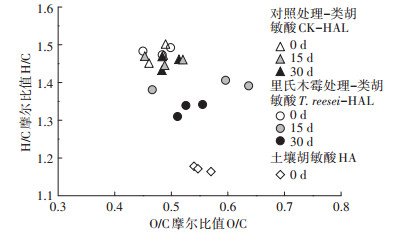
通过对元素组成分析,可以简单分析和判断样品中分子结构的变化情况。H/C可以直观地表征HA的缩合度,O/C可以表征氧化度强弱,与含氧基团数量成正比[23]。根据分析结果采用H/C和O/C原子比绘制出图 3,即范氏图(Van Krevelen图)。
|
图 3 不同培养时间下HAL中H/C和O/C的相关性 Figure 3 Correlation of H/C and O/C in HAL in different culture time |
在腐殖化培养开始时,无论是T. reesei还是CK处理,其碱提取物HAL都处于O/C=0.482、H/C=1.471附近的位置上;培养15 d以后,CK处理的位置仅有微小变化,而T. reesei处理的O/C升高,H/C下降;培养30 d时,CK处理的位置更加集中在O/C=0.494、H/C=1.452的附近,而T. reesei处理的位置却更加集中在O/C= 0.531、H/C=1.330的附近,在30 d内与土壤HA的O/C差异缩减了71.08%,H/C比值差异缩减了49.25%,更加接近土壤HA的结构特征。
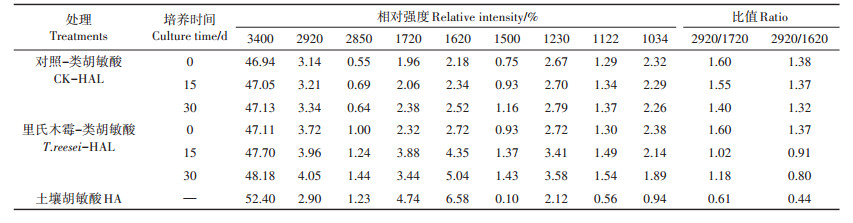
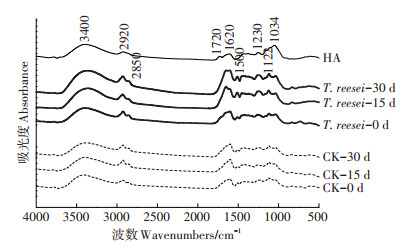
2.3 不同培养时间HAL的红外光谱不同腐殖化培养时间的T. reesei、CK处理的HAL与土壤HA的FTIR如图 4所示。T. reesei与CK处理相比在官能团区的吸收峰强度变化较大,而在指纹区仅略有变化,特征峰的相对影响强度的半定量分析见表 3。
|
图 4 不同培养时间T. reesei、CK处理下的HAL与土壤HA的FTIR谱图 Figure 4 FTIR spectras of HA of soil, HAL of T. reesei and CK treatments in different culture time |
|
|
表 3 不同培养时间下T. reesei、CK处理下的HAL与土壤HA的FTIR光谱主要吸收峰相对强度比较 Table 3 Effects of relative intensity of the main absorption peaks in the FTIR spectrum of HA of soil, HAL by T. reesei and CK treatments in different culture time |
官能团区中3400 cm-1处的宽峰是由酚类ArOH、羟基或羧基的O-H振动引起。相比于CK,T. reesei处理可随着模拟腐殖化时间的增加,增加HAL的羟基含量。2920 cm-1代表不对称脂族-CH3的C-H伸缩振动峰,2850 cm-1代表-CH2-对称脂族C-H伸缩振动峰[24],1720 cm-1则由羧基、醛或酮的C═O振动所致[25],I2920/I1720的值可以衡量脂族含量[26]。2种处理的HAL在2920 cm-1的吸收峰的相对强度在整个培养期间均随时间而增加,T. reesei的增幅大于CK;T. reesei、CK处理在1720 cm-1的吸收峰相对强度在0~15 d均增加,但在15~30 d时CK仍保持增加的同时T. reesei却下降了。T. reesei处理的I2920/I1720值在0~15 d下降了0.58,而CK在此期间仅降了0.05;在15~30 d时T. reesei处理的I2920/I1720值回升,较同期仍保持下降的CK处理小0.22。1620 cm-1及1500 cm-1处来自芳香烃的C═C骨架振动(呼吸),在确定是否有芳核的存在时有重要意义。因此I2920/I1620值可以衡量芳香性的强弱。T. reesei处理的HAL的I2920/I1620值在0~15 d降低了0.46,在15~30 d时下降了0.07,而同期的CK处理在30 d内仅下降了0.06。T. reesei处理的HAL的2项比值在培养的30 d过程中更接近土壤HA,但仍与土壤HA有很大差距。
指纹区中1230 cm-1的峰归属于芳香基团的C-OH振动或芳基醚和酚类的C-O-C振动,脂族的C-OH振动可引起1122 cm-1处峰[27]。2种处理在上述2处的吸收峰相对强度在30 d内持续增加,其中T. reesei处理的增幅更大。1034 cm-1处的峰可代表多糖与类多糖物质中C-O的存在。T. reesei处理的HAL在1034 cm-1处的相对强度随培养时间增加而持续降低,而CK在此处无明显变化。
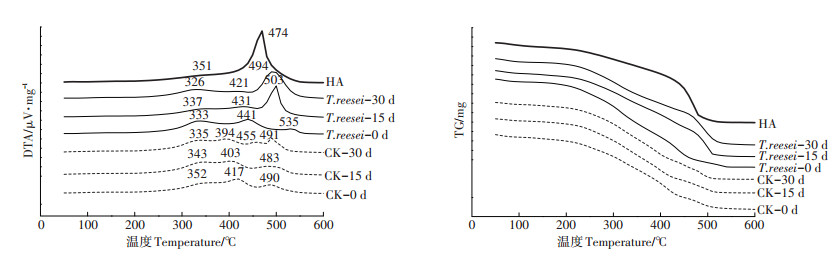
2.4 不同培养时间HAL的热稳定性变化图 5是HAL的DTA及TG曲线,HAL样品在分解过程中表现为中温放热(326~352 ℃)和高温放热(394~535 ℃),且HAL始终较土壤HA多一个(394~ 455 ℃)高温放热峰。值得注意的是CK处理在0 d时DTA曲线与T. reesei处理相似,但其从左至右的高温放热峰较同期T. reesei处理的分别低24、45 ℃;15 d时,T. reesei处理的高温放热峰发生明显变化,而CK处理的DTA曲线线型仍与0 d相似;在30 d时CK处理的高温峰发生了分峰现象,而T. reesei处理在30 d时的DTA曲线线型则与土壤HA更加接近。T. reesei处理的高温峰随着培养时间的增加发生了左移,并逐渐接近土壤HA放热峰的分布位置。
|
图 5 里氏木霉对HAL的DTA与TG曲线的影响 Figure 5 Effects of T.reesei on DTA and TG curves of HAL |
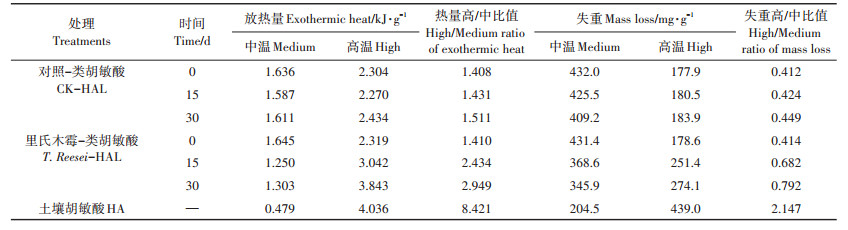
表 4为HAL的半定量分析,T. reesei、CK处理均随着模拟腐殖化时间的增加,其HAL的热量高/中、失重高/中比值在0~15 d不同程度地增加,T. reesei在30 d时的失重高/中比值有微小下降,30 d内其2项比值分别提升了1.539、0.378;CK处理的2项比值在30 d内仅提升了0.103、0.037。
|
|
表 4 不同培养时间下里氏木霉HAL及土壤HA的放热与失重比较分析 Table 4 Exothermic heat and mass loss of T. reesei' s HAL in different culture times and soil HA |
仅通过外观变化便可以判定,HAL与成熟土壤中的HA仍存在着很大的差别,但伴随着腐殖化过程中T. reesei对玉米秸秆的转化合成与利用,使其在外观上更加接近了HA,缩小了原本的差异。不仅是外观的变化,HAL的相对含量在30 d时已经是同期CK的2倍。Juradom等[28]发现半纤维素、纤维素和木质素降解率比未接种微生物的堆体分别高28%、21%和25%,接种微生物可以增加HS的数量从而加快腐殖化进程。李国平等[29]认为放入微生物菌剂能够较为显著增加胡敏酸含量。
通过对不同腐殖化时间下HAL元素组成分析,发现接种T. reesei可以有效降低HAL的C/N值。在腐殖化的过程中C和N是最重要的2种元素,C为微生物提供能源,N可以提供微生物建造细胞结构[30]。Eneji等[31]通过元素分析得出秸秆堆肥过程中类胡敏酸的结构是C高O低的,表明其氧化程度较低,同时堆肥过程中有机物含量、总C含量一般呈减少的趋势,但腐殖酸的相对含量是增加的。Amir等[32]通过元素分析得出,在好氧发酵过程中HA的H含量减少,H/C值和C/N值下降。而在本实验中,C元素在HAL中表现为先下降后升高的变化趋势。这可以归因于在15~30 d的高分解阶段,释放出了一些来自其他顽固结构(如木质素)中的一些脂族化合物。SánchezMonedero等[33]曾研究表明,在堆肥过程中一些其他物质如木质素的降解残留物被释放出来,其表现的特征与HA类似,并会在pH=2时沉淀。
通过分析范氏图的分布状况,结合FTIR谱图,可以得出接种T. reesei处理的HAL的O/C呈现出均值增加又略有下降的趋势,可以归因于在15~30 d新被释放出的氧化度较低的脂族化合物致使O/C值下降,这与HAL在30 d时的I2920/I1720值和中温放热回升、失重下降变缓的结果相符。T. reesei处理下的HAL的H/C却能持续降低,且在FTIR和DTA、TG的分析结果中显示前0~15 d时HAL的芳香性增加速度高于15~30 d。促成这种现象的原因是0~15 d的腐殖化过程中,HAL中的脂族碳易被利用,而芳香碳较稳定在此期间被保留,即核心胡敏酸(cHAL)在此期间逐渐暴露,致使H/C下降,这一结果符合多酚学说。Adani等[34]将HAL分为不易被生物利用的的稳定组分(芳香碳)和易被微生物降解的不稳定组分(脂肪族碳)研究,他提出HAL的形成是通过不稳定部分的降解和更稳定部分的保存而进行。但HAL的降解与合成是同时进行的,很显然在15~30 d时,伴随着降解过程中脂族性物质的不断释放增多,芳香族/脂肪族的比例仍在显著提升,这要归功于T. reesei的合成作用。Jouraiphy等[35]通过傅里叶红外光谱分析,发现HS在好氧发酵后芳香结构增多,其来源于发酵原料和微生物合成。Awasthi等[36]研究表明,接种真菌处理的HAL芳香化程度比未接种处理更高。在本研究的FTIR的半定量分析中,T. reesei处理下的HAL在1620 cm-1处和1500 cm-1处来自芳香烃的C═C骨架振动的吸收峰强度持续增加、I2920/I1620比值持续降低也均可证明HAL的结构在模拟腐殖化的过程中芳香性持续增加。在HAL和HLS的DTA与TG分析中也可以发现接种T. reesei可以在30 d内大幅改变芳香性与脂族性物质的比例分布,增加热稳定性。
通过观察FTIR谱图中1034 cm-1处的相对强度变化,可以判断在T. reesei处理下的HAL中,多糖类物质在30 d内大幅下降,相对于HAL中的其他碳源,多糖更容易被T. reesei消耗和利用,González-Pérez等[37]认为多糖在HA中的含量可以表征该土壤有机质组成与植物残体的接近程度。HA中的多糖类物质含量越低,其腐殖质越成熟,1034 cm-1处影响强度的降低预示着T. reesei可以在30 d内有效促进HAL向成熟的HA转化。
4 结论(1)在30 d的腐殖化过程中,接种里氏木霉(T. reesei)可以显著改变其培养产物的碱提取物——类胡敏酸(HAL)的结构特征,其芳香性/脂族性的比例变化支持了多酚学说。
(2)HAL在整个过程中随着模拟腐殖化时间的增加,与土壤HA的特征差异持续缩小。里氏木霉可以在30 d内将HAL的元素结构集中在O/C=0.528、H/ C=1.322左右,与土壤HA的O/C比值、H/C比值差异缩减了71.08%、49.25%。
(3)里氏木霉在降低HAL的脂族性、增强芳构化程度和热稳定性方面能力很强,可以高效促进玉米秸秆的腐殖化进程。虽然里氏木霉处理下的HAL并不具备与土壤HA完全相同的特异性,但其可随着模拟腐殖化时间的增加,与土壤HA的结构特征差异持续缩小,逐渐具有特异性。为利用里氏木霉与玉米秸秆腐殖化的应用提供参考。
| [1] |
唐景春, 孙青, 王如, 等. 堆肥过程中腐殖酸的生成演化及应用研究进展[J]. 环境污染与防治, 2010(5): 73-77, 88. TANG Jing-chun, SUN Qing, WANG Ru, et al. Progress in the formation, evolution and application of humic acid during composting[J]. Environmental Pollution and Prevention, 2010(5): 73-77, 88. DOI:10.3969/j.issn.1001-3865.2010.05.017 |
| [2] |
Zhang L, Zhang H, Wang Z, et al. Dynamic changes of the dominant functioning microbial community in the compost of a 90 m3 aerobic solid state fermentor revealed by integrated meta-omics[J]. Bioresoure Technology, 2016, 203: 1-10. DOI:10.1016/j.biortech.2015.12.040 |
| [3] |
Zhang X, Zhong Y, Yang S, et al. Diversity and dynamics of the microbial community on decomposing wheat straw during mushroom compost production[J]. Bioresource Technology, 2014, 170: 183-195. DOI:10.1016/j.biortech.2014.07.093 |
| [4] |
窦森, 李艳, 关松, 等. 腐殖物质特异性及其产生机制[J]. 土壤学报, 2016(4): 821-831, 53. DOU Sen, LI Yan, GUAN Song, et al. The structural distinctiveness of humic substances and its formation mechanism in simulated incubation[J]. Acta Pedologica Sinica, 2016(4): 821-831, 53. |
| [5] |
Rodríguez F J, Schlenger P, García-Valverde M. A comprehensive structural evaluation of humic substances using several fluorescence techniques before and after ozonation. Part Ⅰ:Structural characterization of humic substances[J]. Science of the Total Environment, 2014, 476/477: 718-730. DOI:10.1016/j.scitotenv.2013.11.150 |
| [6] |
Schulten H R, Schnitzer M. A state of the art structural concept for humic substances[J]. Naturwissenschaften, 1993, 80: 29-30. DOI:10.1007/BF01139754 |
| [7] |
Kelleher B P, Simpson A J. Humic substances in soils:Are they really chemically distinct?[J]. Environmental Science & Technology, 2006, 40: 4605-4611. |
| [8] |
Kawasaki S, Maie N, Watanabe A. Composition of humic acids with respect to the degree of humification in cultivated soils with and without manure application as assessed by fractional precipitation[J]. Soil Science and Plant Nutrition, 2008, 54(1): 57-61. DOI:10.1111/j.1747-0765.2007.00219.x |
| [9] |
Camiatelli P, Ceppi S. Effects of composting technologies on the chemical and physicochemical properties of humic acids[J]. Geoderma, 2008, 144(1/2): 325-333. |
| [10] |
Quagiltto P L, Montonoeri E, Tambone F, et al. Chemicals from wastes:Compost-derived humic acid-like matter as surfactant[J]. Environment Science Technology, 2006, 40(5): 1686-1692. DOI:10.1021/es051637r |
| [11] |
Genevini P, Adani F, Veeken A H, et al. Qualitative modifications of humic acid-like and core-humic acid-like during high-rate composting of pig faeces amended with wheat straw[J]. Soil Science and Plant Nutrition, 2002b, 48(2): 143-150. DOI:10.1080/00380768.2002.10409184 |
| [12] |
付丽丽.作为秸秆纤维素降解菌的分离与筛选[D].杭州: 浙江大学, 2012. FU Li-li, Separation and screening of straw cellulose degrading bacteria[D]. Hangzhou: Zhejiang University, 2012. |
| [13] |
Bahri H, Rasse D P, Rumpel C, et al. Lignin degradation during a laboratory incubation followed by 13C isotope analysis[J]. Soil Biology and Biochemistry, 2008, 40(7): 1916-1922. DOI:10.1016/j.soilbio.2008.04.002 |
| [14] |
Sánchez C. Lignocellulosic residues:Biodegradation and bioconversion by fungi[J]. Biotechnology Advances, 2009, 27(2): 185-194. DOI:10.1016/j.biotechadv.2008.11.001 |
| [15] |
Grover M, Maheswari M, Desai S, et al. Elevated CO2:Plant associated microorganisms and carbon sequestration[J]. Applied Soil Ecology, 2015, 95: 73-85. DOI:10.1016/j.apsoil.2015.05.006 |
| [16] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2(8): 17105. DOI:10.1038/nmicrobiol.2017.105 |
| [17] |
宋仅星.新型稻草还田多功能复合菌系的构建及其功能研究[D].合肥: 安徽农业大学, 2011. SONG Jin-xing. Construction and functional study of a novel multifunctional compound strain of straw returning to the field[D]. Hefei: Anhui Agricultural University, 2011. http://xueshu.baidu.com/s?wd=paperuri%3A%283754da481b89632b456a6a9878b894fa%29&filter=sc_long_sign&tn=SE_xueshusource_2kduw22v&sc_vurl=http%3A%2F%2Fcdmd.cnki.com.cn%2FArticle%2FCDMD-10364-1013163390.htm&ie=utf-8&sc_us=3177506165919732722&sc_as_para=sc_lib%3A |
| [18] |
Reynaldo D C, Felipe R P, Cristóbal N A, et al. Forced aeration inluence on the production of spores by Trichoderma strains[J]. Waste Biomass Valorization, 2017, 8: 2263-2270. |
| [19] |
Gastón E O, María E G, et al. Characterization, optimization, and scale-up of cellulases production by Trichoderma reesei cbs 836. 91 in solid-state fermentation using agro-industrial products[J]. Bioprocess Biosystems Engineering, 2015, 38: 2117-2128. DOI:10.1007/s00449-015-1451-2 |
| [20] |
Kumada K, Sato O, Ohsumi Y, et al. Humus composition of maintain soil in central Japan with special reference to the distribution of Ptype humic acid[J]. Soil Science and Plant Nutrition, 1967, 13(5): 151-158. DOI:10.1080/00380768.1967.10431990 |
| [21] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 30-34. LU Ru-kun. Soil agricultural chemical analysis method[M]. Beijing: China Agricultural Science and Technology Press, 2000: 30-34. |
| [22] |
Kuwatsuka S, Watanabe A, Itoh K, et al. Comparison of two methods of preparation of humic and fulvic acids, IHSS method and NAGOYA method[J]. Soil Science and Plant Nutrition, 1992, 38(1): 23-30. DOI:10.1080/00380768.1992.10416948 |
| [23] |
窦森. 土壤有机质[M]. 北京: 科学出版社, 2010: 95-98. DOU Sen. Soil organic matter[M]. Beijing: Science Press, 2010: 95-98. |
| [24] |
Filip Z, Tesarová M. Microbial degradation and transformation of humic acids from permanent meadow and forest soils[J]. Intrenational Biodeterioration & Biodegradation, 2004, 54: 225. |
| [25] |
Zhang Y L, Du J Z, Zhang F F, et al. Chemical characterization of humic substances isolated from mangrove swamp sediments:The Qinglan area of Hainan Island, China[J]. Estuarine, Coastal and Shelf Science, 2011, 93: 220. DOI:10.1016/j.ecss.2010.12.025 |
| [26] |
肖彦春, 窦森. 土壤腐殖质各组分红外光谱研究[J]. 分析化学, 2007, 11(35): 1596. XIAO Yan-chun, DOU Sen. Infrared spectroscopy study on various components of soil humus[J]. Chinese Journal of Analytical Chemistry, 2007, 11(35): 1596. |
| [27] |
Zhang J J, Hu F, Li H X, et al. Effects of earthworm activity on humus composition and humic acid characteristics of soil in a maize residue amended rice-wheat rotation agroecosystem[J]. Applied Soil Ecology, 2011, 51: 1-8. DOI:10.1016/j.apsoil.2011.08.004 |
| [28] |
Juradom M, Suárez-estrella F, López M J, et al. Enhanced turnover of organic matter fractions by microbial stimulation during lignocellulosic waste composting[J]. Bioresource Technology, 2015, 186: 15-24. DOI:10.1016/j.biortech.2015.03.059 |
| [29] |
李国平, 杨鹭生, 王宇晴, 等. 不同微生物菌剂对芒萁秸秆腐熟过程中腐殖质构成的影响[J]. 热带作物学报, 2015, 36(4): 719-723. LI Guo-ping, YANG Lu-sheng, WANG Yu-qing, et al. Effects of several microorganisms on humus formation in stalk decomposition of Dicranopteris dichotoma[J]. Chinese Journal of Tropical Crops, 2015, 36(4): 719-723. DOI:10.3969/j.issn.1000-2561.2015.04.014 |
| [30] |
Iqbal M K, Shafiq T, Hussain A, et al. Effect of enrichment on chemical properties of MSW compost[J]. Bioresource Technology, 2010, 101(15): 5969-5977. DOI:10.1016/j.biortech.2010.02.105 |
| [31] |
Eneji A E, Honna T, Yamamoto S, et al. Changes in humic substances and phosphorus fractions during composting[J]. Communications in Soil Science and Plant Analysis, 2003, 34: 15-16. |
| [32] |
Amir S, Jouraiphy A, Meddich A, et al. Structural study of humic acids during composting of activated sludge-green waste:Elemental analysis, FTIR and 13C NMR[J]. Journal of Hazardous Materials, 2010, 177(1/2/3): 524-529. |
| [33] |
Sánchez-Monedero M, Roig A, Cegarra J, et al. Relationships between water-soluble carbohydrate and phenol fractions and the humification indices of different organic wastes during composting[J]. Bioresource Technology, 1999, 70(2): 193-201. DOI:10.1016/S0960-8524(99)00018-8 |
| [34] |
Adani F, Ricca G. The contribution of alkali soluble(humic acidlike)and unhydrolyzed-alkali soluble(core-humic acid-like)fractions extracted from maize plant to the formation of soil humic acid[J]. Chemosphere, 2004, 56(1): 13-22. DOI:10.1016/j.chemosphere.2004.01.040 |
| [35] |
Jouraiphy A, Amir S, Winterton P, et al. Structural study of the fulvic fraction during composting of activated sludge-plant matter:Elemental analysis, FTIR and 13C NMR[J]. Bioresource Technology, 2008, 99(5): 1066-1072. DOI:10.1016/j.biortech.2007.02.031 |
| [36] |
Awasthi M K, Pandey A K, Khan J, et al. Evaluation of thermophilic fungal consortium for organic municipal solid waste composting[J]. Bioresource Technology, 168: 214-221. DOI:10.1016/j.biortech.2014.01.048 |
| [37] |
González-Pérez M, Torrado P V, A Colnaga L A, et al. 13C NMR and FTIR spectroscopy characterization of humic acids in spodosols under tropical rain forest in southeastern Brazil[J]. Geoderma, 2008, 146: 425. DOI:10.1016/j.geoderma.2008.06.018 |
 2019, Vol. 38
2019, Vol. 38