2. 汕头大学, 广东 汕头 515021
2. Shantou University, Shantou 515021, China
磷是植物体内基本元素之一,是植物体内核酸、磷脂、辅酶等多种化合物的主要组成部分,也是高能磷酸化合物的主要元素之一,参与植物体内的代谢和能量转移[1]。磷在土壤里的移动性差,磷肥施入土壤后作物当季利用率仅10%~25%,造成土壤全磷量颇丰,而有效磷含量很低[2]。大量磷肥的使用,在作物增产的同时,也对环境产生了不可忽视的负面影响,如土壤酸化板结、水体富营养化等[3]。叶面磷肥作为根外追肥可有效减少土壤肥料使用量,提高肥料利用率,针对性强,吸收快,同时也减少了对土壤的负面影响。叶面磷肥主要有磷酸二氢钾、磷酸二氢钠、多聚磷酸盐等,多聚磷酸盐(如三聚或四聚磷酸盐)的喷施效果好于正磷酸盐及其他形态无机磷,叶面磷肥的使用可显著提高植物磷含量,减少作物蒸腾作用,增强光合作用,促进植物生长,提高植物抗逆性[4]。目前叶面肥种类繁多,无机营养型直接提供必需元素;氨基酸、腐植酸、生长调节剂、表面活性剂和螯合剂等加营养元素型在为植物提供营养物质的同时也直接调节了植物生长,促进了营养元素的吸收[5-6]。
纳米技术的快速发展和工程纳米材料的大量生产以及纳米材料独特的理化性质,使得纳米材料在作物栽培上的使用越来越广泛。基于纳米材料的一些独特的理化性质[7-8],如尺寸效应、界面与表面效应,以及较高的表面活性等,已经有一些研究将纳米材料应用到土壤与植物营养领域[9]。纳米材料的不同施用方式,如根施、叶面喷施以及和其他材料混合施用都对不同植物的生长发育、产品品质起到不同程度的促进作用[10-15]。纳米羟基磷灰石(nHA),分子式:Ca10(PO4)6(OH)2,具有良好的生物相容性,广泛应用于生物医学上[16-18],并能提供磷源;纳米三氧化二铁(nFe2O3)和纳米零价铁(nFe),可提供铁元素,纳米三氧化二铁可降解H2O2[19],纳米零价铁的暴露,使叶面积增加,气孔孔径更宽,从而可能导致CO2摄取增加[20];许多研究[21]表明稀土元素可以刺激植物吸收、转移和吸收营养物质,能显著提高植物体内营养物质的代谢,在植物上喷洒稀土通常被认为是比在稀土中混合种子更好的方法,并且纳米二氧化铈(nCeO2)在适量情况下不会对植物产生毒害作用[22];甲壳素(CH,(C8H13NO5)n)也可促进植物生长[23],增加植物体内可溶性糖、蛋白等物质,提高植物抗逆性。
叶面喷施相较于根施更直接作用于植物叶片[24],养分进入叶肉细胞后参与植物生理活动,植物对其利用效果与根部吸收的养分相同[6]。生物量是光合效率的直接表征[25],非生物胁迫和生物胁迫是限制植物生长的主要因素,植物受到胁迫后往往会减少生物量和作物产量[26],因此生物量是植物生长状态最直观的反映方式。而喷施纳米材料对水稻幼苗生物量和磷含量的影响还未见报道。利用水培实验,研究在不同磷素供给水平下,叶面喷施不同纳米材料对水稻幼苗吸收磷素的影响,以期为纳米材料叶面施用提供支撑。
1 材料与方法 1.1 实验材料水稻种子早籼稻24(X24),购自湖南隆平种业有限公司,进行水培试验。
40 nm羟基磷灰石悬浊液(nHA),纯度99.9%,体积密度0.8 g·cm-3;40 nm羟基磷灰石悬浊液(nHA),纯度99.9%,体积密度0.8 g·cm-3;40 nm三氧化二铁(nFe2O3);40 nm零价铁(nFe);40 nm二氧化铈(nCeO2),均购自北京德科岛金科技有限公司。甲壳素(CH,(C8H13NO5)n,MW:203.19),购自上海阿拉丁生化科技股份有限公司。
超纯水(> 18 MΩ·cm)使用Barnstead E-Pure water(Thermo Scientific,Dubuque,IA,USA)系统制备。
所有化学药品均为分析纯试剂。
1.2 水稻培育选饱满种子用浓度5% H2O2浸泡,消毒30 min,用去离子水冲洗若干次,同时除去悬浮种子。用同样的方法清洗消毒网格育苗盘。剩余种子均匀铺在育苗盘网格上,倒入去离子水,水量刚刚浸到种子。放入恒温培养箱(28 ℃,湿度80%)中,催芽48 h。露白后移入人工气候室,白天温度28 ℃,夜间温度25 ℃,光照时长16 h·d-1,光照强度400 μmol·m-2·s-1,遮光处理2 d。水稻幼苗长到两叶一心后,挑选长势一致的幼苗,移入8 L装有1/10营养液(国际水稻所营养液配方配制)水培箱,调节pH至5.5~6。三叶一心时,更换营养液浓度为1/4。培育6 d后进行处理。
1.3 试验设计营养液含磷量设置为正常营养液,来探究正常生长条件下喷施不同纳米材料对水稻幼苗生物量和磷含量的影响。分别喷施0、50、100、150、200 mg·L-1和500 mg·L-1的nHA、nFe2O3、nFe。用超纯水稀释至所需浓度,使用CNC超声清洗装置(昆山超声波仪器有限公司)100 Hz超声处理30 min,加冰控制温度不高于20 ℃,保证粒子分散均匀,每次处理前超声30 min。每天上午9点处理一次,下午3点处理一次,每次处理大约喷施20 mL(使喷施液体尽量均匀分布在叶片上),每个处理3个重复,处理14 d。
营养液含磷量设置为正常营养液的1/2,1/2的NH4·H2PO4使用NH4Cl补充N元素,以形成缺磷条件,探究缺磷条件下喷施不同纳米材料对水稻幼苗生物量和磷含量的影响。喷施0、50、100、150、200 mg·L-1和500 mg·L-1的nHA、nFe2O3、nFe、nCeO2和CH。每个处理3个重复,处理20 d。
1.4 测量指标 1.4.1 水稻干质量测定每个处理随机取9株幼苗,用超纯水冲洗水稻幼苗,用滤纸按压,吸去幼苗外部超纯水,分为茎叶和根系两部分,分别装入信封,放入烘箱110 ℃杀青15 min,75 ℃烘干至恒质量。剪碎后用分析天平称量。
1.4.2 水稻全磷含量测定取称完干质量的样品,加水润湿,加入5 mL H2SO4,过夜后消煮,待硫酸发白烟,溶液呈褐色时,停止加热。稍冷后加入10滴H2O2,继续加热消煮,冷却,再滴加H2O2消煮,如此反复至溶液呈无色或清亮后再继续加热5 min,除尽多余的H2O2。冷却后,定容到100 mL容量瓶中,过滤即得待测液A,同时做试剂空白试验。加入适量样品,稀释,滴二硝基酚指示剂,滴加氢氧化钠溶液中和至刚呈黄色,再加入1滴2 mol·L-1硫酸溶液,使溶液的黄色刚刚褪去,然后加入钼锑抗显色剂5 mL,定容。用分光光度计在波长700 nm处测定其吸光度,计算直线回归方程。
样品中磷(P)的含量以质量分数w 计,数值以克每百克(g·100 g-1)表示,按下式进行计算[27]:

|
式中:ρ 为待测液A中磷(P)质量浓度,mg·L-1;v 为待测液A定容体积,mL;v1为吸取待测液A体积,mL;v2为显色溶液定容体积,mL;m为试样质量,g。
1.5 数据处理数据用Excel 2007进行统计绘图,使用SPSS软件(18.0版,美国)进行单因素方差分析(ANOVA)和Duncan检验,使用Origin 8.6作图。
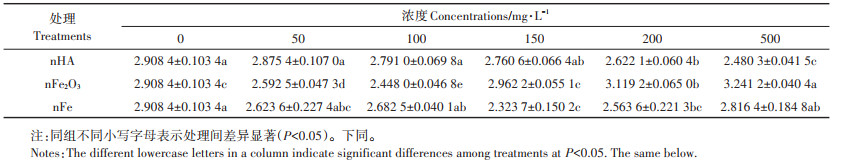
2 结果与分析 2.1 对生物量的影响正常含磷营养液培养,喷施0、50、100、150、200 mg·L-1和500 mg·L-1 nHA、nFe2O3、nFe(图 1中HA、Fe2O3、Fe)处理14 d后,测量地上部生物量(图 1)和根部生物量(图 2)。nHA处理后,随着处理浓度的增加,地上部生物量也不同程度地增加。地上部生物量在200 mg·L-1处理时达到最大,相较于对照组增加了19.97%。nFe2O3处理后,地上部生物量在100 mg·L-1处理时达到最高,比对照组增加了12.94%。nFe处理后,地上部生物量在150 mg·L-1处理时达到最高,增加了26.49%,是各个处理中生物量增加最多的处理。
|
同组不同小写字母表示处理间差异显著(P < 0.05)。下同 The different lowercase letters in a column indicate significant differences among treatments at P < 0.05. The same below 图 1 全磷营养液喷施三种不同纳米材料处理后地上部生物量 Figure 1 Shoot biomass after treatment of three different nanomaterials by total phosphorus nutrient solution |

|
图 2 全磷营养液喷施三种不同纳米材料处理后根部生物量 Figure 2 Root biomass after treatment of three different nanomaterials by total phosphorus nutrient solution |
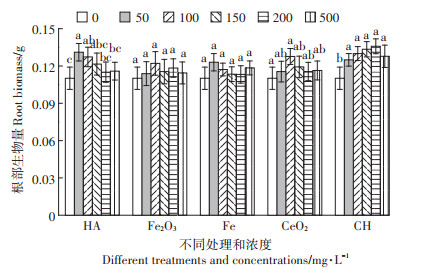
不同浓度nHA处理后,根部生物量随处理浓度的升高先增加再降低,整体促进了根部生物量,并在150 mg·L-1处理时根部生物量增长最多,比对照组增加了15.53%;地上部在200 mg·L-1处理时增加最多,而根部增加了11.26%。nFe2O3处理后,在100 mg·L-1处理时,根部生物量达到最高,增加了11.97%,根部和地上部生物量同时达到最多。nFe处理的情况下,100 mg · L-1处理时生物量增加最多,比对照增加15.87%。
为了制造水稻培养在供磷不充足的条件,我们将营养液中磷含量减少了1/2。在含磷为正常营养液含量1 / 2培养条件下,对水稻喷施5种材料nHA、nFe2O3、nFe、nCeO2和CH处理,为了使处理效果更明显,处理时间增加到了20 d,各处理地上部和根部生物量如图 3、图 4所示。

|
图 3 1/2磷营养液喷施五种不同纳米材料处理后地上部生物量 Figure 3 Shoot biomass after treatment of five different nanomaterials by 1/2 phosphorus nutrient solution |
|
图 4 1/2磷营养液喷施五种不同纳米材料处理后根部生物量 Figure 4 Root biomass after treatment of five different nanomaterials by 1/2 phosphorus nutrient solution |
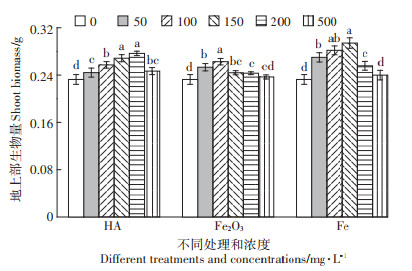
50 mg·L-1的nHA处理,使水稻地上部生物量增加最多,增加了26.33%。nFe2O3处理后,地上部生物量在100 mg·L-1时达到最大,增加了13.29%。nFe处理后,100 mg · L-1处理生物量达到最大,增加了14.32%。nCeO2处理后,生物量在100 mg·L-1处理时增加最多为14.50%。CH处理后,150 mg·L-1处理时生物量达到最高,增加了16.27%。
根部的生物量如图 4所示。nHA处理后,50 mg· L-1处理根部生物量达到最高,增加了18.97%。nFe2O3处理后,在100 mg·L-1处理时,生物量达到最高,增加了10.82%,地上部在此处理时也达到最高。nFe处理后,50 mg·L-1处理生物量增加最多,增加了11.68%。nCeO2处理后,100 mg · L-1时生物量增加最多,为15.88%。CH处理后,在200 mg·L-1处理时生物量增加最多,为23.33%,在所有处理中增加最多。
2.2 对磷素吸收的影响正常含磷营养液培养,喷施0、50、100、150、200 mg·L-1和500 mg·L-1 nHA、nFe2O3、nFe处理14 d后,测量地上部和根部磷含量。如图 5所示,nHA处理后,随着处理浓度的增加,地上部磷含量也不同程度地增加,相较于对照组,地上部磷含量也在200 mg·L-1时达到最高,比对照组增加了6.07%。nFe2O3处理后,磷含量在100 mg·L-1处理时达到最高,增加了8.11%,地上部生物量也是在此时增加最多。nFe处理后,地上部磷含量随着生物量的增加而减少,最少含量是150 mg·L-1处理时,比对照减少了14.22%。
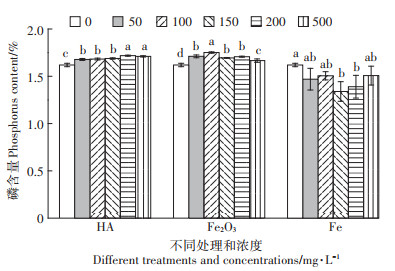
|
图 5 全磷营养液喷施三种不同纳米材料处理后地上部磷含量 Figure 5 Shoot phosphorus content after treatment of three different nanomaterials by total phosphorus nutrient solution |
如图 6所示,不同浓度nHA处理后,根部磷含量随着处理浓度增加一直增加,在500 mg·L-1时达到最高,增加了23.78%。nFe2O3处理后,在100 mg·L-1处理时,根部磷含量达到最高,增加了28.40%。nFe处理的情况下,各处理对磷含量影响不大,100 mg·L-1处理时磷量增加最多,比对照增加3.39%。

|
图 6 全磷营养液喷施三种不同纳米材料处理后根部磷含量 Figure 6 Root phosphorus content after treatment of three different nanomaterials by total phosphorus nutrient solution |
在含磷为正常营养液含量1/2培养条件下,对水稻喷施5种材料nHA、nFe2O3、nFe、nCeO2和CH处理,处理20 d,各处理地上部和根部磷含量如图 7、图 8所示。
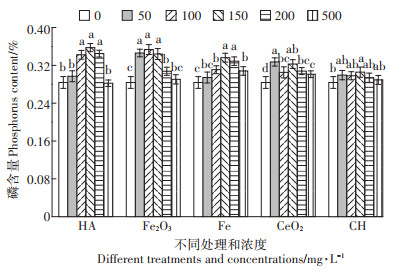
|
图 7 1/2磷营养液喷施五种不同纳米材料处理后地上部磷含量 Figure 7 Shoot phosphorus content after treatment of five different nanomaterials by 1/2 phosphorus nutrient solution |

|
图 8 1/2磷营养液喷施五种不同纳米材料处理后根部磷含量 Figure 8 Root phosphorus content after treatment of five different nanomaterials by 1/2 phosphorus nutrient solution |
50 mg·L-1的nHA处理,使水稻地上部生物量增加最多,增加了26.33%,磷含量只增加了4.66%;而在150 mg · L-1处理时,磷含量增加最多,为25.98%。nFe2O3处理后,磷含量在100 mg·L-1时达到最大,增加了24.55%。nFe处理后,磷含量在150 mg·L-1时达到最大,增加了18.49%。nCeO2处理后,磷含量在100 mg·L-1含量达到最高,增加15.32%。CH处理后,150 mg·L-1处理时磷含量达到最高,增加7.69%,各处理磷含量均有增加,增加量并不多。
nHA处理后,50 mg·L-1处理根部生物量达到最高,而磷含量增加极少,只有0.71%;而150 mg·L-1时增加最多,为23.68%。nFe2O3处理后,磷含量在200 mg·L-1处理增加最多,为17.06%。nFe处理后,磷含量在500 mg·L-1处理时增加最多为25.17%。nCeO2处理后,100 mg·L-1时生物量增加最多,而磷含量增加最少为1.13%;150 mg·L-1处理时磷含量增加最多为12.57%。CH处理后,磷含量相比对照组,都不同程度减少,50 mg·L-1时减少最多,为7.45%;而500 mg·L-1处理时减少最少,为0.27%。
水稻幼苗培养在不缺磷条件下,各种材料不同浓度处理均可不同程度增加水稻地上部和根部生物量,整体趋势为随着处理浓度的增加,地上部和根部生物量先增加再减少。地上部生物量在nFe处理浓度150 mg·L-1时增加最多;而根部则是在nFe 100 mg·L-1处理时增加最多为15.87%,其次增长最多的是nHA在150 mg·L-1浓度处理时,比对照组增加了15.53%。nHA和nFe2O3处理对地上部磷含量增加的影响不显著,而nFe的处理却不同程度降低了地上部磷含量,并在生物量增加最多的150 mg·L-1处理时,磷含量降低最多,可能是生长速率过高,提高了体内磷的利用率。各处理后,nHA处理根部磷含量持续增加,可能是叶片对nHA吸收后叶片磷含量充足并向根部转运了,也可能是处理促进了根部对营养液中磷的吸收。
水稻幼苗培养在营养液含磷1/2条件下,即磷元素供应不是完全充足的情况下,5种材料的处理也都不同程度地促进了地上部和根部生物量的增长,50 mg·L-1的nHA处理对地上部生物量促进最显著,磷含量在150 mg·L-1处理时增加最多。这些处理整体对地上部生物量促进并不极显著,而对地上部磷含量促进较显著,尤其是nHA和nFe2O3处理;CH处理对磷含量影响最小,而对地上部生物量整体促进效果较好。这些处理对根部来说也全都促进了根部生长,就各材料而言,CH对根部生物量促进效果最好,其次是nHA。200 mg·L-1的CH处理,生物量增加最多,其次是50 mg·L-1的nHA处理。对磷含量的影响,500 mg· L-1 nFe处理增加最多为25.17%,其次是150 mg·L-1的nHA处理为23.68%;整体对根部磷含量促进效果最好的是nHA,较nFe规律更明显;而CH处理在最大限度促进根部生长的同时磷的含量降低了,可能是提高了体内磷的利用率,最大限度促进了植株生长。
水稻幼苗培育在不缺磷条件下,各种材料处理均可不同程度促进水稻幼苗生长,而对幼苗体内磷含量影响不大;在营养液含磷1/2条件下,除了CH处理对根部磷含量没有促进,各材料处理在促进水稻幼苗生长的同时也促进了磷的吸收。
2.3 磷的转运系数由表 1可知,全磷营养液培养时,在nHA相对低的浓度处理时,不高于150 mg·L-1处理,磷的转运系数较高;nFe2O3处理浓度较高时,转运系数较大;nFe处理时,对照组的转运系数最大。并且由表 1可知,对照组是nHA和nFe处理组中转运系数最高的。
|
|
表 1 全磷营养液喷施三种不同纳米材料处理磷的转运系数 Table 1 Transfer coefficients of phosphorus treated by three nanomaterials treated with total phosphorus nutrient solution |
由表 2可知,在营养液含磷1/2培养条件下,不同处理对磷的转运系数产生了不同影响。nHA、nFe2O3、nFe、nCeO2和CH处理下,浓度分别在100、100、200、50 mg·L-1和50 mg·L-1时转运系数最大,各处理的磷转运系数均不同程度大于对照组,说明营养液含磷1/ 2培养条件下,各处理促进了磷向地上部的转运,而转运系数低于不缺磷条件。
|
|
表 2 1/2磷营养液喷施五种不同纳米材料处理磷的转运系数 Table 2 Transfer coefficients of phosphorus treated by five different nanomaterials with 1/2 phosphorus nutrient solution |
即使nHA具有良好的生物相容性,高浓度处理对生长的促进作用仍降低,原因可能是,高浓度纳米材料易团聚[24,28],同时,随处理时间和处理次数的增加,纳米粒子可能在叶片表面聚集增多,而影响叶片气孔开闭并造成光合作用强度下降,同时引起膜损伤和氧化应激反应,从而影响水稻幼苗生长,这也可能是其他材料高浓度处理对水稻幼苗生长促进效果降低的原因[29]。而低浓度处理时,nHA使水稻幼苗磷含量增加,可能是纳米材料自身的特性促进了磷向地上部转运,也可能是由于材料本身含有磷元素,这还缺乏充足的试验验证。
铁是植物和动物营养的必需元素,是呼吸、光合作用和许多其他细胞功能所必需的,如DNA合成、固氮和激素产生[30]。含铁的纳米复合材料最近被认为是一种新的抗铁素缺乏的杠杆[31],可能在食品科学中有很大的应用前景[32],甚至鼓励对其生物相容性进行全面评估。Ghafariyan等[33]的研究表明大豆中转运的纳米氧化铁增加了叶绿素水平,并且没有任何毒性,叶绿素a与b的含量比率表明在光合作用效率上没有显著差异,并观察到对大豆叶绿素含量的影响可能对光合作用反应不同阶段的生化和酶效率都有影响本文中施用nFe2O3使生物量增加的效果与此一致,而且nFe2O3具有过氧化氢酶活性,可能在生产应用中能提高作物的抗逆能力。
纳米零价铁具有独特的氧化还原反应性。Kim等[20]的研究表明拟南芥对纳米零价铁的暴露使质膜H+-ATPase活性提高,负责气孔开放的H+-ATPase同种型Arabidopsis H+-ATPase 2水平比未暴露的对照植物高5倍,进而导致质外体pH的降低,产生酸性条件,允许膨胀驱动的细胞壁松动,从而增强气孔开放,叶面积的增加以及更宽的气孔孔径,导致CO2摄取增加的可能性。这与本试验中nFe处理促进水稻幼苗生长趋势一致。CO2摄取增加,叶片面积增大,极有利于叶片光合作用的提高,从而促进叶片生长,提高叶片活力,进而促进根系生长和磷的吸收。
许多研究表明稀土元素可以刺激植物转移和吸收营养物质。铈已被用作稀土肥料,以改善植物生长和作物生产,据报道[17],水稻施用稀土后,对氮、磷和钾的吸收分别增加16.4%、12%和8.5%;大豆施用稀土对硫酸盐的吸收也得到了增强。Dimkpa[34]报道,nCeO2刺激大豆和香菜根系生长,诱导抗氧化酶活性,有助于防止膜的过氧化和电解质渗漏。Yang等[35]的研究表明,对拟南芥施用nCeO2时,在低于500 mg· L-1处理时,生物量是增加的,这与本文研究结果一致;同时也增加了叶绿体含量和H2O2。因此我们推测对水稻幼苗喷施nCeO2处理可能是在增加了叶绿体含量的情况下促进了光合作用,从而促进了生物量的增加;在促进生物量增加时,也促进了植株对磷的吸收,而促进磷吸收的机制尚不明确;但是同时增加的H2O2含量使生长速率降缓,因而在高浓度的情况下生物量反而下降[23]。
甲壳素在农业生产中使用广泛[36-39],尤其是对果蔬的叶面喷施,提高作物中可溶性蛋白、可溶性糖和游离氨基酸含量而提高抗寒能力,提高的脯氨酸含量可提高抗旱能力,并降低硝酸盐含量而提高作物品质;同时提高了叶绿体含量和光合作用强度,但其影响机制尚不明确。光合作用的增强也可能是在本试验中促进水稻幼苗生长的重要原因。
影响植物生长和磷吸收的因素有很多,在本试验中,喷施纳米材料自身的理化性质、喷施浓度和处理时间,水稻幼苗生长环境(磷的含量,即正常含磷与含量1/2)等,都会对水稻幼苗产生各种影响。如纳米材料自身的性质可能通过影响叶片气孔开度来影响其对CO2的吸收,如适量浓度nFe可提高气孔开度[20],促进对CO2的吸收。影响叶绿素含量和叶绿素a和b的比例,叶绿素作为光合作用中的主要色素,在光能的吸收、传递和转化中起着至关重要的作用,叶绿素含量可以反映植物的光合作用速率。影响Rubisco酶(核酮糖-1,5-二磷酸羧化酶/加氧酶)的含量和活性,而Rubisco酶在CO2含量高的时候在卡尔文循环中进行碳固定,而在CO2含量低时进行光呼吸,消耗多碳糖和能量,进而影响光合作用,通过影响植物对碳水化合物的固定而影响植物生长。
各种处理条件也有可能会对植物产生氧化应激反应,产生活性氧ROS,造成质膜过氧化,丙二醛、超氧阴离子、过氧化氢含量会增加,而清除活性氧的酶,如SOD、CAT、POD等含量和活性也会随之发生变化,来清除活性氧,增强植物抗逆能力。SOD是对ROS的第一道防御,可以催化O2-·转化为H2O2,它是植物自我保护的核心酶。CAT是最主要的H2O2清除酶,可将H2O2分解生成无害的H2O和O2。POD酶能够有效清除H2O2,同时可消除酚类、胺类毒性。这些酶不仅与许多生理代谢过程有关,而且与细胞的分化和生长也有着密切的联系,广泛参与植物的呼吸作用、光合作用及生长素的氧化等,其活性的高低直接影响植物的正常生长发育[40]。
而磷处理量的不同,除了影响植物各种与磷吸收代谢相关基因表达、蛋白含量以及酶活性的变化外[41],还可能通过提高自身磷的利用率来调节生长。缺磷时,水稻幼苗不定根上的侧根长度和数量增加以增加根系吸收的表面积;高亲和力磷酸盐转运家族基因表达量上升,磷酸转运蛋白含量增加,促进植物对磷的吸收和转运。根中磷的浓度参与控制磷酸酶活性,磷含量低时,根部酸性磷酸酶含量和活性增加,提高磷的吸收效率和自身有机磷的重复利用。同时核糖核酸酶和磷酸烯醇丙酮酸羧化酶含量和活性提高,并引起脂质代谢的重编程,其中强烈诱导半乳糖脂和硫脂合成基因。这种复杂的机制网络增强了植物对磷的吸收能力。降低Rubisco的羧化活性、核酮糖-1,5-二磷酸的再生以及CO2在气孔和叶肉中的扩散进而抑制光合作用。参与碳水化合物代谢的基因,例如淀粉酶、蔗糖磷酸合酶、蔗糖磷酸酶、和蔗糖合酶等表达也会发生调节。
4 结论(1)nHA、nFe2O3和nFe 3种材料的5个处理浓度对不缺磷营养液培育的水稻幼苗均可不同程度促进生长。
(2)nHA、nFe2O3、nFe、nCeO2和CH 5种材料的5个处理浓度对含磷1/2营养液培育的水稻幼苗也均可不同程度促进生长,nHA、nFe2O3、nFe、nCeO2处理显著促进磷的吸收。
(3)营养液含磷1/2培养条件下,各处理促进了磷向地上部的转运,而转运系数低于不缺磷条件。
| [1] |
布坎南, 格鲁依森姆, 琼斯. 植物生物化学与分子生物学[M]. 北京: 科学出版社, 2002. Bob B, Russell L J, Wilhelm G, et al. Biochemistry and Molecular Biology of Plants[M]. Beijing: Science Press, 2002. |
| [2] |
寇长林, 张福锁. 小麦和花生利用磷形态差异的研究[J]. 土壤通报, 1999, 30(4): 181-184. KOU Chang-lin, ZHANG Fu-suo. Study on different forms of phosphorus utilized by wheat and peanut[J]. Chinese Journal of Soil Science, 1999, 30(4): 181-184. DOI:10.3321/j.issn:0564-3945.1999.04.013 |
| [3] |
闵继胜, 孔祥智. 我国农业面源污染问题的研究进展[J]. 华中农业大学学报(社会科学版), 2016(2): 59-66. MIN Ji-sheng, KONG Xiang-zhi. The research progress on agricultural non-point source pollution in China[J]. Journal of Huazhong Agricultural University (Social Sciences Edition), 2016(2): 59-66. |
| [4] |
Barel D, Black C A. Foliar application of P. II. Yield responses of corn and soybeans sprayed with various condensed phosphates and PN compounds in greenhouse and field experiments1[J]. Agronomy Journal, 1979, 71(1): 21-24. |
| [5] |
李俊红, 丁志强, 张洁, 等. 叶面肥在生产中的应用效果研究[J]. 耕作与栽培, 2008(6): 40-40. LI Jun-hong, DING Zhi-qiang, ZHANG Jie, et al. Application effect of foliar fertilizer in production[J]. Tillage and cultivation, 2008(6): 40-40. DOI:10.3969/j.issn.1008-2239.2008.06.022 |
| [6] |
李燕婷, 李秀英, 肖艳, 等. 叶面肥的营养机理及应用研究进展[J]. 中国农业科学, 2009, 42(1): 162-172. LI Yan-ting, LI Xiu-ying, XIAO Yan, et al. Advances in study on mechanism of foliar nutrition and development of foliar fertilizer application[J]. Scientia Agricultura Sinica, 2009, 42(1): 162-172. DOI:10.3864/j.issn.0578-1752.2009.01.020 |
| [7] |
倪星元. 纳米材料的理化特性与应用[M]. 北京: 化学工业出版社, 2006. NI Xing-yuan. Physical and chemical properties and applications of nanomaterials[M]. Beijing: Chemical Industry Press, 2006. |
| [8] |
刘芳. 纳米材料的结构与性质[J]. 光谱实验室, 2011, 28(2): 735-738. LIU Fang. Structure and character of nano-materials[J]. Chinese Journal of Spectroscopy Laboratory, 2011, 28(2): 735-738. DOI:10.3969/j.issn.1004-8138.2011.02.061 |
| [9] |
肖强, 孙焱鑫, 王甲辰, 等. 纳米材料在土壤与植物营养领域的应用进展[J]. 中国土壤与肥料, 2009(4): 10-15. XIAO Qiang, SUN Yan-xin, WANG Jia-chen, et al. Application progress of nano-materials in soil and plant nutrition research fields[J]. Soils and Fertilizers Sciences in China, 2009(4): 10-15. DOI:10.3969/j.issn.1673-6257.2009.04.003 |
| [10] |
王世华, 罗群胜, 刘传平, 等. 叶面施硅对水稻籽实重金属积累的抑制效应[J]. 生态环境, 2007, 16(3): 875-878. WANG Shi-hua, LUO Sheng-qun, LIU Chuan-ping, et al. Effects of leaf application of nanometer silicon to the accumulation of heavy metals in rice grains[J]. Ecology and Environment, 2007, 16(3): 875-878. DOI:10.3969/j.issn.1674-5906.2007.03.034 |
| [11] |
齐红岩, 王丹, 齐明芳, 等. 不同形态钙对高温逆境下番茄叶片光合作用的调控作用[J]. 应用生态学报, 2014, 25(12): 3540-3546. QI Hong-yan, WANG Dan, QI Ming-fang, et al. Regulation of different calcium forms on the photosynthesis of tomato leaves under heat stress[J]. Chinese Journal of Applied Ecology, 2014, 25(12): 3540-3546. |
| [12] |
Wang W N, Tarafdar J C, Biswas P. Nanoparticle synthesis and delivery by an aerosol route for watermelon plant foliar uptake[J]. Journal of Nanoparticle Research, 2013, 15(1): 1417. DOI:10.1007/s11051-013-1417-8 |
| [13] |
Ma Y, He X, Zhang P, et al. Xylem and phloem based transport of CeO2 nanoparticles in hydroponic cucumber plants[J]. Environmental Science & Technology, 2017, 51(9): 5215-5221. |
| [14] |
Zhang P, Ma Y, Zhang Z, et al. Biotransformation of ceria nanoparticles in cucumber plants[J]. Acs Nano, 2012, 6(11): 9943-9950. DOI:10.1021/nn303543n |
| [15] |
Ashenden T W. Responses of herbaceous plants to urban air pollution:Effects on growth, phenology and leaf surface characteristics[J]. Environmental Pollution, 2009, 157(4): 1279-1286. DOI:10.1016/j.envpol.2008.11.049 |
| [16] |
Abd E H, Helmy Y, Elkholy B, et al. In vivo animal histomorphometric study for evaluating biocompatibility and osteointegration of nanohydroxyapatite as biomaterials in tissue engineering[J]. Journal of the Egyptian National Cancer Institute, 2010, 22(4): 241-50. |
| [17] |
Yuan H, Ning C, Lü X Y, et al. Experimental study of natural hydroxyapatite/chitosan composite on reconstructing bone defects[J]. The Journal of Biomedical Research, 2008, 22(6): 372-375. |
| [18] |
孟纯阳, 安洪, 蒋电明, 等. 新型纳米骨重建和修复材料羟基磷灰石/聚酰胺体内植入的生物相容性及安全性[J]. 中国组织工程研究, 2004, 8(29): 6330-6333. MENG Chun-yang, AN Hong, JIANG Dian-ming, et al. Biocompatibility and security of new type nano-hydroapatite crystals and polyamide for bone reconstruction and repair after implanting in vivo[J]. Chinese Journal of Clinical Rehabilitation, 2004, 8(29): 6330-6333. DOI:10.3321/j.issn:1673-8225.2004.29.024 |
| [19] |
Chen Z, Yin J J, Zhou Y, et al. Dual enzyme-like activities of iron oxide nanoparticles and their implication for diminishing cytotoxicity[J]. ACS Nano, 2012, 6(5): 4001-4012. DOI:10.1021/nn300291r |
| [20] |
Kim J H, Oh Y, Yoon H, et al. Iron nanoparticle-induced activation of plasma membrane H+-ATPase promotes stomatal opening in Arabidopsis thaliana[J]. Environmental Science and Technology, 2014, 49(2): 1113-1119. |
| [21] |
Xin P, Decheng L, An P. Application of rare-earth elements in the agriculture of China and its environmental behavior in soil[J]. Environmental Science & Pollution Research International, 2002, 9(2): 143-148. |
| [22] |
Diatloff E. Effects of the rare earth elements, lanthanum and cerium, on the growth and nutrition of corn and mungbean[J]. Journal of Plant Nutrition, 1995, 18(10): 1963-1976. DOI:10.1080/01904169509365037 |
| [23] |
蒋小姝, 莫海涛, 苏海佳, 等. 甲壳素及壳聚糖在农业领域方面的应用[J]. 中国农学通报, 2013(6): 170-174. JIANG Xiao-shu, MO Hai-tao, SU Hai-jia, et al. The application of chitin and chitosan in agriculture[J]. Chinese Agricultural Science Bulletin, 2013(6): 170-174. DOI:10.3969/j.issn.1000-6850.2013.06.031 |
| [24] |
周伯瑜. 植物叶面施肥[J]. 云南农业科技, 1991(4): 42-44. ZHOU Bo-yu. Plant foliage is fertilized[J]. Yunnan Agricultural Science and Technology, 1991(4): 42-44. |
| [25] |
Li Q, Lv L R, Teng Y J, et al. Apoplastic hydrogen peroxide and superoxide anion exhibited different regulatory functions in salt-induced oxidative stress in wheat leaves[J]. Biologia Plantarum, 2018, 62(4): 752-762. |
| [26] |
Kharshiing E, Sinha S P. Deficiency in phytochrome A alters photosynthetic activity, leaf starch metabolism and shoot biomass production in tomato[J]. Journal of Photochemistry and Photobiology B:Biology, 2016, 165: 157-162. DOI:10.1016/j.jphotobiol.2016.10.026 |
| [27] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil agro-chemistrical analysis[M]. Beijing: China Agriculture Press, 2000. |
| [28] |
Sato K, Hotta Y, Nagaoka T, et al. Agglomeration control of hydroxyapatite nano-crystals grown in phase-separated microenvironments[J]. Journal of Materials Science, 2006, 41(17): 5424-5428. DOI:10.1007/s10853-006-0258-6 |
| [29] |
袁文俊, 周勇敏. 纳米颗粒团聚的原因及解决措施[J]. 材料导报, 2008, 22(3): 59-61. YUAN Wen-jun, ZHOU Yong-min. Reasons for aggregation of nanoparticles and solutions[J]. Materials Review, 2008, 22(3): 59-61. |
| [30] |
陈雄文. 植物叶片对沙尘的短时间生理生态反应[J]. 植物学报, 2001, 43(10): 1058-1064. CHEN Xiong-wen. Study of the short-time eco-physiological response of plant leaves to dust[J]. Acta Botanica Sinica, 2001, 43(10): 1058-1064. DOI:10.3321/j.issn:1672-9072.2001.10.012 |
| [31] |
金亚波, 韦建玉, 王军. 植物铁营养研究进展Ⅰ:生理生化[J]. 安徽农业科学, 2007, 35(32): 10215-10219. JIN Ya-bo, WEI Jian-yu, WANG Jun. Research progress on the physiological and biochemical of iron nutrition in plants[J]. Journal of Anhui Agricultural Sciences, 2007, 35(32): 10215-10219. DOI:10.3969/j.issn.0517-6611.2007.32.016 |
| [32] |
Zimmermann M B, Hilty F M. Nanocompounds of iron and zinc:their potential in nutrition[J]. Nanoscale, 2011, 3(6): 2390-2398. DOI:10.1039/c0nr00858c |
| [33] |
Ghafariyan M H, Malakouti M J, Dadpour M R, et al. Effects of magnetite nanoparticles on soybean chlorophyll[J]. Environmental Science & Technology, 2013, 47(18): 130906140819003. |
| [34] |
Dimkpa C. Potential of nanotechnology in crop fertilization:Current state and future perspectives[J]. Discrete & Continuous Dynamical Systems, 2014, 35(6): e53444. |
| [35] |
Yang X, Pan H, Wang P, et al. Particle-specific toxicity and bioavailability of cerium oxide(CeO2) nanoparticles to Arabidopsis thaliana[J]. Journal of hazardous materials, 2016, 322(Pt A): 292-300. |
| [36] |
陈惠萍. 壳聚糖在农作物产品保鲜及抗逆性方面的研究进展[J]. 安徽农业科学, 2010, 38(13): 6898-6899. CHEN Hui-ping. Research process of chitosan on product freshkeeping and resistibility of crop[J]. Journal of Anhui Agricultural Sciences, 2010, 38(13): 6898-6899. DOI:10.3969/j.issn.0517-6611.2010.13.111 |
| [37] |
罗兵, 徐朗莱, 孙海燕. 壳聚糖对黄瓜品质和产量的影响[J]. 南京农业大学学报, 2004, 27(1): 20-23. LUO Bing, XU Lang-lai, SUN Hai-yan. Effects of chitosan on the quality and product yield of cucumber[J]. Journal of Nanjing Agricultural University, 2004, 27(1): 20-23. |
| [38] |
刘婷, 赵永富. 低聚壳聚糖对小麦幼苗抗干旱胁迫的影响[J]. 江苏农业科学, 2009(1): 88-89. LIU Ting, ZHAO Yong-fu. Effects of oligochitosan on drought resistance of wheat seedlings[J]. Jiangsu Agricultural Sciences, 2009(1): 88-89. DOI:10.3969/j.issn.1002-1302.2009.01.031 |
| [39] |
杨峰, 胡景江, 武杭菊. 外源壳聚糖对苹果幼苗生长及抗旱性的影响[J]. 西北林学院学报, 2007, 22(3): 60-63. YANG Feng, HU Jing-jiang, WU Hang-ju. Effects of exogenous chitosan on growth and drought resistance of apple seedlings[J]. Journal of Northwest Forestry University, 2007, 22(3): 60-63. DOI:10.3969/j.issn.1001-7461.2007.03.014 |
| [40] |
Dat J, Vandenabeele S, Vranová E, et al. Dual action of the active oxygen species during plant stress responses[J]. Cellular & Molecular Life Sciences, 2000, 57(5): 779-795. |
| [41] |
Pandey R, Zinta G, Abdelgawad H, et al. Physiological and molecular alterations in plants exposed to high[CO2] under phosphorus stress[J]. Biotechnology Advances, 2015, 33(3/4): 303-316. |
 2020, Vol. 39
2020, Vol. 39