2. 农业农村部环境保护科研监测所, 天津 300191
2. Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin 300191, China
苯并三唑(Benzotriazole,BTR)及其衍生物(BTRs)在医药、农药、材料、生物染色剂和离子受体等多个领域具有广泛的潜在应用[1-2]。例如美国每年BTRs的平均总产量高达9000 t[3]。由于其庞大的生产量及各种消费和工业产品广泛的使用,BTRs对环境的污染日益受到重视。Wang等[4]研究发现,美国和东亚地区的室内灰尘总BTRs的浓度大约在20~90 ng·g-1,而中国室内灰尘中的浓度最高能达2000 ng· g-1。世界范围内淡水和海洋环境中BTRs的总浓度约为0.08~200 μg·L-1 [5-6]。含有甲基的BTRs在人体脂肪组织中也被广泛检测到[7]。BTRs的急性毒性较低,但是会产生各种慢性毒性[8]。研究发现BTR具有发育毒性、致突变性和内分泌干扰特性,被列为环境可疑致癌物[9-10]。
BTRs芳香环上的氮硫杂原子上有孤对电子,易与各种重金属离子或受体结合。两者结合后的联合毒性效果还存在争议。大部分工作认同有机络合可以显著降低重金属的毒性,因为金属与有机试剂的络合降低了其游离形态的浓度。如Haghighi等[11]研究发现天然水体中腐植酸(HA)可降低Cd的毒性。作者前期研究发现5 μmol·L-1苯并三唑在斑马鱼胚胎24 h血液流动发育和56 h死亡率这2项指标上都会显著降低1 μmol·L-1 Cd的毒性[12]。另一方面,有机物与重金属的螯合作用会提高重金属的富集率和生物有效性。陈敏等[13]发现分子量相对较小的螯合剂二乙氨基二硫代甲酸钠(DDTC)与Cd螯合后,会导致Cd浓度增加,从而能产生各种不良反应。
随着水体和土壤污染问题的日益突出,人们对污染物引发的食品安全日趋关注。当前,农作物遭受重金属污染的生理生态毒性及其治理措施备受重视,重金属与新兴污染物对农作物联合毒性的研究已经有很多[14]。芥菜型小油菜是我国广泛食用的常见蔬菜,有研究表明小油菜对Cd有富集能力,且Cd能够在小油菜体内进行迁移[15]。BTR是一种广泛应用的金属缓蚀剂[16]。尽管这两种污染物在水体和土壤环境中经常被检测到,但是它们对蔬菜的联合效应还未见报道。因此,本研究以可食蔬菜上海青小油菜(Brassica campestris L.)为研究对象,从小油菜生长状况、Cd的蓄积以及抗氧化酶和金属硫蛋白(MT)表达这3个方面探讨了BTR和重金属Cd的联合毒性效果,并从不同次序联合暴露方式下Cd形态变化的角度分析其联合作用机制,以期为农业生产中BTR存在条件下重金属对作物毒性效应的研究提供一定的理论依据。
1 材料和方法 1.1 试验材料与试剂选用上海青小油菜(Brassica campestris L.)作为供试植物,种子购自中国农业科学院蔬菜花卉研究所。塑料花盆购自天津市某花卉市场。花盆尺寸为45 cm×20 cm×30 cm。
本试验中氯化镉(CdCl2)、氯化银(AgCl)和苯并三唑(1 - H - benzotriazole,BTR)为分析纯(纯度 > 99.9%),购于Sigma-Aldrich公司。称取一定量的粉末溶于重组水中,稀释到需要的浓度。根据水体环境中重金属的实际浓度和预试验结果,本试验中CdCl2的暴露浓度为0.1、0.5、1.0、5、10 μmol·L-1,BTR的暴露浓度为5 μmol·L-1。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)试剂盒均购自南京建成生物工程研究所。
1.2 试验设置 1.2.1 育苗挑选籽粒饱满一致、无虫害、无破损的种子,用5% H2O2浸泡20 min,然后用去离子水冲洗干净。将种子整齐地排列在铺有一层滤纸的托盘中,使每粒种子间保持匀称的距离,保证与溶液的接触面积和充足的成长空间,托盘放入26 ℃恒温培养箱中。每日向托盘中加入适量相应浓度霍格兰培养液,保持浓度、湿度等适宜生长的条件稳定。霍格兰培养液成分有NH4NO3(0.71 mmol·L-1)、NaH2PO4(0.32 mmol·L-1)、K2SO4(1.02 mmol · L-1)、Ca(NO3)2(0.5 mmol · L-1)、MgSO4(0.65 mmol · L-1)、MnCl2 · 4H2O(2 μmol · L-1)、(NH4)6 · Mo7O24 · 4H2O(0.1 μmol · L-1)、H3BO3(8.5 μmol·L-1)、ZnSO4·7H2O(0.1 μmol·L-1)、CuSO4·5H2O(0.2 μmol·L-1)和FeCl(3 5.8 μmol·L-1)。托盘培养一周至幼苗5 cm左右,然后进行移栽。选取大小均等的20株幼苗移栽到温室的花盆中,自然光照下生长,具体如图 1所示。

|
图 1 试验设置 Figure 1 Experiment setup |
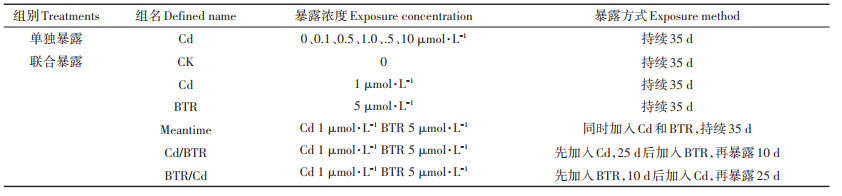
为降低无机阳离子对Cd离子的潜在影响,暴露试验中培养液浓度稀释为上述霍格兰培养液浓度的1/4。试验先进行Cd(0、0.1、0.5、1.0、5、10 μmol·L-1)和BTR(5 μmol·L-1)的单独暴露,然后进行Cd和BTR的联合暴露(Cd浓度为1 μmol · L-1,BTR浓度为5 μmol·L-1),每组取3个花盆作为3个平行,每盆选取大小均等的20株幼苗进行移栽,温室自然光照下生长。隔天更换溶液。联合暴露包含3种次序暴露,具体如表 1所示。
|
|
表 1 暴露设置 Table 1 Exposure setup |
暴露35 d后,单独和联合暴露组每组每盆随机计数10棵小油菜,测定其茎长,计算3盆的平均值和标准误差值以表征结果。
1.3.2 Cd含量测定将采集的每组小油菜用蒸馏水冲洗干净后放入烘箱中,在105 ℃杀青30 min、80 ℃下烘至恒质量后研碎。分别称取0.25 g干质量上述样品,加入混合酸(7 mL 65%~68%的HNO3和2 mL 30%的H2O2)浸泡过夜,转入消解罐中,110 ℃下消解约7 h,180 ℃加热赶酸后取下冷却,定容至25 mL。用电感耦合等离子体光谱仪(ICP-OES)测定每组样品中Cd的浓度。Cd的检出限为0.002 mg·L-1,加标回收率94%~105%。Cd的富集倍数以蔬菜体内的Cd含量(干质量)与相应的暴露浓度之比表示。
1.3.3 抗氧化酶和金属硫蛋白的测定(1)抗氧化酶POD、SOD和CAT的测定
联合暴露组随机选择每组每盆3棵油菜,摘取所有叶片,用蒸馏水洗净后晾干。每组随机称取0.2 g叶片,用剪刀剪碎置于研钵中,加入液氮充分研磨后全部转移至5 mL离心管。加入3.5 mL蛋白质提取液(15 mL三羟甲基氨基甲烷盐酸盐、25 mL甘油、2 g聚乙烯吡咯烷酮)、4 ℃条件下3500 r·min-1离心45 min,提取总蛋白。然后按照超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)试剂盒说明测定相应蛋白浓度。
(2)金属硫蛋白(MT)的测定
联合暴露组随机选择每组每盆3棵油菜,摘取所有叶片,用蒸馏水洗净后晾干。每组随机称取0.2 g叶片,加入液氮充分研磨。取0.6 mL待测样品溶液于2 mL离心管中,加入0.6 mL甘氨酸缓冲液和0.5 mL 20 μg·mL-1AgCl溶液,室温放置5 min;再加入100 μL血红蛋白溶液,混合均匀,80 ℃水浴加热5 min,然后冰浴5 min。室温条件下,12 000 r·min-1离心5 min,取上清液;再加100 μL血红蛋白溶液重复提取1次。合并上清液并用5 mL HNO(3 65%~68% HNO3)消解,用ICP-OES测定每组样品中银离子的浓度。
1.4 统计分析每个试验组设3个平行样。采用SPSS 17.0软件进行数据分析,结果用均值±标准误差的形式表示;组间用Student-t检验,P < 0.05表示有显著差异,P < 0.01表示有极显著差异。
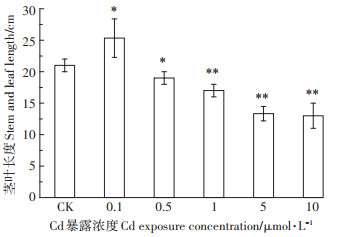
2 结果与分析 2.1 Cd单独暴露 2.1.1 Cd对小油菜的生长影响小油菜暴露35 d后,其生长状况如图 2所示。可见,空白对照组的小油菜生长较好,茎叶平均长度为21 cm。相对空白对照组,0.1 μmol·L-1 Cd暴露对小油菜的生长有着显著的促进作用(P < 0.05),茎叶平均长度为25.33 cm,茎叶增长率为20.63%,即低浓度Cd会对小油菜产生刺激效应。当Cd的暴露浓度增加到0.5 μmol·L-1以上时,显著抑制了小油菜茎叶的生长,并且剂量-抑制效应关系显著(R2=0.779)。
|
*表示与空白对照相比有显著差异,P < 0.05;**表示与空白对照相比有极显著差异,P < 0.01。下同 * indicates a significant difference compared with the blank control, P < 0.05;** indicates a significant difference compared with the blank control, P < 0.01. The same below 图 2 不同浓度CdCl2作用下小油菜的茎叶长度 Figure 2 The stem length of the rapes affected by different concentrations of CdCl2 |
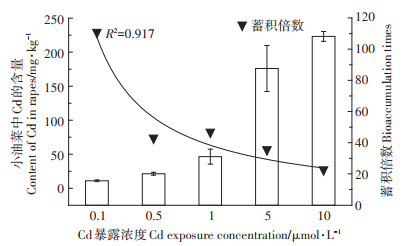
小油菜暴露35 d后,不同暴露剂量下小油菜中Cd的含量如图 3所示。可见,空白对照组中小油菜中的Cd未检出。随着Cd暴露剂量增大,小油菜体内Cd蓄积浓度也增大,剂量-蓄积效应关系显著(R2= 0.931)。当Cd暴露浓度从0.1 μmol·L-1增加至10 μmol·L-1时,小油菜组织中的Cd蓄积量由11.05 mg· kg-1增加到223.22 mg·kg-1,增加了约20倍。但是从蓄积倍数这个指标来看,最低暴露浓度0.1 μmol·L-1时,蓄积倍数最大,约为110.47。当暴露浓度增大到0.5 μmol·L-1以上时,蓄积逐渐饱和,蓄积倍数呈现负相关关系(R2=0.917)。即小油菜在低浓度Cd暴露下刺激吸收、高浓度Cd暴露时抑制吸收。
|
图 3 不同浓度CdCl2作用下小油菜中Cd的蓄积 Figure 3 The Cd bioaccumulation in the rapes affected by different concentrations of CdCl2 |
Cd与BTR联合暴露35 d后,小油菜茎叶长度如图 4所示。5 μmol·L-1 BTR暴露组茎叶平均长度为20.05 cm,与空白对照组相比无明显变化(P > 0.05),因此BTR对小油菜的生长发育无显著影响。1 μmol· L-1 Cd单独暴露下小油菜植株显著变矮(P < 0.01),茎叶长度为17.1 cm。联合暴露组中,Meantime、Cd / BTR、BTR/Cd各组的茎叶长度分别为18.1、18.6、16.9 cm,即Meantime、Cd/BTR这两种暴露次序能降低Cd对小油菜的生长抑制(P < 0.01),而BTR/Cd组降低Cd对小油菜的生长抑制效果不显著(P > 0.05)。

|
#表示与Cd单独暴露组相比有显著差异, P < 0.05; ##表示与Cd单独暴露组相比有极显著差异, P < 0.01 # indicates a significant difference compared with Cd singly treatment, P < 0.05; ## indicates a extremely significant difference compared with Cd singly treatment, P < 0.01 图 4 Cd与BTR联合作用下小油菜的茎叶长度和Cd的蓄积 Figure 4 The stem length and Cd bioaccumulation in BTR and Cd joint exposure to the rapes |
如图 4所示,空白对照组和BTR单独暴露组小油菜中的Cd未检出。不同次序联合暴露改变了Cd在小油菜中的蓄积。Cd单独、Meantime、Cd/BTR、BTR/ Cd各组中Cd的含量分别为24.09、20.86、21.50、24.51 mg·kg-1。即Meantime、Cd/BTR组能降低Cd在小油菜中的蓄积(P < 0.01),而BTR/Cd组却不能(P > 0.05)。
2.2.3 Cd与BTR联合暴露对小油菜体内酶活的影响试验选择了SOD、CAT和POD这3种典型的抗氧化酶和金属硫蛋白MT为研究对象,以探讨不同次序联合暴露毒性差异的机制。如图 5所示,5 μmol·L-1 BTR对小油菜产生了一定的氧化性压力,表现在SOD酶的表达显著受到抑制、含量相对空白对照组降低了7.67%(P < 0.01),但是CAT和POD的表达都无显著变化(P > 0.05)。1 μmol·L-1 Cd单独暴露下小油菜SOD、CAT酶表达受到抑制,含量相对空白对照组分别降低了28.39%(P < 0.01)和65.46%(P < 0.05),POD酶含量却升高了24.84%(P < 0.01),证明1 μmol·L-1 Cd对小油菜产生更为显著的氧化性压力。

|
图 5 BTR和Cd联合暴露中抗氧化酶的表达和MT含量的变化 Figure 5 The changes of anti-oxidative enzyme expressions and MT content in the rapes induced by BTR and Cd joint exposure |
Cd与BTR不同次序联合暴露对小油菜抗氧化酶的表达存在差异。与Cd单独暴露组相比,Meantime暴露下SOD和POD的表达都显著降低(P < 0.01),Cd/BTR暴露只有POD酶表达的抑制有所降低(P < 0.05),而BTR/Cd暴露下3种抗氧化酶表达的影响都无明显差异(P > 0.05)。因此,Cd与BTR不同次序联合暴露中,Meantime暴露对Cd造成的氧化压力的降低作用最大,BTR/Cd对Cd造成的氧化压力的降低作用最小。
Cd与BTR不同次序联合暴露对小油菜MT蛋白的表达也存在差异。1 μmol·L-1 Cd单独暴露下小油菜MT的表达量为8.30 mg·kg-1,相对空白对照组增加了的84.44%(P < 0.01)。Meantime、Cd/BTR、BTR/Cd次序联合暴露中,小油菜叶片中MT的表达量分别为5.52、6.10、6.50 mg·kg-1。因此,Meantime暴露对Cd诱导MT的抑制作用最大,BTR/Cd暴露对Cd诱导MT的抑制作用最小。
3 讨论鉴于BTRs在水环境中的高溶解度(28 g·L-1),和大量暴露且稳定性较高、难降解,BTRs将会在水环境中将会长期存在。虽然BTRs的水生生物毒性引起了极大的关注[17],但是其对水生生物(绿藻、大型蚤、斑马鱼等)的急性毒性效应报道却很少[18],研究的浓度范围为μmol·L-1级。BTR在可直接食用农作物的蓄积和毒性作用也鲜有报道。Liu等[16]发现500 μmol· L-1 BTR能够在水稻幼苗中进行蓄积,并且根部的蓄积量显著高于茎叶,但是BTR对水稻幼苗的生长没有影响。因此,BTRs在农业环境中是以低毒的形式存在的。氧化性压力[19-20]的诱导一直被认为是重金属在生物体内产生毒性作用机制的重要组成部分。本研究中也发现5 μmol·L-1 BTR能够诱导小油菜SOD酶的表达,表现出一定氧化性压力损伤,但是从小油菜的生长状况来看无显著毒性效应(图 4)。
水体和土壤环境中重金属的有效态以可溶无机离子态和离子可交换态存在。一方面,pH可能是控制土壤中重金属有效态的主要因素[21]。冉洪珍等[22]发现石灰单施及石灰与有机肥配施均能显著提高稻田土壤pH值,降低土壤中有效态Cd的含量和水稻各部位Cd的含量,从而降低Cd对水稻的毒性作用。另一方面,环境中有机质的存在可以改变环境中重金属的有效态,使得重金属向植物根系的扩散速度等方面受到影响。段明梦等[23]发现土壤中易降解有机质中的有机配位体和Cd2+的络合作用增加了有效态Cd的含量,并进一步促进了高粱地上部对Cd的积累。尹炳奎等[24]在研究中表明,土壤有机物料的降解产物可以显著增加土壤溶液中可溶性有机碳(DOC)浓度,改变重金属在其固液相的分布,影响重金属在土壤中的吸附,从而影响重金属的生物有效性。Grüter等[25]报道长期施用有机质也会降低小麦中Cd的浓度。
本研究发现,BTR和Cd同时加入的方式能够降低Cd在小油菜中的蓄积及其对小油菜的毒性效应,表现为Meantime组中Cd对小油菜的生长发育以及SOD、POD和MT表达的抑制作用都显著降低(P < 0.01)。本试验对暴露系列的pH值进行了测定,Cd单独及和BTR联合暴露的pH值均为6.5左右。前期研究中分析了不同pH值下,Cd和BTR同时暴露且Cd: BTR=1:5时水溶液中Cd的离子形态[15],Cd单独暴露组中Cd的形态为100%的Cd2+,而Meantime组中Cd的形态为90%的Cd(BTR-)2和10%的Cd2+,因此Meantime联合暴露组中Cd2+的浓度相对单独暴露组显著降低,从而使Cd进入小油菜时的离子有效态降低,导致联合暴露组中小油菜Cd的蓄积量减低(图 4),最终使得该组中Cd对抗氧化酶和MT的影响都显著降低(图 5)。
本研究中还发现,暴露次序对于联合作用效果有重要意义。3种暴露次序中,BTR对Cd在小油菜中的蓄积和毒性的降低表现为Meantime组 > Cd/BTR组 > BTR/Cd组。Cd/BTR这种暴露次序中BTR对Cd在小油菜中的蓄积和毒性的影响略低于Meantime组,表现为与Cd单独暴露组相比,Cd/BTR暴露只有POD酶表达的抑制有所降低(P<0.05)。推测Cd/BTR组中,除了预先Cd暴露产生的蓄积和毒性效应以外,后期联合作用效果与Meantime组类似,在溶液中也主要形成了Cd(BTR-)2,影响了Cd的生物有效性,抑制Cd从溶液中向小油菜根系的传递,从而最终导致小油菜茎叶中Cd的含量相对降低。但是,BTR/Cd这种暴露次序与其他两者却截然不同。BTR/Cd组中BTR不能降低Cd在小油菜中的蓄积。究其原因,BTR主要是在植物的根部蓄积[16],一方面,预先暴露的BTR在小油菜根部蓄积后,能够促进Cd在小油菜根系的累积。Liu等[16]也证实了预先暴露BTR能够促进Cd在水稻根系的累积;另一方面,溶液中也会形成一定量的Cd(BTR-)2,使得溶液中能够被根部BTR促进吸收的Cd的总量降低。这两种效果复合起来,最终使得BTR/ Cd组中Cd的蓄积量与Cd单独暴露组相比无显著差异。作者前期在Cd和BTR对斑马鱼肝脏的联合毒性研究中也发现,Meantime这种暴露方式能够显著降低Cd在斑马鱼肝脏中的蓄积,而BTR/Cd这种联合暴露方式却不能[26]。
农田重金属的联合毒性作用效果不仅要考虑自然环境因素的影响,还要考虑由于农业生产过程由于灌溉、施肥、翻耕所带来的污染物的不同次序暴露的影响。但是目前暴露顺序对植物吸收重金属的影响的相关研究仍然有限。Wang等[27]发现先加入铜后加入多溴二苯醚的暴露次序中,由于铜对玉米根细胞膜的预先损伤作用,更多的多溴二苯醚会渗入玉米根系,并在芽中向上移位。
4 结论(1)5 μmol·L-1 BTR虽能够诱导小油菜SOD酶的表达,但是对小油菜最终的生长状况无显著毒性效应。
(2)BTR能够降低Cd在小油菜中的蓄积及毒性效应,但是暴露次序的改变对联合暴露毒性效果有显著影响。
| [1] |
Zhang Z, Ren N, Li Y F, et al. Determination of benzotriazole and benzophenone UV filters in sediment and sewage sludge[J]. Environmental Science & Technology, 2011, 45(9): 3909-3916. |
| [2] |
Luongo G, Avagyan R, Hongyu R, et al. The washout effect during laundry on benzothiazole, benzotriazole, quinoline, and their derivatives in clothing textiles[J]. Environmental Science and Pollution Research, 2016, 23(3): 2537-2548. DOI:10.1007/s11356-015-5405-7 |
| [3] |
Hart D S, Davis L C, Erickson L E, et al. Sorption and partitioning parameters of benzotriazole compounds[J]. Microchemical Journal, 2004, 77(1): 9-17. DOI:10.1016/j.microc.2003.08.005 |
| [4] |
Wang L, Asimakopoulos A G, Moon H B, et al. Benzotriazole, benzothiazole, and benzophenone compounds in indoor dust from the United States and East Asian Countries[J]. Environmental Science & Technology, 2013, 47(9): 4752-4759. |
| [5] |
Cancilla D A, Martinez J, Van Aggelen G C. Detection of aircraft deicing/antiicing fluid additives in a perched water monitoring well at an international airport[J]. Environmental Science & Technology, 1998, 32(23): 3834-3835. |
| [6] |
Seeland A, Oetken M, Kiss A, et al. Acute and chronic toxicity of benzotriazoles to aquatic organisms[J]. Environmental Science and Pollution Research, 2012, 19(5): 1781-1790. DOI:10.1007/s11356-011-0705-z |
| [7] |
Wang L, Asimakopoulos A G, Kannan K. Accumulation of 19 environmental phenolic and xenobiotic heterocyclic aromatic compounds in human adipose tissue[J]. Environment International, 2015, 78: 45-50. DOI:10.1016/j.envint.2015.02.015 |
| [8] |
Kadar E, Dashfield S, Hutchinson T H. Developmental toxicity of benzotriazole in the protochordate Ciona intestinalis(Chordata, Ascidiae)[J]. Analytical and Bioanalytical Chemistry, 2010, 396(2): 641-647. DOI:10.1007/s00216-009-3293-8 |
| [9] |
Zeng F, Sherry J P, Bols N C. Use of the rainbow trout cell lines, RTgill-W1 and RTL-W1 to evaluate the toxic potential of benzotriazoles[J]. Ecotoxicology & Environmental Safety, 2016, 124: 315-323. |
| [10] |
王亚韡, 王宝盛, 傅建捷, 等. 新型有机污染物研究进展[J]. 化学通报, 2013, 1(1): 3-14. WANG Ya-wei, WANG Bao-sheng, FU Jian-jie, et al. Recent research progresses of emerging organic pollutants[J]. Chemistry, 2013, 1(1): 3-14. |
| [11] |
Haghighi M, Kafi M, Fang P, et al. Humic acid decreased hazardous of cadmium toxicity on lettuce(Lactuca sativa L.)[J]. Vegetable Crops Research Bulletin, 2010, 72(Jun): 49-61. |
| [12] |
端正花, 陈晓欧, 刘灵丽, 等. 苯并三唑和镉对斑马鱼肝脏的联合毒性效应[J]. 中国环境科学, 2015, 35(6): 1872-1876. DUAN Zheng-hua, CHEN Xiao-ou, LIU Ling-li, et al. Joint toxicity of benzotriazole and cadmium to zebrafish liver[J]. China Environmental Science, 2015, 35(6): 1872-1876. DOI:10.3969/j.issn.1000-6923.2015.06.033 |
| [13] |
陈敏, 宋霞, 田晓雷, 等. 新型螯合剂对镉致小鼠睾丸毒性的解毒作用[J]. 中国公共卫生, 2007, 23(4): 470-472. CHEN Min, SONG Xia, TIAN Xiao-lei, et al. Effects of new chelating agents on testicular toxicity in mice induced by acute exposure to cadmium[J]. Chinese Journal of Public Health, 2007, 23(4): 470-472. DOI:10.3321/j.issn:1001-0580.2007.04.036 |
| [14] |
Cao X, Wang X, Tong W, et al. Distribution, availability and translocation of heavy metals in soil-oilseed rape(Brassica napus L.)system related to soil properties[J]. Environmental Pollution, 2019, 252(Part A): 733-741. |
| [15] |
武文飞, 南忠仁, 王胜利, 等. 单一与复合胁迫下油菜对镉、铅的吸收效应[J]. 环境科学, 2012, 33(9): 3253-3260. WU Wen-fei, NAN Zhong-ren, WANG Sheng-li, et al. Uptake effect of Cd and Pb by rape under single Cd/Pb and Cd-Pb combined stress[J]. Chinese Journal of Environmental Science, 2012, 33(9): 3253-3260. |
| [16] |
Liu Z, Wang L, Wang C, et al. Effect of corrosion inhibitor benzotriazole on the uptake and translocation of Cd in rice (Oryza sativa, L.)under different exposure conditions[J]. Chemosphere, 2017, 186: 24-30. DOI:10.1016/j.chemosphere.2017.07.095 |
| [17] |
Jia J B, Zhu Q Q, Liu N, et al. Occurrence of and human exposure to benzothiazoles and benzotriazoles in mollusks in the Bohai Sea, China[J]. Environment International, 2019, 130: 104925. DOI:10.1016/j.envint.2019.104925 |
| [18] |
高礼, 袁涛, 王文华. 环境中有机紫外防晒剂残留及其生态毒性研究进展[J]. 生态毒理学报, 2013, 8(4): 465-472. GAO Li, YUAN Tao, WANG Wen-hua. A review on the residues and ecotoxicity of organic UV filters in environment[J]. Asian Journal of Ecotoxicology, 2013, 8(4): 465-472. |
| [19] |
Liu X, Chen Q W, Ali N, et al. Single and joint oxidative stress-related toxicity of sediment-associated cadmium and lead on Bellamya aeruginosa[J]. Environmental Science and Pollution Research International, 2019, 26: 24695. DOI:10.1007/s11356-019-05769-9 |
| [20] |
Shen X, Liu W, Chen Y, et al. Diagnostic significance of metallothionein members in recognizing cadmium exposure in various organs under low-dose exposure[J]. Chemosphere, 2019, 229: 32-40. DOI:10.1016/j.chemosphere.2019.04.192 |
| [21] |
Ettler V, Vrtisková R, Mihaljevic M, et al. Cadmium, lead and zinc leaching from smelter fly ash in simple organic acids-simulators of rhizospheric soil solutions[J]. Journal of Hazardous Materials, 2009, 170(2/3): 1264-1268. |
| [22] |
冉洪珍, 郭朝晖, 肖细元, 等. 改良剂连续施用对农田水稻Cd吸收的影响[J]. 中国环境科学, 2019, 39(3): 1117-1123. RAN Hong-zhen, GUO Zhao-hui, XIAO Xi-yuan, et al. Effects of continuous application of soil amendments on cadmium availability in paddy soil and uptake by rice[J]. China Environmental Science, 2019, 39(3): 1117-1123. DOI:10.3969/j.issn.1000-6923.2019.03.027 |
| [23] |
段明梦, 王帅, 黄道友, 等. 易降解有机物及其施加方式对高粱吸收镉的影响[J]. 农业环境科学学报, 2019, 38(5): 1000-1007. DUAN Ming-meng, WANG Shuai, HUANG Dao-you, et al. Effect of biodegradable organic materials and application regimes on cadmium absorption in Sorghum bicolor L.[J]. Journal of Agro-Environment Science, 2019, 38(5): 1000-1007. |
| [24] |
尹炳奎, 黄满红, 张大磊, 等. 菜籽饼施加对镉-铜污染土壤中重金属形态转化及其植物有效性的影响[J]. 环境工程学报, 2017, 11(6): 3879-3883. YIN Bing-kui, HUANG Man-hong, ZHANG Da-lei, et al. Effects of rapeseed cake on cadmium and copper forms and its phytoavailabilityin heavy metals contaminated paddy soil[J]. Chinese Journal of Environmental Engineering, 2017, 11(6): 3879-3883. |
| [25] |
Grüter R, Costerousse B, Mayer J, et al. Long-term organic matter application reduces cadmium but not zinc concentrations in wheat[J]. Science of the Total Environment, 2019, 669: 608-620. DOI:10.1016/j.scitotenv.2019.03.112 |
| [26] |
Duan Z, Xing Y, Feng Z, et al. Hepatotoxicity of benzotriazole and its effect on the cadmium induced toxicity in zebrafish, Danio rerio[J]. Environmental Pollution, 2017, 224: 706-713. DOI:10.1016/j.envpol.2017.02.055 |
| [27] |
Wang S, Wang Y, Luo C, et al. Could uptake and acropetal translocation of PBDEs by corn be enhanced following Cu exposure? Evidence from a root damage experiment[J]. Environmental Science & Technology, 2016, 50(2): 856-863. |
 2020, Vol. 39
2020, Vol. 39