2. 北京市农林科学院北京农业生物技术研究中心, 北京 100097
2. Beijing Agricultural Biotechnology Research Center, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097, China
为了满足消费者对禽畜产品日益增长的需求,我国的养殖模式已从散户养殖转向规模化、集约化养殖。伴随着集约化禽畜养殖业的发展,抗生素作为疾病预防和治疗药物、生长促进剂广泛应用于集约化畜禽养殖[1]。我国每年抗生素原料生产量约21万t,其中有近一半的抗生素应用于畜禽养殖业[2]。而这些用于畜禽养殖的抗生素大多数不能被动物完全吸收,约有60%~90%的抗生素以原药或初级代谢产物的形式排放到环境中,导致抗生素残留,并引起环境中耐药菌和耐药基因的富集扩散[3-4],如不经有效的无害化处理,会给公共健康带来严重威胁[5-6]。众多研究证实,畜禽粪便已经成为了自然环境中耐药细菌和耐药基因的“储存库”[7]。多重耐药菌是指对临床使用的3类或3类以上抗菌药物同时呈现耐药的细菌,牛天琦[8]利用卡那霉素等8种抗生素平板从鸡粪中分离并鉴定了多株多重耐药菌,集中分布于厚壁菌门、放线菌门、变形菌门中。张昊等[9]研究发现,在含有四环素、环丙沙星及庆大霉素的平板上,从猪粪、鸡粪中分离出的多重耐药菌主要为埃希氏菌属、不动杆菌属、变形杆菌属、依格纳季氏菌属和费克蓝姆菌属。Yang等[10]在鸡粪样品中检测到包括大肠埃希氏菌(Escherichia coli)、粪产碱杆菌(Alcaligenes faecalis)和肠球菌(Enterococcus spp)在内的多种抗生素耐药的致病菌。但以上研究多集中于养殖粪便中抗生素耐药微生物的分离及鉴定,对猪、牛、鸡等不同养殖来源粪便以及有机肥中多耐药细菌特征的对比研究并不多见。
由于四环素类、大环内酯类、喹诺酮类和磺胺类抗生素是我国畜禽规模化养殖常用的抗生素[11],这四类抗生素多重耐药菌的存在会对畜禽养殖造成危害,如果粪污处理不当会造成一定的环境及健康风险。因此,本研究从我国北方地区的典型集约化养殖场采集了肉鸡、蛋鸡、肉牛、奶牛、生猪5种不同禽畜粪便,以及粪源有机肥样品。首先,通过对四环素、恩诺沙星、磺胺甲恶唑和泰乐菌素4类抗生素的多重耐药菌计数,了解不同养殖粪污中多重耐药菌的污染状况及堆肥前后多重耐药菌的数量变化特征;其次,通过对多重耐药菌的分离、纯化及16S rDNA基因全长对比,确定所获得的耐药菌株的分类地位;通过药敏试验,探讨不同养殖粪便来源的多重耐药细菌对不同抗生素的耐药分布情况;最后,通过扩增整合子基因盒,总结畜禽粪便中多重耐药菌的可移动元件特征。本研究为了解禽畜粪便中常见的多耐药微生物种类及其耐药特征,以及养殖粪污处理对耐药微生物的有效控制等方面均提供了基础数据。
1 材料与方法 1.1 样品的来源、采集及含水率测定本次试验所需用的畜禽粪便采取5点混合取样的方法,共采集16个样品,分别是鸡粪样品5种(蛋鸡2种,肉鸡3种)、牛粪样品4种(奶牛2种,肉牛2种)、猪粪3种、鸡粪有机肥2种、猪粪有机肥2种,每种样品各20 g。鸡粪及猪粪有机肥样品均采自养殖小区的堆肥设施,采样季节堆肥辅料以秸秆为主。采集粪便样品后,迅速带回实验室于4 ℃保藏,在24 h内进行耐药菌的计数和含水率测定。
1.2 培养基的配制将溶化的LB固体培养基降温至50 ℃左右后,加入4种抗生素后倒平板。抗生素的最终浓度为:四环素16 µL·mL-1,恩诺沙星1 µL·mL-1,磺胺甲恶唑76 µL·mL-1,泰乐菌素1 µL·mL-1。同时设置不加抗生素的LB培养基平板,进行细菌总数的测定。
1.3 多重耐药菌的计数、分离及筛选称取10 g粪便或有机肥样品,倒入装有已灭好菌的90 mL生理盐水的三角瓶中,制成均匀的悬液。按10倍法进行系列稀释,稀释到10-6。土壤悬液涂布接种:空白板选取10-3、10-4、10-5 3个稀释度,添加抗生素板选取10-2、10-3、10-4 3个稀释度。待土壤悬液吸收后将平板倒置于28 ℃恒温箱中,培养48 h。取出平板,选取菌落数在20~200的平板进行计数。同时随机挑选5个单菌落,接种新平板并培养48 h。随后多次划线纯化后,将获得的菌液与30%甘油等体积比混合后,保藏于-80 ℃冰箱中待用。
1.4 多重耐药菌的分子鉴定采用EasyPure Bacteria Genomic DNA Kit试剂盒提取菌株DNA,PCR扩增16S rDNA基因,引物为:27F、1492R。PCR反应体系为:PCR mix为12.5 µL,forward primer及reverse primer均为1 µL,ddH2O为9.5 µL,template DNA为1 µL,共25 µL。PCR反应条件:初始变性98 ℃,3 min循环1次;变性98 ℃,10 s循环30次;退火55 ℃,10 s循环30次;延伸72 ℃,10 s循环30次;最终延伸72 ℃,3 min循环1次;4 ℃保持。待PCR反应结束后,将扩增产物送到北京博迈德基因技术有限公司测序。
1.5 多重耐药菌的耐药性试验 1.5.1 药敏纸片本次试验采用药敏纸片琼脂扩散法(K-B)检测细菌耐药性,所用的抗生素纸片有头孢噻呋、氟苯尼考、环丙沙星、青霉素、庆大霉素、诺氟沙星、氨苄西林、恩诺沙星、红霉素、氯霉素、磺胺甲恶唑、左氧氟沙星、阿米卡星、四环素、头孢哌哃。
1.5.2 涂布法测定细菌耐药性采用纸片法进行药物敏感性检测,具体试验方法参照文献[12]。
1.6 耐药菌整合子扩增 1.6.1 Ⅰ、Ⅱ类整合子的扩增对已有的85株菌株进行PCR扩增Ⅰ、Ⅱ类整合子基因,引物为:intlF、intlR;int2F、int2R。PCR反应体系及反应条件参考文献[13]。待PCR反应结束后,对扩增出的DNA进行电泳,有电泳条带的则表示含有Ⅰ、Ⅱ类整合子基因。
1.6.2 Ⅰ、Ⅱ类整合子基因盒的扩增对上述有电泳条带的DNA进行PCR扩增Ⅰ、Ⅱ类整合子基因盒,引物为:intl-VF、intl-VR;int2-VF、int2-VR。PCR反应体系为:PCR mix为20 µL,引物为0.8 µL,ddH2O为16.4 µL,template DNA为2 µL,共40 µL。PCR反应条件同上。待PCR反应结束后,将扩增产物送到北京博迈德基因技术有限公司测序。
1.7 数据分析利用软件Origin 8.5进行试验数据的整理和作图;采用R语言LSD方法对不同种类样品的计数结果是否存在显著差异进行统计分析;利用MEGA-X软件进行16S rDNA序列比对和系统发育树分析。
2 结果与分析 2.1 养殖场粪污中多重耐药菌概况本文选择四环素、恩诺沙星、磺胺甲恶唑和泰乐菌素作为典型抗生素,对17个养殖场粪便及有机肥样品进行多重耐药培养后计数,结果表明,所有粪样品中,鸡粪中多重耐药菌绝对数量较高,范围在8.23× 106~8.61×107 cfu · g-1;猪粪其次,范围在2.83×104~ 3.70×106 cfu· g-1;牛粪最少,范围在2.53×105~1.70×106 cfu· g-1。而有机肥样品中耐药菌的绝对数量有明显下降,其范围在5.30×103~1.23×106 cfu· g-1之间。
如表 1所示,在粪样品中,鸡粪中耐药菌平均绝对数量和相对数量均最高,耐药菌的平均数量是4.26×107 cfu· g-1,平均占比为29.14%;其次为猪粪,耐药菌的平均数量是3.95 × 106 cfu · g-1,平均占比为9.13%;而牛粪中耐药菌的绝对数量和相对数量均最低,耐药菌的平均数量是1.17×106 cfu· g-1,平均占比为0.79%。与Yang等[10]研究结果类似,虽然生猪养殖过程中抗生素使用浓度和粪便中抗生素残留均高于肉鸡养殖,但鸡粪中多重耐药菌的比例都远高于猪粪,这说明抗生素残留浓度并不是多重耐药菌多少的唯一决定因素,还与养殖动物肠道微生物组成相关。而养牛场中抗生素使用频率和浓度均最低,这与牛粪中多重耐药菌浓度较低的规律保持一致。统计分析表明,鸡粪中多重耐药菌数显著高于其他粪源(P < 0.01)。
|
|
表 1 养殖场粪污与有机肥中可培养多耐药细菌计数结果 Table 1 Counting results of culturable multi-drug resistant bacteria in farm manure and organic fertilizer |
在有机肥中,鸡粪有机肥耐药菌平均相对丰度最低,耐药菌的平均数量是7.45×103 cfu· g-1,平均占比为0.43%;而猪粪有机肥耐药菌平均相对丰度最高,耐药菌的平均数量是3.69×105 cfu· g-1,平均占比为3.17%。鸡粪有机肥中耐药菌的绝对数量与鸡粪相比下降了4个数量级,平均相对数量也同时降低,从29.14%下降到3.17%;猪粪有机肥中虽然平均绝对数量变化不大,但由于堆肥能够减少总的微生物数量,使得多重耐药微生物的相对数量有所下降,从9.13%下降到0.43%。统计分析表明,鸡粪和猪粪中多重耐药菌的比例显著高于牛粪和有机肥,说明对鸡粪和猪粪进行好氧堆肥能够有效降低其中的多重耐药菌的绝对数量和相对数量,而牛粪中多重耐药菌数量相对较少。
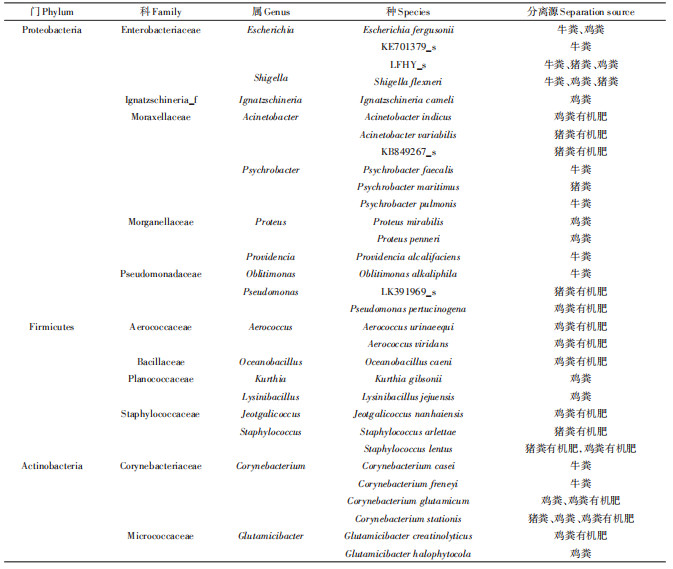
2.2 养殖粪污中多重耐药菌多样性分析通过多重耐药培养基筛选、分离和纯化,总共分离出75株多重耐药菌,其中来自于鸡粪源的有23株,猪粪源的有11株,牛粪源的有18株,有机肥来源的23株。经16S rDNA序列全长测序及系统发育树分析(图2),75株菌共有32个种(Species)分布于17个属、11个科、3个门中(表 2)。

|
图 1 养殖场粪便中多重耐药菌系统发育树 Figure 1 Multi-drug resistant phylogenetic tree in farm manure |
|
|
表 2 多重耐药菌系统发育关系 Table 2 Phylogenetic relationships of multi-drug resistant bacteria |
经系统发育树图分析表明,在门水平,禽畜养殖粪便中多重耐药菌集中分布Proteobacteria、Firmicutes和Actinobacteria,这与王晓慧[14]研究的结果较为一致。其主要分布在Proteobacteria,有41株,包括鸡粪源13株、牛粪源16株、猪粪源6株、鸡粪有机肥源3株和猪粪有机肥源3株;其次是Firmicutes,有18株,包括鸡粪源7株、鸡粪有机肥源5株和猪粪有机肥源6株;在Actinobacteria中也有16株分布,包括鸡粪源3株、牛粪源2株、猪粪源5株和鸡粪有机肥源6株。在属水平中,Escherichia中分离到的耐药菌株数量最高,为13株,占总耐药菌株数量的17.33%,该属细菌在鸡粪、猪粪、牛粪和有机肥中均有分离。Escherichia是动物粪便中常见的耐药菌属[15-16],其分离源主要有猪粪、鸡粪等[17],我们应更加重视其在环境中的传播风险。其次为Corynebacterium,占总耐药菌株数量的14.67%,已有研究表明棒状杆菌能够引起严重的呼吸道感染、心内膜炎、骨髓炎、肺炎等[18-19]。再次为Staphylococcus,占总耐药菌株数量的9.33%,葡萄球菌也是重要的人畜共患致病菌,近年来MRSA[20-22]由于其超强的耐药性而受到临床和环境研究领域的广泛关注,虽然本研究中并未发现金黄色葡萄球菌,但有两个近源属被分离,且都分离自有机肥,说明堆肥对葡萄菌属耐药菌的控制作用有限。最后为Kurthia,占总耐药菌株数量的8%,目前,并未发现特库氏菌为病原菌的明确记载,其广泛分布于环境中,尤其是动物粪便中[23]。
通过对比不同养殖用途畜禽粪便中多重耐药菌的数量及种类可知,在23株鸡粪分离源的菌株中,有8株菌来自于蛋鸡源,15株菌来自于肉鸡源。蛋鸡源中分离出的变形杆菌属菌株最多,有3株,占37.5%;而在肉鸡源中,分离出的库特氏菌属最多,有6株,占40%。其次是志贺氏菌属,有5株,占33.33%。在18株牛粪分离源的菌株中,来自于奶牛源和肉牛源的株菌各为9株。奶牛源的菌株中,嗜冷杆菌属比例最多,有4株,占44.44%,其次是埃希氏菌属,有3株,占33.33%。肉牛源的9株菌中,分离出的埃希氏菌属菌株最多,有5株,占55.56%。
在所有耐药菌株中,仅在鸡粪中分离出的菌有:Ignatzschineria cameli、Proteus mirabilis、Proteus penneri、Kurthia gibsonii、Lysinibacillus jejuensis、Glutamicibacter halophytocola,其中Ignatzschineria是鸡粪中主要的多重耐药菌属之一,并且其菌体内携带有能够整合多重耐药基因的整合子结构[10]。Proteus mirabilis是一种腐生性的条件致病菌,其自身的多重耐药性可能与养殖场抗生素使用不规范有关[24-25]。Kim等[26]在猪粪中分离出Lysinibacillus jejuensis,本研究表明其分离源并不仅限于猪粪中。仅在牛粪中分离出的菌有KE701379_s、Psychrobacter faecalis、Psychrobacter pulmonis、Providencia alcalifaciens、Oblitimonas alkaliphila、Corynebacterium casei、Corynebacterium freneyi,嗜冷杆菌属(Psychrobacter)主要存在于鱼类、家禽及肉制品中[27],目前并未发现它的致病性。由于长期滥用广谱抗生素,造成普罗威登斯菌属(Providencia)对β-内酰胺类、氟喹诺酮类、氨基糖苷类等11类的13种常用药物高度耐药[28],此外王建昌等[29]也在一进口美国种猪新鲜粪便样品中分离到一株blaNDM-1基因阴性的雷氏普罗威登斯菌;仅在猪粪中分离出的菌有Psychrobacter maritimus、Corynebacterium stationis,棒杆菌属(Corynebacterium)的部分细菌是一类生猪鼻腔内常携带的病原菌,目前有研究表明,其有可能通过空气传播给人类[30]。有机肥中耐药菌与养殖粪便中有所不同,其主要分布在不动杆菌、假单胞菌、气球菌和葡萄球菌属内,而在畜禽粪便耐药菌中占优势的肠杆菌和棒状杆菌并不占据优势,可能原因是肠杆菌和棒状杆菌的耐热性不好,在堆肥的高温过程中多被有效杀灭,曾维扬[31]的研究中指出在60 ℃水浴处理0.5 min后,肠杆菌的死亡率高达99.9%。王晓慧[14]也指出棒状杆菌在经过高温堆肥后也呈现下降趋势,而革兰氏阳性菌的Aerococcus和Staphylococcus相对有更好的耐热性,因此在有机肥中更易于存活。续彦龙等[32]研究指出在堆肥第0 d,样品中金黄色葡萄球菌浓度均达到108 cfu· g-1,堆肥第7 d时,实验组样品中金黄色葡萄球菌即使降低至103 cfu· g-1,但仍有较好存活。此外,Aerococcus和Staphylococcus同属于厚壁菌门,许修宏等[33]指出,在堆肥中其相对丰度整体呈先升后降趋势,在升温期和高温期相对丰度最高表明其耐热性较好。
2.3 分离菌株的耐药性特征对23株鸡粪多重耐药菌样品、18株牛粪多重耐药菌样品、11株猪粪多重耐药菌样品进行药敏试验,其抗生素耐药检测结果见表 3~表 5。
|
|
表 3 鸡粪中抗生素耐药检测结果(株) Table 3 Statistical results of antibiotic resistance test in poultry manure |
|
|
表 4 牛粪中抗生素耐药检测统计结果(株) Table 4 Statistical results of antibiotic resistance test in cow manure |
|
|
表 5 猪粪中抗生素耐药检测统计结果(株) Table 5 Statistical results of antibiotic resistance test in swine manure |
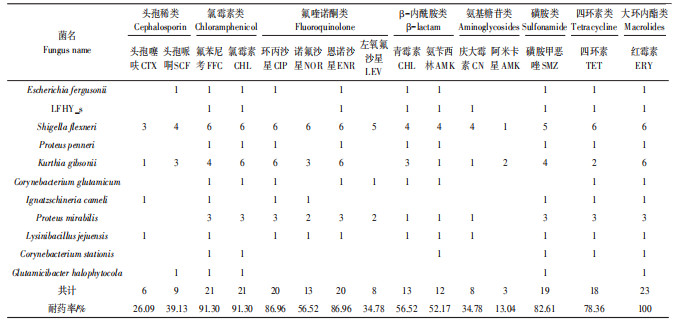
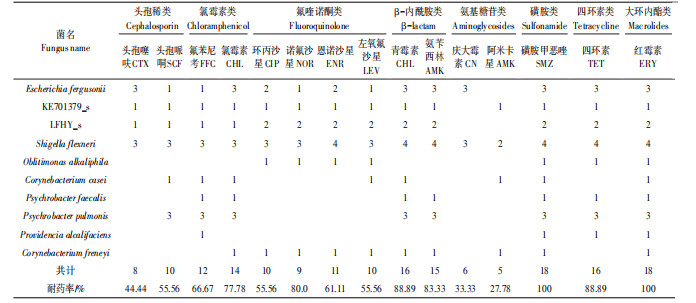
在鸡粪中分离出的23株多重耐药菌中,对15种抗生素的耐药性由弱至强依次为:阿米卡星 < 头孢噻呋 < 庆大霉素=左氧氟沙星 < 头孢哌哃 < 氨苄西林 < 青霉素=诺氟沙星 < 四环素 < 磺胺甲恶唑 < 环丙沙星=恩诺沙星 < 氯霉素=氟苯尼考 < 红霉素;而在牛粪中分离出的18株多重耐药菌中,耐药性由弱至强依次为:阿米卡星 < 庆大霉素 < 头孢噻呋 < 左氧氟沙星=环丙沙星=头孢哌哃 < 恩诺沙星 < 氟苯尼考 < 氯霉素 < 诺氟沙星 < 氨苄西林 < 四环素=青霉素 < 磺胺甲恶唑=红霉素。在猪粪中分离的11株多重耐药菌的耐药性由弱至强依次为:阿米卡星 < 头孢噻呋=头孢哌哃 < 恩诺沙星 < 青霉素=庆大霉素=氨苄西林=诺氟沙星 < 左氧氟沙星 < 环丙沙星 < 氟苯尼考=氯霉素=磺胺甲恶唑 < 四环素 < 红霉素。其中,3种分离源的菌株对红霉素和四环素的耐药性均高于70%,这可能与养殖过程中长期使用大环内脂类和四环素类抗生素作为饲料添加剂有关,Pan等[34]检测表明猪粪中四环素类抗生素残留量达到764.4 mg·kg-1。除此以外,鸡粪分离源菌株中检测到耐药率超过70%的抗生素有5种,为磺胺甲恶唑、环丙沙星、恩诺沙星、氯霉素及氟苯尼考。在牛粪分离源菌株中检测到耐药率超过70%的抗生素也有5种,为氯霉素、诺氟沙星、氨苄西林、青霉素及磺胺甲恶唑,它们常用于治疗和预防疾病,Zhao等[35]对我国规模化养殖场畜禽粪便调查发现,环丙沙星、恩诺沙星在牛粪中含量分别为29.59 mg·kg-1和46.70 mg·kg-1。
蛋鸡和肉鸡分离源菌株耐药性对比结果表明,在8株蛋鸡分离源的菌株中,其对氟苯尼考、磺胺甲恶唑、红霉素的耐药率均达100%;而对头孢哌哃及阿米卡星的耐药率低于30%。与肉鸡分离源的8株菌对比,除红霉素耐药率相同外,氯霉素和恩诺沙星的耐药率也为100%;敏感率较高的是阿米卡星和头孢噻呋。奶牛和肉牛分离源菌株耐药性对比结果表明,两者对磺胺甲恶唑和红霉素的耐药率均达到100%。在奶牛的分离源株菌中,其对头孢稀类、氟喹诺酮类和氨基糖苷类抗生素耐药率均低于50%,而耐药率低于50%的肉牛分离源菌株中只有氨基糖苷类中的阿米卡星。
3类动物粪污中的多重耐药菌均对养殖中常用的抗生素如氯霉素类、氟喹诺酮类、β-内酰胺类、磺胺类、四环素类、大环内脂类等抗生素有着较高的耐药性,而对氨基糖苷类和头孢稀类抗生素都有着较高的敏感率,尤其是对阿米卡星这种抗生素,猪粪中的多抗菌对其耐药率为0,而在鸡粪和牛粪中多抗菌的耐药率也分别仅为13.04%和27.78%。杨永珍等[12]的研究也表明,在河南部分地区大多数鸡志贺氏菌对氨苄/舒巴坦和阿米卡星较为敏感。佟盼盼[36]对来自东北和江苏地区鸡粪样品中的大肠杆菌进行的药敏试验指出,其对四环素、环丙沙星、氯霉素、左氧氟沙星、庆大霉素耐药率在50%以上,而对阿米卡星为敏感。对新疆耆县规模化猪场大肠杆菌药敏试验显示,对氨苄西林、氟苯尼考、庆大霉素、诺氟沙星及恩诺沙星这五种药物耐药率在26.5%~66.3%[37],采集于武汉郊区规模化养殖场的样品中分离的大肠杆菌对于头孢噻呋、头孢哌哃及阿米卡星的高敏率均在80%以上[38]。这表明不同地区多重耐药菌的耐药性都是类似的,与本研究相符。庞歌[39]在2010年研究显示,针对河南区域鸡源志贺氏菌的药敏试验,其对磺胺类及氟喹诺酮类抗生素耐药性较高,而对氨基糖苷类抗生素较为敏感。由此可知,近些年来β-内酰胺类抗生素的耐药性有所提高。畜禽养殖动物发病的复杂性增加了抗菌药物在临床上的预防及治疗用量,这使得来自于粪便的细菌也产生了严重的耐药性。本研究也为日后养殖粪污处理过程中抗生素耐药细菌的去除规律研究提供了基础数据,也使进一步改进粪污处理工艺的相关研究更易聚焦关键耐药细菌和耐药基因。
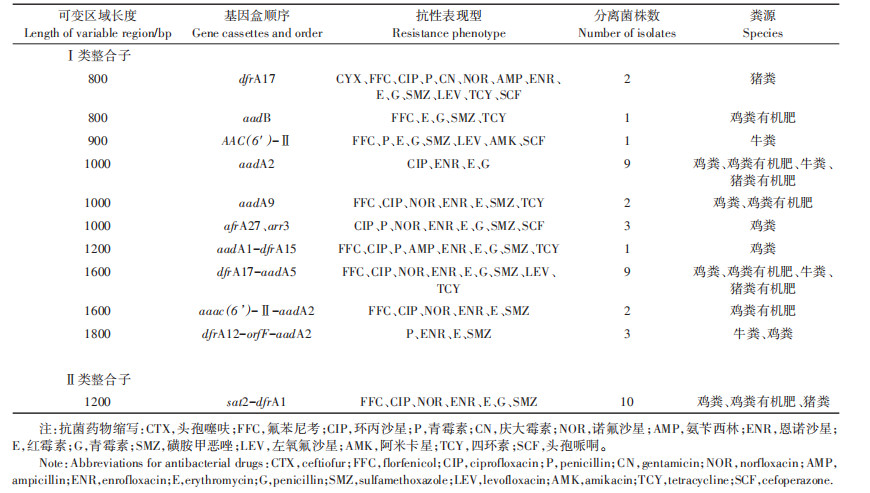
2.4 多重耐药菌的整合子构成整合子(Integrons)是耐药基因传播的重要参与者,它们常常能整合启动子与新耐药基因,虽然耐药整合子本身不具有移动性,但其能与一系列耐药基因的转移和插入作用相关联,对整合子结构的解析有助于研究多重耐药菌的进化及转移能力评估。笔者对获得的85株多重耐药菌进行整合子检测,结果表明,有69株菌含有Ⅰ类整合子基因,占81.2%;有50株菌含有Ⅱ类整合子基因,占58.8%。进一步对整合子的基因盒进行扩增,总共获得了11种基因盒(表 6),片段长度从0.8 kb到1.8 kb不等。在Ⅰ类整合子中有10个基因盒,其中分布较为广泛的基因为氨基糖苷类耐药基因aadA2 36%(n=12/33)和磺胺类耐药基因dfrA17 33%(n=11/33)两种,在鸡粪、牛粪和有机肥中均有检出。在Ⅱ类整合子中,仅有sat2-dfrA1一种基因盒检出,片段大小均为1.2 kb,这一结果与Yang等[13]研究相类似,说明Ⅱ类整合子基因盒较为保守。
|
|
表 6 分离菌株的抗生素耐药性及其与整合子的关系 Table 6 Antibiotic resistance of isolated strains and their relationship to integrons |
(1)规模化畜禽养殖场粪便中,四环素、恩诺沙星、磺胺甲恶唑和泰乐菌素4种抗生素的多重耐药菌污染状况(绝对数量和相对数量)排序为鸡粪>猪粪>牛粪,粪源有机肥中可培养的多重耐药菌的绝对数量和相对数量均有所下降,说明堆肥是一种控制多重耐药细菌的有效手段。
(2)规模化禽畜养殖粪便中多重耐药菌主要集中在Proteobacteria、Firmicutes和Actinobacteria3个门中,多重耐药菌的优势属为Escherichia、Corynebacterium、Kurthia;而有机肥样品中多抗耐药菌的优势属与粪便中有所不同,为 Staphylococcus和Glutamicibacter。
(3)多重耐药菌株的药敏试验结果表明,3类养殖动物粪便中的多重耐药菌均对养殖常用抗生素如氯霉素类、氟喹诺酮类、β-内酰胺类、磺胺类、四环素类、大环内脂类抗生素等都有着较高的耐药性;而对氨基糖苷类和头孢稀类抗生素,尤其是阿米卡星都有着较高的敏感率。
(4)通过对Ⅰ、Ⅱ类整合子基因盒的扩增,明确了在养殖粪便和堆肥中广泛存在的Ⅰ类整合子基因盒类型为aadA2和dfrA17,以及Ⅱ类整合子基因盒主要类型是sat-dfrA1。
| [1] |
Sun W, Qian X, Gu J, et al. Mechanisms and effects of arsanilicacid on antibiotic resistance genes and microbial communities during pig manure digestion[J]. Bioresource Technology, 2017, 234: 217-223. DOI:10.1016/j.biortech.2017.03.025 |
| [2] |
Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. |
| [3] |
Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences, 2013, 110(9): 3435-3440. DOI:10.1073/pnas.1222743110 |
| [4] |
Zhao L, Dong Y H, Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5): 1069-1075. DOI:10.1016/j.scitotenv.2009.11.014 |
| [5] |
Hoa P T P, Managaki S, Nakada N, et al. Antibiotic contamination and occurrence of antibiotic-resistant bacteria in aquatic environments of northern Vietnam[J]. Science of the Total Environment, 2011, 409(15): 2894-2901. DOI:10.1016/j.scitotenv.2011.04.030 |
| [6] |
Zhang H, Zhou Y, Huang Y, et al. Residues and risks of veterinary antibiotics in protected vegetable soils following application of different manures[J]. Chemosphere, 2016, 152: 229-237. DOI:10.1016/j.chemosphere.2016.02.111 |
| [7] |
孙刚, 袁守军, 计峰, 等. 畜禽粪便中抗生素残留危害及其研究进展[J]. 环境健康杂志, 2009, 26(3): 277-279. SUN Gang, YUAN Shou-jun, JI Feng, et al. The harm of antibiotic residues in livestock manure and its research progress[J]. Journal of Environmental Health, 2009, 26(3): 277-279. |
| [8] |
牛天琦.鸡粪中多重耐药细菌的分离鉴定及介导抗性基因水平转移元件的检测[D].新乡: 河南师范大学, 2015: 24-25. NIU Tian-qi. Isolation and identification of multi-drug resistant bacteria in chicken manure and detection of horizontal transfer elements of resistance genes[D]. Xinxiang: Henan Normal University, 2015: 24-25. http://cdmd.cnki.com.cn/Article/CDMD-10476-1015416413.htm |
| [9] |
张昊, 王盼亮, 杨清香, 等. 畜禽粪便中多重耐药细菌及耐药基因的分布特征[J]. 环境科学, 2018, 39(1): 460-466. ZHANG Hao, WANG Pan-liang, YANG Qing-xiang, et al. Distribution characteristics of multi-drug resistant bacteria and drug resistance genes in livestock manure[J]. Environmental Science, 2018, 39(1): 460-466. |
| [10] |
Yang Q X, Ren S W, Niu T Q, et al. Distribution of antibiotic-resistant bacteria in chicken manure and manure-fertilized vegetable[J]. Environmental Science and Pollution Research, 2014, 21(2): 1231-1241. DOI:10.1007/s11356-013-1994-1 |
| [11] |
吴丹.北京地区禽场粪便中抗生素及抗性基因污染特性与好氧堆肥实验研究[D].北京: 北京化工大学, 2018. WU Dan. Study on pollution characteristics of antibiotics and resistance genes in feces of poultry farms in Beijing and aerobic composting experiments[D]. Beijing: Beijing University of Chemical Technology, 2018. |
| [12] |
杨永珍, 许兰菊, 张丹鹤, 等. 河南省部分地区鸡志贺氏菌病病原分离鉴定及药敏试验[J]. 河南农业科学, 2011, 40(3): 134-139. YANG Yong-zhen, XU Lan-ju, ZHANG Dan-he, et al. Isolation, identification and drug sensitivity test of chicken Shigella disease in some areas of Henan Province[J]. Journal of Henan Agricultural Sciences, 2011, 40(3): 134-139. DOI:10.3969/j.issn.1004-3268.2011.03.038 |
| [13] |
Yang Q, Tian T, Niu T, et al. Molecular characterization of antibiotic resistance in cultivable multidrug-resistant bacteria from livestock manure[J]. Environmental Pollution, 2017, 229: 188-198. DOI:10.1016/j.envpol.2017.05.073 |
| [14] |
王晓慧.禽畜粪便堆肥过程中耐药基因变化的研究[D].上海: 华东师范大学, 2017. WANG Xiao-hui. Study on the changes of drug resistance genes in poultry manure composting process[D]. Shanghai: East China Normal University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10269-1017075897.htm |
| [15] |
Gerson N, Tatiana A C, Eliana G S, et al. Virulence factors of avian pathogenic Escherichia coli(APEC)[J]. Vet Bras, 2009, 29(7): 479-486. DOI:10.1590/S0100-736X2009000700001 |
| [16] |
Jiang H X, Lv D H, Chen Z L, et al. High prevalence and widespread distribution of multi-resistant Escherichia coli isolatesin pigs and poultry in China[J]. The Veterinary Journal, 2011, 187(1): 99-103. DOI:10.1016/j.tvjl.2009.10.017 |
| [17] |
祁诗月, 任四伟, 李雪玲, 等. 禽畜养殖粪便中多重抗生素耐药细菌研究[J]. 生态学报, 2013, 33(13): 3970-3977. QI Shi-yue, REN Si-wei, LI Xue-ling, et al. Study on multiple antibiotic resistant bacteria in poultry manure[J]. Journal of Ecology, 2013, 33(13): 3970-3977. |
| [18] |
杨雪静, 曹俊敏, 许志良, 等.纹带棒状杆菌的分离鉴定及体外药敏试验分析[C]//2006年浙江省检验医学学术年会论文汇编, 2006. YANG Xue-jing, CAO Jun-min, XU Zhi-liang, et al. Isolation and identification of coryneform bacteria and in vitro susceptibility test[C]//2006 Zhejiang Provincial Laboratory of Medicine Annual Conference Papers, 2006. |
| [19] |
Suh J W, Ju Y, Lee C K, et al. Molecular epidemiology and clinical significance of Corynebacterium striatum isolated from clinical specimens[J]. Infection and Drug Resistance, 2019, 12: 161-171. DOI:10.2147/IDR.S184518 |
| [20] |
Hiramatsu K, Cui L, Kuroda M, et al. The emergence and evolution of methicillin-resistant Staphylococcus aureus[J]. Trends in Microbiology, 2001, 9(10): 486-493. DOI:10.1016/S0966-842X(01)02175-8 |
| [21] |
姜慧娇, 苏艳, 韦海娜, 等. 牛乳源耐甲氧西林金黄色葡萄球菌的检测与耐药性分析[J]. 新疆农业大学学报, 2013(1): 16-20. JIANG Hui-jiao, SU Yan, WEI Hai-na, et al. Detection and drug resistance analysis of methicillin-resistant Staphylococcus aureus in bovine milk source[J]. Journal of Xinjiang Agricultural University, 2013(1): 16-20. DOI:10.3969/j.issn.1007-8614.2013.01.004 |
| [22] |
Alt K, Fetsch A, Schroeter A, et al. Factors associated with the occurrence of MRSA CC398 in herds of fattening pigs in Germany[J]. BMC Vet Res, 2011, 7: 69. DOI:10.1186/1746-6148-7-69 |
| [23] |
陈翠珍, 房海, 张晓君, 等. 锦鲤中吉氏库特菌的分离与鉴定[J]. 微生物学杂志, 2010(1): 1-5. CHEN Cui-zhen, FANG Hai, ZHANG Xiao-jun, et al. Isolation and identification of K. sinensis from Koi[J]. Chinese Journal of Microbiology, 2010(1): 1-5. DOI:10.3969/j.issn.1005-7021.2010.01.001 |
| [24] |
Cohen-Nahum K, Saidel-Odes L, Riesenberg K, et al. Urinary tract infections caused by multi-drug resistant Proteus mirabilis:Risk factors and clinical outcomes[J]. Infection, 2010, 38(1): 41-46. DOI:10.1007/s15010-009-8460-5 |
| [25] |
徐睿, 李颜桃. 鸡源致病性奇异变形杆菌的分离鉴定与遗传进化分析[J]. 中国畜牧兽医, 2018, 45(9): 212-220. XU Rui, LI Yan-tao. Isolation, identification and genetic evolution analysis of pathogenic Proteus from chicken origin[J]. China Animal Husbandry and Veterinary Medicine, 2018, 45(9): 212-220. |
| [26] |
Kim J Y, Park S H, Oh D C, et al. Lysinibacillus jejuensis sp. nov. isolated from swinery waste[J]. Journal of Microbiology, 2013, 51(6): 872-876. DOI:10.1007/s12275-013-2500-7 |
| [27] |
曹俊敏, 杨雪静, 周宏伟, 等. 一株嗜冷杆菌属细菌的分离鉴定[J]. 中华检验医学杂志, 2012, 35(12): 1183-1184. CAO Jun-min, YANG Xue-jing, ZHOU Hong-wei, et al. Isolation and identification of a Psychrotrophic bacteria[J]. Chinese Journal of Laboratory Medicine, 2012, 35(12): 1183-1184. DOI:10.3760/cma.j.issn.1009-9158.2012.12.029 |
| [28] |
芮萍, 田瑞, 刘玄福, 等. 致仔猪腹泻的雷氏普罗威登斯菌的分离鉴定[J]. 中国兽医学报, 2017(10): 1910-1912, 1932. RUI Ping, TIAN Rui, LIU Xuan-fu, et al. Isolation and identification of Providencia serrata in diarrhea of piglets[J]. Chinese Journal of Veterinary Medicine, 2017(10): 1910-1912, 1932. |
| [29] |
王建昌, 姜彦芬, 王金凤, 等. 猪源性blaNDM-1阴性雷氏普罗威登斯菌的分离鉴定[J]. 中国动物检疫, 2015(4): 22-25. WANG Jian-chang, JIANG Yan-fen, WANG Jin-feng, et al. Isolation and identification of Porogen-derived blaNDM-1 Negative P. edodes[J]. Chinese Journal of Animal Quarantine, 2015(4): 22-25. DOI:10.3969/j.issn.1005-944X.2015.04.006 |
| [30] |
Boschert V, Berger A, Konrad R, et al. Corynebacterium species nasal carriage in pigs and their farmers in Bavaria, Germany:Implications for public health[J]. Veterinary Record, 2014, 175(10): 248-248. DOI:10.1136/vr.102634 |
| [31] |
曾维扬. 乳粉中阪崎肠杆菌耐热性的研究[J]. 福建畜牧兽医, 2011, 33(5): 11-13. ZENG Wei-yang. Study on heat tolerance of Enterobacter Sakazakii in milk powder[J]. Fujian Journal of Animal Husbandry and Veterinary Medicine, 2011, 33(5): 11-13. DOI:10.3969/j.issn.1003-4331.2011.05.005 |
| [32] |
续彦龙, 王丽丽, 龚改林, 等.猪粪堆肥热压力对金黄色葡萄球菌的影响[C]//中国畜牧兽医学会2014年学术年会, 2014: 1. XU Yan-long, WANG Li-li, GONG Gai-lin, et al. Effect of heat stress of pig manure compost on US taphylococcus aureus[C]//2014 Annual Meeting of China Animal Husbandry and Veterinary Society, 2014: 1. |
| [33] |
许修宏, 成利军, 许本姝, 等. 基于高通量测序分析牛粪堆肥中细菌群落动态变化[J]. 东北农业大学学报, 2018, 49(3): 10-20. XU Xiu-hong, CHENG Li-jun, XU Ben-shu, et al. Dynamic analysis of bacterial community in cow manure compost based on highthroughput sequencing[J]. Journal of Northeast Agricultural University, 2018, 49(3): 10-20. DOI:10.3969/j.issn.1005-9369.2018.03.002 |
| [34] |
Pan X, Qiang Z, Ben W, et al. Residual veterinary antibiotics in swine manure from concentrated animal feeding operations in Shandong Province, China[J]. Chemosphere, 2011, 84(5): 695-700. DOI:10.1016/j.chemosphere.2011.03.022 |
| [35] |
Zhao L, Dong Y H, Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5): 1069-1075. DOI:10.1016/j.scitotenv.2009.11.014 |
| [36] |
佟盼盼.鸡粪便菌耐药基因及其产ESBLs大肠杆菌耐药性的研究[D].长春: 吉林大学, 2015. TONG Pan-pan. Study on drug resistance of chicken fecal bacteria and Escherichia coli resistance of ESBLs[D]. Changchun: Jilin University, 2015. |
| [37] |
隆茂俊, 姚晓慧, 夏利宁. 某猪场不同生长期猪源大肠杆菌耐药性分析[J]. 中国畜禽种业, 2018, 14(7): 31-32. LONG Mao-jun, YAO Xiao-hui, XIA Li-ning. Analysis of drug resistance of Escherichia coli in pigs in different growing seasons[J]. China Animal and Poultry Industry, 2018, 14(7): 31-32. DOI:10.3969/j.issn.1673-4556.2018.07.020 |
| [38] |
邓均华, 熊忠良, 王红琳, 等. 规模化养殖场大肠杆菌的分离鉴定与耐药性监测[J]. 湖北农业科学, 2008, 47(6): 85-89. DENG Jun-hua, XIONG Zhong-liang, WANG Hong-lin, et al. Isolation, identification and drug resistance monitoring of Escherichia coli in large-scale farms[J]. Hubei Agricultural Sciences, 2008, 47(6): 85-89. |
| [39] |
庞歌.河南省部分地区鸡源志贺氏菌的分离鉴定、耐药性及PCR检测[D].郑州: 河南农业大学, 2010. PANG Ge. Isolation, identification, drug resistance and PCR detection of Shigella isolated from chicken in some areas of Henan Province[D]. Zhengzhou: Henan Agricultural University, 2010. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=2010270777.nh |
 2020, Vol. 39
2020, Vol. 39