2. 沈阳农业大学农学院, 沈阳 110866;
3. 锦州市生态与农业气象中心, 辽宁 锦州 121000;
4. 辽宁省农业科学院植物营养与环境资源研究所, 沈阳 110161
2. College of Agriculture, Shenyang Agricultural University, Shenyang 110866, China;
3. Jinzhou Ecological and Agricultural Meteorological Center, Jinzhou 121000, China;
4. Plant Nutrition and Environmental Resources Research Institute, Liaoning Academy of Agricultural Science, Shenyang 110161, China
大气平流层当中臭氧(O3)衰减引起的地表UVB辐射增强是全球气候变化问题之一。太阳紫外辐射到达地面需通过平流层中的O3层进行过滤,O3衰减乃至空洞的出现,致使到达地面的太阳紫外辐射增强。据北京监测数据显示,我国大气平流层的O3衰减情况也很严重,平流层O3总量呈降低趋势,我国各地平均降低5.1%[1-2]。研究表明,大气平流层O3每减少1%,到达地面的太阳紫外辐射增加2%[3-4]。UV-B辐射(280~320 nm)是可见光的天然成分,对植物具有重要的生物学作用[5-6]。Dehariya等[7]认为,增强的UV-B辐射可以改变植物的光合作用、水分的代谢以及碳从生长池分配到二级代谢的途径,且外观形态上与在UV-B环境下生长的植物相比,在没有紫外辐射下的叶片生长速度更快、叶片更大。
有研究者认为当发生常规光合作用时,激发态的光子传递到光系统Ⅱ(PSⅡ)后使光反应中心P680发生电荷分离,产生光合电子流,且光合电子流越大,表明其光合能力越强[8-10],但当受到外界UV-B胁迫的时间和强度增加时,光合反应中心的开放程度以及光合效率则会降低[11]。在研究水稻等C3植物过程中,曾由Farquhar等[12-13]提出的FvCB模型因能描述稳态的C同化过程且具有明确的生物学意义而被广泛应用于光合作用研究[14]。用该模型可描述植物光合作用中如最大羧化速率、最大电子传递速率等几个重要参数[15-16],但叶子飘等[17]在估算植物叶片电子最大传递速率以及计算具体的C同化和光呼吸所分配的光合电子流时, 估算值高于FvCB生化模型的测算值,因此本文采用叶子飘等[17]的研究方法进行估算。
近些年,研究者们常通过研究叶绿素a快速荧光诱导动力学参数的变化进而研究外界胁迫对植物光合作用的影响[18]。叶子飘等[19]利用快速荧光诱导动力学技术,发现UV-B辐射增加使绿豆幼苗的光合作用效率降低,捕光复合体和电子传递系统被损坏,电子传递速率下降。王伟等[20]在实验中增设UV-B辐射后,紫花苜蓿的各项荧光参数均降低,表明:一是紫花苜蓿叶片的光合器官活性受UV-B胁迫后降低,进而对C的同化和固定减少,导致光能过剩;二是植物叶片光系统PSⅡ为维持自身运转,通过减少光合电子传递方式来调节对C的代谢力,这与王锦旗等[21]的研究结果相一致,且有研究发现当PSⅡ反应中心开放程度变大时,光化猝灭也会增大[22]。而韩文等[23]研究表明,短时间的UV-B辐射对拟南芥叶绿素荧光特性有影响,原初光能转化效率、光化学猝灭系数等指标降低,NPQ值则呈上升趋势。研究认为,只有经过长时间的UV-B辐射PSⅡ反应中心才会受创,从而影响光合电子传递,而短时间辐射对PSⅡ反应中心影响较小。
已有研究表明,作物对UV-B辐射增强表现敏感,株高、叶面积、干物质量等均有降低表现[24],水稻产量与品质以及有效穗数和结实率显著下降,叶绿素含量与光合速率也有所降低[25-27]。但针对UV-B辐射对北方粳稻光合特性的研究还相对较少,尤其是针对营养生长时期,因此本文以东北粳稻为受试材料,探究了营养生长时期UV-B辐射增强对粳稻光化学活性和光合电子流传递分配等方面的影响机制。
1 材料与方法 1.1 试验材料与方法以粳稻品种‘沈农265’为试验材料,于2014年5—10月在沈阳农业大学水稻研究所试验田进行,试验布局如图 1所示。采用盆栽方式种植,并选用南地大田水稻土作为生长土壤,土壤有机质含量33.8 g· kg-1,速效钾含量155.7 mg·kg-1、速效磷含量138.2 mg·kg-1、速效氮含量187.8 mg·kg-1。设置对照组CK(自然光照射)、处理组T1(自然光照射+UV-B辐射1.05 W·m-2)和T2(自然光照射+UV-B辐射2.1 W· m-2)。夏季自然光照实际日均UV-B辐射为21 W· m-2数据来源于沈阳气象局,即T1和T2处理分别增加了实际辐射的5%和10%,各组均种植42盆,每日8:00起连续照射8 h。移栽后每隔20 d对叶片进行一次活体测量和取样,每处理重复3次。
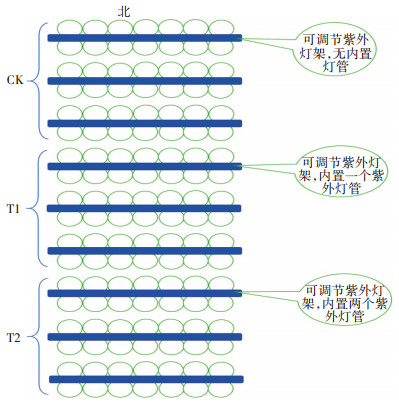
|
图 1 试验布局图 Figure 1 Experimental design layout |
选取水稻所培育的三叶期幼苗移栽于无孔试验盆中,试验盆上直径0.33 m、下直径0.20 m、盆深0.29 m,插秧时3穴·桶-1,1株·穴-1,对照组CK和处理组T1、T2各42桶,并进行常规水肥管理。架设北京电光源研究所生产的紫外灯管于幼苗上方,每个灯架配有防雨灯罩,且呈东西方向摆放,以减少遮阴效果,灯架高度可调整,始终与植株保持0.3~0.4 m高度,以保证植株受到相同剂量的UV-B辐射,每日8:00-16:00开启紫外灯照(阴雨天除外)。
在营养生长3个测定日期即移栽后第20、40、60 d(孕穗期前),在CK和处理组中各随机选出6株植株做标记。选择晴朗午前进行活体测量,利用暗适应夹进行30 min暗适应后,测定荧光诱导动力学曲线及其参数;用Li-6400型光合测定仪测定净光合速率(Pn)和暗呼吸速率(Rd),选择人工红蓝光源,光强设定为1 000 μmol·m-2·s-1;利用FMS–Ⅱ型便携式荧光测定系统(Hansatech,UK)测定同期荧光参数,暗反应参数则需叶片暗适应30 min后测定,测量时设定光照强度为1 000 μmol·m-2·s-1。每处理重复3次。
1.3 模型应用与数据处理 1.3.1 模型简介计算分配到碳同化和光呼吸光合电子流的模型[28]。
(1)光合电子传递活性:通过PSⅡ的非环式光合总电子传递速率:JF=ΦPSⅡ×I×a×f=rETR;
参与光呼吸的电子流:Jo=2/3[JF-4(Pn+Rd)];参与碳还原的电子流:Jc=1/3[JF+8(Pn+Rd)];PSⅡ实际光化学量子效率:ΦPSⅡ=(Fm′-Fs)/Fm′。
(2)Rubisco的氧化速率(Vo)和羧化速率(Vc):JF=4Vc+6Vo,Vc=Pn+Rd+0.5Vo。
其中ΦPSⅡ为实际光化学量子效率;I为入射叶面光强;a为叶片的光吸收系数;f为光能在光系统Ⅱ中所占比;rETR为光电子传递相对速率;Pn为净光合速率;Rd为暗呼吸速率;Fm′为光下最大荧光;Fs为光下稳态荧光。
1.3.2 荧光诱导动力学参数的计算荧光诱导动力学参数及计算方法见表 1。
|
|
表 1 叶绿素荧光动力学参数 Table 1 Parameters of fluorescence transient |
数据采用SPSS 17.0进行方差分析,采用LSD法对数据进行多重比较,显著性检验在0.05的水平下进行,并运用Office 2003制图。
2 结果与分析 2.1 UV-B辐射增强对光合电子传递活性的影响在营养生长期,参与光呼吸的非环式电子流传递速率Jo在UV-B处理下,T2对Jo的抑制虽然大于T1,但降低趋势不显著。参与碳还原的非环式电子流传递速率Jc,在T1处理下只有移栽后60 d表现出显著下降趋势,较CK下降了9.44%,但在T2处理下移栽后20 d降低13.64%,移栽后40 d下降了10.54%,60 d时降低了18.3%,整个营养生长期都呈现出高剂量UV-B辐射下的Jc明显小于CK的趋势,说明UV-B增强抑制了光合电子向光化学方向的传递。参与光呼吸的电子流比例Jo/JF,在T1处理下移栽后60 d较CK增加了3.52%,在T2处理下移栽后40 d和60 d较CK分别增加了3.41%和7.16%,说明营养生长期随着UV-B辐射的增强,总电子流参与光呼吸的比例也增大。光呼吸和碳还原方向的光合电子分配比例Jo/Jc在营养生长期随UV-B辐射增强呈增加的趋势,在T1处理下移栽后60 d增加了8.42%,在T2处理下均呈增加趋势,且在移栽后60 d增加了19.78%,增幅最大,说明UV-B辐射增强随着辐射时间增加,光合电子的光呼吸消耗增加,碳还原过程被减弱。
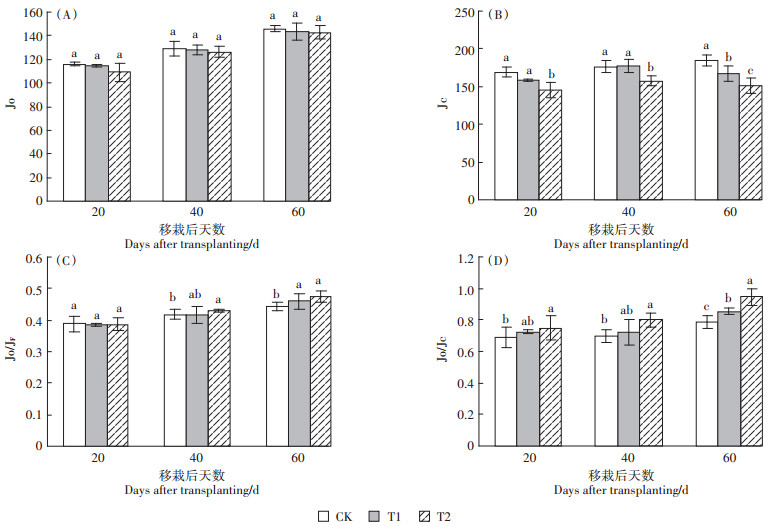
|
图 2 UV-B辐射增强对粳稻Jo、Jc、Jo/JF、Jo/Jc的影响 Figure 2 Effects of enhanced UV-B radiation on Jo, Jc, Jo/JF, Jo/Jc in Japonica rice |
Rubisco氧化速率Vo在营养生长期UV-B处理下变化趋势不显著。Rubisco羧化速率Vc,在T1处理下移栽后60 d较CK显著降低了19.49%,T2与CK在第20、40、60 d均达到显著差异(P<0.05),分别下降了10.74%、19.55%和31.17%,说明随着UV-B辐射的增强,光合电子进入Rubisco羧化反应受到了抑制,羧化传递速率显著降低。专一因子用Vo/Vc表示,即叶片Rubisco氧化速率/羧化速率,在营养生长期,T1处理下移栽后60 d较CK显著增加了20.3%,T2处理下移栽后40 d和60 d较CK分别显著增加了34.21%和48.02%。
2.3 UV-B辐射增强对荧光诱导动力学曲线的影响OJIP曲线一般分为O、J、I、P四相特征点位,分别表示10~50 μs、2 ms、30 ms、0.3~2 s时的荧光。由图 4可以看出:移栽后20 d(图 4A),CK和处理组相比在整个阶段均表现出一些差异,而在移栽后40 d(图 4B)和60 d(图 4C)影响较小;移栽20 d后J-I阶段表现出明显的CK>T1>T2,说明高剂量UV-B辐射降低了快还原型PQ库数量,其他阶段没有表现出明显特征;在I-P段,移栽后20 d和60 d表现出明显的CK大于处理组,说明UV-B辐射抑制了慢还原型PQ库的还原,而P点(0.3~2 s间的峰值)呈现最明显的变化出现在移栽后60 d,此时CK明显大于处理组,说明即使在短暂的UV-B辐射下P点没有明显变化,但是随着时间推移,最终会降低荧光产量。
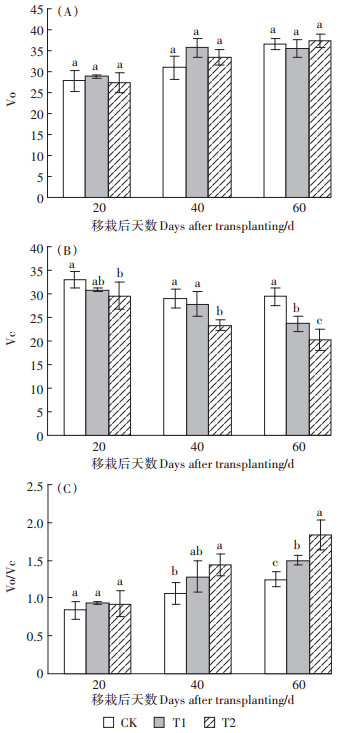
|
图 3 UV-B辐射增强对粳稻Vo、Vc、Vo/Vc的影响 Figure 3 Effects of enhanced UV -B radiation on Vo, Vc, Vo/Vc in Japonica rice |
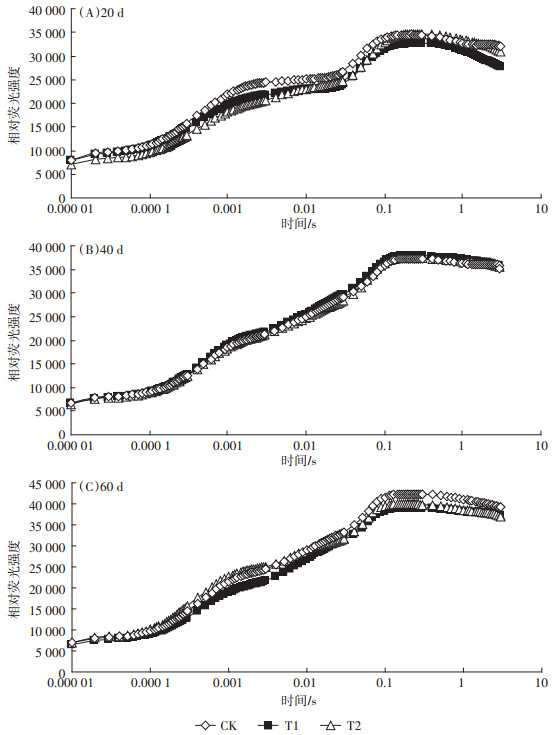
|
图 4 粳稻移栽后20 d、40 d、60 d荧光诱导动力学曲线的变化 Figure 4 The changes of chlorophyll fluorescence transient after transplanting 20 days, 40 days, 60 days in Japonica rice |
随UV-B辐射的增强,Fv/Fm在移栽期后的40、60 d均呈减小趋势,且CK大于处理组,移栽后20 d变化不显著;移栽后40 d和60 d均显著降低(图 5A),说明UV-B辐射的增强能够降低粳稻原初光能转换效率。随着UV-B辐射增强,qP在T2处理下移栽20 d后显著降低了8.98%(图 5B),但在移栽后40和60 d没有显著降低。
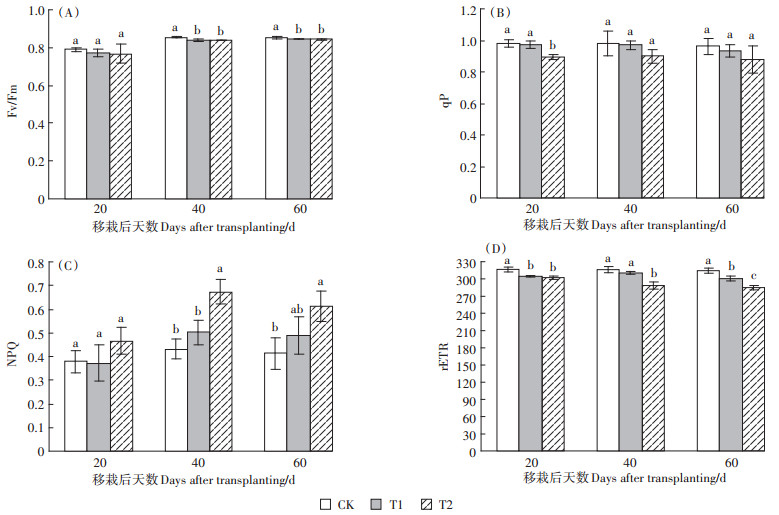
|
图 5 移栽后荧光动力学参数的变化 Figure 5 The changes of basic parameters on fluorescence after transplanting in Japonica rice |
随UV-B辐射的增强,在T2处理下移栽后40 d和60 d NPQ极显著增加了56.13%和48.8%(图 5C),说明UV-B辐射的增强,抑制了粳稻光化猝灭,促进了非光化猝灭作用。随UV-B辐射的增强,T2处理下3个测定时期的rETR均显著降低(图 5D),呈现出CK>T1>T2的趋势。移栽后20 d,T1、T2分别降低了3.77%和4.53%;移栽后40 d T2处理降低了8.76%;移栽后60 d,两处理分别降低了4.32%和9.4%,说明UV-B辐射越强,光合电子传递的相对速率越低,T2对于rETR的抑制作用大于T1。
3 讨论光合电子流是C同化的动力来源,也是光合能力的基础[28]。本试验采用的粳稻为C3植物,在C3植物中,光呼吸是非环式光合电子流分配的主要途径,同时也是重要的C代谢途径之一[29],光合电子流分配是植物光合系统的重要部分[30],提高C3植物的光合效率,减少光合产物消耗的主要影响因素是光呼吸活性,通过对各类环境中各种植物的光合电子流传递分配规律的探索有助于诠释光合机理与传递模式[31]。因此,在本实验中,通过增设UV-B辐射,探讨分析了粳稻营养期叶片的光合电子流分配规律。杜清洁等[32]在试验中发现,番茄叶片在受干旱与亚低温共同胁迫下PSⅡ总电子流及流向各库的电子流均下降,包括光合碳同化的电子流占总电子流比例,此外其他部位电子流比例均上升,且分配给光呼吸的电子流比例增幅最大,表明受到胁迫时光呼吸可作为主要的电子流库,耗散过剩光能。这与本试验得出的结论一致,在本试验中,Jc降低,但Jo/Jc增加,表明UV-B抑制了营养时期非环式光合电子流参与碳还原的比例,而增加了光呼吸电子流占比,同时Vc降低,专一因子Vo/Vc却有所增长,表明对向羧化方向传递的光合电子有抑制作用。
叶子飘等[33]和薛娴等[34]在植物光合原初反应过程中发现,光合电子流是经捕光色素分子采集光能后,在PSI和PSⅡ之间传递所产生的电荷形成的电子汇集而成。这些电子经由电子受体流转,最终被传递到NADPH和ATP中,此时在为碳同化和光呼吸提供能量的同时完成了光能到化学能的转换。余小龙等[35]认为细叶青冈的叶绿体PSⅡ反应中心如果受到损伤,从PSⅡ反应中心到QA、QB和PQ的电子转移会受到一定的限制,进而影响反应中心色素的激发能转移。本试验中,在UV-B处理20 d后降低了Pheo将电子传给QA,QA-传递给QB的过程,即快还原型PQ库的数量。李晓科等[36]认为光合速率下降的原因可能是高强度的UV-B辐射导致大麦幼苗叶片叶绿素遭到破坏致使含量降低,并且光合酶如PEP羧化酶、RuBP羧化酶活性下降,光系统受到影响,特别是捕光色素,最终使叶绿体吸收的光能降低。
张玉红等[37]和李雪莹等[38]在研究中发现,被测作物原初光能捕获效率及光合电子传递效率光化猝灭系数等受UV-B胁迫后显著降低,这与本试验中3个测定时期Fv/Fm、rETR、qP均与UV-B强度的增大而呈负相关结论一致。祁虹等[39]在研究棉花时发现,随着UV-B辐射增强,叶片中NPQ与之呈正相关增强,这与本研究结论一致,在本试验中3个测定时期NPQ都随UV-B辐射的增强而增少,表明PSⅡ反应中心受损,光化学效率降低,用于光合作用的激发能比例降低,NPQ的提高反映出一种自我保护机制。
4 结论在营养生长期UV-B辐射增加总体上会增加叶片的光呼吸耗能,降低叶片对光的利用能力,进而影响植株粳稻光合性能。
(1)在营养生长期UV-B增强总体上对光合电子的Rubisco氧化速率起到了推进作用,光合电子进入Rubisco羧化反应受到抑制,同时专一因子Vo/Vc也呈上升趋势,说明UV-B辐射的增强迫使Rubisco氧化反应消耗更多的光电子,从而没有更多光电子用于羧化反应。
(2)UV-B短期处理会影响OJIP整个阶段,随着辐射时间增加,处理间差距缩小,最后测量阶段荧光产量的明显降低说明UV-B辐射最终会影响营养生长时期叶片的相对荧光产量。
(3)UV-B辐射的增强会使移栽期后3个测定时期的Fv/Fm、qP、rETR减小,但NPQ升高,说明UV-B辐射的增强,抑制了营养生长期叶片的光化猝灭速度,却促进了非光化猝灭速度,同时光电子传递速率也随之越低。
| [1] |
Caldwell M M, Ballare C L, Bornman J F, et al. Terrestrial ecosystems, increased solar ultraviolet radiation and interactions with other climatic change factors[J]. Photochemical & Photobiological Sciences, 2003, 2(1): 29-38. |
| [2] |
娄运生, 张震, 武君. UV-B增强对作物生产影响的研究回顾与展望[J]. 农业环境科学学报, 2020, 39(4): 812-821. LOU Yun-sheng, ZHANG Zhen, WU Jun. Crop growth, yield and quality as affected by ultraviolet-B(UV-B)radiation elevating[J]. Journal of Agro-Environment Science, 2020, 39(4): 812-821. |
| [3] |
Zhang W, Jiang W. UV treatment improved the quality of postharvest fruits and vegetables by inducing resistance[J]. Trends in Food Science & Technology, 2019, 92: 71-80. |
| [4] |
McKenzie R L, Aucamp P J, Bais A F, et al. Ozone depletion and climate change:Impacts on UV radiation[J]. Photochemical & Photobiological Sciences, 2011, 10(2): 182-198. |
| [5] |
Yang Y, Liang T, Zhang L B, et al. UVR8 interacts with WRKY36 to regulate HY5 transcription and hypocotyl elongation in Arabidopsis[J]. Nature Plants, 2018, 4(2): 98-107. DOI:10.1038/s41477-017-0099-0 |
| [6] |
Kataria S, Jajoo A, Guruprasad K N. Impact of increasing Ultraviolet-B (UV-B) radiation on photosynthetic processes[J]. Journal of Photochemistry and Photobiology B:Biology, 2014, 137: 55-66. DOI:10.1016/j.jphotobiol.2014.02.004 |
| [7] |
Dehariya P, Kataria S, Guruprasad K N, et al. Saponin synthesis and cotton growth is antagonistically regulated by solar UV-B radiation[J]. Journal of Cotton Research, 2018, 1: 14. DOI:10.1186/s42397-018-0014-x |
| [8] |
Baker N R. ChlorophyⅡ fluorescence:A probe of photosynthesis in vivo[J]. Annual Review of Plant Biology, 2008, 59(1): 89-113. DOI:10.1146/annurev.arplant.59.032607.092759 |
| [9] |
贺俐, 罗辉, 贺晓鹏, 等. 基于光合电子流的超级早稻光合特性研究[J]. 核农学报, 2020, 34(2): 418-424. HE Li, LUO Hui, HE Xiao-peng, et al. Photosynthetic characteristics of different super early rice based on mechanistic model of light-response of photosynthetic electron flow[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(2): 418-424. |
| [10] |
Sperdouli I, Moustakas M. Differential blockage of photosynthetic electron flow in young and mature leaves of Arabidopsis thaliana by exogenous proline[J]. Photosynthetica, 2015, 53(3): 471-477. DOI:10.1007/s11099-015-0116-3 |
| [11] |
潘雪, 茅云翔, 王俊皓, 等. UV-B紫外辐射对条斑紫菜生理生化的影响[J]. 渔业科学进展, 2020, 41(3): 125-132. PAN Xue, MAO Yun-xiang, WANG Jun-hao, et al. Effects of UV-B ultraviolet radiation on the physiology and biochemistry of Pyropia yezoensis[J]. Progress in Fishery Sciences, 2020, 41(3): 125-132. |
| [12] |
Farquhar G D, Busch F A. Changes in the chloroplastic CO2 concentration explain much of the observed Kok effect:A model[J]. New Phytologist, 2017, 214: 570-584. DOI:10.1111/nph.14512 |
| [13] |
Silva-Pérez V, Furbank R T, Condon A G, et al. Biochemical model of C3 photosynthesis applied to wheat at different temperatures[J]. Plant, Cell & Environment, 2017, 40(8): 1552-1564. |
| [14] |
Dubois J J B, Fiscus E L, Booker F L. Optimizing the statistical estimation of the parameters of the Farquharvon Caemmerer-Berry model of photosynthesis[J]. New Phytologist, 2007, 176(2): 402-414. DOI:10.1111/j.1469-8137.2007.02182.x |
| [15] |
唐星林, 曹永慧, 顾连宏, 等. 基于FvCB模型的叶片光合生理对环境因子的响应研究进展[J]. 生态学报, 2017, 37(19): 6633-6645. TANG Xing-lin, CAO Yong-hui, GU Lian-hong, et al. Advances in photo-physiological responses of leaves to environmental factors based on the FvCB model[J]. Acta Ecologica Sinica, 2017, 37(19): 6633-6645. |
| [16] |
唐星林, 周本智, 周燕, 等. 基于FvCB模型的几种草本和木本植物光合生理生化特性[J]. 应用生态学报, 2017, 28(5): 1482-1488. TANG Xing-lin, ZHOU Ben-zhi, ZHOU Yan, et al. Photophysiological and photobiochemical characteristics of several herbaceous and woody species based on FvCB model[J]. Chinese Journal of Applied Ecology, 2017, 28(5): 1482-1488. |
| [17] |
叶子飘, 段世华, 安婷, 等. 最大电子传递速率的确定及其对电子流分配的影响[J]. 植物生态学报, 2018, 42(4): 498-507. YE Zi-piao, DUAN Shi-hua, AN Ting, et al. Determination of maximum electron transport rate and its impact on allocation of electron flow[J]. Chinese Journal of Plant Ecology, 2018, 42(4): 498-507. |
| [18] |
李鹏民.快速叶绿素荧光诱导动力学在植物逆境生理研究中的应用[D].泰安: 山东农业大学, 2006. LI Peng -min. Application of chlorophyll a fluorescence transient in study of plant physiology under stress conditions[D]. Tai'an: Shandong Agricultural University, 2006. |
| [19] |
叶子飘, 杨小龙, 冯关萍. 植物电子传递速率对光响应模型的比较研究[J]. 扬州大学学报(农业与生命科学版), 2018, 39(1): 97-104. YE Zi-piao, YANG Xiao-long, FENG Guan-ping. Comparative study on light-response models of electron transport rates on plants[J]. Journal of Yangzhou University(Agricultural and Life Science Edition), 2018, 39(1): 97-104. |
| [20] |
王伟, 王岩, 梁变变, 等. 初花期喷镧对UV-B辐射增强下紫花苜蓿光合及荧光特性的影响[J]. 中国农业气象, 2017, 38(4): 230-239. WANG Wei, WANG Yan, LIANG Bian-bian, et al. Effects of spraying lanthanum in farly flowering stage on photosynthetic characters and chlorophy Ⅱ fluorescence parameters of Medicago sativa under enhanced UV-B radiation[J]. Chinese Journal of Agrometeorology, 2017, 38(4): 230-239. |
| [21] |
王锦旗, 郑有飞, 薛艳. UV-B辐射对菹草成株叶绿素荧光参数的影响[J]. 生态学杂志, 2015, 34(7): 1898-1904. WANG Jin-qi, ZHENG You-fei, XUE Yan. Effects of ultraviolet-B radiation on chlorophyll fluorescence of Potamogeton crispus[J]. Chinese Journal of Eoology, 2015, 34(7): 1898-1904. |
| [22] |
Belshe E F, Durako M J, Blum J E. Photosynthetic rapid light curves (RLC)of Thalassia testudinum exhibit diurnal variation[J]. Journal of Experimental Marine Biology and Ecology, 2007, 342(2): 253-268. DOI:10.1016/j.jembe.2006.10.056 |
| [23] |
韩雯, 韩榕. 不同时间的UV-B辐射对拟南芥幼苗生长的影响[J]. 植物学报, 2015, 50(1): 40-46. HAN Wen, HAN Rong. Effect of different times of UV-B radiation on seedling growth of Arabidopsis thaliana[J]. Chinese Bulletin of Botany, 2015, 50(1): 40-46. |
| [24] |
方荧, 刘风珍, 张昆, 等. UV-B辐射增强影响作物生长发育的研究进展[J]. 山东农业科学, 2018, 50(6): 183-188. FANG Ying, LIU Feng-zhen, ZHANG Kun, et al. Research advances in effect of enhanced UV-B radiation on growth and development of crops[J]. Shandong Agricultural Sciences, 2018, 50(6): 183-188. |
| [25] |
乔媛, 殷红, 李虎, 等. 增强UV-B辐射对水稻叶绿素荧光特性的影响[J]. 华北农学报, 2014, 29(2): 146-151. QIAO Yuan, YIN Hong, LI Hu, et al. Influence of enhanced UV-B radiation on chlorophyll fluorescence characteristics of rice[J]. Acta Agriculturae Boreali-Sinica, 2014, 29(2): 146-151. |
| [26] |
殷红, 郭巍, 毛晓艳, 等. 紫外线-B增强对水稻产量及品质的影响[J]. 沈阳农业大学大学学报, 2009, 40(5): 590-593. YIN Hong, GUO Wei, MAO Xiao-yan, et al. Effect of enhanced UV-B radiation on yield and quality of rice[J]. Journal of Shenyang Agricultural University, 2009, 40(5): 590-593. |
| [27] |
苏本卿.水稻和稗草对UV-B辐射增强的生理生态响应差异[D].沈阳: 沈阳农业大学, 2018. SU Ben-qing. Physiological and ecological responses to enhanced UV-B radiation in rice and barnyard grass[D]. Shenyang: Shenyang Agricultural University, 2018. |
| [28] |
叶子飘, 胡文海, 肖宜安, 等. 光合电子流对光响应的机理模型及其应用[J]. 植物生态学报, 2014, 38(11): 1241-1249. YE Zi-piao, HU Wen-hai, XIAO Yi-an, et al. A mechanistic model of light-response of photosynthetic electron flow and its application[J]. Chinese Journal of Plant Ecology, 2014, 38(11): 1241-1249. |
| [29] |
Betti M, Bauwe H, Busch F A, et al. Manipulating photorespiration to increase plant productivity:Recent advances and perspectives for crop improvement[J]. Journal of Experiental Botany, 2016, 67(10): 2977-2988. DOI:10.1093/jxb/erw076 |
| [30] |
叶子飘, 段世华, 安婷, 等. 小麦光呼吸途径电子流分配的模型研究[J]. 麦类作物学报, 2019, 39(4): 446-454. YE Zi-piao, DUAN Shi-hua, AN Ting, et al. Investigating photosynthetic electron flow allocation to photorespiration pathway in wheat[J]. Journal of Triticeae Crops, 2019, 39(4): 446-454. |
| [31] |
Hagemann M, Bauwe H. Photorespiration and the potential to improve photosynthesis[J]. Current Opinion in Chemical Biology, 2016, 35(9): 109-116. |
| [32] |
杜清洁, 代侃韧, 李建明, 等. 亚低温与干旱胁迫对番茄叶片光合及荧光动力学特性的影响[J]. 应用生态学报, 2015, 26(6): 1687-1694. DU Qing-jie, DAI Kan-ren, LI Jian-ming, et al. Effects of sub-low temperature and drought stress on characteristics of photosynthetic and fluorescence kinetics in tomato leaves[J]. Chinese Journal of Applied Ecology, 2015, 26(6): 1687-1694. |
| [33] |
叶子飘, 段世华, 安婷, 等. C4作物电子传递速率对CO2响应模型的构建及应用[J]. 植物生态学报, 2018, 42(10): 1000-1008. YE Zi-piao, DUAN Shi-hua, AN Ting, et al. Construction of CO2-response model of electron transport rate in C4 crop and its application[J]. Chinese Journal of Plant Ecology, 2018, 42(10): 1000-1008. |
| [34] |
薛娴, 许会敏, 吴鸿洋, 等. 植物光合作用循环电子传递的研究进展[J]. 植物生理学报, 2017, 53(2): 145-158. XUE Xian, XU Hui-min, WU Hong-yang, et al. Research progress of cyclic electron transport in plant photosynthesis[J]. Plant Physiology Journal, 2017, 53(2): 145-158. |
| [35] |
余小龙, 余树全, 伊力塔, 等. UV-B辐射胁迫对细叶青冈幼苗叶绿素荧光特性的影晌[J]. 东北农业大学学报, 2011, 42(10): 114-119. YU Xiao-long, YU Shu-quan, YI Li-ta, et al. UV-B radiative forcing on chlorophyll fluorescence characteristics of Cyclobalanopsis gracilis seedlings[J]. Journal of Northeasl Agricuhural Universily, 2011, 42(10): 114-119. |
| [36] |
李晓科, 武玉珍, 张义贤. UV-B对大麦幼苗叶片部分生理和光合特性的影响[J]. 山西农业科学, 2018, 46(12): 2001-2004. LI Xiao -ke, WU Yu -zhen, ZHANG Yi-xian. Effects of UV-B on physiological and photosynthetic characteristics of Hordeum vulgare seedling leaves[J]. Journal of Shanxi Agricultural Sciences, 2018, 46(12): 2001-2004. |
| [37] |
张玉红, 陈路瑶, 刘彤, 等. 增补UV-B辐射对药用植物黄檗幼苗生长及光合生理影响[J]. 中国农学通报, 2018, 34(4): 76-82. ZHANG Yu-hong, CHEN Lu-yao, LIU Tong, et al. The growth and photosynthetic physiological responses of Phellodendron amurense seedlings under supplementary UV -B Radiation[J]. Chinese Agricultural Science Bulletin, 2018, 34(4): 76-82. |
| [38] |
李雪莹, 殷红, 战莘晔, 等. 添加UV-B辐射对灌浆期水稻剑叶光合特性及抗氧化能力的影响[J]. 沈阳农业大学学报, 2017, 48(3): 271-276. LI Xue-ying, YIN Hong, ZHAN Shen-ye, et al. Effects of enhanced UV-B radiation on photosynthetic characteristics and anti-oxidation of rice flag leaves in filling stage[J]. Journal of Shenyang Agricultural University, 2017, 48(3): 271-276. |
| [39] |
祁虹, 段留生, 王树林, 等. 全生育期UV-B辐射增强对棉花生长及光合作用的影响[J]. 中国生态农业学报, 2017, 25(5): 708-719. QI Hong, DUAN Liu-sheng, WANG Shu-lin, et al. Effect of enhanced UV-B radiation on cotton growth and photosynthesis[J]. Chinese Journal of Eco-Agriculture, 2017, 25(5): 708-719. |
 2020, Vol. 39
2020, Vol. 39



