2. 中国科学院土壤环境与污染修复重点实验室, 中国科学院南京土壤研究所, 南京 210008
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
随着现代农业的发展,邻苯二甲酸酯(Phthalic Acid Esters,PAEs)在现代农业生产活动中被广泛应用。农用地膜、肥料的使用以及自然沉降等诸多因素导致了大量邻苯二甲酸酯类化合物进入土壤[1-3]。研究表明,我国土壤中PAEs的浓度可以达到0.89~46 mg·kg-1 [4]。北京、西藏、辽宁、福建以及吉林等几个省份地膜非回收地区检出的最高PAEs污染浓度可达4.0mg·kg-1 [5]。南京郊区大棚土壤的总PAEs污染最高可达245 mg·kg-1土(干质量)[6]。PAEs在进入农田土壤后,可以被作物吸收累积并通过食物链进行传递,最终危害人体健康[6]。因此,对PAEs污染进行控制和修复尤为重要。
目前针对PAEs污染的修复方法主要有物理、化学与生物降解等3类。物理方法主要是利用PAEs的疏水性,采用吸附性较强的吸附剂通过物理吸附去除环境中的PAEs。如Gao等[7]研究比较了多种碳基吸附剂(活性炭、生物炭等)对PAEs的吸附,发现活性炭是一种优秀的PAEs吸附剂。但是物理吸附只能实现污染物在介质中的转移,不能彻底消除其污染,且吸附剂必须进行定期更换和再生,处理成本较高[8]。微生物降解是自然环境条件下PAEs衰减的主要路径,前人在不同环境中寻找并分离PAEs高效降解菌方面也开展了大量研究[9-10],但是微生物降解PAEs易受环境条件(温度、pH等)的影响,实际应用的修复效果不佳、周期较长。近些年,化学方法也常被用于PAEs污染的修复,如光催化氧化[11-12]、臭氧氧化[13-14]等诸多化学方法都能实现PAEs的高效降解,但以上过程操作复杂,限制了其在修复过程中的大规模应用。因此,发展一类高效、易于应用的PAEs污染修复方法尤为必要。
近年来,化学氧化技术被大量应用于有机污染修复领域,该技术因反应条件温和、快速高效而备受关注。化学氧化技术是利用氧化剂的分解产生具有强氧化能力的自由基,使有机污染物变为小分子和CO2的技术。基于过氧化氢(H2O2)的化学氧化技术被广泛应用到有机污染的修复中[15-16],传统的Fe2+/H2O2技术虽然具有反应条件温和、反应速度快等优点[17],但是该体系适用pH范围窄,并且Fe2+的使用会导致大量沉淀物的产生,这就需要花费更多的成本来完成后续处理[18]。为了克服以上缺点,基于非均相活化剂活化H2O2的类Fenton被提出并应用,非均相催化剂可以有效解决pH作用范围窄、催化剂难回收等问题[19-21],常见的如零价铁[22-24]、赤铁矿[25-27]、黏土[28-29]、黄铁矿[30-31]等都先后被用来活化H2O2去除有机污染物。
目前,非均相催化剂主要存在合成步骤复杂、获得成本高等缺点。因此,发展一类易获得且成本低的H2O2催化剂尤为必要。从自然界中存在的大量过渡金属矿物中筛选出一种乃至多种H2O2催化剂也是一种可行的方式,如过渡金属硫化矿物黄铁矿被报道可以活化H2O2[30-31]。铜基催化剂如CuO、Cu2+等也曾报道用来活化H2O2以去除污染物,常见的含铜矿物如靛铜矿的主要成分为CuS[32]。但是对于CuS活化H2O2去除有机污染物的研究鲜有报道。本研究主要采用商业购买的CuS粉末,利用一定浓度的硝酸对CuS粉末进行处理,考察了处理前后CuS的基本性质及其活化CuS去除邻苯二甲酸二乙酯(Diethyl phthalate,以下简称DEP)的能力,从而发展了一种便宜易得的H2O2催化剂。
1 材料与方法 1.1 实验材料硫化铜(CuS,>98%)购自Macklin生化技术有限公司(中国上海)。邻苯二甲酸二乙酯(DEP,>99.9%)和5,5-二甲基-1-吡咯啉-N-氧化物(DMPO,97%)购自美国Sigma-Aldrich公司。氢氧化钠(NaOH,97%)、硫酸(H2SO4,98%)、乙醇(EtOH,99%)购自国药集团化学试剂有限公司。过氧化氢(H2O2,30%)和四硼酸钠(Na2B4O7,99.5%)购自南京化学试剂有限公司。HPLC级甲醇购自百灵威科技有限公司。实验所有溶液均由超纯水配制。
1.2 材料处理及表征方法CuS粉末的处理步骤:首先使用200目筛筛选出颗粒较小、粗细均匀的CuS固体颗粒;再取3 g过筛的CuS粉末加入到15 mL浓度为0.1 mol·L-1的硝酸溶液中,并进行超声处理;离心收集CuS粉末,并多次使用超纯水进行洗涤直至洗涤后的溶液不再呈蓝色;将洗涤过后的CuS粉末进行冷冻干燥,而后放入厌氧手套箱中保存(N2/H2=9/1)。酸洗前的CuS编号为F-CuS(Fresh CuS),酸洗后的编号为N - CuS(Nitric acid wash CuS)。
利用日本理学Ultima Ⅳ全自动X射线粉末衍射仪(XRD)对CuS粉末的晶体结构进行分析,分析条件为40 kV和20 mA的Cu-Kα辐射源。利用X射线光电子能谱(XPS)分析反应前后CuS表面Cu和S的化学价态,荷电校正标准为C1s峰,在284.8 eV。
1.3 实验及检测方法反应体系为100 mL锥形瓶,将其放置于磁力搅拌器上进行不间断搅拌反应。
反应温度为室温(25±2)℃,分别向锥形瓶中加入一定量的CuS颗粒、一定浓度的H2O2和初始浓度为20 mg·L-1的DEP。使用2.0 mmol·L-1硼酸盐缓冲溶液维持反应体系pH为6.0。在不同的反应时间点,吸取一定体积的液体,并加入体积分数为10%的甲醇终止反应,然后使用0.22 μm PTFE滤膜进行过滤,再利用高效液相色谱仪对DEP的残留浓度进行分析。
DEP浓度通过高效液相色谱仪(HPLC,Agilent 1260)进行测定,色谱柱为C18色谱柱(25 cm × 4.6 mm,5 μmol·L-1),配备自动进样器,检测器为光电二极管阵列检测器。色谱流动相由35%的超纯水和65%的甲醇组成,流速为1.0 mL·min-1,检测波长设置为224 nm。
利用电子顺磁共振波谱仪(EPR,EMX-10/12)分析体系中产生的自由基,以浓度为0.1 mol ·L-1的DMPO为自由基捕获剂。检测波段为X-波段,微波功率为6.33 mW,谐振频率为9.42 GHz,调制幅度为1.0 G,调制频率为100 kHz。
铜离子浓度利用原子吸收光谱(Z-2000,Hitachi,Japan)测定。
2 结果与讨论 2.1 酸洗前后的CuS表征酸洗前后CuS的XRD表征结果如图 1所示。未经过硝酸处理的CuS表面含有大量的CuSO4,这可能是由于CuS与空气中的氧气、水蒸气长期接触反应的结果。而酸洗后CuS表面的CuSO4被硝酸溶液去除,经过硝酸处理后的CuS纯度更高、晶型更好。
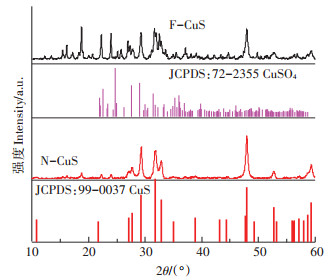
|
图 1 处理前后CuS的XRD表征 Figure 1 XRD patterns of CuS before and after HNO3 washing |
图 2是酸洗前后CuS粉末的XPS表征结果。可以看出,酸洗前CuS表面S的形态主要有S2-、Sn2-、S0和S(Ⅳ),其比例分别为24.7%、25.9%、15.3%和34.1%,结合XRD的结果,说明酸洗前的CuS表面存在大量的CuSO4,Cu(Ⅰ)和Cu(Ⅱ)的比例分别为63.1%和36.9%。在经过硝酸洗涤后,S(Ⅵ)峰消失,S2-、Sn2-和S0的比例分别为40.2%、36.9%和22.9%,Cu(Ⅰ)比例为74.8%、Cu(Ⅱ)的比例为25.2%,说明表面的可溶性CuSO4消失。研究发现经过硝酸洗涤后的CuS表面Cu(Ⅰ)比例上升,Cu(Ⅱ)比例下降,这应是表面CuSO4被纯化的结果。

|
图 2 酸洗前后CuS粉末的XPS表征结果 Figure 2 XPS spectra of CuS before and after HNO3 washing |
在反应温度为室温,催化剂剂量为1.0 g·L-1,H2O2浓度为4.0 mmol·L-1,反应pH为6.0,初始DEP浓度为20 mg·L-1的条件下,酸洗前后CuS活化H2O2去除DEP的能力结果如图 3所示。在经过4 h的反应后,F-CuS活化4.0 mmol·L-1 H2O2对20 mg·L-1DEP的去除率为70%,而N-CuS对同样浓度的DEP的去除率为28%。利用电子顺磁共振技术,采用DMPO作为自由基捕获剂,测得不同处理CuS活化H2O2体系产生的自由基信号如图 4所示。EPR检测到了4条间距相等的峰,且峰高比为1:2:2:1,该结构的超精细分裂常数为aN=aH=14.89 G,这是DMPO-OH的特征信号,表明该体系有·OH产生[33]。F-CuS活化H2O2产生的·OH信号远强于N-CuS活化H2O2产生的·OH信号。
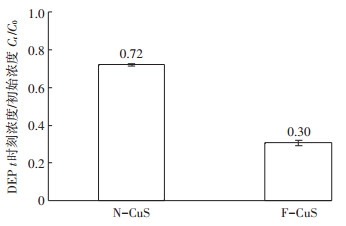
|
图 3 酸洗前后的CuS活化H2O2对DEP的降解 Figure 3 Degradation of DEP by H2O2 activated by CuS before and after HNO3 washing |

|
图 4 酸洗前后的CuS活化H2O2的自由基信号 Figure 4 EPR spectra of different reaction systems |
以上两个事实均说明了F-CuS活化H2O2的能力明显强于N-CuS。原因可能是由于F-CuS表面存在大量的CuSO4,当利用F-CuS活化H2O2时,CuS表面的CuSO4会溶解于溶液中并向溶液中释放大量的Cu2+。Cu2+也可以活化H2O2以降解有机污染物[34-35],CuS在反应过程中溶出的Cu2+同样会催化H2O2分解。本研究测量了两种体系过程中Cu2+的溶出,发现F-CuS在活化过程中释放了高达401.2 mg·L-1的Cu2+,而N-CuS在活化过程中Cu2+的溶出浓度仅为8.2 mg·L-1。F-CuS/H2O2体系中有更多的Cu2+溶出是该体系产生自由基效率高于N-CuS/H2O2体系的原因。除此之外,Xing等[36]报道了利用过渡金属硫化物增强Fenton反应中自由基的产生效率,该过程主要是由于过渡金属硫化物表面的不饱和S促进了Fe3+到Fe2+的还原,从而提高了Fenton体系自由基的产生效率。在CuS活化H2O2体系中,CuS表面的不饱和S应当也会促进Cu2+还原到Cu+,从而提高了溶液中Cu+催化分解H2O2产生自由基的能力。
综上,F-CuS催化H2O2的能力优于N-CuS是由于F-CuS在催化过程中有更多的Cu2+释放,以及高浓度Cu2+与CuS协同催化H2O2分解。由于未经酸洗的CuS在反应过程中释放的Cu2+远高于N-CuS,接下来将选用N-CuS作为催化剂。
2.3 不同浓度H2O2对DEP降解的影响在室温下,以N-CuS为活化剂并控制剂量为1 g·L-1,DEP初始浓度为20 mg·L-1,反应pH为6时,不同浓度H2O2对DEP降解的影响如图 5所示。H2O2浓度为0 mmol·L-1,即单独加入N-CuS时,DEP浓度在4 h内基本没有变化,这说明单独的CuS对DEP的吸附较少。H2O2浓度为2 mmol·L-1时,DEP在经过4 h反应后的去除率为9%。考虑到H2O2浓度为4 mmol·L-1时DEP在4 h内的去除率为28%,实验直接将H2O2浓度提高到20 mmol·L-1,发现在这一条件下DEP的4 h去除率为71%。继续提高H2O2浓度,DEP在4 h内的去除率不断上升。当H2O2浓度分别为40、60、80 mmol·L-1时,20 mg·L-1的DEP在4 h内的去除率分别达到了80%、83%、95%。随着H2O2浓度的提高,CuS/H2O2体系去除DEP的能力不断增强,最后基本能够实现DEP的完全去除。
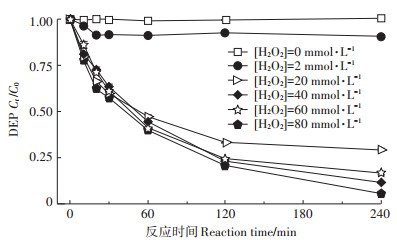
|
图 5 不同浓度H2O2对DEP降解的影响 Figure 5 Effects of H2O2 concentration on DEP degradation in the CuS/H2O2 system |
对CuS活化不同浓度H2O2降解DEP的动力学结果进行一级动力学拟合,结果如图 6所示。随着H2O2浓度从2 mmol·L-1提高到40 mmol·L-1时,拟合得到的一级动力学常数Kobs(表观反应动力学常数)从0.001 min-1提高到了0.012 min-1,原因是随着H2O2浓度的提高,CuS/H2O2体系产生自由基的速率越来越快,从而导致了DEP的降解速率越来越快。当H2O2浓度从40 mmol·L-1提高到80 mmol·L-1时,反应速率常数基本没有变化,原因是由于CuS的剂量一定,其表面的反应位点也是一定的,在H2O2浓度提高到一定水平后,H2O2在CuS表面产生自由基的速率就不会再变化,从而导致了DEP的降解速率基本不变。
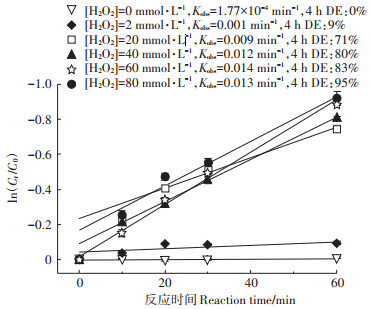
|
4 h DE: 4 h内降解率 Degradation efficiency within 4 h 图 6 与图 5相对应的动力学拟合 Figure 6 Pseudo-first-order fitting for the kinetics of DEP degradation |
本课题组之前对·OH降解DEP做了大量的研究[37-38],报道了·OH进攻DEP的3种方式,即单电子转移、氢原子转移和形成自由基加合物[37]。在之前的研究中,通过理论计算和实际实验相结合的方式,排除了单电子转移这一机制存在的可能性,而证实了氢原子提取和·OH加成这两种机制的存在。在CuS/H2O2降解DEP的过程中,·OH是导致DEP降解的主要原因,结合之前的研究结果,我们推断在这一过程中DEP的可能降解路径如图 7所示。DEP的降解主要有两种机制,结合以前的理论实验和实际实验结果,认为在本实验中可能存在3条路径和5种产物。第一,通过·OH提取DEP 9号C与10号C上的H原子,而后进行·OH加成,生成产物1。·OH可以继续加成在产物1苯环的位置上,由于·OH加成位置有1、2、3、6号4个位置,所以有产物2和产物3两种产物生成。第二,·OH直接加成在苯环上,生成产物2和产物3两种产物。第三,·OH提取7号C和8号C上的H原子,继而·OH再进行加成,而后脱去一分子的C2H5OH,生成产物4,产物4再进行转化生成产物5(邻苯二甲酸),邻苯二甲酸再开环氧化生成CO2与H2O。
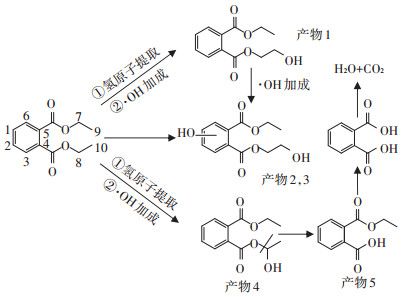
|
图 7 DEP的可能降解路径 Figure 7 Proposed pathways of DEP degradation |
综合以上实验事实并通过相关报道,我们可推断出CuS活化H2O2的机制。在CuS活化H2O2的过程中,应当是CuS表面的Cu(Ⅰ)分解H2O2产生·OH与Cu(Ⅱ),活化过程中产生的·OH会进攻并降解DEP,而Cu(Ⅱ)则会被H2O2和CuS表面不饱和的S还原。其基本的反应机制如方程(1)~方程(4)所示,可能的反应机制图如图 8所示。
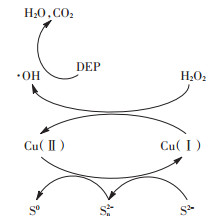
|
图 8 CuS活化H2O2的可能机制 Figure 8 Proposed mechanisms for activation by CuS |
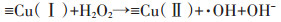
|
(1) |

|
(2) |
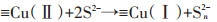
|
(3) |
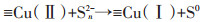
|
(4) |
实际土壤中存在的矿物与有机质(Soil organic matter,SOM),可能会对CuS/H2O2体系应用于土壤污染修复产生一定的影响。有研究表明,由于·OH无选择性,土壤中的SOM可能会与DEP竞争自由基,影响污染物的降解效果[39-40]。但也有研究表明,SOM中含有的醌基、类醌基、羟基等官能团一方面可以作为电子穿梭体加速过渡金属的还原从而提高自由基的产生效率[41],另一方面,这些官能团同样可以为过渡金属在催化剂表面的吸附提供配位点,提高过渡金属离子的催化效率。因此,不同种类污染物、不同SOM含量和类型,对CuS/H2O2体系降解污染的影响具有较大差异,笔者下一步将开展深入的研究工作。
土壤中同样存在着大量的过渡金属矿物,如铁锰等过渡金属氧化物,早有报道表明这类氧化物对H2O2有一定的催化分解作用[37, 42-43]。因此,在高矿物含量的土壤中,其对H2O2的分解和自由基的形成有一定的贡献,可以与CuS协同催化分解H2O2,从而提高污染物的降解效率[44]。
不同土壤理化性质差别很大,土壤pH对化学氧化体系修复效果的影响不可忽视。传统Fenton的pH适宜范围为2~4[45],本实验选取的pH为6。一般酸性土壤条件对H2O2的分解有利,而碱性土壤则不利于CuS分解H2O2。同样,pH会影响·OH的氧化电位,当pH=0时,·OH的氧化电位为2.8 V,当pH=14时,·OH的氧化电位下降到1.95 V[46]。高pH实则不利于CuS/H2O2体系的应用。因此,在实际的修复应用中,关于土壤性质影响化学氧化体系修复效率的机制需要开展进一步的研究工作。
3 结论采用经过硝酸处理的CuS可以有效活化H2O2去除DEP。CuS可以在pH接近中性的条件下很好地活化H2O2去除有机污染物,拓宽了类芬顿体系的pH作用范围。CuS成本低廉且容易获得,因此CuS/H2O2这一化学氧化体系具有一定的应用前景。
| [1] |
Hu X Y, Wen B, Shan X Q. Survey of phthalate pollution in arable soils in China[J]. Journal of Environmental Monitoring, 2003, 5(4): 649-653. DOI:10.1039/b304669a |
| [2] |
Vikelsøe J, Thomsen M, Carlsen L. Phthalates and nonylphenols in profiles of differently dressed soils[J]. Science of the Total Environment, 2002, 296(1/2/3): 105-116. |
| [3] |
Net S, Sempere R, Delmont A, et al. Occurrence, fate, behavior and ecotoxicological state of phthalates in different environmental matrices[J]. Environmental Science & Technology, 2015, 49(7): 4019-4035. |
| [4] |
Cai Q Y, Mo C H, Wu Q T, et al. The status of soil contamination by semivolatile organic chemicals(SVOCs)in China:A review[J]. Science of the Total Environment, 2008, 389(2/3): 209-224. |
| [5] |
Chen Y, Wu C, Zhang H, et al. Empirical estimation of pollution load and contamination levels of phthalate esters in agricultural soils from plastic film mulching in China[J]. Environmental Earth Sciences, 2012, 70(1): 239-247. |
| [6] |
Ma T T, Wu L H, Chen L, et al. Phthalate esters contamination in soils and vegetables of plastic film greenhouses of suburb Nanjing, China and the potential human health risk[J]. Environmental Science and Pollution Research, 2015, 22(16): 12018-12028. DOI:10.1007/s11356-015-4401-2 |
| [7] |
Gao B, Wang P, Zhou H, et al. Sorption of phthalic acid esters in two kinds of landfill leachates by the carbonaceous sorbents[J]. Bioresource Technology, 2013, 136(14): 295-301. |
| [8] |
Kim W H, Nishijima W, Baes A U, et al. Micropollutant removal with saturated biological activated carbon(BAC)in ozonation-BAC process[J]. Water Science and Technology, 1997, 36(12): 283-298. DOI:10.2166/wst.1997.0458 |
| [9] |
He Z, Li Z, Zhang Q, et al. Simultaneous remediation of As(Ⅲ)and dibutyl phthalate(DBP)in soil by a manganese-oxidizing bacterium and its mechanisms[J]. Chemosphere, 2019, 220: 837-844. DOI:10.1016/j.chemosphere.2018.12.213 |
| [10] |
Jianlong W, Xuan Z, Weizhong W. Biodegradation of phthalic acid esters(PAEs)in soil bioaugmented with acclimated activated sludge[J]. Process Biochemistry, 2004, 39(12): 1837-1841. DOI:10.1016/j.procbio.2003.08.005 |
| [11] |
Wang G, Chen Q, Liu Y, et al. In situ synthesis of graphene/WO3 codecorated TiO2 nanotube array photoelectrodes with enhanced photocatalytic activity and degradation mechanism for dimethyl phthalate[J]. Chemical Engineering Journal, 2018, 337: 322-332. DOI:10.1016/j.cej.2017.12.058 |
| [12] |
Chen G, Hanukovich S, Chebeir M, et al. Nitrate removal via a formate radical-induced photochemical process[J]. Environmental Science & Technology, 2019, 53(1): 316-324. |
| [13] |
Wen G, Ma J, Liu Z Q, et al. Ozonation kinetics for the degradation of phthalate esters in water and the reduction of toxicity in the process of O3/H2O2[J]. Journal of Hazardous Materials, 2011, 195: 371-377. DOI:10.1016/j.jhazmat.2011.08.054 |
| [14] |
Zhao Y, An H, Dong G, et al. Elevated removal of di-n-butyl phthalate by catalytic ozonation over magnetic Mn-doped ferrospinel ZnFe2O4 materials:Efficiency and mechanism[J]. Applied Surface Science, 2020, 505: 144476. DOI:10.1016/j.apsusc.2019.144476 |
| [15] |
王春艳, 李晓亮, 董芬, 等. 化学氧化修复PAHs污染土壤的性质及毒性变化[J]. 北京化工大学学报(自然科学版), 2012, 39(4): 95-100. WANG Chun-yan, LI Xiao-liang, DONG Fen, et al. Changes in polyaromatic hydrocarbons contaminated soil properties and phytotoxicity under chemical oxidation[J]. Journal of Beijing University of Chemical Technology(Natural Science), 2012, 39(4): 95-100. |
| [16] |
张海欧, 郭书海, 李凤梅, 等. 焦化场地PAHs污染土壤的电动-化学氧化联合修复[J]. 农业环境科学学报, 2014, 33(10): 1904-1911. ZHANG Hai-ou, GUO Shu-hai, LI Feng-mei, et al. Remediation of PAHs contaminated soil at coking site by integrated electrokinetics and chemical oxidation[J]. Journal of Agro-Environment Science, 2014, 33(10): 1904-1911. |
| [17] |
刘强, 孙英平, 汪小雄, 等. 对苯二酚强化多相类-Fenton过程降解活性艳红MX-5B的效能与机理[J]. 环境科学学报, 2012, 32(7): 1589-1595. LIU Qiang, SUN Ying-ping, WANG Xiao-xiong, et al. The efficiency and mechanisms of the enhancement of hydroquinone on the degradation of reactive red MX-5B by heterogeneous Fenton-like reaction[J]. Acta Scientiae Circumstantiae, 2012, 32(7): 1589-1595. |
| [18] |
林志荣, 赵玲, 董元华, 等. 针铁矿催化过氧化氢降解PCB28[J]. 环境科学学报, 2011, 31(11): 2403-2408. LIN Zhi -rong, ZHAO Ling, DONG Yuan-hua, et al. Degradation of PCB28 by goethite-catalyzed hydrogen peroxide[J]. Acta Scientiae Circumstantiae, 2011, 31(11): 2403-2408. |
| [19] |
徐萍, 王娜, 文志潘, 等. 新型纳米CeO2催化类Fenton降解盐酸四环素[J]. 环境化学, 2020, 39(3): 601-609. XU Ping, WANG Na, WEN Zhi-pan, et al. Degradation of tetracycline hydrochloride via a heterogeneous Fenton-like catalyzed by nano-CeO2[J]. Environmental Chemistry, 2020, 39(3): 601-609. |
| [20] |
任逸, 施梦琦, 尹越, 等. Fe2O3/MIL-53(Al)催化类芬顿氧化性能及其作用机制研究[J]. 环境科学学报, 2019, 39(8): 2508-2516. REN Yi, SHI Meng-qi, YIN Yue, et al. Study on efficiency and mechanism of Fe2O3/MIL-53(Al)catalytic Fenton-like oxidation[J]. Acta Scientiae Circumstantiae, 2019, 39(8): 2508-2516. |
| [21] |
高聪, 全燮, 陈硕. Cu掺杂MIL-88B-Fe活化双氧水降解有机污染物性能研究[J]. 大连理工大学学报, 2019, 59(1): 1-7. GAO Cong, QUAN Xie, CHEN Shuo. Performance study of Cu doped MIL-88B-Fe in activation of H2O2 for organic pollutants degradation[J]. Journal of Dalian University of Technology, 2019, 59(1): 1-7. |
| [22] |
Remya N, Lin J-G. Microwave-assisted carbofuran degradation in the presence of GAC, ZVI and H2O2:Influence of reaction temperature and pH[J]. Separation and Purification Technology, 2011, 76(3): 244-252. DOI:10.1016/j.seppur.2010.10.012 |
| [23] |
Liu J, Ou C, Han W, et al. Selective removal of nitroaromatic compounds from wastewater in an integrated zero valent iron(ZVI)reduction and ZVI/H2O2 oxidation process[J]. RSC Advances, 2015, 5(71): 57444-57452. DOI:10.1039/C5RA08487C |
| [24] |
Xue G, Wang Q, Qian Y, et al. Simultaneous removal of aniline, antimony and chromium by ZVI coupled with H2O2:Implication for textile wastewater treatment[J]. Journal of Hazardous Materials, 2019, 368: 840-848. DOI:10.1016/j.jhazmat.2019.02.009 |
| [25] |
Zhang Y, Li Z, Sun W, et al. A magnetically recyclable heterogeneous catalyst:Cobalt nano-oxide supported on hydroxyapatite-encapsulated γ-Fe2O3 nanocrystallites for highly efficient olefin oxidation with H2O2[J]. Catalysis Communications, 2008, 10(2): 237-242. DOI:10.1016/j.catcom.2008.08.030 |
| [26] |
Zhang G, Gao Y, Zhang Y, et al. Fe2O3-pillared rectorite as an efficient and stable Fenton-like heterogeneous catalyst for photodegradation of organic contaminants[J]. Environmental Science & Technology, 2010, 44(16): 6384-6389. |
| [27] |
Luca C d, Massa P, Fenoglio R, et al. Improved Fe2O3/Al2O3 as heterogeneous Fenton catalysts for the oxidation of phenol solutions in a continuous reactor[J]. Journal of Chemical Technology & Biotechnology, 2014, 89(8): 1121-1128. |
| [28] |
Luo M, Bowden D, Brimblecombe P. Catalytic property of Fe-Al pillared clay for Fenton oxidation of phenol by H2O2[J]. Applied Catalysis B:Environmental, 2009, 85(3/4): 201-206. |
| [29] |
Zong S, Xu X, Ran G, et al. Comparative study of atrazine degradation by magnetic clay activated persulfate and H2O2[J]. RSC Advances, 2020, 10(19): 11410-11417. DOI:10.1039/D0RA00345J |
| [30] |
Zhao Z, Pan S, Ye Y, et al. FeS2/H2O2 mediated water decontamination from p-arsanilic acid via coupling oxidation, adsorption and coagulation:Performance and mechanism[J]. Chemical Engineering Journal, 2020, 381: 122667. DOI:10.1016/j.cej.2019.122667 |
| [31] |
Diao Z H, Xu X R, Jiang D, et al. Enhanced catalytic degradation of ciprofloxacin with FeS2/SiO2 microspheres as heterogeneous Fenton catalyst:Kinetics, reaction pathways and mechanism[J]. Journal of Hazardous Materials, 2017, 327: 108-115. DOI:10.1016/j.jhazmat.2016.12.045 |
| [32] |
Yin W, Yang B, Fu Y, et al. Effect of calcium hypochlorite on flotation separation of covellite and pyrite[J]. Powder Technology, 2019, 343: 578-585. DOI:10.1016/j.powtec.2018.11.048 |
| [33] |
Qin W, Fang G, Wang Y, et al. Efficient transformation of DDT by peroxymonosulfate activated with cobalt in aqueous systems:Kinetics, products, and reactive species identification[J]. Chemosphere, 2016, 148: 68-76. DOI:10.1016/j.chemosphere.2016.01.020 |
| [34] |
Inchaurrondo N, Contreras E, Haure P. Catalyst reutilization in phenol homogeneous cupro-Fenton oxidation[J]. Chemical Engineering Journal, 2014, 251: 146-157. DOI:10.1016/j.cej.2014.04.019 |
| [35] |
Caudo S, Centi G, Genovese C, et al. Homogeneous versus heterogeneous catalytic reactions to eliminate organics from waste water using H2O2[J]. Topics in Catalysis, 2006, 40(1/2/3/4): 207-219. |
| [36] |
Xing M, Xu W, Dong C, et al. Metal sulfides as excellent Co-catalysts for H2O2 decomposition in advanced oxidation processes[J]. Chem, 2018, 4(6): 1359-1372. DOI:10.1016/j.chempr.2018.03.002 |
| [37] |
Fang G, Deng Y, Huang M, et al. A mechanistic understanding of hydrogen peroxide decomposition by vanadium minerals for diethyl phthalate degradation[J]. Environmental Science & Technology, 2018, 52(4): 2178-2185. |
| [38] |
Chen N, Fang G, Liu G, et al. The effects of Fe-bearing smectite clays on·OH formation and diethyl phthalate degradation with polyphenols and H2O2[J]. Journal of Hazardous Materials, 2018, 357: 483-490. DOI:10.1016/j.jhazmat.2018.06.030 |
| [39] |
Xie P, Ma J, Liu W, et al. Removal of 2-MIB and geosmin using UV/persulfate:Contributions of hydroxyl and sulfate radicals[J]. Water Research, 2015, 69: 223-233. DOI:10.1016/j.watres.2014.11.029 |
| [40] |
Basfar A A, Mohamed K A, Al-Abduly A J, et al. Radiolytic degradation of atrazine aqueous solution containing humic substances[J]. Ecotoxicology and Environmental Safety, 2009, 72(3): 948-953. DOI:10.1016/j.ecoenv.2008.05.006 |
| [41] |
Colon D, Weber E J, Anderson J L. Effect of natural organic matter on the reduction of nitroaromatics by Fe(Ⅱ)species[J]. Environmental Science & Technology, 2008, 42(17): 6538-6543. |
| [42] |
Yeh C K, Hsu C Y, Chiu C H, et al. Reaction efficiencies and rate constants for the goethite-catalyzed Fenton-like reaction of NAPLform aromatic hydrocarbons and chloroethylenes[J]. Journal of Hazardous Materials, 2008, 151(2/3): 562-569. |
| [43] |
Kim E J, Oh D, Lee C S, et al. Manganese oxide nanorods as a robust Fenton-like catalyst at neutral pH:Crystal phase-dependent behavior[J]. Catalysis Today, 2017, 282: 71-76. DOI:10.1016/j.cattod.2016.03.034 |
| [44] |
Pardo F, Peluffo M, Santos A, et al. Optimization of the application of the Fenton chemistry for the remediation of a contaminated soil with polycyclic aromatic hydrocarbons[J]. Journal of Chemical Technology & Biotechnology, 2016, 91(6): 1763-1772. |
| [45] |
Duan H, Liu Y, Yin X, et al. Degradation of nitrobenzene by Fentonlike reaction in a H2O2/schwertmannite system[J]. Chemical Engineering Journal, 2016, 283: 873-879. DOI:10.1016/j.cej.2015.08.033 |
| [46] |
Venny, Gan S, Ng H K. Current status and prospects of Fenton oxidation for the decontamination of persistent organic pollutants(POPs)in soils[J]. Chemical Engineering Journal, 2012, 213: 295-317. DOI:10.1016/j.cej.2012.10.005 |
 2020, Vol. 39
2020, Vol. 39


