2. 西北农林科技大学资源环境学院, 陕西 杨凌 712100
2. College of Natural Resources and Environment, Northwest A & F University, Yangling 712100, China
地膜覆盖具有增温保墒、减少养分流失、促进作物根系发育、提高产量的作用[1],但非降解地膜使用中产生的残膜会破坏土壤结构[2],降低土壤水分和养分活性,阻碍作物生长[3],并且存在“微塑料”污染问题。而降解膜能在作物生长后期自行降解为CO2和H2O[4-5],可有效减少残膜对作物根系生长和土壤环境的不良影响。因此,相比非降解膜,降解膜既可减少土壤污染,又可更大程度地减少对作物生长的干扰,对农田持续利用具有优势。同时,研究认为,相比白色地膜光热效应高但会促进杂草生长而消耗地力的缺点[6],黑色地膜具有防止膜下温度过高而损害作物根系发育、抑制杂草生长、防止作物因缺少水肥而早衰的优势[7]。因此,降解膜和黑色地膜具有更好的应用前景,但降解膜和黑色地膜在我国使用面积仍然较小,所以需要研究其水肥效应以便于推广。
土壤微生物和酶活性对环境变化十分敏感[8],可作为评价土壤肥力和土壤质量的重要生物学指标。地膜覆盖可通过改变农田水热条件而改变土壤微生物量、群落结构及酶活性,对土壤质量和农田生态系统产生影响[9]。研究认为,地膜覆盖可以提高细菌丰富度[10]和真菌活性[11]。另外,一些研究表明降解膜覆盖可提高微生物量和酶活性[12],并引起土壤微生物群落结构变化[13],如降解膜覆盖显著影响了小麦根际微生物群落,提高了细菌属(变形杆菌和贪噬菌)相对丰度[14]。但若非直接进行降解膜与非降解膜或白色膜与黑色膜的比较研究,难以明确不同地膜对土壤微生物及其活性影响的差异,也难以探究这种差异是否来自不同地膜对土壤水热和养分状况调控能力的不同。黄土高原是典型的干旱半干旱地区,也是我国最重要的旱作地区之一,地膜覆盖措施在该区广泛应用。该区水热不足且降水季节差异大,加之土壤肥力低下,特殊的气候条件和水肥条件使微生物与酶活性对地膜覆盖的响应可能与其他地区不同。然而该区降解/非降解膜覆盖对微生物活性及群落结构影响的对比研究较少,尤其是白/黑色地膜覆盖方面的研究更少。因此,有必要在黄土高原开展降解/非降解、白/黑色地膜覆盖如何影响农田土壤水热和养分状况以及如何提高微生物和酶活性、改变微生物群落结构的研究。
渭北旱塬是我国黄土高原典型的旱作农业区,对水热条件要求较高的玉米种植主要采用地膜覆盖。本文以该区覆膜玉米地为研究对象,运用磷脂脂肪酸(PLFA)法,分析不同种类地膜覆盖下玉米收获期土壤微生物量、群落结构和酶活性差异及其关键影响因子。研究结果可明确不同种类地膜在改变农田土壤水热和养分状况、提高微生物和酶活性、改变微生物群落结构方面的差异,也有助于揭示不同种类地膜对土壤质量的影响,可为旱作农业区覆膜玉米体系最佳覆膜种类的选择提供科学指导。
1 材料与方法 1.1 试验区概况试验于2019年4—10月在中国科学院水土保持研究所长武农业生态试验站进行(35°12′ N,107°40′ E)。试验区属暖温带半湿润季风气候区;海拔940~ 1 220 m,年均气温9.1 ℃,日照时数2 230 h,全年≥0 ℃积温3 688 ℃,≥10 ℃积温3 029 ℃,无霜期171 d;年均降水584 mm,降水主要集中在7—9月,地下水深50~80 m;地带性土壤为黑垆土,母质是中壤质马兰黄土,肥力中等,属典型的旱作农业区。
1.2 试验设计试验共设5种处理,包括不覆膜(CK)、非降解白膜(ND-WP)、非降解黑膜(ND-BP)、降解白膜(DWP)和降解黑膜(D-BP)。每个处理3次重复,共15个小区,小区面积18 m2(4.3 m×4.2 m)。各覆膜小区在整地后玉米播种前施肥,之后起垄(垄宽70 cm、高15 cm,垄间沟宽30 cm),再分别覆盖4种地膜,膜宽均为100 cm,膜厚0.01 mm。最后将玉米种子(品种为先玉335)穴播(穴深3~4 cm)于膜两侧15 cm处,株距30 cm,播种密度为5.2万株·hm-2。肥料在播种时一次性施入,品种为尿素(N 46.4%)、过磷酸钙(P2O5 12%)和硫酸钾(K2O 51%),施肥量为氮225 kg N · hm-2、磷150 kg P2O5·hm-2和钾90 kg K2O·hm-2。对照处理(CK)不起垄不覆膜,但施肥量、施肥方式、播种密度、管理措施与4种覆膜处理一致。4月底播种,9月下旬收获,玉米全生育期不灌溉,田间管理措施与当地大田一致。非降解白/黑膜主要原材料为聚乙烯塑料,可降解白/黑膜主要原材料为PBAT(己二酸丁二醇酯和对苯二甲酸丁二醇酯的共聚物),其可在覆膜后50 d开始降解。至玉米收获期采样时,两种可降解地膜已有60%破碎降解,而两种非降解地膜仅出现少许裂缝。
1.3 样品采集于2019年9月底(玉米收获期)用土钻在每一小区按“S”型随机选择5个点采集0~20 cm土样(采样点位于植株间隙),将5个样点土壤混合为混合样,再用“四分法”获取足够土样。所采土样一部分装入铝盒待测土壤含水量,其余土样分为3份装入无菌封口袋带回实验室:一份过10目筛(约2.00 mm)后立即置于-20 ℃恒温冰箱保存待测土壤微生物群落和微生物量氮;一份过10目筛后置于4 ℃恒温冰箱保存待测土壤酶活性;第三份风干研磨后过20目筛(约0.85 mm)和100目筛(约0.15 mm)待测土壤理化性质。
1.4 样品分析 1.4.1 土壤理化性质测定土壤含水量(Moisture content,SWC,%)用烘干法(105 ℃,8 h)测定,土壤温度(Soil temperature,T,℃)为各小区20 cm深处温度(用地温计测得,取连续3 d测量的平均值),全氮(Total N,TN,g·kg-1)和碱解氮(Available N,AN,mg·kg-1)含量分别用半微量开氏法和碱液扩散法测定,硝态氮(Nitrate nitrogen,NO3-N,mg·kg-1)含量用2 mol·L-1的KCl浸提-连续流动分析仪法测定,有效磷(Available P,AP,mg·kg-1)和速效钾(Available K,AK,mg · kg-1)含量分别用0.5 mol · L-1 NaHCO3浸提-钼锑抗比色法和醋酸铵浸提-火焰光度计法测定[15]。
1.4.2 土壤酶活性及微生物量氮测定土壤脲酶、脱氢酶、碱性蛋白酶和硝酸还原酶活性测定分别采用靛酚蓝比色法、三苯基四氮唑氯化物(TTC)比色法、茚三酮比色法和苯磺酸−醋酸-α-萘胺比色法[16]。土壤微生物量氮采用氯仿熏蒸K2SO4浸提法测定。
1.4.3 土壤微生物群落结构测定土壤微生物群落结构测定采用磷脂脂肪酸(Phospholipid fatty acid,PFLA)法[17],该方法主要包括提取、分离、酯化和分析4个步骤。提取液按甲醇、氯仿、柠檬酸缓冲液以2:1:0.8的比例配制,分离用柱层析法,测定用Agilent6850气相色谱仪,计算用内标19:0,PFLA的命名采用Frostegard方法[18]。本研究中检测到的PFLA分类如下:i14:0、i15:0、a15:0、i16:0、a16:0、i17:0、a17:0、10:0 3OH、12:0 3OH、12:0、14:0、16:1 2OH、16:1 w9c、cy17:0、18:1 w5c、18:1 w7c、cy19:0、16:0、17:0、17:1 w8c和18:0指示细菌(B),其中i14:0、i15:0、a15:0、i16:0、a16:0、i17:0和a17:0指示革兰氏阳性菌(G+),10:0 3OH、12:0 3OH、12:0、14:0、16:1 2OH、16:1 w9c、cy17:0、18:1 w5c、18:1 w7c和cy19:0指示革兰氏阴性菌(G-),16:0、17:0、17:1 w8c和18:0指示普通细菌;16:1 w5c、18:1 w9c和18:3 w6c(6,9,12)指示真菌(F)[19-20]。
1.5 数据分析利用Excel 2010和SPSS 21.0软件进行数据整理和单因素方差分析(One-way ANOVA,α=0.05),利用Canoco 5软件进行冗余分析(Redundancy analysis,RDA),利用OriginPro 2018软件作图。
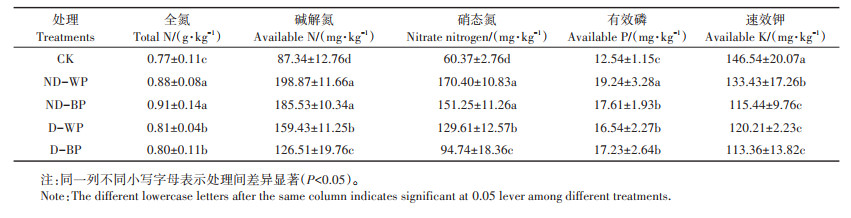
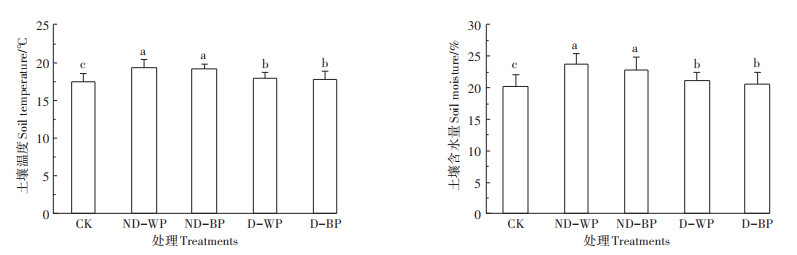
2 结果与分析 2.1 土壤理化性质从不同处理土壤温度和含水量差异来看(图 1),ND-WP和ND-BP土壤温度和含水量高于D-WP和D-BP(P < 0.05),分别高出1.4、1.3 ℃和2.5%、2.2%,但ND-WP和ND-BP之间、D-WP和D-BP之间无显著差异。此外各覆膜处理土壤温度和含水量均高于CK(P < 0.05)。由表 1可知,全氮含量表现为ND-WP和ND-BP高于D-WP和D-BP(P < 0.05),高出8.6%~ 13.8%(平均11.2%),碱解氮和硝态氮表现为NDWP、ND-BP>D-WP>D-BP(P < 0.05),有效磷和速效钾表现为ND-WP高于ND-BP、D-WP和D-BP(P < 0.05)。与CK相比,4种覆膜处理土壤温度、含水量和养分含量明显偏高。说明覆膜后土壤水热状况和养分状况明显改善,并且非降解膜在改善作物收获期土壤水热状况和增加土壤活性氮的效应方面较降解膜明显。地膜颜色对土壤氮、磷、钾的影响在降解膜和非降解膜处理中表现不同。
|
K为平作不覆膜;ND-WP为覆非降解白膜;ND-BP为覆非降解黑膜;D-WP为覆降解白膜;D-BP为覆降解黑膜。不同小写字母表示处理间差异显著,P<0.05。下同 CK: Planting without mulching as a control; ND-WP: White non-biodegradable film mulching; ND-BP: Black non-biodegradable film mulching; D-WP:White biodegradable film mulching; D-BP:Black biodegradable film mulching. The different lowercase letters indicates significant differences at 0.05 lever among different treatments. The same follow 图 1 不同覆膜处理土壤温度和含水量差异 Figure 1 Differences in soil temperature and moisture of different treatments |
|
|
表 1 不同覆膜处理土壤化学性质差异 Table 1 Differences in soil chemical properties of different treatments |
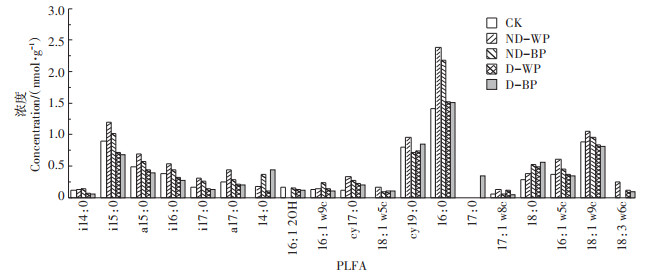
5种处理中共检测出24种微生物PLFA,若从其中浓度大于0.1 nmol·g-1的19种PLFA来看(图 2),D-BP处理种类最多,共19种;其次为D-WP(18种),17:0(B)未检测到;ND-WP和ND-BP微生物种类最少,为17种,ND-WP未检测到16:1 2OH(G-)和17:0(B),ND-BP未检测到17:0(B)和18:3 w6c(F)。此外,4种覆膜处理微生物种类和各微生物PLFA浓度均高于CK处理(14种)。i15:0(G+)、a15:0(G+)、cy19:0(G-)、16:0(B)和18:1 w9c(F)浓度总和占总PLFA浓度的55.6%~62.9%,是覆膜农田微生物群落的优势菌种,其中i15:0、16:0和18:1 w9c浓度在不同覆膜处理间差异显著,说明这3种PLFA是对地膜种类敏感的微生物菌种,并且有研究显示这些菌种指示了土壤具有较好的理化性质和质量[19, 21]。
|
图 2 不同覆膜处理土壤PLFA浓度差异 Figure 2 Difference in soil PLFA concentration of different treatments |
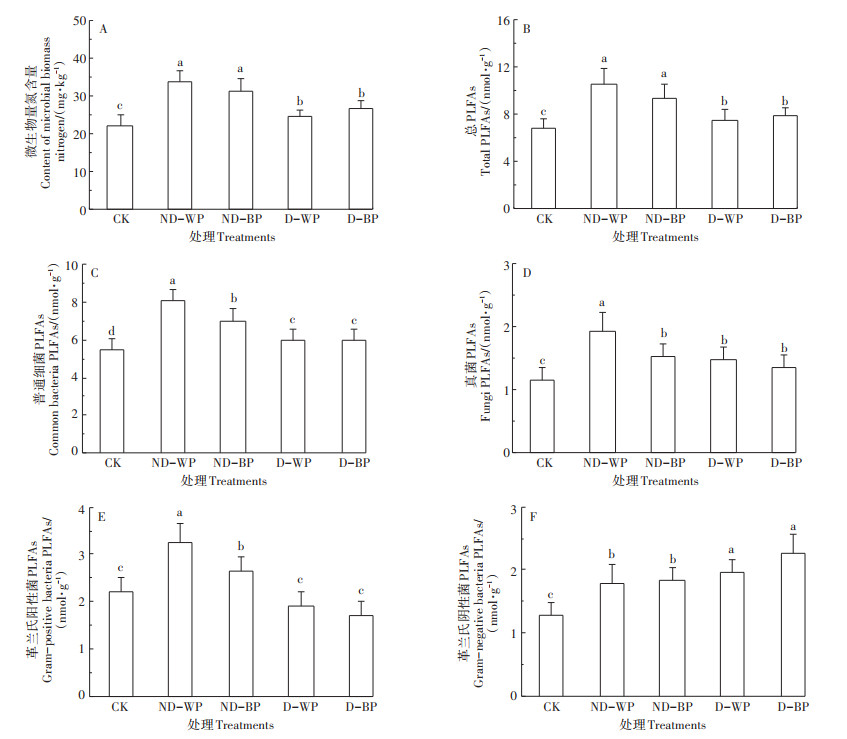
图 3A是不同覆膜处理土壤微生物量氮的差异。在4种覆膜处理中,ND-WP和ND-BP土壤微生物量氮含量高于D-WP和D-BP(P < 0.05),分别高出35.4%和20.7%,但ND-WP和ND-BP之间、D-BP和D-WP之间无显著差异。此外,4种覆膜处理土壤微生物量氮含量均高于CK处理。微生物量氮可反映土壤供氮能力,这表明覆膜可提高土壤供氮能力,并且非降解膜较降解膜更优。
|
图 3 不同覆膜处理土壤微生物量氮含量和微生物群落PLFA浓度 Figure 3 Difference in soil microbial nitrogen and microbial community PLFA concentration of different treatments |
图 3B至图 3F为不同覆膜处理间土壤微生物PLFA总浓度和各微生物群落PLFA浓度差异。首先,微生物PLFA总浓度表现为ND-WP和ND-BP高于D-WP和D-BP(P < 0.05),高出24.2%~34.8%(平均29.5%),但ND-WP和ND-BP之间、D-WP和D-BP之间无显著差异(图 3B)。普通细菌PLFA浓度表现为ND-WP和ND-BP高于D-WP和D-BP(P < 0.05),高出18.0%~34.6%(平均26.3%)。真菌和革兰氏阳性菌群落PLFA浓度在ND-WP中最高,分别为1.82 nmol·g-1和3.25 nmol·g-1,其次为ND-BP,D-WP和D-BP较低。革兰氏阴性菌刚好相反,表现为D-WP和D - BP高于ND - WP和ND - BP(P < 0.05),高出5.6%~26.3%(平均15.9%)。另外,4种覆膜处理微生物PLFA总浓度和各微生物群落PLFA浓度均高于CK处理(P < 0.05)。可见,覆膜处理显著提高了土壤微生物活性,并且非降解膜处理优于降解膜处理,但同为降解膜或非降解膜时,地膜颜色对土壤微生物活性的影响不显著。
从各处理真菌与细菌PLFA浓度比(F/B)和革兰氏阳性菌与阴性菌PLFA浓度比(G+/G-)的差异来看(图 4),ND-BP和D-BP处理的F/B显著高于ND-WP和D - WP处理(P < 0.05),高出17.6%~22.4%(平均20.6%),但两种黑色地膜处理(ND-BP与D-BP)之间和两种白色地膜处理(ND-WP与D-WP)之间并无显著差异,同时各覆膜处理F/B显著高于CK(P < 0.05)。D-BP和D-WP处理的G+/G-分别为0.76和0.98,显著低于ND-BP(1.43)、ND-WP(1.82)和CK(1.73)(P < 0.05)。可见,地膜颜色对F/B影响显著,但在相同颜色地膜中,降解、非降解膜对其影响不明显。而降解、非降解膜对G+/G-影响显著,白、黑色地膜处理G+/G-的差异仅出现在两种非降解膜处理中。
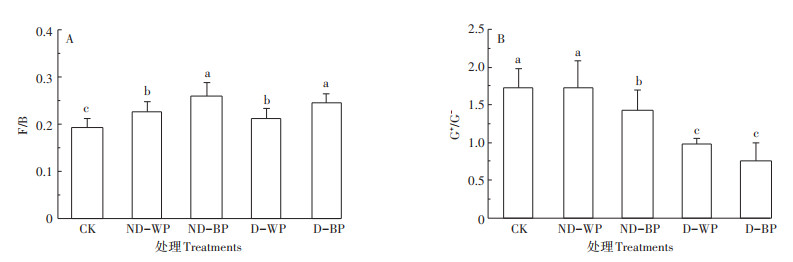
|
图 4 不同覆膜处理土壤微生物群落结构特征 Figure 4 Structural characteristics of microbial community of different treatments |
从不同覆膜处理脲酶、脱氢酶、硝酸还原酶和碱性蛋白酶活性差异来看(图 5),4种覆膜处理脲酶、脱氢酶和碱性蛋白酶活性的差异表现一致,均为NDWP和ND-BP高于D-WP和D-NP(P < 0.05),分别提高10.6%~12.2%、28.6%~56.2%和11.8%~25.3%(平均为11.4%、42.4%、18.5%),但硝酸还原酶活性在4种覆膜处理间无显著差异。表明降解、非降解膜对土壤酶活性的影响不同,非降解膜对提高脲酶、脱氢酶和碱性蛋白酶活性的效应较降解膜明显,但同为降解膜或非降解膜时,地膜颜色对其无显著影响。
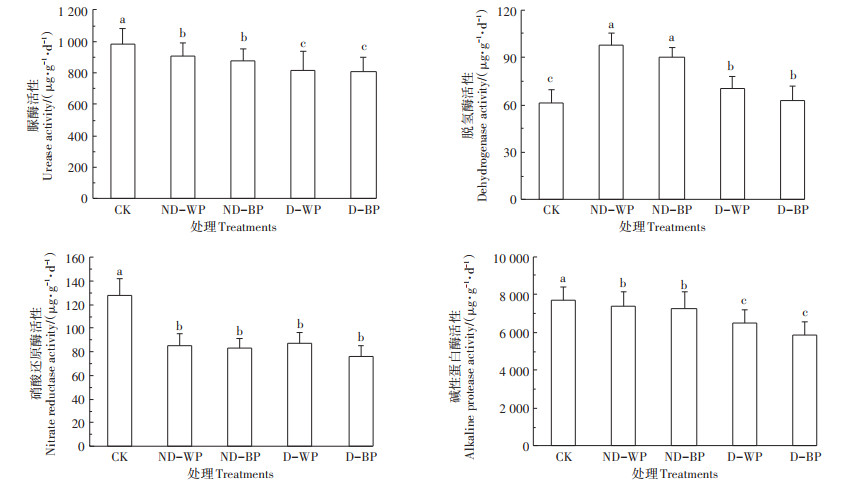
|
图 5 不同覆膜处理土壤酶活性差异 Figure 5 Differences in soil enzyme activity of different treatments |
从土壤微生物群落浓度和酶活性与土壤水肥因子的冗余分析(RDA)结果看(图 6),第一轴解释了微生物群落浓度和酶活性变异的48.25%,第二轴解释了28.31%,累计解释量为76.56%,模拟效果较好。Monte Carlo置换检验得到对土壤微生物群落浓度和酶活性影响较高(P < 0.05)的土壤因子主要是微生物量氮(MBN)(F=3.8,P=0.008)、全氮(TN)(F=3.8,P= 0.010)、速效钾(AK)(F=3.2,P=0.019)、有效磷(AP)(F=3.1,P=0.023)、硝态氮(NO3-N)(F=2.9,P=0.036)和碱解氮(AN)(F=2.8,P=0.042),表明玉米收获期土壤微生物和酶活性主要受土壤氮、磷、钾含量影响。此外,土壤含水量和温度对微生物和酶活性的影响不显著,这可能是由于此时水热条件较好,其并非微生物和酶发育的关键限制因子。
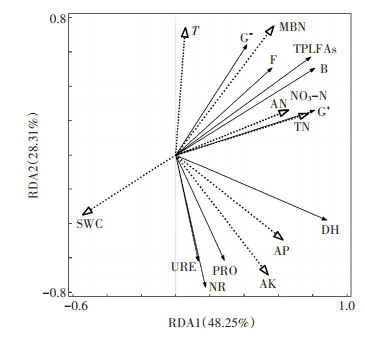
|
TPLFAs:总PLFA;B:普通细菌;F:真菌;G+:革兰氏阳性菌;G-:革兰氏阴性菌;DH:脱氢酶;PRO:碱性蛋白酶;NR:硝酸还原酶;URE:脲酶;T:土壤温度;SWC:土壤含水量;TN:全氮;NO3-N:硝态氮;AN:碱解氮;AK:速效钾;AP:有效磷;MBN:微生物量氮 图 6 土壤微生物群落、酶活性与环境因子的冗余分析 Figure 6 Redundancy analysis(RDA)of soil microbial community and enzyme activity with soil factors |
研究发现,两种非降解膜处理土壤微生物量氮、微生物PLFA总浓度、普通细菌、真菌、革兰氏阳性菌PLFA浓度、脲酶、碱性蛋白酶和脱氢酶活性均高于两种降解膜处理,说明在作物收获期非降解膜处理微生物和酶活性高于降解膜处理。研究认为,微生物活性能表征土壤水肥状况,脲酶和碱性蛋白酶可促进土壤有机氮的分解[22],脱氢酶可间接反映土壤氮硝化速率[23]。同时RDA表明,收获期土壤微生物和酶活性主要受土壤氮、磷、钾含量影响。由此可知,相比降解膜,非降解膜覆盖下作物收获期土壤水肥状况更好,土壤氮积累增加,尤其是硝态氮(表 1)。其原因可能在于降解膜会随作物生长降解破裂,到作物生长后期大部分破碎[24],其隔绝作用减弱,导致膜内水热条件变差[25]。本研究发现两种非降解膜处理玉米收获期土壤温度和含水量较降解膜处理高1.4、1.3 ℃和2.5%、2.2%(图 1)。所以非降解膜处理较好的水热条件加速了氮、磷、钾等营养元素的转化,形成了更有利于微生物和酶生存的土壤环境,使微生物和酶活性提高。本结论仅是针对玉米收获期研究所得,两种地膜在作物其他生育期或整个生育期使用后如何影响土壤微生物和酶活性仍有待研究。此外,有研究认为适度升温会降低微生物对氮养分的利用效率,提高氮转化相关酶活性,并导致土壤氮矿化作用加强[26]。本研究中非降解膜处理较高的温度与较强的微生物和酶活性提高了氮矿化率,导致硝态氮大量累积的结论与之类似(表 1),这在作物生育后期会引起土壤有机氮库的快速损耗而对下茬作物生长不利,而且还可造成膜下硝酸盐累积并带来一定的环境负效应[27-28](如表 1中,两种非降解膜处理土壤碱解氮和硝态氮较两种降解膜处理平均高70.2%和69.5%)。而降解膜处理在作物生育后期微生物活性下降,氮矿化作用减弱,有效减少了土壤中硝态氮的累积,对土壤中硝酸盐的累积有一定的调控作用[29]。同时考虑到非降解膜残留会引起土壤环境恶化,特别是近年来土壤“微塑料”污染问题的凸显[30],使降解膜的优势更加明显。
研究还发现,两种黑色地膜处理F/B高于两种白色地膜处理,并且非降解白膜处理G+/G-高于非降解黑膜处理,说明地膜颜色显著影响了土壤微生物群落结构。这可能是缘于白色地膜覆盖农田地温较高,水肥消耗量大,作物生长后期出现水肥匮缺[31],而黑色地膜较低的透光率避免了高温引起的水肥过度损耗,有助于作物后期土壤水肥保持[32]。F/B越高表明土壤的营养状况越好[33],土壤生态系统越稳定[34];而G+/G-低说明土壤质量状况更优,土壤微生物群落对环境变化缓冲能力更好[35]。可见,相同材料的黑色地膜在维持土壤生态系统稳定性和对土壤环境变化的缓冲能力方面较白色地膜更有优势,更有利于土壤质量的保持和农田的持续利用。综上说明,黄土高原地区用黑色降解膜替代目前大面积使用的白色非降解膜是可行的。
4 结论(1)与降解膜处理相比,非降解膜处理玉米收获期土壤微生物PLFA总浓度,普通细菌、真菌、革兰氏阳性菌PLFA浓度和脲酶、碱性蛋白酶、脱氢酶活性均明显偏高,同时非降解膜处理土壤硝态氮含量显著高于降解膜处理,说明作物生育后期较强的微生物和酶活性会加强氮素矿化作用,从而造成非降解膜处理膜下土壤硝酸盐累积。
(2)在同为降解膜或非降解膜时,地膜颜色对土壤微生物量和酶活性的影响不显著,但对土壤微生物群落结构存在显著影响。黑色膜处理F/B较白色膜处理高,但G+/G-较白色膜处理低,表明相同材料的黑色膜在维持土壤生态系统稳定性和对土壤环境变化的缓冲能力方面较白色膜更有优势。
(3)RDA显示,玉米收获期土壤微生物和酶活性主要受土壤氮、磷、钾含量影响,土壤温度和含水量并非土壤微生物和酶活性的关键限制因子
| [1] |
Zhou L F, Feng H. Plastic film mulching stimulates brace root emergence and soil nutrient absorption of maize in an arid environment[J]. Journal of the Science of Food and Agriculture, 2020, 100(2): 540-550. DOI:10.1002/jsfa.10036 |
| [2] |
Bandopadhyay S, Mtin-Closas L, Pelacho A M, et al. Biodegradable plastic mulch films:Impacts on soil microbial communities and ecosystem functions[J]. Frontiers in Microbiology, 2018, 9: 819-823. DOI:10.3389/fmicb.2018.00819 |
| [3] |
刘建国, 李彦斌, 张伟, 等. 绿洲棉田长期连作下残膜分布及对棉花生长的影响[J]. 农业环境科学学报, 2010, 29(2): 246-250. LIU Jian-guo, LI Yan-bin, ZHANG Wei, et al. The distributing of the residue film and influce on cotton growth under continuous cropping in oasis of Xinjiang[J]. Journal of Agro-Environment Science, 2010, 29(2): 246-250. |
| [4] |
Henry Y S, Sreejata B, Marie E E. Impacts of biodegradable plastic mulches on soil health[J]. Agriculture, Ecosystems & Environment, 2018, 273: 36-49. |
| [5] |
Sintim H Y, Flury M, et al. Is biodegradable plastic mulch the solution to agriculture's plastic problem?[J]. Environmental Science & Technology, 2017, 51(3): 1068-1069. |
| [6] |
张冬梅, 池宝亮, 黄学芳, 等. 地膜覆盖导致旱地玉米减产的负面影响[J]. 农业工程学报, 2008, 24(4): 99-102. ZHANG Dong-mei, CHI Bao-liang, HUANG Xue-fang, et al. Analysis of adverse effects on maize yield decrease resulted from plastic film mulching in dryland[J]. Transactions of the Chinese Society of Agricultural Engineering, 2008, 24(4): 99-102. |
| [7] |
Qin X L, Li Y Z, Han Y L, et al. Ridge-furrow mulching with black plastic film improves maize yield more than white plastic film in dry areas with adequate accumulated temperature[J]. Agricultural and Forest Meteorology, 2018, 262: 206-214. DOI:10.1016/j.agrformet.2018.07.018 |
| [8] |
Rutigliano F A, D' Ascoli R, De Santo Santo A V. Soil microbial metabolism and nutrient status in a Mediterranean area as affected by plant cover[J]. Soil Biology and Biochemistry, 2004, 36(11): 1719-1729. DOI:10.1016/j.soilbio.2004.04.029 |
| [9] |
Huang F Y, Liu Z H, Mou H Y, et al. Effects of different long-term farmland mulching practices on the loessial soil fungal community in a semiarid region of China[J]. Applied Soil Ecology, 2019, 137: 111-121. DOI:10.1016/j.apsoil.2019.01.014 |
| [10] |
Farmer J, Zhang B, Jin X X, et al. Long-term effect of plastic film mulching and fertilization on bacterial communities in a brown soil revealed by high through-put sequencing[J]. Archives of Agronomy and Soil Science, 2017, 63: 230-241. DOI:10.1080/03650340.2016.1193667 |
| [11] |
Muñoz K, Schmidt-Heydt M, Stoll D, et al. Effect of plastic mulching on mycotoxin occurrence and mycobiome abundance in soil samples from asparagus crops[J]. Mycotoxin Research, 2015, 31(4): 191-201. DOI:10.1007/s12550-015-0231-9 |
| [12] |
Kimiko Y T, Syuntaro H, Takashi W, et al. Contribution of soil esterase to biodegradation of aliphatic polyester agricultural mulch film in cultivated soils[J]. AMB Express, 2015, 5(1): 101-109. |
| [13] |
Fumihiro M, Yuya T, Yukiko K, et al. Influences of poly(butylene adipate-co-terephthalate)on soil microbiota and plant growth[J]. Polymer Degradation and Stability, 2016, 129: 338-346. DOI:10.1016/j.polymdegradstab.2016.05.018 |
| [14] |
Qi Y L, Adam O, Yang X M, et al. Effects of plastic mulch film residues on wheat rhizosphere and soil properties[J]. Journal of Hazardous Material, 2020, 387: 121-129. |
| [15] |
刘光崧. 土壤理化分析与土壤剖面描述[M]. 北京: 中国标准出版社, 1996. LIU Guang-song. Soil physical and chemical analysis description of soil profiles[M]. Beijing: Standards Press of China, 1996. |
| [16] |
关松荫. 土壤酶及研究法[M]. 北京: 农业出版社, 1986. GUAN Song-yin. Soil enzyme and study method[M]. Beijing: Agricultural Press, 1986. |
| [17] |
Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities:Phospholipid fatty acid profiles and substrate utilization patterns[J]. Microbial Ecology, 1998, 35(3): 265-278. DOI:10.1007/s002489900082 |
| [18] |
Frostegard J, Haegerstrand A, Gidlund M, et al. Biologically modified LDL increases the adhesive properties of endothelial cells[J]. Atherosclerosis, 1991, 90(2/3): 119-126. |
| [19] |
McKinley V L, Peacock A D, White D C. Microbial community PLFA and PHB responses to ecosystem restoration in tallgrass prairie soils[J]. Soil Biology and Biochemistry, 2005, 37(10): 1946-1958. DOI:10.1016/j.soilbio.2005.02.033 |
| [20] |
Ute H, Holger H, Bert M, et al. Impact of the antibiotic sulfadiazine and pig manure on the microbial community structure in agricultural soils[J]. Soil Biology and Biochemistry, 2008, 40(7): 1583-1591. DOI:10.1016/j.soilbio.2008.01.010 |
| [21] |
王继萍, 庞碧琳, 于亚军. 不同复垦年限煤矸山土壤微生物群落特征及其指示作用[J]. 干旱区资源与环境, 2017, 31(9): 140-144. WANG Ji-ping, PANG Bi-lin, YU Ya-jun. Soil microbial community characteristics and indicator function in coal gangue mountains[J]. Journal of Arid Land Resources and Environment, 2017, 31(9): 140-144. |
| [22] |
Van O M J, Dell' Aversana E, Ruggiero A, et al. Omeprazole treatment enhances nitrogen use efficiency through increased nitrogen uptake and assimilation in corn[J]. Frontiers in Plant Science, 2019, 10: 1507-1516. DOI:10.3389/fpls.2019.01507 |
| [23] |
Wang M J, He D, Shen F, et al. Effects of soil compaction on plant growth, nutrient absorption, and root respiration in soybean seedlings[J]. Environmental Science and Pollution Research International, 2019, 26(22): 22835-22845. DOI:10.1007/s11356-019-05606-z |
| [24] |
Huang F Y, Liu Z H, Mou H Y, et al. Impact of farmland mulching practices on the soil bacterial community structure in the semiarid area of the loess plateau in China[J]. European Journal of Soil Biology, 2019, 92: 8-15. DOI:10.1016/j.ejsobi.2019.04.001 |
| [25] |
Wang Z H, Wu Q, Fan B H, et al. Effects of mulching biodegradable films under drip irrigation on soil hydrothermal conditions and cotton (Gossypium hirsutum L.) yield[J]. Agricultural Water Management. |
| [26] |
Dai Z M, Yu M J, Chen H H, et al. Elevated temperature shifts soil N cycling from microbial immobilization to enhanced mineralization, nitrification and denitrification across global terrestrial ecosystems[J]. Global Change Biology, 2020, 217. |
| [27] |
Jiang R, Li X, Zhu W, et al. Effects of the ridge mulched system on soil water and inorganic nitrogen distribution in the Loess Plateau of China[J]. Agricultural Water Management, 2018, 203: 277-288. DOI:10.1016/j.agwat.2018.03.027 |
| [28] |
Ma D D, Chen L, Qu H C, et al. Impacts of plastic film mulching on crop yields, soil water, nitrate, and organic carbon in northwestern China:A meta-analysis[J]. Agricultural Water Management, 2018, 202: 166-173. DOI:10.1016/j.agwat.2018.02.001 |
| [29] |
Zhang X Y, You S Y, Tian Y Q, et al. Comparison of plastic film, biodegradable paper and bio-based film mulching for summer tomato production:Soil properties, plant growth, fruit yield and fruit quality[J]. Scientia Horticulturae, 2019, 249: 38-48. DOI:10.1016/j.scienta.2019.01.037 |
| [30] |
Yin M H, Li Y N, Fang H, et al. Biodegradable mulching film with an optimum degradation rate improves soil environment and enhances maize growth[J]. Agricultural Water Management, 2019, 216: 127-137. DOI:10.1016/j.agwat.2019.02.004 |
| [31] |
Hu Y J, Ma P H, Duan C X, et al. Black plastic film combined with straw mulching delays senescence and increases summer maize yield in northwest China[J]. Agricultural Water Management, 2020, 231: 127-137. |
| [32] |
Schimel J, Balser T C, Wallenstein M. Microbial stress-response physiology and its implications for ecosystem function[J]. Ecology, 2007, 88(6): 1386-1394. DOI:10.1890/06-0219 |
| [33] |
Kourtev P S, Ehrenfeld J G, Häggblom M. Experimental analysis of the effect of exotic and native plant species on the structure and function of soil microbial communities[J]. Soil Biology and Biochemistry, 2003, 35(7): 895-905. DOI:10.1016/S0038-0717(03)00120-2 |
| [34] |
Anderson J P E, Domsch K H. Quantification of bacterial and fungal contributions to soil respiration[J]. Archiv für Mikrobiologie, 1973, 93(2): 113-127. DOI:10.1007/BF00424942 |
| [35] |
张蓉, 于亚军. 煤矸山复垦林地和草地土壤微生物多样性和群落组成的差异及其影响因素[J]. 生态学杂志, 2018, 37(6): 1662-1668. ZHANG Rong, YU Ya-jun. Differences of soil microbial diversity and community composition between reclaimed woodland and grassland in coal waste pile and their influencing factors[J]. Chinese Journal of Ecology, 2018, 37(6): 1662-1668. |
 2020, Vol. 39
2020, Vol. 39