2. 中国科学院大学, 北京 100864
2. University of Chinese Academy of Sciences, Beijing 100864, China
多环芳烃(PAHs)由于其致癌、致畸、致突变、生物蓄积和远距离运输等特性,在1977年被美国环境保护署列为优先控制污染物[1]。自然过程和人为活动产生的PAHs会通过大气沉降(湿法或干法)、污水灌溉和污泥施肥等多种途径进入土壤[2]。PAHs作为一大类持久性有机污染物,具有的脂溶性、疏水性和抗降解性,导致其在土壤环境中大量残留[3]。2014年调查显示,我国土壤中PAHs的点位超标率高达1.4%[4]。有文献报道,南京、上海、台州、珠江三角洲、北京、长春和西安等地的土壤中PAHs含量超过1 000 μg·kg-1,呈超重度污染状况[5]。植物会通过根部吸收土壤中的PAHs,并将其转移到其他组织部位[6],因此土壤生态系统的状况直接关系到全球的粮食安全。经调查,我国南部地区废水灌溉的土壤上种植的可食蔬菜含有的PAHs浓度范围在158~995 μg·kg-1(16种PAHs的总浓度)[7]。含有PAHs的植物可能会被人类直接摄食[8],或被昆虫、家禽等动物食用进入到下一营养级,进而在食物网中累积,随后逐渐进入到肉制品或乳制品中,最终间接地通过摄食途径进入人体,从而对人体健康造成巨大的潜在威胁[9]。
截至2011年3月,销售市场上已有1 300多种含纳米技术的产品,如医疗设备、化妆品、食品包装、环境修复剂等[10-12]。从原材料的生产到产品的制造,再到产品的使用和废弃,工程纳米材料在其整个生命周期中都不可避免地被大量释放到土壤环境中[13-15]。同时由于纳米材料(NMs)具有尺寸依赖性、比表面积大和光学性能独特的性质,而在植物保护和营养方面具有广阔的应用前景,从而吸引了大量研究人员的关注[16]。例如,有研究显示,植物根部吸收培养介质中的纳米颗粒(NPs)后表现出对自身生长有益的作用(就改善根部生长而言)[17]。在土培实验中,纳米二氧化钛(TiO2 NPs)的施用促进了花生(Arachis hypogaea L.)根部的伸长,增加了植株根部生物量[18]。但有研究人员给小麦(Triticum aestivum L.)植株施加500 mg·kg-1的TiO2 NPs发现,TiO2 NPs对其生长状况没有影响,却增加了其可食用部分的氨基酸含量[19]。Zhang等[20]使用不同浓度的纳米铜(Cu NPs)处理小麦植株,发现Cu NPs显著诱导了体内抗氧化剂(如脯氨酸)的合成。然而多数研究都集中在NMs单独的利与弊或有机污染物单独的毒理方面,关于它们联合的生物学效应研究仍然十分有限[21-22]。有研究表明,添加100 mg·L-1 TiO2 NPs显著提高了被1 mg·L-1四环素(TC)污染的拟南芥(Arabidopsis thaliana L.)的鲜质量[23]。也有学者研究了镍/铁双金属纳米颗粒(Ni/Fe NPs)对多溴联苯醚(PBDEs)在大白菜(Brassica pekinensis L.)体内毒性的影响,发现Ni/Fe NPs的施用显著降低了PBDEs对植物的毒性[24]。但De La Torre-Roche等[25]探究富勒烯纳米材料对1,1-双(对氯苯基)-2,2-二氯乙烯(DDE)在西葫芦(Cucurbita pepo L.)、大豆(Glycine max L.)和番茄(Solanum lycopersicum L.)体内累积的影响时,却发现富勒烯纳米材料的存在显著增加了植物对DDE的吸收与累积(30%~65%)。
虽然目前有关于纳米材料对作物吸收有机污染物(如DDE)影响的研究,但涉及PAHs的研究仍然有限。基于以上研究现状,本研究选用TiO2 NPs(< 100 nm)作为纳米材料的代表,因为TiO2 NPs是目前使用最广泛的纳米材料之一,特别是在农业、美容、医学和抗菌剂方面,全球每年产量高达1×107 kg[26-27];选择芘作为代表性PAHs;选取大豆(Glycine max L.)作为粮食作物的代表,从农产品的安全生产和保障人类健康的角度出发,探究排放到土壤中或人为施用的NMs是否可以抑制植物对PAHs的吸收与累积。
1 材料与方法 1.1 试验材料纳米二氧化钛(TiO2 NPs,纯度为99.0%,尺寸在15~25 nm)购自南京先丰纳米材料科技有限公司;芘(标准物质,难溶于水,易溶于有机试剂)购自上海阿拉丁试剂有限公司;大豆种子购自南京明达种子有限公司。
1.2 幼苗培养选取一定量大小一致、外观无破损的大豆种子,用去离子水浮选筛除瘪粒。使用0.2%次氯酸钠溶液消毒30 min,然后浸泡在去离子水中。24 h后,将大豆种子均匀地置于底部铺有湿润滤纸的托盘中,放入人工气候箱,在黑暗、25 ℃的条件下进行催芽。种子发芽至2 cm左右,转移到去离子水中培养4 d。人工气候箱的条件设置为:白天(光强为375 μmol·s-1· m-2)25 ℃、16 h;夜晚(黑暗)20 ℃、8 h;相对空气湿度为75%。
1.3 水培试验选取生长状况较一致的大豆幼苗,先后转移到1/2浓度及全浓度Hoagland营养液(H)中分别培养4 d。接着用去离子水“饥饿处理”1 d,选取长势一致的大豆植株,在茎基处剪去地上部,对完整的离体根进行4 h如下处理:(1)空白对照(HR),培养液中只有大豆根部;(2)1 mg·L-1芘溶液(HRP);(3)100 mg·L-1 TiO2 NPs溶液(HRT);(4)1 mg · L-1芘溶液+ 100 mg · L-1 TiO2 NPs溶液(HRPT)。所有处理各3个平行,均在包裹有铝箔纸的玻璃烧杯中进行。处理所用的芘溶液均用甲醇助溶(为避免甲醇对植物生长产生影响,培养液中甲醇总浓度需低于0.1%),所有处理均含有等量的甲醇溶液。暴露结束后,所有大豆根部用去离子水冲洗干净,并在甲醇中浸泡30 s,再用去离子水洗净,擦干水分,-20 ℃冷冻保存备用。
1.4 根部芘含量测定取部分大豆根冷冻干燥,研磨至粉末,称取0.150 0 g样品到40 mL棕色玻璃瓶中,加10 mL二氯甲烷与正己烷的混合溶液(V:V=1:1),超声1 h,收集萃取液,共重复3次。准确量取20 mL萃取液旋蒸浓缩至少于1 mL,用混合溶液定容至2 mL。取0.5 mL浓缩液至已活化的SPE小柱进行纯化(SPE小柱从下向上分别填充有:垫片、0.5 g无水硫酸钠、1.0 g硅胶、1.0 g无水硫酸钠、垫片。SPE小柱活化流程为:向柱中依次加入10 mL二氯甲烷、5 mL正己烷),用10 mL混合溶液进行洗脱。将收集到的洗脱液再次进行旋蒸浓缩,用二氯甲烷定容至2 mL,再过0.22 μm有机滤头,采用气相质谱(GC-MS,GC-MS 2020,日本岛津)进行测定。
GC-MS测样条件:气相色谱仪使用Rt-max5(30 m×0.25 mm×0.25 μm)气相毛细管柱。进样口温度为250 ℃,进样体积为1 μL,采用不分流进样方式。载气为高纯氦气(99.999%)。程序升温:初始温度60 ℃,保持1 min,再以10 ℃·min-1升温至280 ℃,保持2 min。溶剂延迟5 min,离子化方式为电子轰击(EI),离子化能量为70 eV,扫描模式选择SIM模式。
1.5 根部钛元素含量测定取部分大豆根在70 ℃下烘干至恒质量,在常温下加入6 mL 65% HNO3和2 mL H2O2混合溶液消解24 h,再在280 ℃电热板上消解约6 h至1 mL左右,且控制溶液澄清。用2% HNO3将消解液转移并定容至10 mL,过0.45 μm水系滤头,采用电感耦合等离子体质谱(ICP-MS,Agilent 8800x,美国)测定溶液中钛离子的浓度。使用植物标准样品(紫菜,GBW10020,中国地质科学院地球物理化学勘查研究所,中国)作为质控样同时进行消解测定。
ICP-MS测样条件:仪器功率为1 550 W,设置雾化气流量为1.0 L·min-1,冷却气流量为14.0 L·min-1,辅助气流量为0.8 L·min-1,样品提升量为4.0 L·min-1,每次采样深度为7.8 mm,重复采样3次。
1.6 根部生理指标测定收集处理后的大豆根部,用去离子水冲洗干净,擦干水分后,按照质量(g):体积(mL)=1:9的比例加入匀浆介质,在冰水浴条件下制备组织匀浆液。采用黄嘌呤氧化酶法(NBT法)测定超氧化物歧化酶(Superoxide Dismutase,SOD)活力(U·g-1),以每克组织在1 mL反应液中将NBT还原50%为一个活力单位;采用硫代巴比妥酸比色法(TBA法)测定丙二醛(Malondialdehyde,MDA)含量(nmol·g-1);采用二硫代二硝基苯甲酸显色法(DTAB法)测定还原型谷胱甘肽(Reduced glutathione,GSH)含量(μmol·g-1prot)[20]。
1.7 统计分析使用Excel 2016、SPSS 17.0和Origin 8.0软件对试验数据进行处理、绘图;使用单因素方差分析(Oneway ANOVA)确定各处理之间的差异显著性,然后用Duncan法进行多重比较检验(α=0.05)。
2 结果与讨论 2.1 大豆根部对钛的吸收在没有添加TiO2 NPs的处理中,大豆根部的钛含量都非常低,说明测试仪器运行稳定。单独添加TiO2 NPs时,大豆根部钛含量为320 mg·kg -1。由于培养液中钛离子含量很低,在μg·kg-1数量级,并且在处理过程中浓度稳定(图 1),可见植物中的钛元素主要来源于根部对TiO2 NPs的直接吸收。有文献利用双稳定同位素示踪法研究水稻对Ag NPs的吸收与转化时,在植物体内检测到了Ag NPs,暗示了水稻根部直接摄取Ag NPs的可能性[28]。也有利用同步辐射显微X射线荧光技术来研究小麦植物组织中NPs的分布,并通过透射电镜对其进行观察,发现TiO2 NPs在根中积累并通过整个植物组织分布,没有溶解或晶体相修饰[29]。通过电子显微镜、单粒子电感耦合等离子体质谱仪(sp-ICP-MS)来研究水稻对TiO2 NPs的吸收时发现,5 mg·L-1和50 mg·L-1浓度下TiO2 NPs的总元素分析结果与电镜结果一致,表明TiO2 NPs会被吸收到植物根中[30]。相比于TiO2 NPs处理,芘+TiO2 NPs处理下大豆根部的钛含量增加了82.3%(图 2),说明PAHs会影响植物对TiO2 NPs的吸收与累积。这有可能是因为芘的加入改变了TiO2 NPs的表面电荷,使其更易被细胞表面固定,从而更多地进入到植物体内[31]。但尚未有明确的手段验证该现象,其产生的具体原因有待进一步探究。
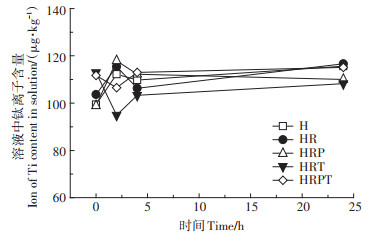
|
图 1 培养液中钛离子浓度随时间的变化 Figure 1 The change of titanium ion concentration in culture medium with time |
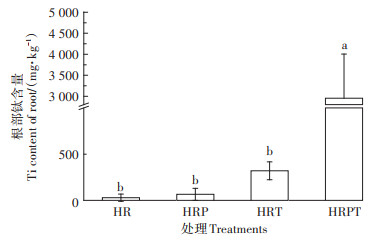
|
图中不同小写字母表示处理间差异显著(P < 0.05)。下同 Different letters indicate significant differences among the treatments(P < 0.05). The same below 图 2 不同处理大豆根部钛含量 Figure 2 Titanium content in soybean root under different treatments |
图 3为不同处理大豆根部的芘含量。没有添加芘的处理在大豆根部检测到了芘的存在,有可能是因为植物本身会生成一些内源性PAHs[32],也有可能是仪器自带的系统误差,没有办法做到绝对零含量检测。但是相比其他处理而言,其含量非常低,可以忽略不计。与空白对照相比,单独芘处理的大豆根部含有27.8 mg·kg-1的芘,可见大豆植株的根部确实会吸收PAHs,并将其累积在根部组织中。Dupuy等[33]对玉米根部进行菲暴露,利用荧光显微镜观察玉米根部的微观结构,发现了菲的存在。本实验结果验证了PAHs确实会进入植物体内,进而累积在食物网中,对人体健康造成潜在的风险[34]。有文献报道PAHs通过植株的蒸腾拉力经由木质部向地上部迁移[35]。但结合该试验中去除了大豆植株的地上部分,一定程度上说明蒸腾拉力并不是植物根部吸收PAHs的唯一动力。Zhan等[36]也研究发现,植物可以通过形成PAHs/氢质子同向转运体的形式实现对PAHs的主动吸收。
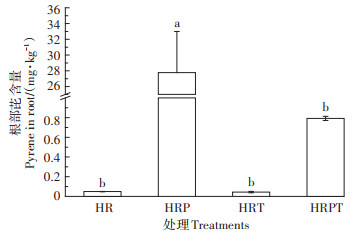
|
图 3 不同处理大豆根部芘含量 Figure 3 Pyrene content in soybean root under different treatments |
在芘和TiO2 NPs共存的处理下,大豆根部芘含量为0.8 mg·kg-1。可见当大豆根部受芘污染时,TiO2 NPs的添加使得芘含量降低了97.1%,并且与只有芘的处理相比呈现出显著差异。说明TiO2 NPs的存在可以减少大豆根部对PAHs的吸收与累积。有文献报道,TiO2 NPs会吸附固定环境中的PAHs,比如菲[37]。也有文献报道,AgNPs(柠檬酸盐包覆)会吸附重金属污染物形成大的配合物,从而降低污染物的生物利用度,并抑制其在水蚤中的生物蓄积性。本研究结果的原因可能是出现了“特洛伊木马效应”,即培养液中的部分芘会被TiO2 NPs所吸附,而吸附过程通过形成NPs-污染物复合物在短时间内(4 h)缓解了污染物在生物体内的进入和运输[38];也有可能是TiO2 NPs的存在破坏了芘进入植物体内的通道,从而抑制了植物根部对芘的吸收。
2.3 大豆根部的脂质过氧化生物体暴露于外部刺激(如污染胁迫)时,会产生过量的活性氧物质(ROS),这可能会扰乱生物体的内在平衡并引起氧化应激反应,导致毒性效应[39-40]。MDA作为脂质过氧化的细胞毒性产物通常被看作是ROS产生与细胞损伤严重程度的衡量指标[41]。暴露于芘、TiO2 NPs、芘+TiO2 NPs的大豆,其根部MDA含量分别高出空白对照317.6%、64.7%、288.2%(图 4)。TiO2 NPs处理与空白对照之间没有显著差异,可以认为TiO2 NPs在该试验条件下对大豆根部没有毒性。但是有芘存在的处理与其他处理之间呈现显著差异,可见芘的存在促进了ROS的产生,说明芘对大豆根部细胞的脂质化破坏程度显著。芘+TiO2 NPs处理增加的MDA含量少于两个单独处理下的增加量之和,可见芘和TiO2 NPs对大豆根部细胞的脂质过氧化有拮抗作用。与芘处理相比,芘+TiO2 NPs处理MDA含量降低,说明TiO2 NPs的存在可能会缓解芘对大豆根部的损伤。试验结果没有显著性差异,可能是试验浓度限制了TiO2 NPs的能力。De La Torre-Roche等[42]发现,大豆根部受DDE暴露时,Ag NPs的添加没有引起MDA含量的增加。而且Ma等[31]通过研究发现TiO2 NPs可以显著减缓水稻根部的氧化应激反应。
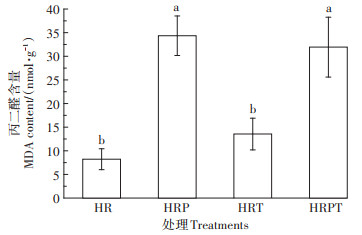
|
图 4 不同处理大豆根部的MDA含量 Figure 4 MDA content in soybean root under different treatments |
植物体内的ROS可以被SOD通过歧化作用转化为过氧化氢(H2O2)和分子氧(O2),这是对过量ROS的第一道防御,也是最重要的抗氧化途径[43]。如图 5,与空白对照(HR)相比,HRP、HRT、HRPT处理大豆根部的SOD酶活性分别降低了87.2、223.7、64.4 U·g-1,可见无论是单独的芘、TiO2 NPs还是芘和TiO2 NPs共存都抑制了SOD的活性。其中TiO2 NPs处理与其他处理间呈现出显著差异,但TiO2 NPs处理的MDA含量与空白对照相比没有显著差异,说明TiO2 NPs有可能是通过提高抗氧化酶活性来保护植物根部的。有研究表明,TiO2 NPs可以增加黄瓜植株内的过氧化氢酶活性[27]。当大豆根部受芘污染时,TiO2 NPs的添加对SOD活力的提高没有显著作用,可能是TiO2 NPs的试验浓度不够高,效果不明显。TiO2 NPs是否可以用来保护植物免受芘的胁迫需要进一步设置系列浓度来探究。
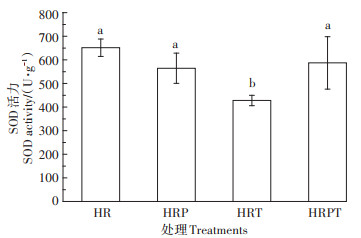
|
图 5 不同处理大豆根部SOD的酶活 Figure 5 SOD activity in soybean root under different treatments |
当植物受到外界胁迫时,体内产生的ROS除了被酶促反应清除以外,也有以GSH为代表的非酶促反应起作用[44]。当ROS诱导产生氧化损伤时,为了保持细胞的正常状态,GSH充当质子供体,清除ROS并被氧化成二硫化物形式[45]。与空白对照相比,TiO2 NPs处理对大豆根部GSH含量没有显著影响,但单独芘处理显著增加了GSH含量(图 6),说明刺激大豆根部产生GSH的程度为芘>TiO2 NPs。有文献报道,烟草受Cd胁迫时,GSH的含量呈增加趋势[44]。Ma等[46]发现Ag NPs会通过增加海甘蓝中GSH的含量来降低植物毒性。虽然芘刺激了大豆根部中GSH的生成,但是单独芘处理下,大豆根部的MDA含量显著增加,说明该试验条件在清除ROS的过程中其他抗氧化物质的能力十分有限。芘+TiO2 NPs同时处理下,其GSH含量与芘处理相比显著降低,可见TiO2 NPs的存在可以明显抑制芘引发大豆根部的非酶促反应,说明对于GSH的生成,两者之间存在拮抗作用。
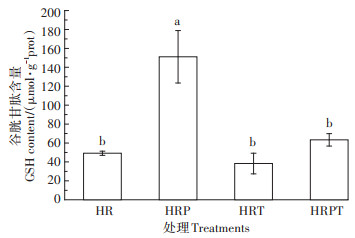
|
图 6 不同处理大豆根部的GSH含量 Figure 6 GSH content in soybean root under different treatments |
大豆根部的钛主要来源于对TiO2 NPs的直接吸收,蒸腾作用并不是大豆吸收PAHs的唯一动力。PAHs会促进植物根部对TiO2 NPs的吸收与累积。但TiO2 NPs的添加使大豆根部芘含量降低了97.1%,说明TiO2 NPs的存在可以显著减少大豆根部对PAHs的吸收与累积。TiO2 NPs在本试验条件下对大豆根部没有毒性,但芘的存在促使了ROS的产生,对大豆根部细胞的脂质化破坏程度显著。TiO2 NPs的存在会缓解芘对大豆根部损伤,抑制大豆根部的SOD活性。芘处理显著刺激了大豆根部GSH的生成,而MDA含量显著增加,可见本试验条件下其他抗氧化物质的能力十分有限。TiO2 NPs的存在可以明显抑制芘引发大豆根部的非酶促反应,两者对GSH的生成存在拮抗作用。
| [1] |
Gan S, Lau E V, Ng H K. Remediation of soils contaminated with polycyclic aromatic hydrocarbons(PAHs)[J]. Journal of Hazardous Materials, 2009, 172(2/3): 532-549. |
| [2] |
Duan L, Naidu R, Thavamani P, et al. Managing long-term polycyclic aromatic hydrocarbon contaminated soils:A risk-based approach[J]. Environmental Science and Pollution Research International, 2015, 22(12): 8927-8941. DOI:10.1007/s11356-013-2270-0 |
| [3] |
Wild S R, Jones K C. Polynuclear aromatic hydrocarbons in the united kingdom environment:A preliminary source inventory and budget[J]. Environmental Pollution, 1995, 88(1): 91-108. DOI:10.1016/0269-7491(95)91052-M |
| [4] |
环境保护, 国土资源部.全国土壤污染状况调查公报(2014年4月17日)[R].环境教育, 2014(6): 8-10. Ministry of Environmental Protection, Ministry of Land and Resources. Bulletin of national survey of soil pollution(April 17, 2014)[J]. Environmental Education, 2014(6):8-10. |
| [5] |
Sun J, Pan L, Tsang D C W, et al. Organic contamination and remediation in the agricultural soils of China:A critical review[J]. Science of the Total Environment, 2018, 615: 724-740. DOI:10.1016/j.scitotenv.2017.09.271 |
| [6] |
Zhan X, Zhu M, Shen Y, et al. Apoplastic and symplastic uptake of phenanthrene in wheat roots[J]. Environmental Pollution, 2018, 233: 331-339. DOI:10.1016/j.envpol.2017.10.056 |
| [7] |
Wang Y C, Qiao M, Liu Y X, et al. Comparison of polycyclic aromatic hydrocarbon uptake pathways and risk assessment of vegetables from waste water irrigated areas in northern China[J]. Journal of Environmental Monitoring, 2011, 13(2): 433-439. DOI:10.1039/C0EM00098A |
| [8] |
Paris A, Ledauphin J, Poinot P, et al. Polycyclic aromatic hydrocarbons in fruits and vegetables:Origin, analysis, and occurrence[J]. Environmental Pollution, 2018, 234: 96-106. DOI:10.1016/j.envpol.2017.11.028 |
| [9] |
Mollea C, Bosco F, Ruggeri B. Fungal biodegradation of naphthalene:Microcosms studies[J]. Chemosphere, 2005, 60(5): 636-643. DOI:10.1016/j.chemosphere.2005.01.034 |
| [10] |
Lead J R, Batley G E, Alvarez P J J, et al. Nanomaterials in the environment:behavior, fate, bioavailability, and effects an updated review[J]. Environmental Toxicology and Chemistry, 2018, 37(8): 2029-2063. DOI:10.1002/etc.4147 |
| [11] |
Peralta-Videa J R, Zhao L, Lopez-Moreno M L, et al. Nanomaterials and the environment:A review for the biennium 2008-2010[J]. Journal of Hazardous Materials, 2011, 186(1): 1-15. DOI:10.1016/j.jhazmat.2010.11.020 |
| [12] |
Roco M C. Environmentally responsible development of nanotechnology[J]. Environmental Science & Technology, 2005, 39(5): 106A-112A. |
| [13] |
Sun T Y, Gottschalk F, Hungerbuhler K, et al. Comprehensive probabilistic modelling of environmental emissions of engineered nanomaterials[J]. Environmental Pollution, 2014, 185: 69-76. DOI:10.1016/j.envpol.2013.10.004 |
| [14] |
Kahru A, Dubourguier H C. From ecotoxicology to nanoecotoxicology[J]. Toxicology, 2010, 269(2/3): 105-119. |
| [15] |
Wu B, Zhu L, Le X C. Metabolomics analysis of TiO2 nanoparticles induced toxicological effects on rice(Oryza sativa L.)[J]. Environmental Pollution, 2017, 230: 302-310. DOI:10.1016/j.envpol.2017.06.062 |
| [16] |
Du W, Gardea-Torresdey J L, Ji R, et al. Physiological and biochemical changes imposed by CeO2 nanoparticles on wheat:A life cycle field study[J]. Environmental Science & Technology, 2015, 49(19): 11884-11893. |
| [17] |
Timmusk S, Seisenbaeva G, Behers L. Titania(TiO2)nanoparticles enhance the performance of growth-promoting rhizobacteria[J]. Scientific Reports, 2018, 8: 617. DOI:10.1038/s41598-017-18939-x |
| [18] |
Rui M, Ma C, White J C, et al. Metal oxide nanoparticles alter peanut (Arachis hypogaea L.)physiological response and reduce nutritional quality:A life cycle study[J]. Environmental Science:Nano, 2018, 5(9): 2088-2102. DOI:10.1039/C8EN00436F |
| [19] |
Wang Y, Jiang F, Ma C, et al. Effect of metal oxide nanoparticles on amino acids in wheat grains(Triticum aestivum L.) in a life cycle study[J]. Journal of Environmental Management, 2019, 241: 319-327. |
| [20] |
Zhang Z, Ke M, Qu Q, et al. Impact of copper nanoparticles and ionic copper exposure on wheat(Triticum aestivum L.)root morphology and antioxidant response[J]. Environmental Pollution, 2018, 239: 689-697. DOI:10.1016/j.envpol.2018.04.066 |
| [21] |
Miralles P, Johnson E, Church T L, et al. Multiwalled carbon nanotubes in alfalfa and wheat:Toxicology and uptake[J]. Journal of the Royal Society, Interface, 2012, 9(77): 3514-3527. DOI:10.1098/rsif.2012.0535 |
| [22] |
Pradhan S, Mailapalli D R. Interaction of engineered nanoparticles with the agri-environment[J]. Journal of Agricultural and Food Chemistry, 2017, 65(38): 8279-8294. DOI:10.1021/acs.jafc.7b02528 |
| [23] |
Liu H, Ma C, Chen G, et al. Titanium dioxide nanoparticles alleviate tetracycline toxicity to Arabidopsis thaliana(L.)[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(4): 3204-3213. |
| [24] |
Wu J, Xie Y, Fang Z, et al. Effects of Ni/Fe bimetallic nanoparticles on phytotoxicity and translocation of polybrominated diphenyl ethers in contaminated soil[J]. Chemosphere, 2016, 162: 235-242. DOI:10.1016/j.chemosphere.2016.07.101 |
| [25] |
De La Torre-Roche R, Hawthorne J, Deng Y, et al. Fullerene enhanced accumulation of p, p'-DDE in agricultural crop species[J]. Environmental Science & Technology, 2012, 46(17): 9315-9323. |
| [26] |
Du W, Sun Y, Ji R, et al. TiO2 and ZnO nanoparticles negatively affect wheat growth and soil enzyme activities in agricultural soil[J]. Journal of Environmental Monitoring, 2011, 13(4): 822-828. DOI:10.1039/c0em00611d |
| [27] |
Servin A D, Morales M I, Castillo-Michel H, et al. Synchrotron verification of TiO2 accumulation in cucumber fruit:A possible pathway of TiO2 nanoparticle transfer from soil into the food chain[J]. Environmental Science & Technology, 2013, 47(20): 11592-11598. |
| [28] |
Yang Q, Shan W, Hu L, et al. Uptake and transformation of silver nanoparticles and ions by rice plants revealed by dual stable isotope tracing[J]. Environmental Science & Technology, 2019, 53(2): 625-633. |
| [29] |
Larue C, Laurette J, Herlin-Boime N, et al. Accumulation, translocation and impact of TiO2 nanoparticles in wheat(Triticum aestivum L.):Influence of diameter and crystal phase[J]. Science of the Total Environment, 2012, 431: 197-208. DOI:10.1016/j.scitotenv.2012.04.073 |
| [30] |
Deng Y, Petersen E J, Challis K E, et al. Multiple method analysis of TiO2 nanoparticle uptake in rice(Oryza sativa L.)plants[J]. Environmental Science & Technology, 2017, 51(18): 10615-10623. |
| [31] |
Ma C, Liu H, Chen G, et al. Effects of titanium oxide nanoparticles on tetracycline accumulation and toxicity in Oryza sativa(L.)[J]. Environmental Science:Nano, 2017, 4(9): 1827-1839. DOI:10.1039/C7EN00280G |
| [32] |
包贞, 潘志彦, 杨晔, 等. 环境中多环芳烃的分布及降解[J]. 浙江工业大学学报, 2003(5): 58-63, 74. BAO Zhen, PAN Zhi-yan, YANG Ye, et al. The distribution and decomposition of PAHs in the environment[J]. Journal of Zhejiang University of Technology, 2003(5): 58-63, 74. |
| [33] |
Dupuy J, Leglize P, Vincent Q, et al. Effect and localization of phenanthrene in maize roots[J]. Chemosphere, 2016, 149: 130-136. DOI:10.1016/j.chemosphere.2016.01.102 |
| [34] |
Chen T B, Zheng Y M, Lei M, et al. Assessment of heavy metal pollution in surface soils of urban parks in Beijing, China[J]. Chemosphere, 2005, 60(4): 542-551. DOI:10.1016/j.chemosphere.2004.12.072 |
| [35] |
Ling W, Zhu L, Gao Y, et al. Root uptake and its prediction model of pahs from soils[J]. Acta Ecologica Sinica, 2005, 25(9): 2320-2325. |
| [36] |
Zhan X, Yi X, Yue L, et al. Cytoplasmic pH-stat during phenanthrene uptake by wheat roots:A mechanistic consideration[J]. Environmental Science & Technology, 2015, 49(10): 6037-6044. |
| [37] |
Tian S, Zhang Y, Song C, et al. Titanium dioxide nanoparticles as carrier facilitate bioaccumulation of phenanthrene in marine bivalve, ark shell(Scapharca subcrenata)[J]. Environmental Pollution, 2014, 192: 59-64. DOI:10.1016/j.envpol.2014.05.010 |
| [38] |
Limbach L K, Wick P, Manser P, et al. Exposure of engineered nanoparticles to human lung epithelial cells:Influence of chemical composition and catalytic activity on oxidative stress[J]. Environmental Science & Technology, 2007, 41(11): 4158-4163. |
| [39] |
Finkel T, Holbrook N J. Oxidants, oxidative stress and the biology of ageing[J]. Nature, 2000, 408(6809): 239-247. DOI:10.1038/35041687 |
| [40] |
Shin S Y, Kim I S, Kim Y H, et al. Scavenging reactive oxygen species by rice dehydroascorbate reductase alleviates oxidative stresses in escherichia coli[J]. Molecules and Cells, 2008, 26(6): 616-620. |
| [41] |
Tripathi B N, Mehta S K, Amar A, et al. Oxidative stress in Scenedesmus sp. during short-and long-term exposure to Cu2+ and Zn2+[J]. Chemosphere, 2006, 62(4): 538-544. DOI:10.1016/j.chemosphere.2005.06.031 |
| [42] |
De La Torre-Roche R, Hawthorne J, Musante C, et al. Impact of Ag nanoparticle exposure on p, p'-DDE bioaccumulation by Cucurbita pepo(zucchini)and Glycine max(soybean)[J]. Environmental Science & Technology, 2013, 47(2): 718-725. |
| [43] |
Sairam R K, Srivastava G C. Changes in antioxidant activity in subcellular fractions of tolerant and susceptible wheat genotypes in response to long term salt stress[J]. Plant Science, 2002, 162(6): 897-904. DOI:10.1016/S0168-9452(02)00037-7 |
| [44] |
Mishra S, Srivastava S, Tripathi R D, et al. Phytochelatin synthesis and response of antioxidants during cadmium stress in Bacopa monnieri L.[J]. Plant Physiology and Biochemistry, 2006, 44(1): 25-37. DOI:10.1016/j.plaphy.2006.01.007 |
| [45] |
Yang J, Cao W, Rui Y. Interactions between nanoparticles and plants:Phytotoxicity and defense mechanisms[J]. Journal of Plant Interactions, 2017, 12(1): 158-169. DOI:10.1080/17429145.2017.1310944 |
| [46] |
Ma C, Chhikara S, Minocha R, et al. Reduced silver nanoparticle phytotoxicity in Crambe abyssinica with enhanced glutathione production by overexpressing bacterial gamma-glutamylcysteine synthase[J]. Environmental Science & Technology, 2015, 49(16): 10117-10126. |
 2020, Vol. 39
2020, Vol. 39


