2. 南京大学环境学院污染控制与资源化研究国家重点实验室, 南京 210023;
3. 生态环境部南京环境科学研究所, 南京 210042;
4. 国家环境保护土壤环境管理与污染控制重点实验室, 南京 210042
2. State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023, China;
3. Nanjing Institute of Environmental Science, Ministry of Ecology and Environment, Nanjing 210042, China;
4. State Environmental Protection Key Laboratory of Soil Environmental Management and Pollution Control, Nanjing 210042, China
我国作为农业生产大国,在农业生产过程中会产生大量农作物秸秆,而农作物秸秆的田间就地焚烧和废弃会造成严重的大气污染和农业面源污染等问题,因此秸秆的安全处置成为农业和环境领域面临的重大问题。目前,秸秆还田、秸秆炭化还田和秸秆制备生物质能是农作物秸秆资源利用的有效途径,农业农村部也将秸秆炭化还田列为秸秆农用的一种模式进行推广[1]。秸秆炭化还田在固碳的同时,能够提升土壤pH,改变土壤微生物群落结构和功能,为植物生长提供氮、磷等营养元素,增加土壤团聚体和持水性,以及减少温室气体排放等,因而在农业领域备受青睐[2]。2014年发布的全国土壤污染状况调查公报指出,我国耕地土壤污染点位超标率达到19.4%,并且主要污染类型为镉、汞、砷等无机重金属污染,因而探讨生物质炭还田对土壤中无机重金属的修复能力也在环境领域引发研究热潮[3]。
在生物质炭用于农田土壤污染修复的过程中,大量研究围绕生物质炭对重金属的吸附固定能力展开[4]。实验室研究表明,生物质炭对镉、汞、铅、锌等重金属阳离子具有很强的吸附固定能力,但是其对砷、磷、硝酸根等无机阴离子的吸附固定能力非常微弱。针对以上问题,近年来也有文献通过在生物质炭表面负载金属或金属氧化物的形式,使其能够固定砷、磷、硝酸根等无机阴离子[5-6]。尽管通过表面改性、表面功能化等方法能够提升生物质炭对阳离子和阴离子型重金属的吸附固定效果,但是在将生物质炭应用于实际农田重金属污染修复过程中,其修复效果却呈现出较大差异[7-10]。在重金属污染农田土壤修复领域中值得注意的是,逐渐有文献报道了土壤中镉和砷等重金属的有效性与土壤氧化还原电位的波动密切相关[11-14],因此有必要在氧化还原的背景下研究生物质炭与土壤重金属的相互作用。
2014年以来,逐渐有研究报道生物质炭具有氧化还原特性[15-16],能够介导土壤中氧化还原过程的电子转移,从而加速碳、氮、铁、锰、硫等元素的生物地球化学循环[17-19]。土壤中铁锰氧化物的氧化还原转化决定了土壤中砷的迁移转化行为[20-21]。我们前期的研究结果发现,生物质炭在加速微生物还原含砷铁矿的过程中,会加剧三价砷[As(Ⅲ)]的释放风险[22]。此外,生物质炭也会加速土壤和沉积物中砷的释放[23-25]。我国南方的水稻主产区面临着严重的稻田土壤砷污染问题,这极大地威胁到稻米质量安全。近年来逐渐有研究尝试将铁负载生物质炭应用于稻田土壤砷污染的修复。稻田土壤砷的迁移转化与土壤氧化还原电位的波动密切相关,而铁负载生物质炭中的含铁矿物和生物质炭均为氧化还原活性物质。稻田土壤砷污染阻控的关键在于水稻淹水期砷的大量释放及植物累积,但是具有氧化还原活性的铁负载生物质炭在稻田淹水期的还原环境中,对砷的固定能力及其稳定性还未得到详尽的评估。基于此,本研究通过制备可以有效固定砷的铁负载生物质炭,构建铁负载生物质炭介导微生物还原含砷铁矿体系和铁负载生物质炭-As(Ⅲ)-铁还原菌还原体系,以评估铁负载生物质炭在还原条件下固定砷的能力及其稳定性。本研究将有助于建立稻田土壤砷污染高效修复材料的筛选方法。
1 材料与方法 1.1 铁负载生物质炭和含As(Ⅲ)水铁矿的制备木屑生物质采集自木材加工厂,将其清洗烘干后,称取200 g加入5.96 g 7水合硫酸亚铁溶液(14.9 g·L-1,400 mL),超声振荡4 h后取出烘干,放入坩埚,在管式炉中氮气条件下高温热解4 h,制备铁负载生物质炭。在热解温度为400、500、600 ℃和700 ℃下制备的铁负载生物质炭分别命名为BC-Fe-400、BC-Fe- 500、BC-Fe-600和BC-Fe-700。将制备的铁负载生物质炭用超纯水清洗、烘干、球磨后装入棕色试剂瓶中备用。铁负载生物质炭的元素组成、比表面积和矿物组成分别通过元素分析仪(VARIO EL Ⅲ,Elementar Inc.,Germany)、比表面积测定仪(Micromeritics,ASAP2020,USA)和X射线电子衍射(XRD,Ultima IV,Rigaku,Japan)进行分析测定。
含As(Ⅲ)的水铁矿[As(Ⅲ)-FH]通过铁盐和碱共沉淀的方法合成:缓慢滴加0.2 mol·L-1的KOH至高速搅拌的Fe(NO3)3(0.2 mol·L-1)和NaAsO2(0.069 4 g·L-1)混合溶液中,中和至pH为7.5。所得到的悬液经过离心清洗后,制备成Fe浓度为0.2 mol·L-1的悬液,装入血清瓶中曝氮气除氧后密封备用。
1.2 铁负载生物质炭在有氧条件下吸附As(Ⅲ)实验铁负载生物质炭吸附As(Ⅲ)实验体系组成为:0.04 mol·L-1的NaClO4电解质溶液,1 g·L-1铁负载生物质炭吸附剂,3 mg·L-1 As(Ⅲ)吸附质。设置不加生物质炭的对照组(CK)和分别加BC-Fe-400、BC-Fe- 500、BC-Fe-600和BC-Fe-700的实验处理组。首先,将45 mL电解质和吸附质混合液加入100 mL三角瓶,调节溶液pH=7,随后取5 mL铁负载生物质炭储备液(10 g·L-1)加至三角瓶启动吸附实验[6]。在设定的时间点取悬液过0.22 μm滤膜,滤液保存于1 mol· L-1的HCl中。As(Ⅲ)浓度通过电感耦合等离子体质谱仪进行分析测定(ICP - MS,PerkinElmer NexION 2000,USA)。
1.3 铁负载生物质炭介导微生物还原含As(Ⅲ)-FH实验厌氧As(Ⅲ)-FH还原实验体系的组成为:模式铁还原菌Shewanella oneidensis MR-1,厌氧矿物质培养基[26],铁负载生物质炭(1 g·L-1),As(Ⅲ)-FH[Fe浓度为10 mmol·L-1,As(Ⅲ)浓度约为2 mg·L-1]。设置5个加微生物的实验组处理(不加生物质炭的CK和分别加BC-Fe-400、BC-Fe-500、BC-Fe-600、BC-Fe- 700的实验组)和5个非生物的对照组处理(不加生物质炭的Abiotic CK和Abiotic BC-Fe-400、Abiotic BCFe-500、Abiotic BC-Fe-600、Abiotic BC-Fe-700)。首先将35 mL厌氧矿物质培养基装入100 mL血清瓶中,曝气除氧、密封、高温灭菌后静置2 d。随后依次加入2 mL As(Ⅲ)-FH储备悬液[Fe浓度为0.2 mol· L-1,As(Ⅲ)浓度约为40 mg·L-1)和2 mL铁负载生物质炭储备悬液(20 g·L-1,已曝气除氧),振荡箱中120 r·min-1、28 ℃培养24 h,在设定时间点(5、10、22、32、46、58、82、122、170、242、310、382、454、526、646 h)用注射器分别在厌氧手套箱里和常规有氧环境中取约0.1 mL悬液样品和滤液样品,并分别保存于0.9 mL的1 mol·L-1无氧HCl溶液和常规HCl溶液中,用于检测铁负载生物质炭对As(Ⅲ)-FH的化学还原作用及对As(Ⅲ)-FH中As(Ⅲ)释放的影响。在24 h时,接种1 mL的S. oneidensis MR-1悬液(在LB培养基中培养16 h后收集菌体,清洗后重悬于血清瓶中,曝气除氧后备用)启动铁负载生物质炭介导微生物还原As(Ⅲ)-FH实验,选择固定的时间点取样分析悬液和上清液中Fe的形态含量及上清液中As(Ⅲ)的浓度。其中As(Ⅲ)的浓度通过ICP-MS分析,Fe(Ⅱ)和Fe(Ⅲ)用邻菲啰啉比色法检测。反应终止时收集固相沉淀样品,冻干后用于XRD分析。
1.4 微生物还原铁负载生物质炭实验微生物还原铁负载生物质炭实验体系的组成为:铁还原菌S. oneidensis MR-1,厌氧矿物质培养基,铁负载生物质炭(1 g·L-1),溶解态As(Ⅲ)(约2.5 mg· L-1)。共设置5个实验处理组,CK和BC-Fe-400、BCFe-500、BC-Fe-600、BC-Fe-700。首先将35 mL厌氧矿物质培养基装入100 mL血清瓶中,曝气除氧、密封、高温灭菌后静置2 d。随后依次加入2 mL的溶解态As(Ⅲ)储备悬液(约50 mg·L-1)和2 mL铁负载生物质炭储备悬液(20 g·L-1,已曝气除氧),振荡箱中120 r·min-1、28 ℃培养18 h,分别在6 h和18 h取厌氧悬液样品和上清液样品保存于1 mol·L-1的无氧HCl和常规HCl溶液中。在18 h时接种1 mL的S. oneidensis MR-1悬液启动微生物还原铁负载生物质炭实验,设定时间点取样监测悬液和上清液中Fe的形态含量及上清液中As(Ⅲ)的浓度。反应终止时收集固相沉淀样品,冻干后用于XRD分析。
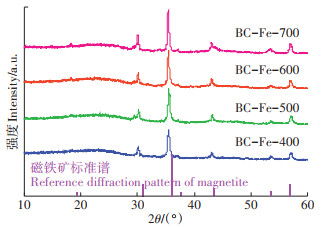
2 结果与分析 2.1 铁负载生物质炭的基本性质及其As(Ⅲ)吸附能力BC-Fe-400、BC-Fe-500、BC-Fe-600和BC-Fe- 700四种生物质炭的铁含量分别为6.0%、5.5%、5.8%和8.9%(表 1)。随着热解温度的升高,铁负载生物质炭中C、H和O的含量基本维持稳定,表明有铁存在时,木屑中的组分在400 ℃经过4 h即可以被完全转化为稳定的碳形态。当温度从400 ℃升到700 ℃时,生物质炭的比表面积从457 m2·g-1降至183 m2·g-1,一方面是由于温度升高导致生物质炭中的孔结构坍塌,另一方面是因为生成的含铁矿物包裹在生物质炭表面堵塞了孔道[27]。XRD分析结果表明(图 1),4种铁负载生物质炭中铁的形态均为晶型较为稳定的磁铁矿。随着热解温度的提升,磁铁矿的谱峰强度逐渐增强,晶型也更为稳定;对于磁铁矿在30.1°处的主峰,由Scherrer公式计算得到的晶体大小依次为19.6、21.5、22.7、24.3 nm。
|
|
表 1 铁负载生物质炭中各元素的含量及其比表面积 Table 1 Elemental composition and specific surface area of iron-loaded biochar |
|
图 1 铁负载生物质炭的X射线衍射谱图(XRD) Figure 1 X-ray diffraction patterns of iron-loaded biochars |
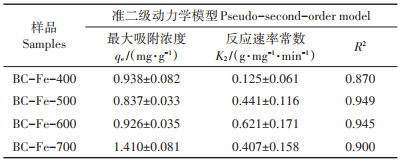
如图 2和表 2所示,4种温度下制备的铁负载生物质炭均可有效吸附水溶液中的As(Ⅲ),准二级动力学拟合[y=a2b(1+abx)]结果表明,BC-Fe-700对As(Ⅲ)的最大吸附量为1.410 mg·g-1,显著高于BCFe-400、BC-Fe-500和BC-Fe-600(0.837~0.938 mg· g-1),这与BC-Fe-700具有更高的铁含量一致。此外,BC-Fe-400吸附As(Ⅲ)的速率常数K2(0.125 g· mg-1·min-1)远低于BC-Fe-500、BC-Fe-600和BCFe-700(0.407~0.421 g·mg-1·min-1)。对于BC-Fe-400和BC-Fe-600,尽管磁铁矿负载量相近,但是比表面积更大的BC-Fe-400对As(Ⅲ)的吸附速度反而更慢。同一铁矿物中Fe(Ⅱ)和Fe(Ⅲ)含量的差别虽然不会影响XRD谱图中的谱峰,但是会明显改变铁矿物对As(Ⅲ)的吸附能力[28]。因而,BC-Fe-400和BCFe-600吸附As(Ⅲ)的速率呈现较大差别的原因可能是不同温度制备的铁负载生物质炭中磁铁矿的晶体大小和晶型存在差异。

|
图 2 铁负载生物质炭对As(Ⅲ)的吸附动力学曲线 Figure 2 Adsorption kinetic for As(Ⅲ)on iron-loaded biochar |
|
|
表 2 铁负载生物质炭吸附As(Ⅲ)的准二级动力学拟合参数 Table 2 Best-fit parameter values for second-order model of kinetic data |
在铁负载生物质炭介导微生物还原含As(Ⅲ)水铁矿的培养体系中,与不加铁负载生物质炭的CK组相比,铁负载生物质炭加速了含As(Ⅲ)水铁矿的还原,经过170 h即可将体系中1 mol·L-1盐酸溶解态Fe(Ⅲ)全部还原为Fe(Ⅱ),而CK组中的Fe(Ⅲ)526 h后才完全还原(图 3A)。在生物质炭介导微生物还原含As(Ⅲ)水铁矿的过程中,生物质炭作为电子穿梭体,一方面接收微生物代谢产生的电子被还原,另一方面释放电子使铁矿被氧化,并且以上电子的得失过程不断循环往复[17, 22]。生物质炭中导电石墨片层对电子输入存储和输出释放的电子传导过程,及醌/酚类官能团被微生物还原后的得电子能力,使其获得氧化还原特性[16]。并且生物质炭的电子穿梭效率与其氧化还原特性正相关[17]。铁负载生物质炭的制备温度越高,加速微生物还原铁矿的能力越强,表明铁负载生物质炭的氧化还原特性随热解温度的增加而增强。含As(Ⅲ)水铁矿的还原使得Fe2+释放至溶液中,铁负载生物质炭促进Fe2+释放达到最大值,随后也促进其从溶液中去除,并且铁负载生物质炭的制备温度越高,促进作用越显著(图 3B)。这是由于Fe2+与溶液中的磷酸根和碳酸根发生沉淀作用并生成次生矿物,Fe2+的生成速度越快,次生矿物的沉淀速度也越快。由图 3C可以看出,在0~400 h之间,尽管铁负载生物质炭具有砷固定能力,但是铁负载生物质炭在加速铁还原的同时,加速了水铁矿中As(Ⅲ)的释放。随着培养时间的进一步延长,加入铁负载生物质炭的培养体系中As(Ⅲ)的浓度均低于CK组,表现为促进As(Ⅲ)的固定。在646 h时,CK组中As(Ⅲ)的释放浓度为1.20 mg·L-1,而加入BC-Fe-400、BC-Fe-500、BC-Fe-600和BC-Fe-700的培养体系中释放的As(Ⅲ)浓度均低于CK组,分别为0.989、0.975、0.899 mg·L-1和0.524 mg·L-1。BC-Fe-700固定As(Ⅲ)的能力显著高于另外3种铁负载生物质炭,并且454~646 h,加入BCFe-700的体系溶液中As(Ⅲ)的浓度逐渐降低,这可能是由于生物质炭中负载的磁铁矿较难被微生物还原,从而可以逐步固定水溶液中的As(Ⅲ)。

|
图 3 铁负载生物质炭介导Shewanella oneidensis MR-1还原含As(Ⅲ)水铁矿还原过程中铁的还原率、上清液中Fe2+和As(Ⅲ)的浓度 Figure 3 The percentage of reduced Fe(Ⅱ), and the concentration of released Fe2+ and As(Ⅲ)in supernatant during iron-loaded biochar mediated Shewanella oneidensis MR-1 reduction of arsenite-bearing ferrihydrite |
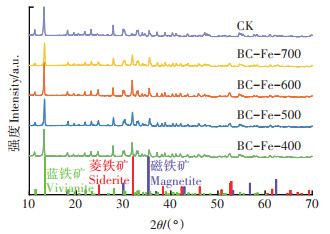
水铁矿还原释放的Fe(Ⅱ)会与培养液中的阴离子发生反应生成次生矿物。经过646 h的还原作用,CK组中生成了大量蓝铁矿[Fe3(PO4)2]和少量菱铁矿(FeCO3)(图 4)。对于蓝铁矿和菱铁矿这两种矿物,它们的logKsp分别为-36和-10.9[29-30],因此在反应体系中先生成蓝铁矿,后生成菱铁矿,这与已有的研究结果一致[22]。在加入了铁负载生物质炭的培养体系中,同样检测到了蓝铁矿和菱铁矿,其中蓝铁矿的谱峰强度均低于CK组,而菱铁矿的谱峰强度均高于CK组,这可能是由于铁负载生物质炭中磁铁矿吸附了体系中的部分磷酸根,阻碍了蓝铁矿的生成,进而促进菱铁矿的生成。此外,对于磁铁矿而言,其位于35.4°的主峰与蓝铁矿的谱峰位置重合,而其非主峰对应的谱峰强度均较弱,但是通过对比不同处理组中蓝铁矿各谱峰的相对强度可以推断出,加入铁负载生物质炭的培养体系中仍有磁铁矿存在。以上结果说明铁负载生物质炭介导微生物还原含As(Ⅲ)水铁矿的过程中未将生物质炭上负载的磁铁矿完全还原,这与反应终止时加入铁负载生物质炭的培养体系中As(Ⅲ)浓度低于CK组一致。虽然体系中仍然存在磁铁矿,但是加入铁负载生物质炭的培养体系中铁矿的还原比例在170 h即达到100%,这是由于在铁还原体系中Fe(Ⅱ)的检测过程中,用1 mol·L-1的HCl可以有效溶解体系中水铁矿、蓝铁矿和菱铁矿,却不能溶解结晶程度较高的磁铁矿[31]。此外,尽管培养体系中残留的磁铁矿依然可以固定As(Ⅲ),但其固定As(Ⅲ)的量为0.211~0.676 mg·g-(1相对于未加铁负载生物质炭的对照组),远低于好氧条件下铁负载生物质炭的As(Ⅲ)固定能力(0.837~1.410 mg·g-1),这可能与铁负载生物质炭中磁铁矿的还原溶解有关,因此还需进一步评估铁负载生物质炭在还原环境中的稳定性。
|
图 4 铁负载生物质炭介导微生物还原含砷水铁矿生成的次生矿物的X射线衍射谱图 Figure 4 X-ray diffraction patterns of biogenic secondary minerals precipitated during iron-loaded biochar mediated Shewanella oneidensis MR-1 reduction of arsenite-bearing ferrihydrite |
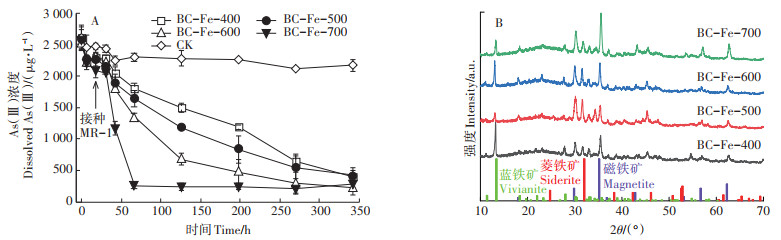
在铁还原菌S. oneidensis MR-1模拟的还原环境中:在0 h加入铁负载生物质炭后,6 h内可以快速吸附溶液中的As(Ⅲ),并在18 h内维持稳定;当在18 h接种S. oneidensis MR-1时,在18~30 h溶液中As(Ⅲ)的浓度基本维持不变;随着培养时间的进一步增加,4种铁负载生物质炭均可以进一步吸附固定As(Ⅲ),并且其热解温度越高,对As(Ⅲ)的吸附固定速度越快,到342 h时,体系中As(Ⅲ)的浓度均低于421 μg· L-1,并达到稳定状态,远低于CK组中溶解态As(Ⅲ)的浓度(图 5A)。由于S. oneidensis MR-1不具有转化As(Ⅲ)的能力[30],而Fe(Ⅲ)矿氧化砷通常需要光照或氧气参与反应[32-33],而本反应在厌氧避光的条件下进行,因而微生物还原铁负载生物质炭的过程中,对溶液中As(Ⅲ)吸附量增加的原因可能与铁负载生物质炭中磁铁矿的还原转化有关。反应终止时固体样品的XRD谱图结果表明,铁负载生物质炭中的部分磁铁矿被还原生成蓝铁矿和菱铁矿(图 5B)。尽管生成的蓝铁矿和菱铁矿不能固定As(Ⅲ)[22],但是Fe(Ⅲ)矿物和混合价态铁矿物均可以固定As(Ⅲ)[34]。Fe(Ⅲ)矿和混合价态铁矿都具有As(Ⅲ)的吸附固定能力,Wang等[28]发现纤铁矿在发生部分还原反应后,对As(Ⅲ)的吸附固定能力变得更强,因而当磁铁矿中的部分Fe(Ⅲ)发生还原转化时,尽管XRD分析结果仍然为磁铁矿,但是其中Fe(Ⅱ)和Fe(Ⅲ)的比例已经发生明显变化,其结构的细微变化可能使其具有更强的As(Ⅲ)吸附能力。在S. oneidensis MR-1模拟的还原环境中,经过342 h的培养,铁负载生物质炭对As(Ⅲ)的吸附量(2.16~2.29 mg·g-1)远高于好氧条件下的吸附量(0.94~1.63 mg·g-1)。但是在铁负载生物质炭介导微生物还原含As(Ⅲ)水铁矿的实验体系中,反应终止时As(Ⅲ)的固定能力(0.211~0.676 mg·g-1)却低于好氧条件的固定能力。铁负载生物质炭介导微生物还原含As(Ⅲ)水铁矿实验体系的培养周期为646 h,而S. oneidensis MR-1还原铁负载生物质炭实验体系的培养周期为342 h,并且XRD谱图中后一培养体系中磁铁矿的谱峰较前一体系更为明显。因此,磁铁矿固定As(Ⅲ)的能力可能随着还原程度的增加而改变:在还原时间较短及磁铁矿还原程度较低时,其对As(Ⅲ)的固定能力增加;随着还原时间的延长及磁铁矿还原程度的进一步增加,其对As(Ⅲ)的吸附固定能力逐渐减弱。
|
图 5 Shewanella oneidensis MR-1还原铁负载生物质炭体系中As(Ⅲ)的固定和还原产物的矿物组成 Figure 5 The concentration of As(Ⅲ)supernatant and the mineralogical composition of bio-reduced solid during Shewanella oneidensis MR-1 reduction of iron-loaded biochar |
铁负载生物质炭由于对As(Ⅲ)有较好的吸附固定效果,近年来逐渐受到关注,并尝试将其应用于稻田土壤砷污染修复。如图 6所示,本研究在铁负载生物质炭吸附As(Ⅲ)的基础上,首先构建了铁负载生物质炭介导微生物还原含As(Ⅲ)水铁矿的体系,探讨了铁负载生物质炭的氧化还原特性对还原条件下固定有As(Ⅲ)的Fe(Ⅲ)矿物的还原溶解及其中As(Ⅲ)释放的影响,同时也论证了这一过程中铁负载生物质炭对释放As(Ⅲ)的吸附固定能力;其次建立了铁还原菌直接还原铁负载生物质炭体系,评估铁还原菌对铁负载生物质炭中磁铁矿的还原转化能力,以及在这一过程中铁负载生物质炭对溶液中As(Ⅲ)的吸附固定能力。

|
图 6 铁还原环境中铁负载生物质炭固定As(Ⅲ)的能力及稳定性评估示意图 Figure 6 Schematic illustration of As(Ⅲ)immobilization capacity and stability of iron-loaded biochar under iron-reducing environment |
在稻田土壤中,随着淹水时间的增加,土壤界面的氧化还原电位不断降低,锰还原、硝酸盐还原、铁还原、硫酸盐还原和产甲烷等生态位会依次出现。本研究仅模拟了稻田土壤铁还原这一生态位,用以评估铁负载生物质炭用于稻田土壤砷污染修复的潜能。基于本研究的结果,铁还原菌的还原作用会影响铁负载生物质炭自身的稳定及其固定As(Ⅲ)的稳定性,因而铁负载生物质炭不宜作为稻田土壤砷污染的长效钝化剂使用,但可以利用其短期内固定砷效率较高的优点,结合稻田水肥管理措施、土壤砷释放和水稻砷累积的规律,在短期内施加用于吸附固定土壤中的砷并阻控砷在水稻中的累积。本研究中的实验方法可用于实验室快速筛选稻田土壤砷污染修复材料。此外,在实际淹水稻田中,砷的形态多种多样,不仅只有铁还原过程会加速无机As(Ⅲ)的释放,硫还原过程和产甲烷过程也会影响砷的巯基化和甲基化等过程。因此,后续还需要在实际稻田土壤复杂生态位下,评估砷污染修复材料的稳定性。
4 结论(1)在好氧条件下,400~700 ℃高温热解含铁生物质制备得到的磁铁矿负载生物质炭吸附As(Ⅲ)的量为0.94~1.63 mg·g-1。
(2)在铁还原菌存在的厌氧条件下,磁铁矿负载生物质炭可以加速微生物还原含As(Ⅲ)水铁矿,导致As(Ⅲ)的释放。短期厌氧培养,磁铁矿的部分还原使磁铁矿负载生物质炭对As(Ⅲ)的吸附固定量增加到2.16~2.29 mg·g-1;长期厌氧培养,磁铁矿负载生物质炭对As(Ⅲ)的固定量降低到0.211~0.676 mg·g-1。
| [1] |
中华人民共和国农业农村部.农业部办公厅推介发布秸秆农用十大模式[R].北京: 中华人民共和国农业农村部, 2017. Ministry of Agriculture and Rural Affairs of PRC. The General Office of the Ministry of Agriculture and Rural Affairs promote the release of ten modes for agricultural applications of straw[R]. Beijing: Ministry of Agriculture and Rural Affairs of PRC, 2017. |
| [2] |
Woolf D, Lehmann J, Cowie A, et al. Biochar for climate change mitigation: Navigating from science to evidence-based policy[M]//Soil and Climate. CRC Press, 2018: 219-248.
|
| [3] |
Wu P, Ata-Ul-Karim S, Singh B, et al. A scientometric review of biochar research in the past 20 years(1998-2018)[J]. Biochar, 2019, 1(1): 23-43. DOI:10.1007/s42773-019-00002-9 |
| [4] |
Yu H, Zou W, Chen J, et al. Biochar amendment improves crop production in problem soils:A review[J]. Journal of Environmental Management, 2019, 232: 8-21. |
| [5] |
Zhu X, Liu Y, Qian F, et al. Carbon transmission of CO2 activated nano-MgO carbon composites enhances phosphate immobilization[J]. Journal of Materials Chemistry A, 2018, 6(8): 3705-3713. DOI:10.1039/C7TA10405G |
| [6] |
Wang S, Gao B, Zimmerman A, et al. Removal of arsenic by magnetic biochar prepared from pinewood and natural hematite[J]. Bioresource Technology, 2015, 175: 391-395. DOI:10.1016/j.biortech.2014.10.104 |
| [7] |
Palansooriya K, Shaheen S, Chen S, et al. Soil amendments for immobilization of potentially toxic elements in contaminated soils:A critical review[J]. Environment International, 2020, 134: 105046. DOI:10.1016/j.envint.2019.105046 |
| [8] |
杜艳艳, 王欣, 谢伟城, 等. 负载铁生物炭对土壤-水稻系统As溶出特性与生物有效性的影响与机理解析[J]. 环境科学学报, 2017, 37(8): 3158-3168. DU Yan-yan, WANG Xin, XIE Wei-cheng, et al. Effects and mechanisms of Fe-impregnated biochar on arsenic solubility and bioavailability in soil-rice system[J]. Acta Scientiae Circumstantiae, 2017, 37(8): 3158-3168. |
| [9] |
Yin D, Wang X, Peng B, et al. Effect of biochar and Fe-biochar on Cd and As mobility and transfer in soil-rice system[J]. Chemosphere, 2017, 186: 928-937. DOI:10.1016/j.chemosphere.2017.07.126 |
| [10] |
Lin L, Li Z, Liu X, et al. Effects of Fe-Mn modified biochar composite treatment on the properties of As-polluted paddy soil[J]. Environmental Pollution, 2019, 244: 600-607. DOI:10.1016/j.envpol.2018.10.011 |
| [11] |
Wang J, Wang P, Gu Y, et al. Iron-manganese(oxyhydro) oxides, rather than oxidation of sulfides, determine the mobilization of Cd during soil drainage in paddy soil systems[J]. Environmental Science & Technology, 2019, 53(5): 2500-2508. |
| [12] |
Fulda B, Voegelin A, Kretzschmar R. Redox-controlled changes in cadmium solubility and solid-phase speciation in a paddy soil As affected by reducible sulfate and copper[J]. Environmental Science & Technology, 2013, 47(22): 12775-12783. |
| [13] |
Kumarathilaka P, Seneweera S, Meharg A, et al. Arsenic speciation dynamics in paddy rice soil-water environment:sources, physicochemical, and biological factors:A review[J]. Water Research, 2018, 140: 403-414. DOI:10.1016/j.watres.2018.04.034 |
| [14] |
Roberts L, Hug S, Dittmar J, et al. Arsenic release from paddy soils during monsoon flooding[J]. Nature Geoscience, 2009, 3(1): 53-59. |
| [15] |
Klüpfel L, Keiluweit M, Kleber M, et al. Redox properties of plant biomass-derived black carbon(biochar)[J]. Environmental Science & Technology, 2014, 48(10): 5601-5611. |
| [16] |
Sun T, Levin B, Guzman J, et al. Rapid electron transfer by the carbon matrix in natural pyrogenic carbon[J]. Nature Communications, 2017, 8: 14873. DOI:10.1038/ncomms14873 |
| [17] |
Wu S, Fang G, Wang Y, et al. Redox-active oxygen-containing functional groups in activated carbon facilitate microbial reduction of ferrihydrite[J]. Environmental Science & Technology, 2017, 51(17): 9709-9717. |
| [18] |
Saquing J M, Yu Y, Chiu P C. Wood-derived black carbon(biochar) as a microbial electron donor and acceptor[J]. Environmental Science & Technology Letters, 2016, 3(2): 62-66. |
| [19] |
Zhang X, Xia J, Pu J, et al. Biochar-mediated anaerobic oxidation of methane[J]. Environmental Science & Technology, 2019, 53(12): 6660-6668. |
| [20] |
Fendorf S, Michael H, van Geen A. Spatial and temporal variations of groundwater arsenic in South and Southeast Asia[J]. Science, 2010, 328(5982): 1123-1127. DOI:10.1126/science.1172974 |
| [21] |
Yu H, Li F, Liu C, et al. Iron redox cycling coupled to transformation and immobilization of heavy metals: Implications for paddy rice safety in the red soil of south China[M]//Advances in Agronomy. Academic Press, 2016: 279-317.
|
| [22] |
Wu S, Fang G, Wang D, et al. Fate of As(Ⅲ)and As(Ⅴ)during microbial reduction of arsenic-bearing ferrihydrite facilitated by activated carbon[J]. ACS Earth and Space Chemistry, 2018, 2(9): 878-887. DOI:10.1021/acsearthspacechem.8b00058 |
| [23] |
Wang N, Xue X, Juhasz A, et al. Biochar increases arsenic release from an anaerobic paddy soil due to enhanced microbial reduction of iron and arsenic[J]. Environmental Pollution, 2017, 220: 514-522. DOI:10.1016/j.envpol.2016.09.095 |
| [24] |
Chen Z, Wang Y, Xia D, et al. Enhanced bioreduction of iron and arsenic in sediment by biochar amendment influencing microbial community composition and dissolved organic matter content and composition[J]. Journal of Hazardous Materials, 2016, 311: 20-29. DOI:10.1016/j.jhazmat.2016.02.069 |
| [25] |
Qiao J, Li X, Hu M, et al. Transcriptional activity of arsenic-reducing bacteria and genes regulated by lactate and biochar during arsenic transformation in flooded paddy soil[J]. Environmental Science & Technology, 2018, 52(1): 61-70. |
| [26] |
吴松, 袁贝嘉, 闫慧珺, 等. 两种典型炭材料对微生物还原含砷水铁矿的影响及其机制研究[J]. 农业环境科学学学报, 2018, 37(7): 1370-1376. WU Song, YUAN Bei-jia, YAN Hui-jun, et al. Mechanism of two representative carbonaceous materials impact on microbial reduction of arsenic-bearing ferrihydrite[J]. Journal of Agro-Environment Science, 2018, 37(7): 1370-1376. |
| [27] |
Zhu X, Liu Y, Zhou C, et al. Novel and high-performance magnetic carbon composite prepared from waste hydrochar for dye removal[J]. ACS Sustainable Chemistry & Engineering, 2014, 2(4): 969-977. |
| [28] |
Wang Y, Morin G, Ona-Nguema G, et al. Arsenic(Ⅲ)and arsenic (Ⅴ)speciation during transformation of lepidocrocite to magnetite[J]. Environmental Science & Technology, 2014, 48(24): 14282-14290. |
| [29] |
Rothe M, Kleeberg A, Hupfer M. The occurrence, identification and environmental relevance of vivianite in waterlogged soils and aquatic sediments[J]. Earth-Science Reviews, 2016, 158: 51-64. DOI:10.1016/j.earscirev.2016.04.008 |
| [30] |
Muehe E M, Scheer L, Daus B, et al. Fate of arsenic during microbial reduction of biogenic versus abiogenic As-Fe (Ⅲ) -mineral coprecipitates[J]. Environmental Science & Technology, 2013, 47(15): 8297-8307. |
| [31] |
Porsch K, Kappler A. Fe Ⅱ oxidation by molecular O2 during HCl extraction[J]. Environmental Chemistry, 2011, 8(2): 190-197. DOI:10.1071/EN10125 |
| [32] |
Bhandari N, Reeder R, Strongin D. Photoinduced oxidation of arsenite to arsenate on ferrihydrite[J]. Environmental Science & Technology, 2011, 45(7): 2783-2789. |
| [33] |
Bhandari N, Reeder R, Strongin D. Photoinduced oxidation of arsenite to arsenate in the presence of goethite[J]. Environmental Science & Technology, 2012, 46(15): 8044-8051. |
| [34] |
Ona-Nguema G, Morin G, Juillot F, et al. EXAFS analysis of arsenite adsorption onto two-line ferrihydrite, hematite, goethite, and lepidocrocite[J]. Environmental Science & Technology, 2005, 39(23): 9147-9155. |
 2020, Vol. 39
2020, Vol. 39