2. 浙江省生物炭工程技术研究中心, 杭州 310021;
3. 浙江工业大学环境学院, 杭州 310014
2. Zhejiang Engineering Research Center of Biochar, Hangzhou 310021, China;
3. College of Environmental Sciences, Zhejiang University of Technology, Hangzhou 310014, China
茶叶是我国重要的经济作物,到2018年底我国茶叶种植面积约298.6万hm2,占世界茶园总量的47%[1]。茶树为喜酸性植物,最适宜生长pH为4.0~6.5,长期的茶树种植和大量的氮肥添加加剧了茶园土壤的酸化。张倩等[2]于2008—2010年对江苏省21个典型茶场定位监测发现,42.8%的茶园土壤pH低于4.0。在生产管理中常采取一定的措施来中和土壤酸性,使之更适宜茶树生长,如增施有机肥、适量施用石灰等。茶叶生产中偏施氮肥的现象日益严重,在一些茶叶主产区,氮肥的施用量高达740 kg·hm-2,但茶园平均氮素利用率仅为30%左右,高量的氮肥施入导致土壤留存较高的NH4+和NO3-,这些形态的氮大部分可通过硝化和反硝化作用以N2O的形式排放到环境中。研究发现,稻田和其他作物土壤的N2O排放系数分别为0.31%和0.62%,而茶园土壤的N2O排放系数高达2.90%[3]。因此,采取有效措施以减缓茶园土壤进一步酸化和降低温室气体排放是保障茶园可持续发展所面临的重要课题。
近几年来,生物质炭(Biochar,BC)作为一种新型的土壤改良剂在农业上得到了广泛重视。生物质炭是有机物原料在完全或者部分缺氧条件下,经过高温热解(通常 < 700 ℃)产生的一类难溶、富碳、高度芳香化和高稳定性的有机物质。根据生物质材料的来源,生物质炭可以分为木炭、竹炭、秸秆炭、稻壳炭、动物粪便炭等[4]。生物质炭的多孔特性和高的比表面积有利于土壤聚集水分、提高孔隙度、降低容重,并且对环境介质中的有机污染物有超强的吸附能力,从而可为植物生长提供良好的环境;其含有的养分元素可直接输入土壤,其表面电荷和官能团也有利于土壤养分的保留。因此,分布在热带亚热带地区的强酸性土壤是生物质炭改良修复的主要对象[5]。陈玉真等[6]研究发现添加生物质炭可提高茶园酸性红壤和黄壤pH高达1.20个和1.34个单位;然而,土壤pH的增加一般会伴随较强的硝化作用,茶树喜铵厌硝,易于吸收铵态氮,硝化过程不利于茶园对氮的吸收[7]。Dai等[8]发现生物质炭能够显著提高土壤pH并促进土壤的硝化作用,且两者之间有显著的正相关关系(r=0.98,P < 0.05)。Ball等[9]研究发现,施入生物质炭能够增加酸性土壤中氨氧化细菌的丰度,进而提高土壤硝化速率。崔静雅[10]发现施入10%BC的茶园土壤净硝化速率显著小于未施加BC的对照处理(P < 0.05),这可能是大量生物质炭释放出的ɑ松萜抑制了硝化作用所致;施入1%BC、2%BC、5%BC的茶园土壤净硝化速率与对照处理并无显著差异,这可能是由于pH改变对硝化的促进作用与释放出ɑ松萜的抑制作用相抵消引起的。因此,生物质炭对土壤硝化作用的影响可能与生物质炭的制备原料、热解温度和土壤性质有关,开展生物质炭对茶园土壤硝化特征的研究将有助于我们采取针对性的措施控制茶园土壤硝化和酸化。
N2O是主要的温室气体之一,能破坏大气平流层中的臭氧层,对人类生存环境产生重要影响。土壤N2O产生的生物源主要来自于土壤微生物推动的硝化作用和反硝化作用[11]。生物质炭的多孔隙结构是土壤微生物良好的栖息环境,而且可以导致土壤孔隙率增加,同时增加土壤氧气含量,这可能会抑制厌氧反硝化过程及N2O和N2的排放[12];也有报道指出生物质炭对N2O的产生没有任何影响;而Bruun等[13]研究表明,土壤中添加生物质炭,CO2和N2O排放量都明显提高。不同结果之间的差异,可能与生物质炭的施加量、施加年限及土壤性质有关。作为土壤环境中最活跃的有机组分之一,土壤酶来源于土壤中动植物和微生物细胞的分泌物及残体分解物,其中微生物是主要来源。生物质炭对土壤酶活性的影响不尽相同,据报道,施加小麦秸秆生物质炭可以提高茶园土壤微生物的数量,增强β-葡萄糖苷酶、脲酶和碱性磷酸酶活性[14];树枝条生物质炭可以提高壤土和砂土中与N、P循环相关的酶活性,却降低壤土中与C循环有关的酶活性[15]。但其具体的作用机制和途径还有待进一步深入研究。
我国养猪业迅速发展伴随的环境污染问题,给我国农业固体废弃物处置和环境保护带来了巨大挑战,猪粪资源化利用途径迫在眉睫。利用慢速热裂解畜禽粪便制备生物质炭,既可保留其含有的多种营养元素,也可消除粪便中的病菌、寄生虫等,是当前规模化养猪场彻底消除粪污污染和实现畜禽粪便无害化利用的重要途径[16]。因此,本文利用室内好气培养试验,研究猪粪高温裂解产生的猪粪炭对茶园土壤的硝化作用、N2O排放和土壤酶活性的影响,旨在为生物质炭在茶园土壤改良中的应用及应对环境效应研究提供科学依据。
1 材料与方法 1.1 材料试验供试土壤采自浙江名茶产区安吉市的黄茶茶园基地(30°40′ N,119°33′ E),此区属中亚热带季风气候区,年均气温15 ℃,年均降雨量1 500 mm。样地具体情况:坡度30~35 ℃,坡向为阳坡,海拔65.9 m。种植年限约15 a,施肥以化肥-有机肥为主,其他茶园管理措施正常。按照“S”型多点混合采集0~20 cm表层土壤,将新鲜土样充分混匀后,一部分装入无菌自封袋,储存于4 ℃冰箱中;另一部分室内自然风干供土壤基本化学性质测定。土壤基本理化性质:有机质10.23 g·kg-1,全氮9.20 g·kg-1,速效磷3.91 mg·kg-1,速效钾142.30 mg·kg-1,pH 4.03,土壤容重1.13 g·cm-3。生物质炭以猪粪炭为原材料,在550 ℃下厌氧烧制而成。猪粪炭的主要理化性状:有机碳360.0 g·kg-1,全氮23.8 g·kg-1,全磷12.1 g·kg-1,全钾24.3 g·kg-1,pH 8.6。
1.2 试验方法 1.2.1 硝化潜力研究试验供试土壤的硝化活性采用35 d的好气培养、破坏性取样方法测定。试验设置4个处理,每个处理3个重复:(1)硫酸铵(CK+N);(2)硫酸铵+1%猪粪炭(低量生物质炭,BC1+N);(3)硫酸铵+2%猪粪炭(中量生物质炭,BC2+N);(4)硫酸铵+5%猪粪炭(高量生物质炭,BC5+N)。施氮量为110 mg N·kg-1,相当于大田施肥250 kg N · hm-2(按每公顷20 cm深土壤质量为2.25×106 kg计算)。具体试验:称取15 g(烘干基质量)风干土样置于250 mL三角瓶中,用去离子水调节至土壤最大持水量(WHC)的40%,具塞,30 ℃恒温预培养1周,以稳定及活化土壤中的微生物。预培养结束后,向培养瓶内均匀加入0.5 mL一定浓度的(NH4)2SO4溶液,再用去离子水调节含水量至60% WHC。之后,所有培养瓶盖上封口膜,并用针孔均匀扎5个孔,保证通气。继续在30 ℃恒温培养箱黑暗培养,每隔2~3 d补足挥发的水分,以保证瓶内的水分不发生变化。在培养的第0、1、7、15、21、27、35 d分别取每个处理的3个重复,按照5:1水土比加入2 mol· L-1的KCl溶液(已加水量考虑在内),在25 ℃、250 r· min-1恒温振荡1 h,定量滤纸过滤,收集滤液于塑料瓶中,用于测定土壤pH及NH4+、NO3-的浓度[17]。若样品不能及时测定,于4 ℃下冷藏,一周内完成测定。NH4+、NO3-的浓度用Skalar连续连动分析仪(Skalar SAN,Netherlands)测定。
1.2.2 N2O的采集与测定分别在加入氮肥溶液后的第1、3、5、9、11、14、17、21 d和35 d采集气体样品。每次采气前先去掉每个处理3个培养瓶的封口膜,将培养瓶用带丁基橡胶塞采气口的特殊硅橡胶塞盖紧并在瓶塞周围涂抹704胶以密封瓶口。将每个培养瓶连接到真空泵上,从采气口将三角瓶抽成真空后通入室内空气,重复3次,每次3 min,使瓶内气体浓度与大气浓度平衡,并采集培养瓶上部气体样本,作为初始气体浓度,记录采样时间。之后将采气口用704胶密封,置于30 ℃恒温培养箱黑暗密闭24 h,用连有三通阀的25 mL螺口式注射器采集第二针气体。每次采气前用注射器反复抽取瓶内气体3次以混匀气体。所采气体用气相色谱分析仪(GC-ECD,Agilent 7890A)测定浓度。
1.2.3 土壤酶活性测定取培养结束后的土壤,风干过40目筛,进行土壤水解酶和氧化还原酶活性的测定。其中,土壤水解酶的测定主要包括:FDA水解酶以无色的荧光素二乙酸为基质,采用比色法测定其活性,以每克土壤每天释放1 μmol荧光素为1个酶活单位[18];脲酶活性的测定采用靛酚蓝比色法,以尿素为基质,测定其活性,以每克土壤每天释放1 μg NH3为1个酶活单位[19];酸性磷酸酶的活性采用磷酸苯二钠比色法测定,在酸性条件下,以磷酸苯二钠为基质,在磷酸酶的作用下,以水解基质所生成的苯酚的量表示[19]。氧化还原酶的测定主要包括:过氧化氢酶的活性采用紫外分光光度法测定,以每20 min内每克土壤分解的过氧化氢的微摩尔数表示[20];土壤脱氢酶活性的测定以氯化三苯基四氮唑(TTC)为氧化剂,测定被还原生成的三苯基甲臜(TF),以每克土壤样品每天催化产生1 μg的TF为一个酶活性单位[21];土壤多酚氧化酶的活性以邻苯三酚为基质,采用比色法测定,以每克土壤产生1 mg紫色没食子定义为1个酶活单位[21]。
1.3 数据处理土壤净硝化速率计算公式为:
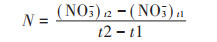
|
(1) |
式中:N为净硝化速率,mg N · kg-1 · d-1;(NO3-)t2和(NO3-)t1分别为t2和t1时NO3-的含量,mg N·kg-1。
N2O的排放速率根据密闭24 h前后测定的三角瓶内气体N2O浓度差值计算[22]。
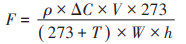
|
(2) |

|
(3) |
式中:F指N2O的排放速率,ng N·kg-1·h-1;ρ指N2O在标准状况下的密度,1.25 kg N2O-N·m-3;ΔC指培养前后N2O的浓度差,10-6L·L-1;V为培养瓶的有效体积,m3;T指培养使用的温度,℃;W指培养用干土的质量,kg;E指N2O的累积排放量,μg N·kg-1;fi和fi+1指在培养时间ti和ti+1时的N2O排放速率,ng N·kg-1·h-1。
采用SSPS 20.0软件进行单因素方差分析和相关性分析,用LSD法分析处理间在0.05水平的差异显著性。图表中数据为平均值±标准差。
2 结果与分析 2.1 猪粪炭对茶园土壤净硝化速率的影响培养期间内各处理NH4+-N浓度变化如图 1A。从培养的第1 d开始,各处理NH4+-N浓度均呈现下降趋势,下降幅度的顺序为BC5+N>BC2+N>BC1+N>CK+ N。其中,在培养的前7 d,BC5+N处理的NH4+-N浓度下降约41.0 mg N·kg-1,并在培养的第21 d浓度达到最小值,随后基本保持稳定的趋势。培养结束时,BC5+N的NH4+-N浓度最小,约为35.7 mg N·kg-1,其他处理之间的NH4+-N浓度差异不大,范围为50.3~54.1 mg N·kg-1。

|
不同小写字母表示处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant differences among treatments(P < 0.05). The same below 图 1 35 d培养期内NH4+-N浓度的动态变化及土壤的平均净硝化速率 Figure 1 The dynamic concentrations of NH4+-N and the average net nitrification rates during 35-day incubation |
由图 1B看出,所有处理的土壤硝化作用微弱,除BC5+N处理的平均净硝化速率为0.31 mg N·kg-1·d-1,其他处理的净硝化速率均小于0.10 mg N·kg-1·d-1。培养结束后,BC1+N和BC2+N处理的土壤净硝化速率与CK+N处理相比均无显著差异,而BC5+N处理则显著增加了茶园土壤的净硝化速率(P < 0.05)。
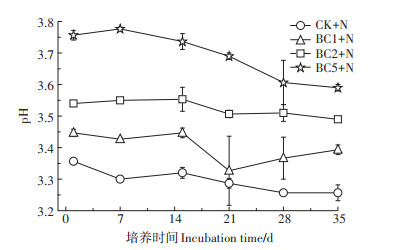
2.2 培养期内各处理pH的动态变化由于培养试验在密闭系统中进行,因此硝化作用的致酸效应使所有处理的pH呈现逐渐下降的趋势(图 2)。培养的第1 d,CK+N处理的pH为3.36,之后逐渐下降到3.26,约在培养的第28 d保持稳定不变。与CK+N相比,3种猪粪炭处理减缓了pH的下降,且随着猪粪炭施加量的增加效果更为明显;在培养的第1 d,BC1+N、BC2+N和BC5+N的pH分别比CK+N高0.09、0.18个和0.40个单位;培养结束时,3种猪粪炭处理pH分别比CK+N高0.13、0.23个和0.33个单位。
|
图 2 35 d培养期内土壤pH的动态变化 Figure 2 The dynamic changes of soil pH during 35-day incubation |
如图 3所示,N2O累积排放量随培养时间的延长而逐渐增加。与CK+N处理相比,所有猪粪炭处理组的N2O累积排放量都显著降低,且BC5+N处理的N2O累积排放量最低,降幅约62.4%;低量猪粪炭显著降低土壤N2O累积排放量约41.2%~58.7%。CK+N处理在前3 d的N2O累积排放量已达到57.2 μg N·kg-1,猪粪炭处理组最大仅为16.4 μg N·kg-1;CK+N处理组在培养结束时N2O累积排放量高达109.1 μg N·kg-1,猪粪炭处理组最高为43.3 μg N·kg-1;且猪粪炭处理组的N2O排放模式相似,在培养结束时N2O排放趋向平稳,而CK+N处理组仍呈现上升趋势。

|
图 3 35 d培养期内N2O的累积排放量 Figure 3 The cumulative N2O emissions during 35-day incubation |
从图 4A~图 4C可以看出,猪粪炭施加导致不同处理间土壤氧化还原类酶的活性呈现不同的变化趋势。其中,猪粪炭处理显著降低土壤过氧化氢酶的活性,且随着猪粪炭施加量的增加呈现递减的趋势,BC5+N处理显著降低土壤过氧化氢酶的活性高达88.0%。BC1+N处理显著增加了土壤多酚氧化酶活性,其他猪粪炭处理均显著降低了多酚氧化酶活性。与CK+N相比,BC1+N和BC5+N处理显著增加了土壤脱氢酶活性,增幅为39.4%~63.2%。土壤水解类酶主要包括FDA水解酶、脲酶和酸性磷酸酶(图 4D~图 4F)。猪粪炭施加不同程度地提高了土壤FDA水解酶和脲酶活性,且均以BC5+N处理增幅最大,其活性分别高达52.93 μmol·g-1·d-1和218.8 μg·g-1·d-1,说明猪粪炭的添加改善了茶园土壤的微生物活性,促进其氮素、磷素及有机质的转化,提高了土壤质量。猪粪炭施加对土壤酸性磷酸酶活性的影响并不显著。

|
图 4 35 d培养结束后土壤氧化还原类酶和水解类酶的活性 Figure 4 The activities of soil redox enzymes and hydrolysis enzymes after 35-day incubation |
60%WHC是对土壤硝化作用比较有利的温度和水分条件,此环境下茶园土壤在培养期内净硝化速率为0.098 mg N·kg-1·d-1。这表明尽管茶园土壤pH较低,但仍能进行硝化作用,可能主要与茶园土壤中存在的嗜酸性氨氧化细菌有关[23]。土壤的硝化作用一般会受到土壤pH、含水率、温度、底物NH4+的供应及硝化微生物活性的影响[24-25]。由于生物质炭的碱度和高pH,其添加能够降低酸性土壤的酸度,改善红壤的不利环境。本研究中,低、中量生物质炭的添加可提高茶园土壤pH约0.1个单位,但并未促进相应处理土壤的净硝化作用,BC1+N处理反而有降低土壤净硝化速率的趋势。Yang等[26]认为生物质炭可对NH4+产生化学吸附从而降低硝化作用的底物可利用性,降低土壤硝化作用,Wang等[27]通过70 d的果园沙壤土-生物质炭的室内培养试验发现,生物质炭本身含有的酚类化合物可以降低氨氧化细菌的基因数量及丰度,从而降低土壤的硝化作用。本研究中,高量生物质炭添加显著增加茶园土壤净硝化速率约4倍,可能因为生物质炭增加土壤pH高达0.5个单位,从而极大促进了底物NH3的存在形态及可利用性,掩盖了生物质炭对硝化作用的负面影响,具体的机理还有待研究。由于茶树是典型的喜铵厌硝植物,土壤硝化作用不利于茶树对氮素的吸收利用,该研究结果表明适宜的猪粪炭施加既可以不刺激茶园土壤硝化作用,又能缓解土壤的进一步酸化,可成为改良茶园土壤的重要手段之一。
3.2 猪粪炭对茶园土壤N2O排放的影响猪粪炭的添加显著降低了茶园的N2O排放,且降低幅度随着猪粪炭施加量的增加而增加。农田土壤中,硝化和反硝化作用是N2O产生的主要途径[13]。本试验中,NH4+的转化过程是在好气培养中进行的,因此,N2O的排放可能主要来自于土壤的硝化过程。试验发现,猪粪炭施加对茶园土壤净硝化速率的影响与其施加量有关,无法直接通过净硝化速率分析N2O排放降低的原因。生物质炭含碳量丰富,具有高度的物理稳定性、生物化学抗分解性以及较大的比表面积、多孔结构等优良特性,不但能大幅度提升土壤碳库,还有利于农田土壤固持养分,提高养分利用率,改善土壤微生态环境,从而对土壤N2O排放产生影响[28]。Cayuela等[29]认为与生物质炭氧化还原能力和吸附能力有关的H:C是决定其降低N2O排放的重要因子。一般认为H:C < 0.3(裂解温度为200~700 ℃)时生物质炭降低N2O排放的能力更强。本试验中猪粪炭的热解温度为550 ℃,具有较多的芳香结构和较小的H:C,猪粪炭的施加降低了茶园土壤N2O的排放。Cheng等[30]认为生物质炭一般带有负电荷,对阳离子NH4+有很强的吸附特性,从而影响土壤中化学物质的转化。Yang等[26]认为生物质炭对NH4+/NH3的吸附作用会降低硝化作用的底物可利用性,从而降低N2O的排放。Lehmann等[31]认为在低pH条件下土壤自养硝化细菌比较敏感,N2O还原酶的活性受到抑制,导致硝化反硝化产物中N2O/N2的比例较大,但随着土壤pH的增加,N2O被还原的速度加快,反硝化产物中N2O/N2的比例减小。本研究中,培养结束时,与CK+N相比,猪粪炭的添加显著增加土壤pH高达0.33个单位,从而显著降低了土壤N2O累积排放量。下一步可加强N2O还原酶活性及基因多样性对猪粪炭施加的响应研究,为指导茶园土壤温室气体N2O减排提供理论依据。
3.3 猪粪炭对茶园土壤微生物酶活性的影响土壤是生态系统中物质循环与能量流动的重要场所,也是微生物参与生化反应的场所。土壤酶是生化反应的催化剂,几乎参与土壤中所有营养元素的生物化学转化过程,其活性的高低基本反映了该转化过程的相对强度,可作为土壤微生物的活性指标。
茶园土壤酶活性的强弱与茶园土壤肥力水平密切相关。一般来说,有利于提高土壤肥力水平的农业生产措施,特别是提高土壤有机质含量的措施有利于提高土壤酶的活性。以往研究发现,除了生物质炭自身含碳量较高,其还可以对土壤有机质本身的矿化产生负激发效应,从而显著增加土壤有机碳含量[32]。本研究中,土壤水解类酶中的脲酶和FDA水解酶的活性与生物质炭的添加量成正比。一方面,猪粪炭的施加改善了茶园土壤的酸性环境,增加土壤肥力,为微生物提供了适宜的生存环境;生物质炭的多孔性也为微生物的生存提供了适宜的载体,促进了微生物的繁殖,刺激土壤酶活性的提高。另一方面,土壤脲酶能水解尿素产生NH4+,而生物质炭可以促进NH4+的氧化,加速NH4+的消耗,从而促进脲酶水解过程的发生,增加脲酶的活性。脲酶活性的增加也可能与土壤有机碳的增加有关,汪洋等[33]的研究发现脲酶活性与土壤有机碳含量呈正相关,且与Nevins等[34]的研究结果一致。FDA水解酶是一种碳循环类酶,其活性与土壤活性有机碳的增加密切相关。生物质炭本身是一类高度芳香化且含碳量较高的物质,并表现出一定的化学或生物学惰性,但新鲜制备的生物质炭含有5%~37%的易分解有机碳,其可以直接被微生物分解利用,从而促进了相关酶的活性[35]。土壤磷酸酶的活性高低直接影响着土壤中有机磷的分解转化及其生物有效性,是评价土壤磷素生物转化方向与强度的指标。土壤中磷酸酶活性具有酸碱敏感性,酸性磷酸酶活性在酸性环境中活性较强,其活性pH范围一般在3.8~4.7之间[36]。本实验中,酸性茶园土壤35 d培养结束后,尽管猪粪炭的施加改善了土壤的酸性环境,但由于硝化作用对土壤造成的二次酸化使茶园土壤的pH范围仍在3.3~4.5之间,各处理之间的酸性磷酸酶活性无显著差异。陈玉真等[6]研究发现茶园土壤酸性磷酸酶活性与土壤pH、有效磷含量显著负相关,且随着生物质炭施加量增加而下降。茶园土壤较低的pH,以及茶区通常高温多雨,导致土壤中盐基离子钾、钙、镁含量等不断减少,铝、铁、锰等元素则相对累积,从而对磷的吸附固定能力增强,造成茶园土壤有效磷含量普遍较低的现象[37]。下一步可加强生物质炭与磷酸酶活性的研究,以改善茶园土壤的缺磷现象。
氧化还原酶是一类能够催化土壤氧化还原反应的酶类,与土壤有机质的转化、腐殖质及其各组分的形成都密切相关。多酚氧化酶主要来源于土壤微生物、植物根系分泌物及动植物残体的分解物,是一种复合性酶,可将土壤中的有毒酚类物质氧化为醌,而后形成类腐殖质的大分子化合物[38]。研究发现,低量生物质炭施加可显著增加土壤多酚氧化酶的活性,而中、高量生物质炭显著降低其活性,高量生物质炭的施加可能对多酚氧化酶分子产生吸附,从而抑制多酚氧化酶酶促反应结合位点的形成,降低酶的活性。土壤过氧化物酶主要来源于土壤微生物,能够氧化土壤有机物质产生过氧化物,在腐殖质的形成过程中具有重要作用[39]。过氧化氢酶的活性随猪粪炭的添加而降低,从而使过氧化物被分解得更慢,保留得更久。土壤脱氢酶属于胞内酶,参与微生物呼吸过程的氧化磷酸化过程,故生物质炭施加显著增加土壤脱氢酶活性,这可能与土壤中微生物的活性及数量增加有关[40]。由此看出,猪粪炭施加可改善与土壤养分转化密切相关的酶活性,有利于茶园土壤生态系统的恢复和重建,全面提升土壤质量。
4 结论(1) 施加猪粪炭可以改善茶园土壤酸性环境,显著提高土壤pH,且随着猪粪炭施加量增加而增加。
(2) 茶树是典型的喜铵厌硝植物,强烈的硝化作用并不利于茶树的生长,低量猪粪炭施加并未促进茶园土壤的硝化作用,且显著降低土壤N2O累积排放量高达41.2%~58.7%。
(3) 猪粪炭施加显著提高FDA水解酶、脲酶及土壤脱氢酶活性,说明适量猪粪炭的添加可以改善茶园土壤的酸碱环境和微生物活性,促进其氮素、磷素及有机质的转化,提高土壤质量。
| [1] |
中华人民共和国国家统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2019. National Bureau of Statistics. China statistical yearbook[M]. Beijing: China Statistics Press, 2019. |
| [2] |
张倩, 宗良纲, 曹丹, 等. 江苏省典型茶园土壤酸化趋势及其制约因素研究[J]. 土壤, 2011, 43(5): 751-757. ZHANG Qian, ZONG Liang-gang, CAO Dan, et al. Study on soil acidification and its restrictive factors of typical tea garden in Jiangsu Province[J]. Soils, 2011, 43(5): 751-757. |
| [3] |
Akiyama H, Yan X, Yagi K. Estimations of emission factors for fertilizer-induced direct N2O emissions and estimate of N2O mission factors from agricultural soils in Japan:Summary of available data[J]. Soil Science and Plant Nutrition, 2006, 52(6): 774-787. |
| [4] |
Mohannad L, Qaiser H, Adel R. Impact of biochar properties on soil conditions and agricultural sustainability:A review[J]. Land Degradation and Development, 2018, 29(7): 2124-2161. |
| [5] |
Crane-Droesch A, Abiven S, Jeffery S, et al. Heterogeneous global crop yield response to biochar:A meta-regression analysis[J]. Environmental Research Letters, 2013, 8(4): 044049. |
| [6] |
陈玉真, 王峰, 吴志丹, 等. 添加生物质炭对酸性茶园土壤pH和氮素转化的影响[J]. 茶叶学报, 2016, 57(2): 64-70. CHEN Yu-zhen, WANG Feng, WU Zhi-dan, et al. Effects of biochar addition on pH and nitrogen transformations in acidic soil at tea plantations[J]. Acta Tea Sinica, 2016, 57(2): 64-70. |
| [7] |
韩文炎, 徐建明. 茶园土壤NO3--N含量与净硝化速率的研究[J]. 茶叶科学, 2011, 31(6): 513-520. HAN Wen-yan, XU Jian-ming. NO3--N concentration and net nitrification rate in tea soils[J]. Journal of Tea Science, 2011, 31(6): 513-520. |
| [8] |
Dai Z, Wang Y, Muhammad N, et al. The effects and mechanisms of soil acidity changes, following incorporation of biochars in three soils differing in initial pH[J]. Soil Science Society of America Journal, 2014, 78(5): 1606-1614. |
| [9] |
Ball P N, MacKenzie M D, DeLuca T H, et al. Wildfire and charcoal enhance nitrification and ammonium-oxidizing bacterial abundance in dry montane forest soils[J]. Journal of Environmental Quality, 2010, 39(4): 1243-1253. |
| [10] |
崔静雅.我国典型茶园土壤硝化特征及其N2O和NO排放规律[D].南京: 南京师范大学, 2017. CUI Jing-ya. Soil nitrification characteristics and N2O and NO emissions in typical tea soils in China[D]. Nanjing: Nanjing Normal University, 2017. |
| [11] |
何莉莉.秸秆生物炭对农田土壤硝化和反硝化作用的影响[D].北京: 中国科学院大学, 2017. HE Li-li. The effects of rice-straw biochar addition on nitrification and denitrification in agricultural soil[D]. Beijing: University of Chinese Academy of Sciences, 2017. |
| [12] |
Richardson D, Felgate H, Watmough N, et al. Mitigating release of the potent greenhouse gas N2O from the nitrogen cycle:Could enzymic regulation hold the key[J]. Trends in Biotechnology, 2009, 27: 388-397. |
| [13] |
Bruun E W, Müller-Stöver D, Ambus P, et al. Application of biochar to soil and N2O emissions:Potential effects of blending fast-pyrolysis biochar with anaerobically digested slurry[J]. European Journal of Soil Science, 2011, 62(4): 581-589. |
| [14] |
郑慧芬, 吴红慧, 翁伯琦, 等. 施用生物炭提高酸性红壤茶园土壤的微生物特征及酶活性[J]. 中国土壤与肥料, 2019(2): 68-74. ZHENG Hui-fen, WU Hong-hui, WENG Bo-qi, et al. Improved soil microbial characteristics and enzyme activities with wheat straw biochar addition to an acid tea plantation in red soil[J]. Soil and Fertilizer Sciences in China, 2019(2): 68-74. |
| [15] |
Bailey V L, Fansler S J, Smith J L, et al. Reconciling apparent variability in effects of biochar amendment on soil enzyme activities by assay optimization[J]. Soil Biology and Biochemistry, 2011, 43(2): 296-301. |
| [16] |
Meng J, Tao M M, Wang L L, et al. Changes in heavy metal bioavailability and speciation from a Pb-Zn mining soil amended with biochars from co-pyrolysis of rice straw and swine manure[J]. Science of the Total Environment, 2018, 633: 300-307. |
| [17] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. BAO Shi -dan. Soil and agrochemistry analysis[M]. Beijing: China Agriculture Press, 2000. |
| [18] |
刘海芳, 马军辉, 金辽, 等. 水稻土FDA水解酶活性的测定方法及应用[J]. 土壤学报, 2009, 46(2): 365-367. LIU Hai-fang, MA Jun-hui, JIN Liao, et al. Determination of activity of FDA hydrolysis in paddy soils and its appliction in Taihu Lake region[J]. Acta Pedologica Sinica, 2009, 46(2): 365-367. |
| [19] |
王灿, 王德建, 孙瑞娟, 等. 长期不同施肥方式下土壤酶活性与肥力因素的相关性[J]. 生态环境学报, 2008, 17(2): 688-692. WANG Can, WANG De-jian, SUN Rui-juan, et al. The relationship between soil enzyme activities and soil nutrients by long-term fertilizer experiments[J]. Ecology and Environmental Sciences, 2008, 17(2): 688-692. |
| [20] |
杨兰芳, 曾巧, 李海波, 等. 紫外分光光度法测定土壤过氧化氢酶活性[J]. 土壤通报, 2011, 42(1): 207-210. YANG Lan-fang, ZENG Qiao, LI Hai-bo, et al. Measurement of catalase activity in soil by ultraviolet spectrophotometry[J]. Chinese Journal of Soil Science, 2011, 42(1): 207-210. |
| [21] |
陈强龙, 谷洁, 高华, 等. 秸秆还田对土壤脱氢酶和多酚氧化酶活性动态变化的影响[J]. 干旱地区农业研究, 2009, 27(4): 146-151. CHEN Qiang-long, GU Jie, GAO Hua, et al. Effect of matching use of straw and fertilizer on the dynamic changes of soil dehydrogenase and polyphenoloxidase activities[J]. Agricultural Research in the Arid Areas, 2009, 27(4): 146-151. |
| [22] |
He L L, Zhao X, Wang S Q, et al. The effects of rice-straw biochar addition on nitrification activity and nitrous oxide emissions in two Oxisols[J]. Soil and Tillage Research, 2016, 164: 52-62. |
| [23] |
Cheng Y, Wang J, Zhang J B, et al. Mechanistic insights into the effects of N fertilizer application on N2O-emission pathways in acidic soil of a tea plantation[J]. Plant and Soil, 2015, 389(1/2): 45-57. |
| [24] |
Che J, Zhao X Q, Zhou X, et al. High pH-enhanced soil nitrification was associated with ammonia-oxidizing bacterial rather than archaea in acidic soils[J]. Applied Soil Ecology, 2015, 85: 21-29. |
| [25] |
Jia Z, Conrad R. Bacteria rather than Archaea dominate microbial ammonia oxidation in an agricultural soil[J]. Environmental Microbiology, 2009, 11(7): 1658-1671. |
| [26] |
Yang F, Cao X, Gao B, et al. Short-term effects of rice straw biochar on sorption, emission, and transformation of soil NH4+-N[J]. Environmental Science and Pollution Research, 2015, 22(12): 9184-9192. |
| [27] |
Wang Z, Zong H, Zheng H, et al. Reduced nitrification and abundance of ammonia-oxidizing bacteria in acidic soil amended with biochar[J]. Chemosphere, 2015, 138: 576-583. |
| [28] |
Liu Q, Liu B, Zhang Y, et al. Biochar application as a tool to decrease soil nitrogen losses(NH3 volatilization, N2O emissions, and N leaching)from croplands:Options and mitigation strength in a global perspective[J]. Global Change Biology, 2019, 25(6): 2077-2093. |
| [29] |
Cayuela M L, Jeffery S, Van Zwieten L. The molar H:Corg ratio of biochar is a key factor in mitigating N2O emissions from soil[J]. Agriculture, Ecosystems and Environment, 2015, 202: 135-138. |
| [30] |
Cheng C H, Lehmann J, Engelhard M H. Natural oxidation of black carbon in soils:Changes in molecular form and surface charge along a climosequence[J]. Geochimica et Cosmochimica Acta, 2008, 72(6): 1598-1610. |
| [31] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota:A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836. |
| [32] |
Lu W, Ding W, Zhang J, et al. Biochar suppressed the decomposition of organic carbon in a cultivated sandy loam soil:A negative priming effect[J]. Soil Biology and Biochemistry, 2014, 76: 12-21. |
| [33] |
汪洋, 杨殿林, 王丽丽, 等. 茶园多植物覆盖种植对土壤酶活性和有机碳矿化特征的影响[J]. 农业资源与环境学报, 2020, 37(3): 371-380. WANG Yang, YANG Dian-lin, WANG Li-li, et al. Effects of cover crops on soil enzyme activity and organic carbon mineralization in a tea plantation[J]. Journal of Agricultural Resources and Environment, 2020, 37(3): 371-380. |
| [34] |
Nevins C J, Lacey C, Armstrong S. The synchrony of cover crop decomposition, enzyme activity, and nitrogen availability in a corn agroecosystem in the midwest United States[J]. Soil and Tillage Research, 2020, 197: 104518. |
| [35] |
Spokas K A, Cantrell K B, Novak J M, et al. Biochar:A synthesis of its agronomic impact beyond carbon sequestration[J]. Journal of Environment Quality, 2012, 41(4): 973-989. |
| [36] |
Gul S, Whalen J K. Biochemical cycling of nitrogen and phosphorus in biochar-amended soils[J]. Soil Biology and Biochemistry, 2016, 103: 1-15. |
| [37] |
李欢, 万青, 胡振民, 等. 江苏茶叶主产区土壤养分空间分布特性[J]. 茶叶通讯, 2019, 46(2): 170-176. LI Huan, WAN Qing, HU Zhen-min, et al. Analysis on spatial variation of soil nutrient in major tea producing regions of Jiangsu Province[J]. Journal of Tea Communication, 2019, 46(2): 170-176. |
| [38] |
巩庆利, 翟丙年, 郑伟, 等. 渭北旱地苹果园生草覆盖下不同肥料配施对土壤养分和酶活性的影响[J]. 应用生态学报, 2018, 29(1): 205-212. GONG Qing-li, ZHAI Bing-nian, ZHENG Wei, et al. Effects of grass cover combined with different fertilization regimes on soil nutrients and enzyme activities in apple orchard in Weibei dryland, China[J]. Chinese Journal of Applied Ecology, 2018, 29(1): 205-212. |
| [39] |
荆瑞勇, 曹焜, 刘俊杰, 等. 东北农田黑土土壤酶活性与理化性质的关系研究[J]. 水土保持研究, 2015, 22(4): 132-137. JING Rui-yong, CAO Kun, LIU Jun-jie, et al. Correlation between soil enzyme activity and physicochemical characteristics in agricultural black soils in northeast China[J]. Research of Soil and Water Conservation, 2015, 22(4): 132-137. |
| [40] |
Liina E, Tiina T, Elina A K K, et al. Effects of acidified pig slurry application on soil chemical and microbiological properties under field trial conditions[J]. Soil and Tillage Research, 2020, 202: 104650. |
 2020, Vol. 39
2020, Vol. 39


