2. 中国水产科学研究院淡水渔业研究中心, 江苏 无锡 214081
2. Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
养殖尾水是指水产养殖过程中或养殖结束后,由养殖体系(包括养殖池塘、工厂化车间等)向自然水域排出的不再使用的养殖水。本课题组基于“三级循环水理论”[1]构建“两坝三区”尾水处理系统[2-3],两坝包括溢流坝、潜流坝,三区包括初沉区、初级净化区、次级净化区。两坝主要对未消化的饲料和悬浮物进行过滤沉淀,初沉区为因地制宜利用的排水沟或不规则的池塘,通常是净水处理系统中的第一个单元,主要作用是降低水中悬浮物浓度及其携带的营养盐。目前关于水产养殖过程坝体和生态沟渠中水质净化材料筛选的研究不多,课题组前期室内模拟初沉区筛选出水质处理效果较好的两种净化材料:除氮型改性凹凸棒土(Al@TCAP-N)和火山石。其中,改性凹凸棒土是在凹凸棒土的基础上进行改性,以扩大孔隙,增大比表面积[4]。Yin等[5]将Al@TCAP-N用于黑臭水体的底泥修复,发现其能有效降低沉积物中TN和TP的含量。而火山石具有多孔结构,比表面积大,研究表明其具有较好的TN、TP和CODMn去除效果[6]。但是该系统存在尾水集中排放期间和冬季因植物生长缓慢、微生物代谢能力弱导致吸收能力降低的问题。因此在实际应用中,常利用载体吸附和微生物净化双重作用强化净化水质的目的。
从微生物强化水质净化效果方面看,芽孢杆菌[7]和活性污泥[8]在水处理中去除氮、磷和有机物的效果好。净化材料表面覆着大量微生物,能分泌分解和转化营养盐的酶类物质,但目前从酶活性角度对微生物强化水质净化效果的机制研究较少。微生物通过分泌酶参与到物质代谢途径,如微生物氨单加氧酶(Ammonia monooxygenase,AMO)[9]参与氨氧化反应,微生物亚硝酸盐还原酶(Nitrite reductase,NIR)[10]参与亚硝化反应,微生物硝酸盐还原酶(Nitrate reductase,Nar)[11]诱导硝态氮的转化过程;微生物有机磷水解酶(Organic phosphorus hydrolase,OPH)[12]可以分解有机磷,微生物碱性磷酸酶(Alkaline phosphatase,AKP)[13]催化分解有机磷;而微生物脱氢酶(Dehydrogenases,DHO)[14]通过传递有机物的氢从而分解有机物。为探究代谢酶类发挥的营养盐去除功效,本试验室内模拟养殖尾水处理系统初级沉淀单元,通过添加外源微生物,分析氮循环、有机磷分解和有机物分解相关酶活性,材料表面富集水质相关细菌、真菌的差异变化及其和水质指标的相关性,研究尾水净化材料Al@TCAP-N和火山石的应用对微生物功能酶活性的影响。
1 材料与方法 1.1 试验材料与设计材料来源:试验用吉富罗非鱼养殖尾水取自中国水产科学研究院淡水渔业研究中心养殖池塘。Al@TCAP-N由中国科学院南京地理与湖泊研究所提供;火山石购自广州花地水族用品有限公司。活性污泥由海力士半导体(无锡)有限公司提供,通过好氧反硝化活性污泥培养基[15]扩增;外源微生物中地衣芽孢杆菌(Bacillus licheniformis)菌粉、复合芽孢杆菌菌粉来自本实验室,通过LB培养基扩增,扩增后的菌液于4 ℃冰箱保存备用(保证浓度≥109 CFU·mL-1),使用前等比混合得到混合菌液。NIR、Nar、DHO、OPH、AMO和AKP试剂盒由上海摩楷生物科技有限公司提供。
外源微生物用量确定及室内模拟初沉区:在2 000 mL三角瓶中(按养殖尾水200 L计算)按2 mL·m-3添加浓度为1×109 CFU·mL-1的菌液,加充分混匀后的养殖尾水稀释到800 mL,再加入试验所需的净化材料600 g,在振荡培养器中30 ℃、150 r·min-1培养24 h后取出净化材料待用。为保证微生物的丰富度,复合菌液采用3种扩增菌液等比例混合。火山石和Al@TCAP-N用网袋包裹,按1:1的比例,放置于沉淀单元模拟系统底部(长方形有机玻璃材质,有效体积为250 L),并按2 mL·m-3添加浓度为1×109 CFU·mL-1的混合菌液。
样本采集:①检测酶活和水质指标的水样样本,试验开始后0、6、12、24、36 h和48 h采集两种材料周围水体(下0.15 m,左右直径0.3 m处)水样,取上述取样点对应组的材料,按1:9(m:V)添加0.01 mol·L-1 PBS缓冲液,浸泡30 min采用超声处理离心到100 μL。按质量比1:10使用0.01 mol·L-1的PBS缓冲液稀释,并于20 kHz、4 ℃条件下超声处理5 min,然后于4 ℃、12 000 g条件下离心10 min,取上清液使用试剂盒进行测定;②检测微生物的样本,采集净化材料表面微生物置于50 mL离心管,储藏于-80 ℃冰箱中,采用高通量手段测定净化材料表面微生物群落中细菌和真菌的主要门类。为减少取样所带来的系统误差,每个时间点对3个平行组样本进行采样。
1.2 材料内外酶活、水质检测与微生物分析酶活检测:参考上海摩楷生物科技有限公司试剂盒说明书采用双抗体夹心法检测,通过固相抗体、酶、酶抗体的结合,形成抗体-抗原-酶标抗体复合物。经过染色、酶催化、酸化步骤后用酶标仪测定吸光度(OD值)。
水质指标测定:试验过程中的水温维持在28± 2 ℃并采用加热棒进行控制,pH维持在6.9±0.3,采用NaHCO3进行调节,硬度碳酸钙指数维持在350±12,溶氧>5 mg·L-1。参照《水质总氮的测定碱性过硫酸钾消解紫外分光光度法》(GB 11894—1989)测定总氮(TN)含量,参照《水质总磷的测定钼酸铵分光光度法》(GB 11893—1989)测定总磷(TP)含量,参照《水质高锰酸盐指数的测定》(GB 11892—1989)测定高锰酸盐指数(CODMn)。
微生物检测:基于北京百迈客生物科技有限公司PacBio测序平台,利用单分子实时测序(SMRT Cell)的方法对marker基因进行扩增测序,之后通过对CCS(Circular Consensus Sequencing)序列过滤,得到Optimization-CCS进行OTUs(Operational Taxonomic Units)聚类,并进行物种注释及丰度分析,揭示样品的物种构成。利用16S rDNA序列进行细菌种类分析,利用ITS序列进行真菌种类分析。Silva(release132)和Unite(release8.0)分别为细菌16S和真菌ITS比对数据库。
1.3 数据分析在Excel 2019软件中完成数据处理,在Origin 9.4中进行相关图形的绘制,在IBM SPSS Statistics 19中完成方差分析及均值LSD多重比较,差异显著水平P < 0.05用不同小写字母表示。
2 结果与分析 2.1 酶活性检测结果材料周围水体中微生物AKP活性为191.58~ 234.15 IU · L-1(图 1),火山石AKP活性为218.49~ 265.07 IU · L-1,Al@TCAP-N中AKP活性为200.82~ 257.98 IU·L-1。0~36 h,火山石中的AKP活性高于其他两组;48 h时,Al@TCAP-N的AKP活性高于其他两组。6 h火山石内和Al@TCAP-N内部AKP活性显著高于净化材料周围水体中微生物的AKP活性。

|
图 1 不同酶活性变化情况 Figure 1 Changes of different enzyme activities |
材料周围水体OPH活性为683.63~793.34 IU · L-1,火山石OPH活性为668.13~763.61 IU · L-1,Al@TCAP-N中OPH活性为588.99~706.66 IU · L-1。0~6 h,火山石中的OPH的活性高于其他两组;12~48 h水中的OPH的活性高于其他两组。24 h时净化材料周围水体中微生物的OPH活性显著高于Al@TCAP-N内部的OPH活性。
材料周围水体DHO活性为1 921.71~2 502.94 IU·L-1,火山石DHO活性为1 717.23~2 397.9 IU·L-1,Al@TCAP-N中DHO活性为1 955.32~2 650.00 IU · L-1。0 h,火山石中的DHO活性高于其他两组;6 h和36~48 h,Al@TCAP-N的DHO活性高于其他两组;12~24 h,净化材料周围水体中微生物的DHO的活性高于其他两组。在0 h,火山石内的酶活性显著高于净化材料周围水体中微生物的DHO活性。6 h净化材料周围水体中微生物的DHO活性和Al@TCAP-N内DHO活性显著高于火山石内的DHO活性。12 h净化材料周围水体中微生物的DHO活性显著高于Al@TCAP-N内的DHO活性。36 h Al@TCAP-N内的DHO活性显著高于火山石内和净化材料周围水体中微生物的DHO活性。48 h火山石内的DHO活性显著低于Al@TCAP-N内的DHO活性。
材料周围水体AMO活性为399.61~467.41 IU· L-1,火山石AMO活性为359.89~438.44 IU · L-1,Al@TCAP-N中AMO活性为363.47~422.61 IU · L-1。0 h和12~48 h,净化材料周围水体中微生物的AMO活性高于其他两组;6 h时,火山石中的AMO活性高于其他两组。6 h火山石内的AMO活性显著高于净化材料周围水体中微生物的AMO活性。48 h净化材料周围水体中微生物的AMO活性显著高于Al@TCAP-N内的AMO活性。
材料周围水体Nar活性为1 035.79~1 271.68 IU· L-1,火山石中Nar活性为1 177.87~1 462.02 IU·L-1,Al@TCAP-N中Nar活性为1 142.35~1 328.14 IU·L-1。0~24 h,火山石中的Nar活性高于其他两组;36~48 h,Al@TCAP-N中的Nar活性高于其他两组。0、12 h和24 h火山石内的Nar活性显著高于净化材料周围水体中微生物的Nar活性。
材料周围水体NIR活性为546.7~672.77 IU·L-1,火山石中NIR活性为557.92~721.62 IU · L-1,Al@TCAP-N中NIR活性为482.34~734.16 IU·L-1。0 h和36 h,火山石中的NIR活性高于其他两组;6、12 h和48 h,净化材料周围水体中微生物的NIR活性高于其他两组;24 h,Al@TCAP-N中的NIR活性高于其他两组。0 h火山石内的NIR活性显著高于净化材料周围水体中微生物和Al@TCAP-N内的NIR活性。6 h净化材料周围水体中微生物的NIR活性显著高于Al@TCAP-N内的NIR活性。48 h,净化材料周围水体中微生物的NIR活性显著高于火山石内和Al@TCAP-N内的NIR活性。
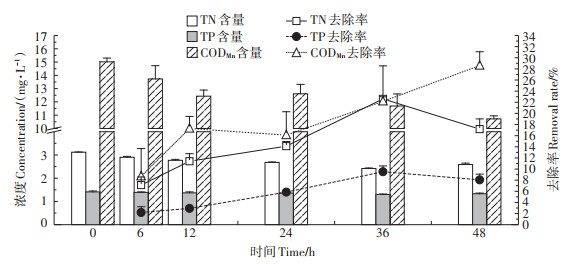
2.2 水质净化效果添加净化材料处理前(0 h),TN、TP和CODMn的含量分别为(3.12±0.01)mg·L-1、(1.41±0.04)mg·L-1和(15.02±0.28)mg·L-1(图 2)。净化材料处理后(48 h)TN、TP和CODMn的含量分别为(2.59±0.06)mg·L-1、(1.33±0.03)mg·L-1和(10.72±0.23)mg·L-1。36 h TN的去除率最高,为(22.61±0.39)%,此时TN含量为(2.42±0.02)mg·L-1;36 h TP的去除率最高,为(9.52± 1.04)%,此时TP含量为(1.30 ± 0.02)mg · L-1;48 h CODMn的去除率最高,为(28.60±2.49)%,此时CODMn含量为(10.72±0.23)mg·L-1。
|
图 2 TN、TP和CODMn的含量和去除率 Figure 2 The contents and removal rates of TN, TP and CODMn |
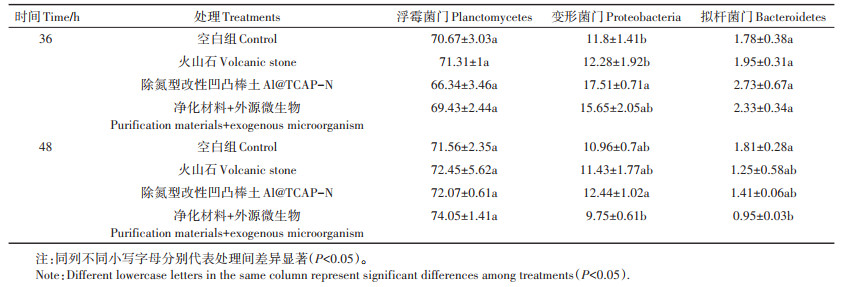
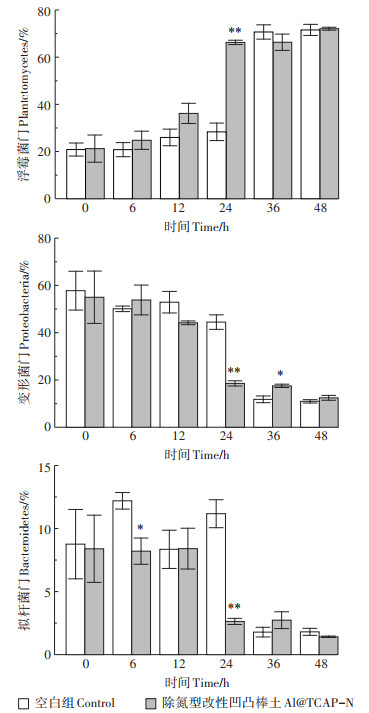
材料表面微生物细菌主要为浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),外源添加的菌制剂和活性污泥的引入并未带来水体和材料表面微生物主要类群的显著变化(表 1)。但通过分析发现,3种细菌门类在36~48 h空白组、吸附材料单独处理组和净化材料+外源微生物组中,Al@TCAP-N与空白组不同时间点间存在显著性变化(图 3)。24 h,Al@TCAP-N内浮霉菌门占比高于空白组内浮霉菌门占比;空白组内变形菌门和拟杆菌门的占比高于Al@TCAP-N内上述两种菌的占比。36 h,Al@TCAP-N内变形菌门的占比与空白组和火山石内变形菌门的占比存在显著差异(表 1)。而48 h,Al@TCAP-N内变形菌门的占比与净化材料+外源微生物组内变形菌门的占比存在显著差异;空白组内拟杆菌门的占比与净化材料+外源微生物组内拟杆菌门的占比存在显著差异。
|
|
表 1 36 h与48 h主要细菌门类对比(%) Table 1 Comparison between 36 h and 48 h of major bacteria(%) |
|
*代表处理间存在显著差异(P < 0.05);**代表处理间存在极显著差异(P < 0.01) *Represents significant difference between treatments(P < 0.05); **represents extremely significant difference between treatments(P < 0.01) 图 3 空白组与除氮型改性凹凸棒土主要细菌门类分析 Figure 3 Analysis of the main bacterial categories in the blank group and Al@TCAP-N |
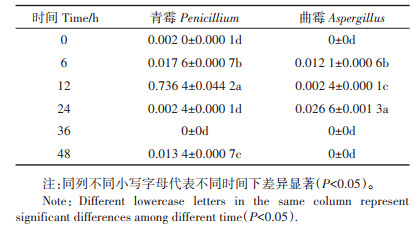
所检测的真菌中主要存在壶菌门(Chytridiomycota),但与水质相关的青霉(Penicillium)和曲霉(Aspergillus)也同时存在(表 2)。其中,12 h,青霉达到占比的最高值,为(0.736 4±0.044 2)%;24 h,曲霉达到占比的最高值,为(0.026 6±0.001 3)%。
|
|
表 2 不同时间净化材料内青霉和曲霉占比(%) Table 2 Proportion of Penicillium and Aspergillus in purified materials at different time(%) |
净化材料表面结构与水质处理效果密切相关,本试验中火山石具有较大的比表面积,内部多孔隙;凹凸棒土进行改性后呈现出疏松多孔的结构[16],研究表明两者均具有较好的吸附能力[16-18]。净化水体中添加外源微生物,可以有效降低水中氮磷含量,从而达到净化水质的强化效果[19-20]。而活性污泥呈絮状,含有大量微生物,具有脱氮除磷的功能,通常被用于生活污水处理领域[21]。市售的芽孢杆菌制剂具有异养硝化-好氧反硝化[19, 22]和解磷[23]的作用,可以降低水体中营养盐的含量[24]。在实际使用过程中,往往将几种不同类型的净化材料复配进行使用,增强对营养盐的降解能力,有研究表明,复合净化材料(火山石[25-26]和凹凸棒土[27)]与外源微生物联合作用可显著提高初级沉淀系统的水质净化能力。本试验中净化材料内酶活性高于净化材料外周围水体中酶活性,外源微生物的加入虽未造成材料及其周围水体中主要细菌门类的变化,但因净化材料的加入可能会改变材料周围的微环境[19, 21]以利于微生物的富集,净化材料内微生物含量可能因载体的存在高于净化材料周围水体中微生物含量。而外源微生物的加入能否带来水质修复相关细菌及酶活性的变化?本试验中检测到的变形菌门中存在可以氧化氨的亚硝化细菌属(Nitrosomonas)[28],可以分泌氨单加氧酶(AMO),催化氨氧化反应。浮霉菌门和拟杆菌门[29]含有参与厌氧氨氧化的细菌,通过协助分泌亚硝酸盐还原酶NIR将NO2--N降解为NH3-N,生成N2。真菌中的青霉和曲霉被证实具有解磷作用[23],通过分泌磷酸酶、核酸酶等,水解有机磷,且解磷能力通常比细菌强[30]。还有相关研究表明,相比于水环境,多孔隙结构会为微生物提供更稳定的生长环境,有利于酶积累、微生物培养和水质净化[31-32]。净化材料(Al@TCAP-N和火山石)表面附着生长的细菌和真菌会促进水中氮、磷的转化,从而降低水体中TN、TP含量,达到改善水质的目的。且在36 h,Al@TCAP-N会促进变形菌门的生长,分泌AMO以促进氨氧化反应和有机物的分解。
3.2 酶活性角度解析净化机理分析各个时段酶活性,可以发现,火山石内的酶活性整体高于Al@TCAP-N内的酶活性。原因可能是Al@TCAP-N固定微生物的能力较弱,火山石比较容易负载微生物[25-26, 33]。该结果提示我们可通过Al@TCAP-N的吸附和火山石负载微生物的双重作用降低水中有害物质的含量。本试验检测的几种酶中,亚硝酸盐还原酶NIR、硝酸盐还原酶Nar和AMO参与氮的循环。其中,AMO是氨氧化反应的催化剂,能够帮助氨氧化菌将NH3-N转化为NO2--N[9];NIR可以将NO2--N降解为N2或NH3-N[10];Nar是一种诱导酶,可直接将NO3--N还原为NO2--N[11]。火山石和Al@TCAP-N中的Nar在12~24 h上升,净化材料周围水体中的Nar在24~36 h上升,说明添加净化材料加快了反硝化作用。有部分时间点存在Al@TCAP-N中AMO、Nar和NIR酶活性高于火山石中AMO、Nar和NIR酶活性以及净化材料周围水体中AMO、Nar和NIR酶活性高于两种净化材料内部AMO、Nar和NIR酶活性的情况。这可能有以下原因:一是溶氧限制了硝化和反硝化作用,进而影响酶活性[9-11];二是硝化细菌的生长过程较为缓慢[33],且易受到其他异养菌的影响[34];三是净化后期净化材料内部孔隙中微生物达到上限,净化能力也随之下降[35]。上述结果充分说明净化材料加入后材料内部微生物富集加速了氮循环过程,但对水体中氮素的去除还受到水质指标、微生物群落中主要类群和材料特性所带来吸附能力的影响。
而对于磷的分解,有机磷水解酶OPH和碱性磷酸酶AKP参与有机磷分解。其中,OPH可以分解有机磷化合物,减少有机磷对于环境的污染[12];AKP能催化有机磷的分解并释放正磷酸盐,增加水中可溶性有效磷,便于吸收利用[13]。试验结果显示,0~6 h时,火山石和Al@TCAP-N中的AKP、AMO的活性有明显升高,而在6~12 h阶段,净化材料周围水体中的AKP、AMO活性才升高。这说明火山石和Al@TCAPN能同时促进有机磷的分解作用和亚硝化作用,研究表明在保证营养盐去除效果的前提下,将净化材料复合使用的添加量要小于单独使用时的添加量[3],提示两种材料复配可以起到一定程度的协同效果,并能极大减少材料的使用量。脱氢酶DHO通过传递有机物上的氢进而分解有机物[14]。本结果表明Al@TCAP-N能在后期(36~48 h)增加DHO的活性,促进有机物的分解。
3.3 净化材料在水质净化中的应用净化材料的吸附和微生物菌落生长需要寻求最佳配合时间以便于吸附和生物降解协同进行。在0~ 36 h,TN、TP和CODMn的去除率上升,说明在微生物和净化材料的作用下水质污染得到一定程度的缓解;在36~48 h,TN和TP的含量上升,说明随着时间的推移,更多微生物充填于材料四周,使其吸附功能下降[35]。该结果提示,在养殖过程中,初沉单元水力停留时间应为36 h,虽然不能确保一些养殖品种在尾水集中排放阶段营养盐的去除效果,但可以明确的是外源微生物的引入能起到一定的营养盐强化去除作用;冬季因植物生长缓慢、微生物代谢能力弱导致吸收能力降低的问题也无法得到解决,但可以筛选性能更好的镧改性等矿物吸附材料,增加坝的数量,改变坝的流向,强化生态湿地净化区的修复功能,实现吸附和生物净化双管齐下。
上述结果均表明外源微生物的加入能带来水质修复相关细菌及酶活性的变化,结合本研究中的最佳水力停留时间36 h及水质修复相关细菌、真菌主要门类等特征,在实际运行过程中,可通过持续外源添加菌制剂和活性污泥强化净化材料的水质修复效果。此外,为防止净化材料在沉淀池中发生堵塞,可将净化材料填充在网袋中延长水力停留时间和便于整体移出进行冲洗,冲洗后的水可经过净化输送到循环利用的生态蓄水池净化区中进行藻类的培养。对使用后的材料对氮磷营养素的承载能力进行的研究结果表明,每克Al@TCAP-N约吸附201.73 µg氮和18.22 µg磷。每克火山石约吸附59.54 µg氮和34.98 µg磷[3]。这些材料经磨碎后具有一定的增加肥力和疏松土壤之功效,方便资源化利用。
4 结论(1)Al@TCAP-N和火山石能促进水体中含磷化合物的分解和氮的转化。火山石能在净化初期(0~6 h)促进有机磷化合物分解和硝态氮(NO3--N)转化为亚硝态氮(NO2--N)。Al@TCAP-N在净化后期(36~48 h)促进有机物的分解。
(2)36 h通过Al@TCAP-N的吸附和火山石负载微生物的双重作用对TN、TP、CODMn的去除效果最佳,去除率分别为22.61%、9.52%和22.16%。
(3)在实际应用过程中,36 h为最佳净化时间,可通过Al@TCAP-N的吸附和火山石负载微生物的双重作用降低水中营养盐的含量。
| [1] |
胡庚东, 宋超, 陈家长, 等. 池塘循环水养殖模式的构建及其对氮磷的去除效果[J]. 生态与农村环境学报, 2011, 27(3): 82-86. HU Geng-dong, SONG Chao, CHEN Jia-zhang, et al. Modeling of water circulating pond aquaculture system and its N & P removal effect[J]. Journal of Ecology and Rural Environment, 2011, 27(3): 82-86. |
| [2] |
王钰钦, 郑尧, 钱信宇, 等. 初沉单元中净化材料的筛选及运行参数研究[J]. 农业环境科学学报, 2020, 39(11): 2621-2630. WANG Yu-qin, ZHENG Yao, QIAN Xin-yu, et al. Study on purification materials selection and its operating parameters in the primary precipitation unit[J]. Journal of Agro-Environment Science, 2020, 39(11): 2621-2630. |
| [3] |
王钰钦, 郑尧, 钱信宇, 等.火山石和改性凹凸棒土对初沉单元净化效果的影响[J]/OL.农业环境科学学报, 2020, 39(12): 2868-2877. WANG Yu-qin, ZHENG Yao, QIAN Xin-yu, et al. Effects of volcanic stone and Al@TCAP-N on the purification effect of primary precipitation units[J]/OL. Journal of Agro-Environment Science, 2020, 39(12): 2868-2877. |
| [4] |
鲍祥, 张艳, 贺学周, 等. 改性凹凸棒土负载铝盐吸附剂去除水中总磷研究[J]. 安徽农学通报, 2016, 22(19): 28-31. BAO Xiang, ZHANG Yan, HE Xue-zhou, et al. Removal of total phosphorus from water by aluminum salt adsorbent modified by modified concave and convex rods[J]. Anhui Agricultural Science Bulletin, 2016, 22(19): 28-31. |
| [5] |
Yin H, Wang J, Zhang R, et al. Performance of physical and chemical methods in the co-reduction of internal phosphorus and nitrogen loading from the sediment of a black odorous river[J]. Science of the Total Environment, 2019, 663. |
| [6] |
聂凤, 熊正为, 黄建洪, 等. 改性火山石-PAC复合絮凝剂处理城镇生活污水试验研究[J]. 水处理技术, 2012, 38(4): 87-90. NIE Feng, XIONG Zheng-wei, HUANG Jian-hong, et al. Treatment of municipal domestic sewage by compound flocculent of modified vesuvianite-PAC[J]. Technology of Water Treatment, 2012, 38(4): 87-90. |
| [7] |
张小平.枯草芽孢杆菌SC02和施氏假单胞菌F1M对草鱼养殖水体水质的影响及机理研究[D].杭州: 浙江大学, 2014: 43-50. ZHANG Xiao-ping. Effects of Bacillus subtilis SC02 and Pseudomonas stutzeri F1M on water quality in grass carp(Ctenovharynsodon idellus) culture and its mechanism[D]. Hangzhou: Zhejiang University, 2014: 43-50. |
| [8] |
朱建龙, 张涛, 蒋路平, 等. 生物膜-活性污泥工艺对甲鱼养殖废水的处理效果研究[J]. 环境污染与防治, 2017, 39(9): 948-951, 956. ZHU Jian-long, ZHANG Tao, JIANG Lu-ping, et al. Study on the treatment effect of HYBAS on turtle breeding wastewater[J]. Environmental Pollution & Control, 2017, 39(9): 948-951, 956. |
| [9] |
李小鹏, 张代均, 曹琳, 等. 氨氧化菌在污水生物处理中的作用[J]. 中国给水排水, 2004, 20(5): 24-27. LI Xiao-peng, ZHANG Dai-jun, CAO Lin, et al. The role of ammonia oxidizing bacteria in biological treatment of sewage[J]. China Water & Wastewater, 2004, 20(5): 24-27. |
| [10] |
张庆芳, 李美玉, 王晓辉, 等. 微生物亚硝酸盐还原酶的研究进展[J]. 微生物学通报, 2019, 46(11): 3148-3157. ZHANG Qing-fang, LI Mei-yu, WANG Xiao-hui, et al. Research progress of microbial nitrite reductase[J]. Microbiology China, 2019, 46(11): 3148-3157. |
| [11] |
吴俊泽, 王艳艳, 李悦悦, 等. 海水人工湿地系统脱氮效果与基质酶活性的相关性[J]. 海洋科学, 2019, 43(5): 36-44. WU Jun-ze, WANG Yan-yan, LI Yue-yue, et al. Enzyme activity in constructed marine wetlands[J]. Marine Science, 2019, 43(5): 36-44. |
| [12] |
白云鹏, 程欢, 许建和. 有机磷水解酶的挖掘、改造及应用[J]. 微生物学报, 2017, 57(8): 1168-1179. BAI Yun-peng, CHENG Huan, XU Jian-he. Recent advances in discovery, engineering and applications of organophosphorus hydrolases[J]. Acta Microbiologica Sinica, 2017, 57(8): 1168-1179. |
| [13] |
王福芳, 屈建航, 胡元森. 太湖水-沉积物界面磷、pH及碱性磷酸酶的时空特征及相关性[J]. 生态环境学报, 2012, 21(5): 907-912. WANG Fu-fang, QU Jian-hang, HU Yuan-sen. Spatio-temporal characteristics and correlation of phosphate, pH and alkaline phosphatase on water-sediment interface of Lake Taihu[J]. Ecology and Environmental Sciences, 2012, 21(5): 907-912. |
| [14] |
解军, 祁峰, 裴海燕, 等. 脱氢酶活性检测方法及其在环境监测中的应用[J]. 中国环境监测, 2006, 22(5): 13-18. XIE Jun, QI Feng, PEI Hai-yan, et al. Determining method of dehydrogenase activity and its application in environmental monitoring[J]. Environmental Monitoring in China, 2006, 22(5): 13-18. |
| [15] |
孙莹.以廉价农业废弃物为缓释碳源的反硝化滤池深度脱氮研究[D].哈尔滨: 哈尔滨工业大学, 2015: 7-8. SUN Ying. Advanced nitrogen removal of denitrification filter with agriculture residue as sustained-release carbon[D]. Harbin: Harbin Institute of Technology, 2015: 7-8. |
| [16] |
王丽丽, 杨倩莹, 翁时岛, 等. 功能化火山石对重金属废水中Cu2+吸附性能研究[J]. 广州化工, 2019, 47(7): 77-80, 95. WANG Li-li, YANG Qian-ying, WENG Shi-dao, et al. Study on adsorption of Cu2+ ion from heavy metals wastewater by functionalized volcanic rocks[J]. Guangdong Chemical Industry, 2019, 47(7): 77-80, 95. |
| [17] |
王华, 刘长发, 秦传新. 用火山石载体生物膜和角叉菜去除水中氮和磷的效果[J]. 大连水产学院学报, 2007, 22(6): 21-25. WANG Hua, LIU Chang-fa, QIN Chuan-xin. Nitrogen and phosphate removal in aquaculture wastewater by a novel filter media vesuvianite and macroalga Chondrus ocellatus[J]. Journal of Dalian Fisheries University, 2007, 22(6): 21-25. |
| [18] |
陈桂娟, 林坦, 梅国威, 等. 改性凹凸棒土的制备及其对颗粒的吸附性能研究[J]. 安徽职业技术学院学报, 2019, 18(3): 19-23. CHEN Gui-juan, LIN Tan, MEI Guo-wei, et al. Preparation of modified attapulgite and its adsorption properties for particles[J]. Journal of Anhui Vocational and Technical College, 2019, 18(3): 19-23. |
| [19] |
梁沪莲, 郭小雅, 刘洋, 等. 基于高通量测序的4种硝化细菌富集培养物微生物群落结构分析[J]. 微生物学通报, 2017, 44(9): 2112-2119. LIANG Hu-lian, GUO Xiao-ya, LIU Yang, et al. Microbial community of four nitrobacteria enrichments by high-throughput sequencing[J]. Microbiology China, 2017, 44(9): 2112-2119. |
| [20] |
Fal Å S P, Longerée P, La C J, et al. Micropollutant removal by attached and suspended growth in a hybrid biofilm activated sludge process[J]. Water Research, 2013, 47(13): 4498-4506. |
| [21] |
李璐. 活性污泥对污水中有机物的吸附性能研究[J]. 当代化工, 2019, 48(8): 1737-1739, 1743. LI Lu. Study on adsorption performance of activated sludge for organic matter in sewage[J]. Contemporary Chemical Industry, 2019, 48(8): 1737-1739, 1743. |
| [22] |
Zhang Q L, Liu Y, Ai G M, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophic us strain L7[J]. Bioresource Technology, 2012, 108(3): 35-44. |
| [23] |
王光华, 赵英, 周德瑞, 等. 解磷菌的研究现状与展望[J]. 生态环境, 2003, 12(1): 96-101. WANG Guang-hua, ZHAO Ying, ZHOU De-rui, et al. Review of phosphate-solubilizing microorganisms[J]. Ecology and Environment, 2003, 12(1): 96-101. |
| [24] |
张翠绵, 贾楠, 胡栋, 等. 淡水养殖底泥净化复合芽孢杆菌的筛选与应用[J]. 环境工程学报, 2017, 11(2): 1281-1286. ZHANG Cui-mian, JIA Nan, HU Dong, et al. Screening and application of compound bacillus for purifying freshwater aquaculture sediment[J]. Chinese Journal of Environmental Engineering, 2017, 11(2): 1281-1286. |
| [25] |
Buitrón G, Melgoza R M, Jiménez L. Pharmaceutical wastewater treatment using an anaerobic/aerobic sequencing batch biofilter[J]. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2003, 38(10): 2077-2088. |
| [26] |
Cheng H, Lin H, Huo H, et al. Continuous removal of ore floatation reagents by an anaerobic-aerobic biological filter[J]. Bioresource Technology, 2012, 114: 255-261. |
| [27] |
Jiang Y, Khan A, Huang H, et al. Using nano-attapulgite clay compounded hydrophilic urethane foams(AT/HUFs)as biofilm support enhances oil-refinery wastewater treatment in a biofilm membrane bioreactor[J]. Science of the Total Environment, 2019, 646: 606-617. |
| [28] |
Ilgrande C, Leroy B, Wattiez B, et al. Metabolic and proteomic responses to salinity in synthetic nitrifying communities of Nitrosomonas spp. and Nitrobacter spp[J]. Frontiers in Microbiology, 2018, 9: 2914. |
| [29] |
Zheng Y L, Hou L J, Liu M, et al. Dynamics and environmental importance of anaerobic ammonium oxidation(anammox)bacteria in urban river networks[J]. Environmental Pollution, 2019, 254. |
| [30] |
Kucey R M N, Janzen H H, Leggett M E. Inorganic phosphate solubilizing microorganisms:Microbially mediated increases in plant available phosphorus[J]. Academic Press Inc, 1989, 202-220. |
| [31] |
万琼, 赵志啸, 鞠恺, 等. 固定化硝化细菌技术的研究及应用[J]. 水处理技术, 2019, 45(8): 21-24, 29. WAN Qiong, ZHAO Zhi-xiao, JU Kai, et al. Research and application of immobilized nitrifying bacteria technology[J]. Technology of Water Treatment, 2019, 45(8): 21-24, 29. |
| [32] |
秦胜东, 郭嘉昒, 刘玉存, 等. 固定化微生物技术研究进展及其在水处理中的应用[J]. 水处理技术, 2014, 40(10): 6-11. QIN Sheng-dong, GUO Jia-wen, LIU Yu-cun, et al. Research progress of immobilized microorganism technology and its application in water treatment[J]. Technology of Water Treatment, 2014, 40(10): 6-11. |
| [33] |
Bin Z, Jiao Y, Yu G, et al. Effects of bioporous carriers on the performance and microbial community structure in side-stream anaerobic membrane bioreactors[J]. Canadian Journal of Microbiology, 2020, 1-15. |
| [34] |
邓岩岩, 迟莉娜, 周伟丽, 等. 包埋固定化硝化菌驯化阶段特性的研究[J]. 水处理技术, 2010, 36(6): 73-76. DENG Yan-yan, CHI Li-na, ZHOU Wei-li, et al. Study on the characteristics of immobilized nitrobacteria during the acclimation period[J]. Technology of Water Treatment, 2010, 36(6): 73-76. |
| [35] |
Liu T, Jia G, Xu J, et al. Simultaneous nitrification and denitrification in continuous flow MBBR with novel surface-modified carriers[J]. Environmental Technology, 2020, 4: 1-11. |
 2020, Vol. 39
2020, Vol. 39