2. 生物膜法水质净化及利用技术教育部工程研究中心, 安徽 马鞍山 243032
2. Engineering Research Center of Water Purification and Utilization Technology Based on Biofilm Process, Ministry of Education, Ma'anshan 243032, China
我国每年都会产生大量的农林废弃物,如秸秆、玉米芯、稻壳、植物果壳和木材加工废料等。对它们的随意丢弃、掩埋或处理不当会造成环境污染和能源浪费[1],因此,农林废弃物资源化合理利用是一个重要的研究方向。
含有天然有机纤维素的植物果壳具有良好的生物相容性、亲水性,可用作污水处理的生物膜填料,不仅对生物膜微生物无毒害作用,且使用后便于生物降解,不会造成二次污染[2]。表面粗糙的花生壳[2]、核桃壳[3]等都已被成功用作生物膜填料,除了作为生物膜附着生长的载体外,植物果壳还能释放碳源,促进微生物生长或作为反硝化过程中的电子供体[4]。目前,植物果壳填料研究较少,主要集中于污水处理效果方面,而果壳类型直接影响附着的生物膜特性,进而影响污水处理效果,值得深入研究。
表征生物膜特性的生物膜量(MLSS)反映填料上生物膜的多少[5]。生物膜主要组分胞外聚合物(EPS)对维持生物膜三维结构完整性、细菌黏附和保护微生物群落有着重要作用[6]。脱氢酶是参与有机物氧化磷酸化的胞内酶,能反映微生物对有机物的降解能力,脱氢酶活性(DHA)可用于表征生物膜微生物活性[7]。影响生物膜特性的因素主要有环境条件、填料与微生物。温度和NH4+-N负荷升高能降低生物膜量以及生物膜中多糖(PS)和磷脂(PL)含量[7]。低温硝化移动床生物膜反应器(Moving Bed Bioflim Reactor, MBBR)中厌氧氨氧化细菌的多少直接决定了填料上生物膜量[8]。作为生物膜微生物生长繁殖的场所,填料是最基本,也是最重要的影响因素。填料表面粗糙度和丰富的亲水性基团、良好生物亲和性有利于微生物附着生长[9]。填料内部空间结构决定营养物质和溶解氧(DO)的传输,影响生物膜的生物膜量、EPS和DHA等特性[10]。良好的机械强度能维持稳定结构,使填料能长时间使用[11]。
绝大多数污水处理工程采用工业生产填料,不仅运行成本高,而且填料生产还消耗大量的资源[12]。本文利用来源广泛、价格低廉的核桃壳、花生壳和夏威夷果壳作为序批式生物膜反应器(Sequencing Batch Biofilm Reactor,SBBR)填料,进行挂膜与废水处理研究,从生物膜量、生物膜化学组分EPS和脱氢酶活性DHA等方面分析果壳填料类型对附着生物膜特性以及废水处理效果的影响,为植物果壳的填料化、资源化提供依据。
1 材料与方法 1.1 试验填料试验所用的花生(Arachis hypogaea Linn.)壳(ρ= 0.45 g·cm-3)、核桃(Juglans regia)壳(ρ=1.04 g·cm-3)和夏威夷果(Macadamia ternifolia F. Muell.)壳(ρ = 1.80 g·cm-3)3种植物果壳均从安徽省马鞍山市某农贸市场采购。用蒸馏水浸泡24 h,去除植物果壳内外表面杂质,晾干待用。
1.2 试验装置和运行本试验采用自建的小试SBBR(图 1),装置由3根规格相同的透明反应柱组成,反应柱内径120 mm,高250 mm,有效容积2.83 L。底部设置纱网布制成的填料承托层,同时起到均匀化曝气的作用。3个反应柱中分别投入果壳填料(体积填充率为40%)。采用电磁式空气泵进行曝气,利用转子流量计控制曝气量为0.2 L·min-1,维持反应器DO浓度3~6 mg·L-1。采用智能计时器控制曝气时间。
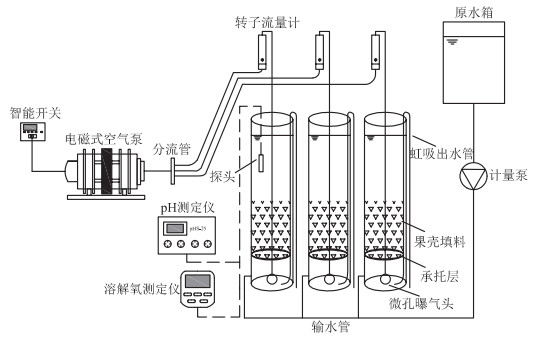
|
图 1 试验装置图 Figure 1 Experimental apparatus |
采用人工接种方法进行挂膜启动。接种活性污泥取自马鞍山市某污水处理厂曝气池。污泥闷曝48 h后,将沉降性能良好的活性污泥(MLSS为4 000 mg· L-1)接种到3个SBBR反应柱中。反应器每日运行2个周期,每周期包括反应(10 h)、沉淀(1.5 h)、排水与进水(0.5 h)。挂膜启动期间,每周期换水率为50%。2周后,植物果壳填料表面上附着了生物膜,COD和NH4+-N去除率稳定达到70%以上,镜检出现轮虫、线虫等微型后生动物,标志挂膜启动成功[13]。此后换水率提升至100%。
1.3 试验用水试验用水为取自马鞍山市某污水处理厂粗格栅后生活污水,COD为(160±30)mg·L-1、NH4+-N为(30± 5)mg·L-1、TP为(5±1)mg·L-1。
1.4 水质指标分析COD、NH4+-N、TP均采用国家标准方法测定[14];DO和温度采用便携式溶解氧测定仪(雷磁JPBJ- 608)测定;pH值采用数显pH计(雷磁pHS-25)测定。
1.5 果壳基本性状分析使用扫描电子显微镜(SEM,JSM-6490LV,日本)观察果壳填料表面微观结构形貌特征。采用溴化钾压片法,利用傅里叶红外光谱仪(FTIR,Nicolet6700,美国)分析果壳填料表面的化学基团组成。
1.6 生物膜特性分析采用质量法[14]测定生物膜量MLSS。采用加热法进行分层提取EPS[15],测定不同层EPS(外层S-EPS、中层LB-EPS、内层TB-EPS)含量。采用改进型的Lowry法[16]测定蛋白质(PN),采用苯酚-硫酸法[17]测定多糖(PS)。采用TTC(2,3,5-氯化三苯基四氮唑)法[18]测定生物膜的脱氢酶活性(DHA)。
2 结果与讨论 2.1 植物果壳填料基本物化特征 2.1.1 果壳填料表面特征为了明确花生壳、夏威夷果壳和核桃壳3种果壳填料的表面微观结构特征,选取粒径5 mm的果壳原料进行SEM观察,结果如图 2所示。

|
a:花生壳内表面,b:花生壳外表面,c:核桃壳内表面,d:核桃壳外表面,e:夏威夷果壳内表面,f:夏威夷果壳外表面 a: Inner surface of peanut husk, b: Outer surface of peanut husk, c: Inner surface of walnut husk, d: Outer surface of walnut husk, e: Inner surface of macadamia husk, f: Outer surface of macadamia husk 图 2 3种植物果壳填料内、外表面SEM图 Figure 2 SEM images of the inner and outer surfaces of the plant husks used as carriers |
从图 2可以看出,3种填料的表面结构完全不同。花生壳内表面纹理杂乱,出现大量褶皱,呈现出层叠形态的鳞片状结构,其上遍布紧密的微孔,这种结构比表面积大,有利于微生物的附着生长繁殖,同时也能够吸附污染物质;外表面粗糙,存在许多分布均匀且规则的网状纤维素骨架结构,网孔壁呈经络状;所能承受破壳力为7~105 N[19],机械强度较弱。核桃壳内表面存在分布均匀的蜂窝状通透微孔结构,有利于营养物质和溶解氧向壳体内部传递;外表面粗糙,质地致密紧实,有颗粒状物质存在,有较浅孔洞,洞壁厚实;所能承受破壳平均力为266 N[20],机械强度稳定。夏威夷果壳内表面由棒状、片状物质堆积或围合而形成一些不规则、大小不一的沟槽和孔洞,微生物易吸附生长;外表面较粗糙,存在不完整的网状结构,网孔很浅,类似于浅坑;所能承受破壳平均力为1 488 N[21],果壳质地最为坚硬。
2.1.2 果壳填料表面化学基团分析花生壳、夏威夷果壳和核桃壳含有C、H、O、N 4种主要元素,还含有如Ca、Mg、Fe、Si、P等微量元素,主要组成成分为纤维素、半纤维素和木质素[22-24]。FTIR如图 3所示。

|
图 3 3种植物果壳红外光谱图 Figure 3 FTIR spectra of plant husks |
由图 3可知,3种果壳填料的红外光谱峰型相似:在3 400、2 900、1 650、1 400 cm-1和1 100 cm-1波数附近均有吸收峰。3 400 cm-1附近的吸收峰主要归属于-OH中的O-H伸缩振动[25];2 900 cm-1附近的吸收峰主要由(-CH3、-CH2)中C-H键伸缩振动引起[26];1 650 cm-1附近的吸收峰归属于羧基或醛和酮基中羰基(C=O)的伸缩振动[27];1 400 cm-1附近的吸收峰主要归属于木质素和糖类中C-H键弯曲振动[28];1 100 cm-1附近的吸收峰主要归属于O-H的弯曲振动以及纤维素上的C-O-C键的伸缩振动[29]。1 000 cm-1波数以下的指纹吸收峰区域由于峰值不明显,不能准确判别出关于峰的来源,故在此不做细致分析[30]。
3种果壳填料均含有如-OH、-COOH等亲水性基团。填料亲水性越好,挂膜效果也就越好,附着生物膜量也就越大。因此,3种植物果壳填料具有挂膜速率高和附着生物膜量大等潜质。
2.2 植物果壳填料生物膜特性 2.2.1 填料附着生物膜量变化废水中的微生物在填料表面发生吸附,氧化分解废水中的污染物增殖形成生物膜,成熟生物膜发生脱落更新,始终保持稳定的微生物数量和活性[31]。本试验反应器共运行了62 d,除去接种挂膜的14 d,依据MLSS变化规律,将试验分为了试验前期(0~20 d)和试验中后期(20~48 d)两个阶段。
不同反应器内填料上生物膜量随时间的变化情况如图 4所示。由图可见,花生壳填料上生物膜量“先增后降”。试验前期,生物膜量迅速上升,从6.80 mg·cm-3上升到24.66 mg·cm-3。由于花生壳的机械强度较小,20 d后开始发生分解坍缩,单位体积内可附着生物膜的表面积减小,花生壳上生物膜在强烈的水力剪切作用下逐渐脱落,导致生物膜量逐渐下降。随着时间的推移,花生壳破损程度增加,生物膜量不断减少。核桃壳填料和夏威夷果壳填料上生物膜量“先快增后缓升”。表面粗糙多孔、质地坚硬的核桃壳和夏威夷果壳可以长时间为微生物提供稳定的附着增殖场所,生物膜量稳定增长。试验前期,生物膜量分别从7.98 mg·cm-3和8.45 mg·cm-3快速上升至26.75 mg·cm-3和25.96 mg·cm-3。20 d后,2种果壳填料生物膜量分别以2.71%和4.82%的较低幅度缓慢增长。在试验中后期果壳填料表面上均长满了成熟的生物膜,反应器中悬浮了较多脱落的老化生物膜。与堆积于反应器底部的夏威夷果壳填料相比,因曝气作用悬浮于反应器中的核桃壳填料受到更为强烈的水力剪切作用,生物膜脱落较多,增长速率略低于夏威夷果壳填料。
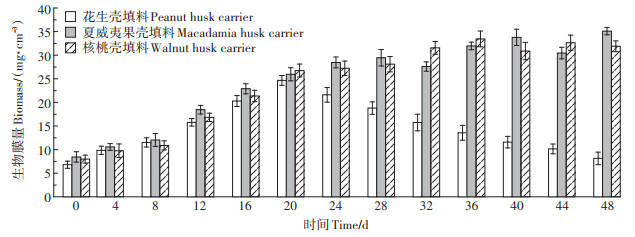
|
图 4 3种植物果壳填料生物膜量变化 Figure 4 Biomass change of biofilms on plant husks carrier |
试验期内,不同反应器内填料生物膜EPS各层、各组分分布情况如图 5所示。核桃壳、花生壳和夏威夷果壳生物膜中总EPS含量分别为66.44、49.90 mg· g-1和54.42 mg·g-1。核桃壳曝气时悬浮于水中,受到更为强烈水力剪切作用,污染物的传质效果增强,促进微生物EPS分泌[6],使得其生物膜中EPS含量最高。花生壳表面生物膜中夹杂腐烂的代谢产物,导致其EPS含量最低。3种果壳填料分层EPS平均含量大小顺序为:TB层(35.64 mg·g-1)>S层(16.78 mg·g-1)>LB层(4.49 mg·g-1),与细胞紧密结合的TB-EPS为总EPS的主要组成(平均占比62.62%)。从组分上看,各层PN含量高于PS,PN/PS为1.32~2.02,PN为EPS的主要组分[32]。核桃壳、花生壳和夏威夷果壳填料的PS含量占总EPS的41.3%、43.17%和33.11%。夏威夷果壳EPS中的PS占比显著低于花生壳、核桃壳填料。推测原因,一是花生壳和核桃壳经过污水的浸泡和微生物侵蚀,体内积累的金属离子[33]释放与PS中带负电荷的羧基官能团产生络合作用,刺激微生物增加PS的分泌[34]。夏威夷果壳质地坚硬,结晶度高[22],纤维素分子结构稳定,难被分解,金属离子不能有效释放。二是花生壳和核桃壳填料表面-OH密度高于夏威夷果壳,-OH会减少对PN的吸附量[35]。夏威夷果壳表面-CH3密度高于核桃壳和花生壳填料,-CH3会增加对PN的吸附量[36]。
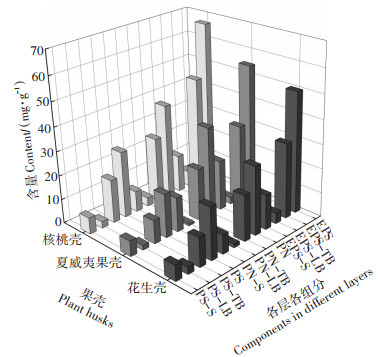
|
图 5 3种植物果壳填料生物膜EPS各层各组分分布 Figure 5 EPS components in different layers of biofilm attaching on plant husks carrier |
3种植物果壳填料附着生物膜内的DHA变化如图 6所示。试验前期,生物膜量MLSS不断增大,微生物代谢增强,DHA不断增加。

|
图 6 3种植物果壳填料生物膜DHA变化 Figure 6 DHA variation in biofilm attaching on plant husks carriers |
花生壳填料生物膜DHA呈现出“先剧增后缓降”的规律。0~16 d,DHA从2.78 mg·g-1·h-1迅速上升至60.14 mg·g-1·h-1,随后开始下降,这是因为虽然花生壳附着生物膜量还在继续增长,但花生壳开始软化,微孔被堵塞,不利于营养物质和DO传输,导致微生物DHA开始下降,也说明生物膜量高并不代表DHA高[37]。花生壳填料生物膜DHA最终下降到30.45 mg· g-1·h-1。夏威夷果壳和核桃壳生物膜DHA呈现“先增后稳”的变化规律,分别从开始的3.64、3.15 mg·g-1· h-1上升至16 d的46.53、44.96 mg·g-1·h-1。良好的机械强度能够为微生物生长增殖提供稳定的空间环境,同时其内部沟槽和孔洞丰富,不断附着更多的生物膜,DHA不断增大,当生物膜生长达到成熟时,DHA也趋于稳定。
2.3 植物果壳填料废水处理效果分析3种果壳填料反应器的污水处理效果如图 7所示。对于污染物的去除效果,3种植物果壳填料反应器呈现2种类型:花生壳填料的倒“V”变化及核桃壳和夏威夷果壳填料的倾斜“N”变化。
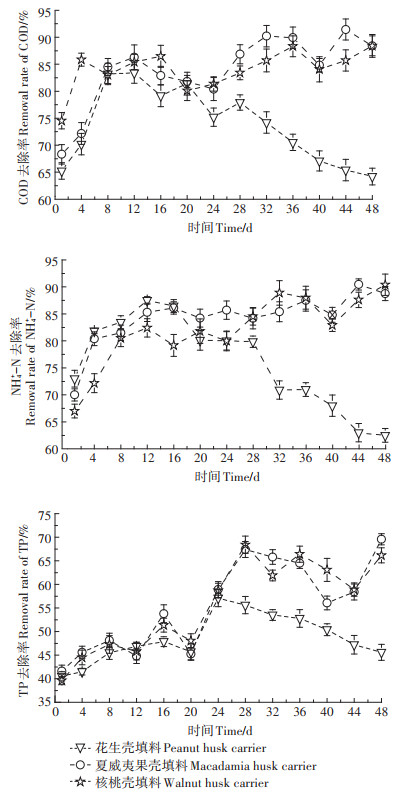
|
图 7 3种植物果壳填料反应器污染物去除效果 Figure 7 Removal efficiency of pollutants in reactors filled with plant husks |
花生壳填料反应器中,试验前期微生物增殖速率低、生物膜量小、活性低,对COD、TP的去除率低,由于还未能建立有效的厌氧、好氧处理区域[38],NH4+-N去除效果也不佳。随着微生物快速繁殖,对污染的去除效果不断提高。8~12 d,COD去除率达到稳定的83%左右。12~20 d,花生壳开始软化坍缩,微生物生长环境发生不利改变,生物膜量、DHA逐渐下降,同时由于花生壳松散的结构,更易释放有机物到污水中,而释放的有机物COD只有部分可被微生物利用,绝大部分继续存在于污水中[39],导致了花生壳填料反应器COD去除率低于其他两者填料反应器。随着花生壳进一步坍缩分解,COD去除率继续下降。花生壳填料反应器NH4+-N的去除规律与COD相似。试验用水为实际生活污水,COD/N的值较低,可供反硝化碳源不足,花生壳填料反应器中溶解于水中的COD为反硝化过程补充了碳源,因此,对NH4+-N去除率高于其他两者[40]。随着花生壳填料发生腐败,结构坍缩造成了好氧-厌氧区域的破坏,硝化和反硝化细菌生存环境恶化,对NH4+-N的去除能力下降。
核桃壳和夏威夷果壳填料反应器在整个试验期内对COD和NH4+-N去除效果不断增加。前20 d,夏威夷果壳填料反应器COD和NH4+-N去除率快速增长,分别达到86.30%和86.10%。此后,对COD的去除率在波动中缓慢增长,在44 d时达到最大值(91.43%)。这是由其附着的生物膜量、DHA所决定的。但后期,虽然生物膜量、DHA还在缓慢增加,但对污染物去除率并没有完全随之变化。成熟的生物膜形成了外层好氧、内层厌氧的结构,为硝化和反硝化细菌提供了良好的环境条件,因此,NH4+-N的去除率稳定增长,在44 d时达到最大值(90.47%)。由于核桃壳填料高含量TB-EPS,加剧了有机物传质的阻塞[41],使得核桃壳填料对COD和NH4+-N去除率均略低于夏威夷果壳填料。
3种植物果壳填料反应器对TP的去除效果并不理想。花生壳填料反应器由于生物膜量在后期比较少,聚磷菌(PAOs)数量也较少,对TP去除率最高仅能达到55%。核桃壳和夏威夷果壳填料对TP的去除率在运行28 d后能维持在70%左右,这可能是由于聚磷菌(PAOs)在摄磷过程中与反硝化细菌在脱氮过程对碳源竞争作用而受到抑制的结果[42]。
3 结论(1)花生壳填料短期内有较好的生物膜特性和污染物去除效果,但由于机械强度弱,易发生腐败坍缩,因此不适合长期作为填料使用。
(2)核桃壳和夏威夷果壳填料拥有良好的物化特征和机械强度,能够为微生物增殖提供稳定环境,各种生物膜特性、污染物去除效果较好,可长期作为填料使用。
(3)3种植物果壳填料对TP的去除效果不佳,其原因值得进一步探讨。
| [1] |
易锦馨, 霍志鹏, Abdullah M Asiri, 等. 农林废弃生物质吸附材料在水污染治理中的应用[J]. 化学进展, 2019, 31(5): 760-772. YI Jin-xin, HUO Zhi-peng, Abdullah M Asiri, et al. Application of agroforestry waste biomass adsorption materials in water pollution treatment[J]. Progress in Chemistry, 2019, 31(5): 760-772. |
| [2] |
Yang X, Jiang Q, Song H, et al. Selection and application of agricultural wastes as solid carbon sources and biofilm carriers in MBR[J]. Journal of Hazardous Materials, 2015, 283: 186-192. DOI:10.1016/j.jhazmat.2014.09.036 |
| [3] |
谢林花.核桃壳基填料BAF释碳与生物氧化耦联脱氮特性研究[D].西安: 陕西科技大学, 2018. XIE Lin-hua. Study on characteristic of removal of nitrogen by coupling carbon release and biological oxidation of walnut shell based filler BAR[D]. Xi' an: Shaanxi University of Science and Technology, 2018. |
| [4] |
Xiong R, Yu X, Zhang Y, et al. Comparison of agricultural wastes and synthetic macromolecules as solid carbon source in treating low carbon nitrogen wastewater[J]. Science of the Total Environment, 2020, 739: 139885. DOI:10.1016/j.scitotenv.2020.139885 |
| [5] |
陈伟华, 陈同辉, 陈洪斌, 等. 悬浮填料生物膜反应器处理黑水的启动挂膜[J]. 环境工程学报, 2016, 10(2): 566-572. CHEN Wei-hua, CHEN Tong-hui, CHEN Hong-bin, et al. Study on starting-up of suspended carrier biofilm reactor treating black-water[J]. Chinese Journal of Environmental Engineering, 2016, 10(2): 566-572. |
| [6] |
Shi Y, Huang J, Zeng G, et al. Exploiting extracellular polymeric sub stances(EPS)controlling strategies for performance enhancement of biological wastewater treatments:An overview[J]. Chemosphere, 2017, 180: 396-411. DOI:10.1016/j.chemosphere.2017.04.042 |
| [7] |
Zhang S, Wang Y, He W, et al. Responses of biofilm characteristics to variations in temperature and NH4+-N loading in a moving-bed biofilm reactor treating micro-polluted raw water[J]. Bioresource Technology, 2013, 131: 365-373. DOI:10.1016/j.biortech.2012.12.172 |
| [8] |
Persson F, Sultana R, Suarez M, et al. Structure and composition of biofilm communities in a moving bed biofilm reactor for nitritation-anammox at low temperatures[J]. Bioresource Technology, 2014, 154: 267-273. DOI:10.1016/j.biortech.2013.12.062 |
| [9] |
Deng L, Guo W, Ngo H H, et al. New functional biocarriers for enhancing the performance of a hybrid moving bed biofilm reactor-membrane bioreactor system[J]. Bioresource Technology, 2016, 208: 87-93. DOI:10.1016/j.biortech.2016.02.057 |
| [10] |
Tarjányi-szikora S, Oláh J, Makό M, et al. Comparison of different granular solids as biofilm carriers[J]. Microchemical Journal, 2013, 107: 101-107. DOI:10.1016/j.microc.2012.05.027 |
| [11] |
Liu Y, Zhu Y, Jia H, et al. Effects of different biofilm carriers on biogas production during anaerobic digestion of corn straw[J]. Bioresource Technology, 2017, 244: 445-451. DOI:10.1016/j.biortech.2017.07.171 |
| [12] |
Zhang X, Zhou X, Xie Y, et al. A sustainable bio-carrier medium for wastewater treatment:Modified basalt fiber[J]. Journal of Cleaner Production, 2019, 225: 472-480. DOI:10.1016/j.jclepro.2019.03.333 |
| [13] |
廖榆敏, 汤兵, 陈秋雯. 移动床生物反应器启动特性研究进展[J]. 水处理技术, 2011, 37(2): 5-8. LIAO Yu-min, TANG Bing, CHEN Qiu-wen. Moving-bed biofilm reactor start-up characteristics[J]. Technology of Water Treatment, 2011, 37(2): 5-8. |
| [14] |
国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京: 中国环境科学出版社, 2002. State Environmental Protection Administration. Methods for monitoring and analysis of water and wastewater[M]. 4th Edition. Beijing: China Environmental Science Press, 2002. |
| [15] |
姚萌, 罗红元, 谢小青, 等. 城市污水厂活性污泥胞外聚合物的三维荧光特性分析[J]. 中国环境科学, 2012, 32(1): 94-99. YAO Meng, LUO Hong-yuan, XIE Xiao-qing, et al. Three dimensional excitation-emission florescence spectra of exopolymer substances in activated sludge of WWTP[J]. China Environmental Science, 2012, 32(1): 94-99. DOI:10.3969/j.issn.1000-6923.2012.01.015 |
| [16] |
Fang F, Lu W, Shan Q, et al. Characteristics of extracellular polymeric substances of phototrophic biofilms at different aquatic habitats[J]. Carbohydrate Polymers, 2014, 106: 1-6. DOI:10.1016/j.carbpol.2014.02.010 |
| [17] |
陈寰. 苯酚-硫酸法测定好氧颗粒污泥胞外聚合物中多糖浓度的研究[J]. 四川环境, 2012, 31(5): 1-3. CHEN Huan. Determination of polysaccharide in extracellular polymeric substances by phenol-sulfuric acid method[J]. Sichuan Environment, 2012, 31(5): 1-3. DOI:10.3969/j.issn.1001-3644.2012.05.001 |
| [18] |
张洛红, 李兴. 活性污泥性质检测方法的比较研究[J]. 工业用水与废水, 2011, 42(6): 89-93. ZHANG Luo-hong, LI Xing. Comparative study on detection methods of property of activated sludge[J]. Industrial Water & Wastewater, 2011, 42(6): 89-93. DOI:10.3969/j.issn.1009-2455.2011.06.024 |
| [19] |
刘德军, 邵志刚, 高连兴. 花生壳挤压碎裂力学特性试验[J]. 沈阳农业大学学报, 2012, 43(1): 81-84. LIU De-jun, SHAO Zhi-gang, GAO Lian-xing. Experimental research of the peanut shell pulverizing mechanical characteristics[J]. Journal of Shenyang Agricultural University, 2012, 43(1): 81-84. |
| [20] |
赵超. 山核桃破壳力学分析[J]. 西南大学学报(自然科学版), 2012, 34(9): 123-127. ZHAO Chao. Mechanical analysis of cracking hickory[J]. Journal of Southwest University(Natural Science Edition), 2012, 34(9): 123-127. |
| [21] |
涂灿.澳洲坚果力学特性研究及破壳机研制[D].昆明: 昆明理工大学, 2016. TU Can. Research on mechanical properties and manufacture of breaking shell machine on macadamia nut[D]. Kunming: Kunming University of Science and Technology, 2016. |
| [22] |
杨护霞, 许艳, 方兴, 等. 常见坚果壳的元素组成·纤维素含量和结晶度分析[J]. 安徽农业科学, 2016, 44(17): 21-23. YANG Hu-xia, XU Yan, FANG Xing, et al. Analysis on element composition, cellulose content and crystallinity of the common nut shells[J]. Journal of Anhui Agri Sci, 2016, 44(17): 21-23. DOI:10.3969/j.issn.0517-6611.2016.17.008 |
| [23] |
董文召, 韩锁义, 徐静, 等. 花生壳研究现状与应用前景分析[J]. 中国农学通报, 2019, 35(32): 14-19. DONG Wen-zhao, HAN Suo-yi, XU Jing, et al. Research status and application prospect of peanut shell[J]. Chinese Agricultural Science Bulletin, 2019, 35(32): 14-19. DOI:10.11924/j.issn.1000-6850.casb18070068 |
| [24] |
石柳, 王金华, 熊智, 等. 澳洲坚果壳中纤维素和木质素成分分析[J]. 湖北农业科学, 2009, 48(11): 2846-2848. SHI Liu, WANG Jin-hua, XIONG Zhi, et al. Components analysis on cellulose and lignin in macadamia shell[J]. Hubei Agricultural Sciences, 2009, 48(11): 2846-2848. DOI:10.3969/j.issn.0439-8114.2009.11.071 |
| [25] |
Acikalin K, Karaca F. Fixed-bed pyrolysis of walnut shell:Parameter effects on yields and characterization of products[J]. Journal of Analytical and Applied Pyrolysis, 2017, 125: 234-242. DOI:10.1016/j.jaap.2017.03.018 |
| [26] |
Ahmadi K A, Ghanadzadeh G H, Ghalami C B. The peanut shell treated with 1-Chloro-2, 3-epoxypropane and its application as an adsorbent in the removal of nitrate from water[J]. Groundwater for Sustainable Development, 2020, 100404. |
| [27] |
Morifi E L, Ofomaja A E, Pillay K. Microwave assisted modified macadamia nutshells/Cu-Mn oxide composite for the removal of Pb(Ⅱ) from aqueous solution[J]. Journal of Environmental Chemical Engineering, 2020, 8(4): 103822. DOI:10.1016/j.jece.2020.103822 |
| [28] |
Hemmati F, Jafari S M, Kashaninejad M, et al. Synthesis and characterization of cellulose nanocrystals derived from walnut shell agricultural residues[J]. International Journal of Biological Macromolecules, 2018, 120: 1216-1224. DOI:10.1016/j.ijbiomac.2018.09.012 |
| [29] |
Niazi L, Lashanizadegan A, Sharififard H. Chestnut oak shells activated carbon:Preparation, characterization and application for Cr(Ⅵ) removal from dilute aqueous solutions[J]. Journal of Cleaner Production, 2018, 185: 554-561. DOI:10.1016/j.jclepro.2018.03.026 |
| [30] |
豆婵婵, 宋继赟, 何笑天, 等.花生壳的红外光谱分析[C].郑州: 第十六届全国分子光谱学学术报告会, 2010. DOU Chan-chan, SONG Ji-yun, HE Xiao-tian, et al. Analysis of infrared spectrum of peanut husk[C]. Zhengzhou: The Sixteenth National Conference on Molecular Spectroscopy, 2010. |
| [31] |
Yuan K, Li S, Zhong F. Treatment of coking wastewater in biofilm-based bioaugmentation process:Biofilm formation and microbial community analysis[J]. Journal of Hazardous Materials, 2020, 400: 123117. DOI:10.1016/j.jhazmat.2020.123117 |
| [32] |
Liang Z, Li W, Yang S, et al. Extraction and structural characteristics of extracellular polymeric substances(EPS), pellets in autotrophic nitrifying biofilm and activated sludge[J]. Chemosphere, 2010, 81(5): 626-632. DOI:10.1016/j.chemosphere.2010.03.043 |
| [33] |
赵梦坷.以花生壳为碳源异养反硝化去除地下水中硝酸盐的研究[D].北京: 中国地质大学(北京), 2019. ZHAO Meng-ke. Heterotrophic denitrification using peanut shell as carbon source for groundwater bioremediation[D]. Beijing: China University of Geosciences(Beijing), 2019. |
| [34] |
杨涛, 郝学凯, 陈宝玉, 等. Al3+对序批式生物膜反应器(SBBR)中污泥脱氢酶活性(DHA)和胞外聚合物(EPS)的影响[J]. 环境科学学报, 2018, 38(4): 1453-1459. YANG Tao, HAO Xue-kai, CHEN Bao-yu, et al. Effects of Al3+ on dehydrogenase activity(DHA)and extracellular polymeric substances (EPS)of activated sludge in a sequencing batch biofilm reactor(SBBR)[J]. Acta Scientiae Circumstantiae, 2018, 38(4): 1453-1459. |
| [35] |
Roach P, Farrar D, Perry C C. Interpretation of protein adsorption: Surface-induced conformational changes[J]. Journal of the American Chemical Society, 2005, 127(22): 8168-8173. DOI:10.1021/ja042898o |
| [36] |
Marsh R J, Jones R A L, Sferrazza M. Adsorption and displacement of a globular protein on hydrophilic and hydrophobic surfaces[J]. Colloids and Surfaces B:Biointerfaces, 2002, 23(1): 31-42. DOI:10.1016/S0927-7765(01)00204-1 |
| [37] |
Moll D M, Summers R S, Fonseca A C, et al. Impact of temperature on drinking water biofilter performance and microbial community structure[J]. Environmental Science & Technology, 1999, 33(14): 2377-2382. |
| [38] |
Gong Z, Yang F, Liu S, et al. Feasibility of a membrane-aerated biofilm reactor to achieve single-stage autotrophic nitrogen removal based on anammox[J]. Chemosphere, 2007, 69(5): 776-784. DOI:10.1016/j.chemosphere.2007.05.023 |
| [39] |
丁绍兰, 谢林花, 马蕊婷. 壳类生物质释碳性能研究[J]. 环境污染与防治, 2016, 38(10): 1-5. DING Shao-lan, XIE Lin-hua, MA Rui-ting. Study on carbon release performance of shells biomass[J]. Environmental Pollution & Control, 2016, 38(10): 1-5. |
| [40] |
Li M, Wu H, Zhang J, et al. Nitrogen removal and nitrous oxide emission in surface flow constructed wetlands for treating sewage treatment plant effluent:Effect of C/N ratios[J]. Bioresource Technology, 2017, 240: 157-164. DOI:10.1016/j.biortech.2017.02.054 |
| [41] |
Sheng G, Yu H, Li X. Extracellular polymeric substances(EPS)of microbial aggregates in biological wastewater treatment systems:A review[J]. Biotechnology Advances, 2010, 28(6): 882-894. DOI:10.1016/j.biotechadv.2010.08.001 |
| [42] |
Zhao J, Wang X, Li X, et al. Improvement of partial nitrification endogenous denitrification and phosphorus removal system:Balancing competition between phosphorus and glycogen accumulating organisms to enhance nitrogen removal without initiating phosphorus removal deterioration[J]. Bioresource Technology, 2019, 281: 382-391. DOI:10.1016/j.biortech.2019.02.109 |
 2020, Vol. 39
2020, Vol. 39


