2. 恩施职业技术学院, 湖北 恩施 445000
2. Enshi Polytecnic, Enshi 445000, China
铅(Pb)是一种严重危害人体健康的重金属元素,是三大重金属污染物之一[1]。Pb具有良好的延展性、柔软性和耐腐蚀性等特性,因而被广泛地应用于冶金、蓄电池、印刷、颜料、油漆等工业与生活用品中[2]。但随着含Pb物质使用的逐渐增加,大量的含Pb化合物随着生活污水、工业废水、工业废料及生活垃圾进入大自然中。由于含Pb化合物在自然条件下不能被降解[3],并可在生物体中进行富集,因此Pb可直接或间接地进入人体,对人体健康造成危害。据报道,Pb进入人体可损伤神经系统及大脑,还可引起婴幼儿脏器发育不全及贫血等疾病,严重威胁人类健康[4]。因此,对于Pb的检测具有十分重要的意义。
目前对Pb2+的常用检测方法有比色法[5-6]、紫外-可见分光光度法[7]、电化学分析法[8]、火焰原子吸收光谱法[9]和电感耦合等离子体质谱法[10]等。但这些方法有的检测灵敏度较低,有的重复性不好,有的需要昂贵的仪器,因此,建立一种简单快速、特异性好、灵敏度高、适用于常规检测Pb2+的方法具有较强的现实意义。
分子信标(Molecular beacon)是一种具有茎-环结构的双标记的寡核苷酸荧光探针,它具有很强的特异性和较高的灵敏度,现已广泛应用于生物学、医学、环境科学及食品科学等领域[11-13]。核酸适配体(Aptamer)是一种经体外筛选得到的、对相应靶标分子(如蛋白质,核酸、病毒,药物分子、重金属离子等)有严格识别能力和高度亲和力的寡核苷酸序列。据报道,Pb2+的核酸适配体已被筛选出来(核酸中的G碱基能与Pb2+形成稳定的G-四联体空间结构)并应用到Pb2+高选择性的检测中[14-16]。目前基于Pb2+核酸适配体及分子信标对Pb2+的定量检测已有一些应用,但检测过程较为复杂,不适合快速的常规检测[17-18]。
为了简化Pb2+定量检测的步骤,加快其检测速度,同时提高检测的灵敏度,本实验基于Pb2+的核酸适配体[19],设计了一个能特异性识别Pb2+的双荧光基团分子信标,利用分子信标直接对Pb2+进行检测,建立了一个Pb2+的快速常规检测方法。该分子信标由能发生荧光共振能量转移的两个荧光基团(FAM和TAMRA)代替经典分子信标中的一个荧光基团和一个猝灭基团,与FAM相连接的3个核苷酸中都含有鸟嘌呤(G碱基),分子信标的环及茎的一部分设计为Pb2+的核酸适配体。在这个分子信标中,TAMRA既是一个荧光基团,又是一个猝灭基团,它本身能发射荧光,同时又可以对一些荧光基团的荧光进行猝灭。FAM的发射光谱与TAMRA的吸收光谱有重叠,所以当荧光基团FAM和TAMRA靠近时,FAM的荧光能被TAMRA所吸收。另外,G碱基在荧光共振能量转移中可以通过光诱导电子转移的方式猝灭TAMRA所发射的荧光,且具有很好的猝灭效果[20]。因此,在该分子信标中,FAM的荧光能被TAMRA所猝灭,TAMRA的荧光能被G碱基所猝灭,在没有Pb2+存在时,FAM和TAMRA的荧光信号都很弱。当分子信标与Pb2+反应后,分子信标的茎-环结构被破坏,FAM与TAMRA、TAMRA与G碱基彼此分开,距离增加,荧光共振能量转移及光诱导的电子转移消失,FAM与TAMRA的荧光同时得到恢复。根据FAM与TAMRA荧光恢复的程度即可实现对Pb2+的定量检测。
与目前已有的基于分子信标及核酸适配体对Pb2+的定量检测方法相比,本方法利用分子信标直接与Pb2+反应实现对Pb2+的检测,简化了Pb2+定量检测的步骤,加快了检测速度。另外,本方法所构建的分子信标在对Pb2+进行定量检测时能产生两个不同的荧光响应信号,利用TAMRA与FAM的总荧光强度对Pb2+进行定量分析,可显著提高检测的灵敏度。
1 材料与方法 1.1 仪器与试剂实验所用仪器包括RF-5301PC型荧光光谱仪(日本Shimadzu公司),PHS-3C pH计(中国上海仪电科学仪器股份有限公司)。Pb(NO3)2试剂为优级纯(型号:GR500G),其他所有化学试剂均为分析纯,购于国药集团化学试剂有限公司(中国);实验所用的缓冲溶液为0.1 mol·L-1的Tris-HNO3缓冲溶液;分子信标由上海生工生物技术有限公司(中国)合成并用高效液相色谱法进行纯化,其碱基序列为:5′ -FAM-(CH2)6-GGG AAA CCA CTG GAA GGT GTG GAA GGT TTC CC-(CH2)6-TAMRA-3′(斜体部分为Pb2+核酸适配体的碱基序列)。
1.2 样品制备分子信标用0.1 mol·L-1的Tris-HNO3缓冲溶液(pH 8.3,含60 mmol·L-1的NaNO3)稀释成浓度为3× 10-7 mol·L-1的储备液,Pb(NO3)2用蒸馏水配制成不同浓度的溶液备用。将50 μL不同浓度的Pb(NO3)2溶液加入到50 μL 3×10-7 mol·L-1的分子信标溶液中混合均匀,在45 ℃的水浴锅中加热12 min,冷却至常温后,加入Tris-HNO3缓冲溶液至终体积达到500 µL,在室温下反应35 min,然后对体系中FAM及TAMRA的荧光信号进行检测。除非文中特别指明,本研究中所有样品的测定条件均与以上条件保持一致。
1.3 水样的取样与消化自来水取自湖北民族大学基础化学实验教学示范中心实验室,天然矿泉水取自湖北恩施龙洞河源头,河水取自湖北恩施龙洞河三孔桥处(离源头3 km处,途经一个医院和一所高校),取样时间均为2020年7月5日中午。采水过程中所用的简易采水器和盛水容器均为聚乙烯材质,采集自来水时先放水5 min再进行取样,天然矿泉水和河水的取样均使用洗净的简易采水器,润洗3次后在水深20 cm处采集水样,水样带回实验室后冷藏保存,并于当日完成测定。所取水样清彻透明,无色、无悬浮杂质和沉淀。消化时,移取水样100 mL于消化罐中,加入5 mL浓HNO3溶液,然后置于温控板上加热,温度设为90 ℃。待样品蒸发至体积约为10 mL时,再加入5 mL浓HNO3与2 mL浓HClO4溶液,再次加热至体积为1 mL左右。重复上述步骤,直至溶液澄清透明为止。将最终样品冷却至室温后,用0.45 μm滤膜过滤,然后转移至100 mL容量瓶中,用2%的硝酸溶液定容。
1.4 Pb2+的检测Pb2+的检测通过对反应后体系中FAM及TAMRA的荧光信号进行检测来实现,本实验采用同步荧光分析法对FAM及TAMRA的荧光信号进行检测。荧光基团FAM最大激发波长为494 nm,最大发射波长为520 nm,荧光基团TAMRA的最大激发波长为559 nm,最大发射波长为582 nm,它们的斯托克斯位移(Stokes shift)分别为26 nm与23 nm,为了同时满足FAM及TAMRA荧光信号的测定,同步扫描的波长间隔(∆λ)设置为25 nm,荧光分光光度计的激发及发射狭缝宽度均设置为10 nm。所有荧光强度的数值均在FAM或TAMRA的最大发射波长处测得。
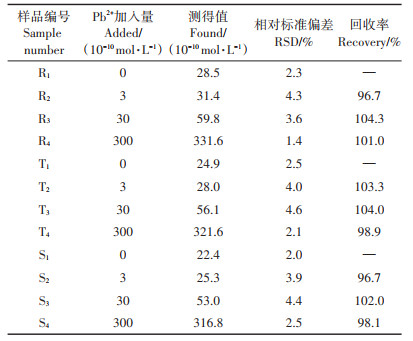
2 结果与讨论 2.1 实验原理检测Pb2+的原理如图 1所示,荧光基团FAM连接在分子信标的5′端,与FAM相连接的3个核苷酸中的碱基均为G碱基,另一个荧光基团TAMRA连接在分子信标的3′端,分子信标的环及茎的一部分设计为Pb2+的适配体(GGA AGG TGT GGA AGG)。没有Pb2+存在时,分子信标为茎-环结构,FAM与TAMRA的荧光信号都很弱。当有Pb2+存在时,分子信标与Pb2+反应形成稳定的G-四联体结构,分子信标的茎-环结构被破坏,FAM与TAMRA的荧光同时得到恢复。在分子信标过量的前提下,Pb2+的浓度越大,与Pb2+结合的分子信标就越多,FAM与TAMRA的荧光信号就越强。根据FAM与TAMRA荧光增加的程度,即可实现对Pb2+的双色荧光定量检测。
|
图 1 基于双荧光基团分子信标检测Pb2+的基本原理 Figure 1 Principle of detection for Pb2+ based on dual-fluorophore molecular beacon |
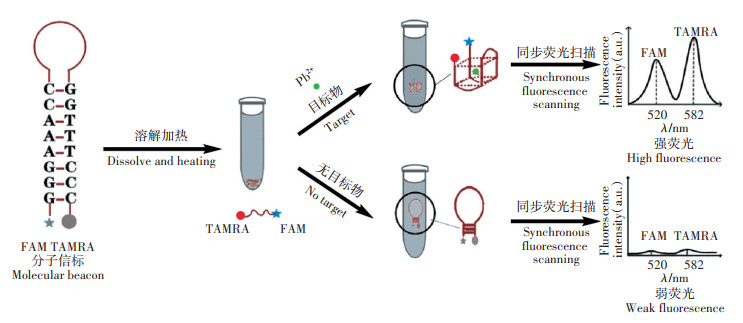
图 2为分子信标与不同浓度的Pb2+反应后,体系中荧光基团TAMRA与FAM所对应的荧光光谱图。从图 2可以看出,当没有Pb2+存在时,TAMRA与FAM的荧光信号都很弱(图 2a),但加入不同浓度的Pb2+后,TAMRA与FAM的荧光信号都显著增强,且Pb2+的浓度越大,它们的荧光信号也越强。这说明利用该方法对Pb2+进行定量检测是可行的。
|
(a)3×10-8 mol·L-1的分子信标;(b)a+2×10-8 mol·L-1的Pb2+;(c)a+4×10-8 mol·L-1的Pb2+ (a)3×10-8 mol·L-1 molecular beacons; (b)a+2×10-8 mol·L-1 Pb2+; (c)a+4×10-8 mol·L-1 Pb2+ 图 2 不同浓度的Pb2+体系所对应的同步荧光光谱图 Figure 2 The synchronous fluorescence spectra of system at different concentrations of Pb2+ |
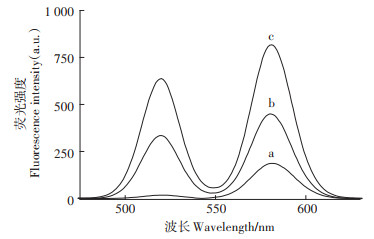
本实验以Tris-HNO3为缓冲体系,探究了缓冲体系的pH对测定结果的影响(图 3)。结果表明,缓冲体系的pH在7.4~8.3的范围内时,荧光基团FAM及TAMRA的荧光强度均随着pH的增加而增加;当pH大于8.3时,FAM及TAMRA的荧光强度均随着pH的增加逐渐降低。这说明当缓冲体系的pH较低时(< 8.3),分子信标与Pb2+形成G-四联体结构的稳定性随pH的升高而加强;当pH较高时(˃8.3),分子信标与Pb2+形成G-四联体结构的稳定性随pH的升高而逐渐减弱。因此,本实验选择pH为8.3的Tris-HNO3缓冲体系。
|
分子信标的浓度为3×10-8 mol·L-1,Pb2+的浓度4×10-8 mol·L-1。下同 Concentration of molecular beacons is 3×10-8 mol·L-1, and the concentration of Pb2+ is 4×10-8 mol·L-1. The same below 图 3 pH对荧光强度的影响 Figure 3 Effect of pH on fluorescence intensity |
为了使分子信标与Pb2+更好更快地结合形成G-四联体结构,反应体系进行了加热处理,目的是在加热时使分子信标的茎部打开,在冷却过程中,分子信标更容易与Pb2+特异性结合,形成稳定的G-四联体结构。为了得到合适的加热时间和温度,本实验对加热时间和温度对测定结果的影响进行了考察。
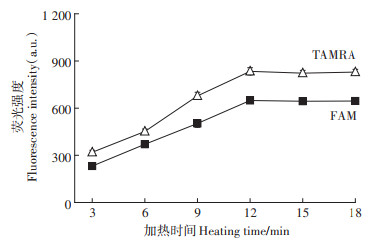
当温度为45 ℃、加热时间为3~12 min时,FAM及TAMRA的荧光强度均随加热时间增加而增大,当加热时间超过12 min后,其荧光强度基本不变,说明在12 min之内分子信标的茎部即可完全打开(图 4),因此本实验孵育时间选择为12 min。
|
图 4 加热时间对荧光强度的影响 Figure 4 Effect of heating time on fluorescence intensity |
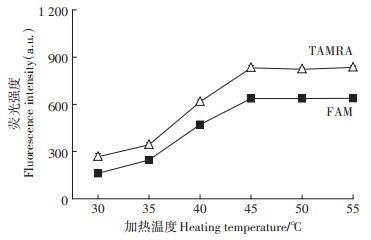
当加热时间为12 min时,考察了温度对测定结果的影响。结果(图 5)表明,当温度在35~45 ℃时,FAM及TAMRA的荧光强度均随温度的升高而增大,当温度高于45 ℃时,其荧光强度几乎不再变化。因此本实验的加热温度选择为45 ℃。
|
图 5 加热温度对荧光强度的影响 Figure 5 Effect of temperature on the fluorescence intensity |
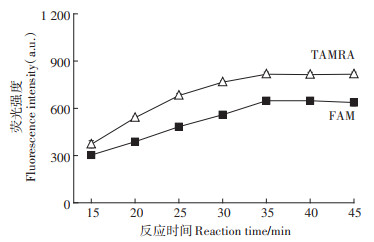
将分子信标与Pb2+的混合物加热之后,取出冷却至室温,此时分子信标与Pb2+特异性结合形成G-四联体。本实验对分子信标与Pb2+的结合时间进行了考察。结果(图 6)表明,在20~35 min内,FAM及TAMRA的荧光强度均随着反应时间的增加而增大,随后趋于稳定。这说明分子信标与Pb2+在35 min内即可反应完成。根据文献[17-18]报道,已有的基于分子信标对Pb2+的检测方法,反应时间都需要60 min以上,因此本方法极大缩短了反应时间,可显著加快Pb2+的检测速度。
|
图 6 反应时间对荧光强度的影响 Figure 6 Effect of reaction time on fluorescence intensity |
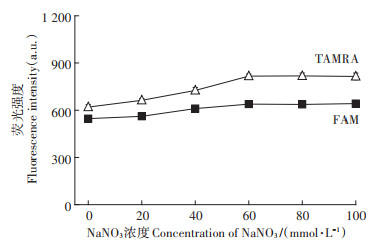
溶液中的阳离子可以中和分子信标的负电荷,使分子信标与Pb2+结合更加稳定[21],因此溶液中电解质的浓度对测定结果会有影响。本实验通过改变缓冲溶液中NaNO3的浓度,来探讨电解质的浓度对反应体系的影响。结果(图 7)表明,当NaNO3浓度在0~60 mmol·L-1时,FAM及TAMRA的荧光强度均随着NaNO3浓度的增大而逐渐增大,当NaNO3的浓度超过60 mmol·L-1时,FAM及TAMRA的荧光强度趋于稳定。因此本实验选择含60 mmol·L-1的NaNO3缓冲溶液。
|
图 7 NaNO3浓度对荧光强度的影响 Figure 7 Effect of NaNO3 concentration on fluorescence intensity |
在优化条件下,对不同浓度Pb2+所对应的FAM及TAMRA的荧光强度进行了考察。图 8a为不同浓度Pb2+所对应的FAM及TAMRA的同步扫描的荧光光谱图。图 8b和图 8c分别为FAM及TAMRA在其最大波长处的荧光强度与Pb2+浓度之间的线性关系,图 8d为FAM及TAMRA在其最大波长处的荧光强度之和与Pb2+浓度之间的线性关系。结果表明,Pb2+浓度在8× 10-10 ~4×10-8 mol·L-1范围内,FAM、TAMRA的荧光强度(ΔI,ΔI=I-I0,I0为体系中没有Pb2+时荧光强度,I为体系中存在Pb2+时的荧光强度)分别与Pb2+的浓度(C)呈现出良好的线性关系,其拟合的回归方程分别为ΔI1 =1.543C+8.953(R12=0.992 8),ΔI2 =1.532C+9.678(R2 2=0.994 6)。利用FAM、TAMRA的荧光强度对Pb2+进行定量分析时的检出限分别为2.5×10-10 mol·L-1及3.0×10-10 mol·L-1。另外,TAMRA与FAM的总荧光强度与Pb2+的浓度(C)在8×10-10 ~4×10-8 mol·L-1范围内同样呈现出良好线性关系,其拟合的回归方程为ΔIT = 3.052C+13.129(RT2=0.998 7),检出限为1.5×10-10 mol·L-1。这说明利用TAMRA与FAM的总荧光强度对Pb2+进行定量分析时,其灵敏度更高(斜率更大)。对9个浓度均为7×10-9 mol·L-1的平行样品进行测定,其相对标准偏差(RSD)为3.8%,说明该方法具有较好的精密度。
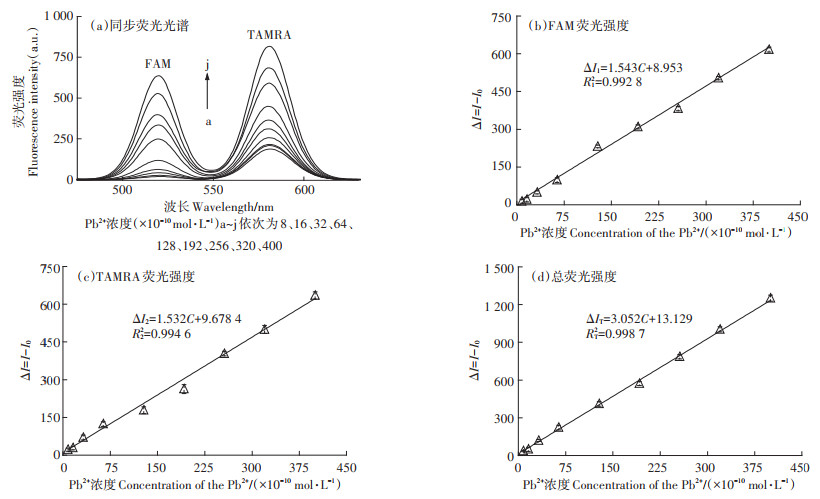
|
图 8 不同Pb2+浓度所对应的FAM及TAMRA的同步荧光光谱图、FAM及TAMRA的荧光强度、FAM和TAMRA的总荧光强度与Pb2+浓度的线性关系图 Figure 8 Synchronous fluorescence spectra of FAM and TAMRA at different concentrations of Pb2+, the linear relationships between the fluorescence intensity of FAM, the fluorescence intensity of TAMRA, and the total fluorescence intensity of FAM and TAMRA and the Pb2+ concentration, respectively |
为了考察方法的特异性,将水体中常见的阳离子及能与Pb2+发生配位或沉淀反应的阴离子分别加入到含Pb2+浓度相同的溶液中,并与只含Pb2+的溶液进行对比实验。在各个浓度均为4×10-8 mol·L-1的Pb2+溶液中分别加入浓度为1×10-5 mol·L-1的Hg2+(Hg)、K+(K)、Na+(Na)、Ca2+(Ca)、Mg2+(Mg)、Mn2+(Mn)、Ni2+(Ni)、Cd2+(Cd)、Cu2+(Cu)、Fe3+(Fe)、Al3+(Al)、Cr3+(Cr)、Cl-(Cl)、Br-(Br)、Ac-(Ac)、SO42-(S)的溶液,在相同的条件下与4×10-8 mol·L-1的Pb2+(Pb)进行对比实验。结果(图 9)表明,即使在含Pb2+的溶液中加入浓度远大于Pb2+浓度的其他离子,各样品所对应的荧光强度也几乎没有变化,这表明上述离子的存在对Pb2+的检测没有干扰,即该方法对Pb2+具有很高的选择性。尽管有一些阳离子(如K+)也能与含G碱基的分子信标形成G-四联体结构,但据文献[19]报道,当Pb2+与K+同时存在时,Pb2+与G碱基结合形成G-四联体结构比K+与G碱基结合形成G-四联体结构要更稳定,因此K+的存在不会对Pb2+的检测产生干扰,本实验的结果也证明了这一点。另外,尽管水样中还存在其他不同的阴离子,但考虑到分子信标是带负电的,水样中带负电的阴离子与分子信标存在排斥作用[22-23],不会发生反应,因此本实验只考察能与Pb2+发生配位或沉淀反应的阴离子。
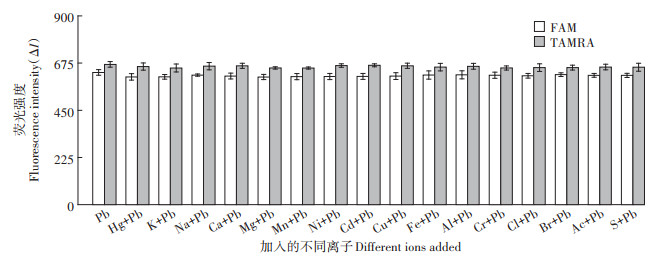
|
分子信标浓度为3×10-8 mol·L-1,Pb2+浓度为4×10-8 mol·L-1,其他离子浓度均为1×10-5 mol·L-1 Concentration of molecular beacon is 3×10-8 mol·L-1, concentration of Pb2+ is 4×10-8 mol·L-1, and concentration of other ions is 1×10-5 mol·L-1 图 9 方法特异性分析 Figure 9 Specificity analysis of methods |
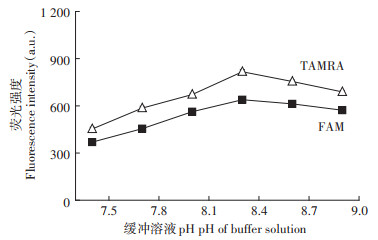
为了验证方法的实用性,本实验对实际水样中的Pb2+进行了检测,并进行加标回收实验。在自来水、天然矿泉水及河水3种不同类型的水样中,分别取4份相同的水样,加入不同浓度的Pb(NO3)2溶液(表 1),消解后各取50 μL按本方法对各样品中的Pb2+浓度进行测定。表 1的结果显示,河水、自来水及天然矿泉水水样中Pb的含量分别为2.85×10-9 mol·L-1、2.49×10-9 mol·L-1及2.24×10-9 mol·L-1,均低于国家规定的饮用水Pb2+含量标准。在这3种实际水样中进行加标回收实验,其回收率在96.7%~104.3%,且所取水样测定结果的相对标准偏差都小于5%,这说明本方法在实际样品的检测中具有较高的准确度。
|
|
表 1 采用本方法分别测定河水水样(Ri)、自来水水样(Ti)与矿泉水水样(Si)中的Pb2+(n=3) Table 1 Determination of Pb2+ in river water samples(Ri), tap water samples (Ti) and spring water sample(Si) by this method(n=3) |
(1)本实验利用Pb2+的适配体及两个荧光基团FAM与TAMRA构建了一种能特异性地识别Pb2+的特殊的双荧光基团分子信标,并利用该分子信标建立了一种高灵敏的Pb离子双色荧光定量检测方法。
(2)利用所建立的分析方法实现了不同类型水样品中Pb2+的定量检测,其加标回收率在96.7% ~ 104.3%,且所取水样测定结果的相对标准偏差都小于5%。
(3)该方法操作简单、特异性好、灵敏度高,是一种适用于水体中Pb2+常规快速的定量检测方法。
| [1] |
Wang C Y, Fang B Y, Yao M H, et al. Visualization detection of ultratrace lead and cadmium ions using cellulose acetate membrane based on silver stain[J]. Sensors and Actuators. B, Chemical, 2016, 228: 643-648. DOI:10.1016/j.snb.2016.01.080 |
| [2] |
Tong P, Zhao R, Zhang R, et al. Characterization of lead(Ⅱ)-containing activated carbon and its excellent performance of extending lead-acid battery cycle life for high-rate partial-state-of-charge operation[J]. Journal of Power Sources, 2015, 286: 91-102. DOI:10.1016/j.jpowsour.2015.03.150 |
| [3] |
Ma L H, Wang H B, Fang B Y, et al. Visual detection of trace lead ion based on aptamer and silver staining nano-metal composite[J]. Colloids and Surfaces. B, Biointerfaces, 2018, 162: 415-419. DOI:10.1016/j.colsurfb.2017.12.011 |
| [4] |
Kosnett M J. Chelation for heavy metals(arsenic, lead, and mercury): Protective or perilous?[J]. Clinical Pharmacology and Therapeutics, 2010, 88(3): 412-415. DOI:10.1038/clpt.2010.132 |
| [5] |
Chaiyo S, Apiluk A, Siangproh W, et al. High sensitivity and specificity simultaneous determination of lead, cadmium and copper using μPAD with dual electrochemical and colorimetric detection[J]. Sensors and Actuators. B, Chemical, 2016, 233: 540-549. DOI:10.1016/j.snb.2016.04.109 |
| [6] |
Rong M, Li J, Hu J, et al. A highly sensitive and colorimetric biosensor based on magnetic nano-DNAzyme for detection of lead(Ⅱ)ion in real water samples[J]. Journal of Chemical Technology and Biotechnology, 2018, 93(11): 3254-3263. DOI:10.1002/jctb.5684 |
| [7] |
Faraji H, Helalizadeh M. Lead quantification in urine samples of athletes by coupling DLLME with UV-Vis spectrophotometry[J]. Biological Trace Element Research, 2016, 176(2): 258-269. |
| [8] |
Huang X, Li J, Zhang Q, et al. A protease-free and signal-on electrochemical biosensor for ultrasensitive detection of lead ion based on GR-5 DNAzyme and catalytic hairpin assembly[J]. Journal of Electroanalytical Chemistry(Lausanne, Switzerland), 2018, 816: 75-82. |
| [9] |
Tavallali H, Lalehparvar S, Nekoei A R, et al. Ion-flotation separation of Cd(Ⅱ), Co(Ⅱ)and Pb(Ⅱ)traces using a new ligand before their flame atomic absorption spectrometric determinations in colored hair and dryer agents of paint[J]. Journal of the Chinese Chemical Society, 2011, 58(2): 199-206. DOI:10.1002/jccs.201190077 |
| [10] |
Yilmaz V, Arslan Z, Rose L. Determination of lead by hydride generation inductively coupled plasma mass spectrometry(HG-ICP-MS): On-line generation of plumbane using potassium hexacyanomanganate(Ⅲ)[J]. Analytica Chimica Acta, 2013, 761: 18-26. DOI:10.1016/j.aca.2012.11.039 |
| [11] |
Su R, Zheng H, Dong S, et al. Facile detection of melamine by a FAM-aptamer-G-quadruplex construct[J]. Analytical and Bioanalytical Chemistry, 2019, 411(12): 2521-2530. DOI:10.1007/s00216-019-01688-3 |
| [12] |
Farzin L, Shamsipur M, Sheibani S. A review:Aptamer-based analytical strategies using the nanomaterials for environmental and human monitoring of toxic heavy metals[J]. Talanta, 2017, 174: 619-627. DOI:10.1016/j.talanta.2017.06.066 |
| [13] |
鲁子敬, 熊威威, 翟琨, 等. 基于双重猝灭分子信标及核酸染料Hoechst 33258对单链核酸的双色定量检测[J]. 分析化学, 2019, 47(7): 1014-1020. LU Zi-jing, XIONG Wei-wei, ZHAI Kun, et al. Dual color fluorescence quantitative detection of DNA sequences with double-quenching molecular beacons and nucleic acid Hoechst 33258[J]. Chinese Journal of Analytical Chemistry, 2019, 47(7): 1014-1020. |
| [14] |
Wei X P, Yang F, Ding F, et al. An electrochemiluminescence biosensor for determination of Pb2+ based on G-Quadruplex of aptamer probe[J]. Chinese Journal of Analytical Chemistry, 2014, 42(7): 942-947. DOI:10.1016/S1872-2040(14)60750-7 |
| [15] |
刘兴奋, 王亚腾, 华笑笑, 等. 基于阳离子型共轭聚合物和核酸适配体的高灵敏铅离子快速检测方[J]. 分析化学, 2016, 44(7): 1092-1098. LIU Xing-fen, WANG Ya-teng, HUA Xiao-xiao, et al. Rapid detection of lead ion(Ⅱ)based on cationic conjugated polymer and aptamer[J]. Chinese Journal of Analytical Chemistry, 2016, 44(7): 1092-1098. |
| [16] |
吕菊波, 张亚会, 孟凡斌, 等. 基于DNA双链取代策略免标记检测铅离子的研究[J]. 分析测试学报, 2018, 37(1): 92-97. LÜ Ju-bo, ZHANG Ya-hui, MENG Fan-bin, et al. Detection of lead ion based on DNA double-strand replacement and lable-free method[J]. Journal of Instrumental Analysis, 2018, 37(1): 92-97. DOI:10.3969/j.issn.1004-4957.2018.01.015 |
| [17] |
刘涛, 李丹, 梁杰, 等. 基于核酸外切酶Ⅲ及DNAzyme的铅离子荧光传感器的研究[J]. 分析化学, 2020, 48(2): 248-254. LIU Tao, LI Dan, LIANG Jie, et al. A fluorescence biosensor for lead ion detection based on DNAzyme and exonuclease Ⅲ[J]. Chinese Journal of Analytical Chemistry, 2020, 48(2): 248-254. |
| [18] |
Liu H W, Chen Y T, Song C L, et al. Novel and label-free colorimet ric detection of radon using AuNPs and lead(Ⅱ)-induced GR5 DNAzyme-based amplification strategy[J]. Analytical & Bioanalytical Chemistry, 2018, 410(17): 4227-4234. |
| [19] |
Lu Y, Li X, Wang G, et al. A highly sensitive and selective optical sensor for Pb2+ by using conjugated polymers and label-free oligonucleotides[J]. Biosensors & Bioelectronics, 2013, 39(1): 231-235. |
| [20] |
Xiang D S, Li F Q, Wu C Y, et al. The G-BHQ synergistic effect:Improved double quenching molecular beacons based on guanine and black hole quencher for sensitive simultaneous detection of two DNAs[J]. Talanta, 2017, 174: 289-294. DOI:10.1016/j.talanta.2017.06.020 |
| [21] |
Yu Z, Zhou W, Han J, et al. Na+ induced conformational change of Pb2+ stabilized G-quadruplex and its influence on Pb2+ detection[J]. Analytical Chemistry, 2016, 88(19): 9375-9380. DOI:10.1021/acs.analchem.6b02466 |
| [22] |
Sigel R K O, Sigel H. A stability concept for metal ion coordination to single-stranded nucleic acids and affinities of individual sites[J]. Accounts of Chemical Research, 2010, 43(7): 974-984. DOI:10.1021/ar900197y |
| [23] |
Turdean, Graziella L. Design and development of biosensors for the detection of heavy metal toxicity[J]. International Journal of Electro-chemistry, 2011. DOI:10.4061/2011/343125 |
 2020, Vol. 39
2020, Vol. 39