2. 生态环境及其信息图谱福建省高等学校重点实验室(莆田学院), 莆田学院环境与生物工程学院, 福建 莆田 351100
2. Laboratory of Ecological Environment and Information Atlas(Putian University) Fujian Provincial University, School of Environmental and Biological Engineering, Putian University, Putian 351100, China
邻苯二甲酸酯类(Phthalic acid esters,PAEs)又称酞酸酯,具有较强的生殖毒性效应和内分泌干扰效应,部分PAEs对动物还具有致畸、致突变作用,对生态环境构成了极大危害,对人体健康构成了严重威胁[1-2]。周生贤[3]报告指出,我国约有1000万hm2耕地受到了污染,占全国总耕地面积的8.3%。大气沉降、污水灌溉、垃圾堆放、塑料薄膜使用等直接或间接途径导致土壤受到PAEs污染,使土壤成为PAEs污染物的集合地[4-6]。调查数据表明,我国多地工业、农业区土壤遭受了PAEs不同程度的污染,污染水平一般在0.09 μg·kg-1至45.67 mg·kg-1,蔬菜基地和灌区污染相对较为严重,在不同的PAEs组分中,邻苯二甲酸正二丁酯(Di-n-butyl phthaiate,DnBP)和邻苯二甲酸二(2-乙基己)酯[Di-(2-ethylhexylPhthalate,DEHP)]的检出率和污染水平较高[7-9]。目前,环境中PAEs的降解主要包括非生物降解和生物降解。其中非生物降解包括水解和光解等,而生物降解又包括好氧生物降解与厌氧生物降解两种形式。土壤环境中PAEs难以通过水解或光解去除,微生物降解被认为是PAEs从土壤环境中消减的主要途径,对影响PAEs在环境中的归宿起着关键作用[10]。
富里酸(Fulvic acid,FA)是广泛存在于土壤、沉积物和水环境中的溶解性有机质,是土壤腐殖质的重要组分之一[11]。FA的分子结构与腐殖质的其他组分(胡敏酸和胡敏素)具有相似性,含有大量羧基、醇羟基、酚羟基、醌型羟基和酮型羟基等官能团[12]。FA的分子中包含疏水结构,因而其具有结合土壤中有机污染物的能力,影响土壤有机污染物的环境归宿,引起了环境科学及其相关领域学者们的广泛关注[13]。Luc等[14]研究发现土壤或沉积物中FA能够明显增强多环芳烃的水溶性,加速多环芳烃在土壤剖面中的垂直移动。土壤淋溶试验表明,在溶解性富里酸(FDOM)持续淋溶条件下,土壤中多环芳烃(Polycy- clic aromatic hydrocarbons,PAHs)的淋失率可达到92%左右[15]。分别从沉积物和土壤中分离出富里酸,然后测定芘在富里酸-水体系中的KOC值,结果表明溶解性的富里酸对芘的亲和力随自身芳香性的增加而加强,而且富里酸的芳香性越高,KOC值越小[16]。
目前,关于腐殖质组分FA对土壤中DnBP的降解动力学及土壤微生物活性方面的研究尚鲜见报道。因此,本文以结构典型且在我国农业土壤中检出率和污染水平较高的DnBP为目标污染物,采用土壤培养试验,研究了FA对土壤中DnBP的降解动力学过程、土壤基础呼吸和土壤酶活性的影响规律,以期为深入理解PAEs在土壤中的降解行为及其污染土壤生物修复提供理论基础和数据依据。
1 材料与方法 1.1 供试材料供试土壤采自辽宁省沈阳市新民蔬菜基地农田,采样点地理坐标为41°48′ 41″ N、122°50′ 47″ E,采样深度0~20 cm。将土壤样品充分混合均匀,自然风干,研磨过2 mm筛,保存备用。土壤类型为潮棕壤,经测定土壤pH为5.81,有机质含量为3.01%,总氮含量为0.21%,总磷含量为0.024%。
供试富里酸(FA)购于南京都莱生物技术有限公司;DnBP标准溶液(1000 µg·mL-1)购于百灵威科技有限公司;所用丙酮、二氯甲烷、正己烷等有机试剂均为色谱纯试剂,且经色谱检验无杂峰;无水硫酸钠(分析纯)在马弗炉中于400 ℃条件下烘干4 h;玻璃器皿均用重铬酸钾洗涤液浸泡、洗净后,于450 ℃烘4 h,备用。
1.2 污染土壤制备结合本地区自然状态下土壤中富里酸的含量,设置土壤中富里酸的处理浓度为10、20、40、80、160 mg· g-1(分别记作F1、F2、F3、F4、F5)。首先向每份400 g的土壤中加入不同质量的FA,使土壤中FA的浓度达到设定梯度,充分混合均匀;同时设不含FA的对照处理组(CK)。将一定量DnBP溶于丙酮中,配成设定浓度的DnBP丙酮溶液,然后按50 mL·kg-1土壤的比例添加到上述土壤中,充分混合均匀,放在通风橱内室温风干7 d,待丙酮自然挥发后,再次充分混合均匀、分装。土壤中DnBP处理浓度为:100 mg·kg-1。同时每个处理保留一份50 g左右的土壤于纸袋中,用于污染土壤中DnBP浓度测定。
1.3 土壤培养试验准确称取15.000±0.002 g土壤样品于250 mL三角瓶中,将土壤样品均匀平铺于锥形瓶底部,按土壤田间持水量的60%加入纯水(从此刻开始计算培养时间)。然后用铝箔纸封口,在铝箔纸中央打孔,放入恒温恒湿培养箱中避光培养,培养条件为:温度25 ℃,湿度80%,每隔2 d称量三角瓶的总质量,计算水分损失量,补充水分,维持土壤含水量。每个处理24个重复。
分别于第5、10、15、20、25、30、35、40 d培养试验开始时的相同时刻,将三角瓶用带有双通阀的胶塞密封,关闭双通阀,密闭培养24 h后在双通阀的一端连接50 mL注射器,打开双通阀,抽取三角瓶内的气体,吸打混合3次后抽取瓶内气体20 mL,关闭双通阀,连同三通阀一起取下注射器,防止采集的气体溢出,采集的气体样品于12 h内完成测试。同时采集土壤样品,用于土壤酶活性测定和土壤中DnBP含量分析。用于酶活性测定的土壤置于纸袋中,放冰箱4 ℃冷藏保存,3 d内完成测定;用于DnBP含量测定的土壤于室温风干,过20目筛,冰箱冷冻保存,备测。每个处理3个重复。
1.4 样品分析土壤中DnBP提取采用超声波提取法[17],提取液中DnBP含量分析采用气相色谱法[18, 20]。色谱分析条件为:进样口温度为250 ℃,检测器温度为300 ℃。柱升温程序:150 ℃保持0.5 min,5 ℃ · min-1升温至220 ℃,3 ℃·min-1升温至255 ℃,30 ℃·min-1升温至280 ℃,保持10 min,载气流量为1.2 mL·min-1。不分流进样模式,进样体积为1 μL。以3倍信噪比作为方法检出限,DnBP的检出限为:0.01 mg·kg-1。DnBP加标回收率为84.33%~94.42%,土壤空白和试剂空白中目标化合物低于检出限,满足分析要求。
气体样品中CO2含量分析采用GC-FID法进行[21],气相色谱仪为CP-7890B(Agilent,USA),色谱柱为Col2:SS-2 m×2 mm Porapak Q(60/80目),检测条件按文献方法进行,检测器温度为250 ℃。土壤脱氢酶活性的测定采用TTC还原法[22];土壤过氧化氢酶活性的测定采用高锰酸钾滴定法[23]。
1.5 数据分析采用SPSS 18.0软件进行ANOVA、Pearson相关分析,采用Microsoft Excel进行通径分析,采用Original 8.5.1进行动力学曲线拟合及制图。
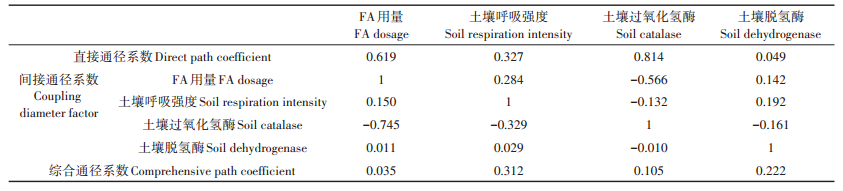
2 结果与讨论 2.1 DnBP在土壤中的降解动力学将DnBP在土壤中的降解动态数据进行拟合,结果发现其在土壤中的降解动力学符合一级反应动力学模型(见图 1),动力学方程及相关参数列于表 1。如表 1所示,DnBP的一级降解动力学方程的相关系数(R2)均大于0.9,表明该拟合方程能够准确描述土壤中DnBP残余量与培养时间的关系。由表中数据可以看出,对照处理组(CK)土壤中DnBP降解的半衰期为5.069 d,添加不同浓度FA各处理组的DnBP降解的半衰期为2.440~3.430 d,约为CK的48.1%~67.7%。F1~F3(10~40 mg·g-1)处理,DnBP在土壤中的半衰期随FA浓度的增加而缩短,而当FA的浓度进一步增加时(80~160 mg·g-1),DnBP的降解半衰期出现了变长的趋势。这表明FA的添加促进了土壤中DnBP的降解,且具有明显的浓度效应,当FA添加浓度过高时,Dn⁃ BP降解速度减慢。
|
图 1 DnBP在土壤中的降解动力学曲线 Figure 1 Degradation kinetics of DnBP in soil |
|
|
表 1 土壤中DnBP的降解动力学方程 Table 1 The kinetic equation of DnBP degradation in soil |
PAEs具有一定的生物降解性,并且碳链越短,降解所需要的时间越短,降解速率越快。王鑫宏[24]研究了DnBP和DEHP在土壤中的生物降解性,降解动力学结果表明,50、100 mg·kg-1的DnBP在土壤中的降解半衰期分别为5.28 d和6.93 d;郭倩[25]在研究不同浓度DnBP在土壤中的降解动力学时发现,当DnBP处理浓度为100 mg·kg-1时,其在潮棕壤中的半衰期为5.87 d;这些研究结果与本研究对照处理的半衰期相近。李丽等[26]试验证明,腐殖质加速了PAHs的降解,提高了微生物聚生体的矿化速率;这些研究结果说明富里酸能够促进土壤中有机污染物的降解,与本文研究结果相一致。
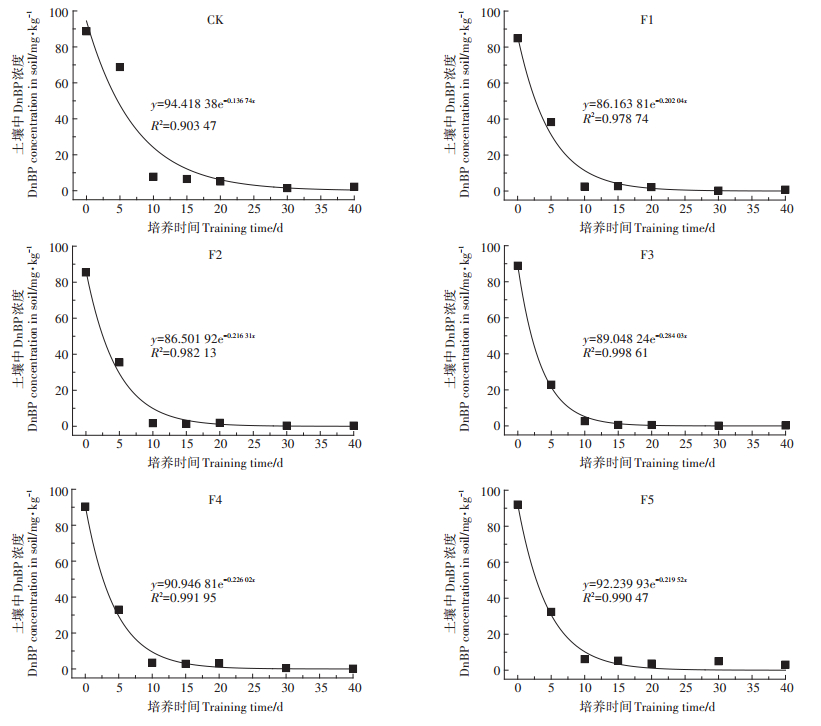
2.2 FA对土壤呼吸作用的影响图 2为不同浓度FA处理组土壤CO2释放量随培养时间的变化情况。如图 2所示,空白对照组(CK)土壤呼吸强度始终保持较低水平,随培养时间的延长呈现先快速增大而后缓慢减小的趋势。FA处理各组CO2释放量随培养时间的变化规律与CK类似,但FA处理各组土壤呼吸强度均高于对照组,说明FA的添加促进了土壤的基础呼吸。在培养第5~10 d,F1~F2(10~20 mg·g-1)处理组CO2释放量逐渐增加,在培养第10 d时,CO2释放量达到峰值;在培养第5~15 d,F3~F5(40~160 mg·g-1)处理组CO2释放量大幅增加,在培养第15 d时CO2释放量达到峰值,但CO2释放量随着FA浓度的增加而减少,F4(80 mg·g-1)处理组对土壤呼吸强度促进作用最大,峰值期CO2释放量约为空白对照组的40.87倍;而后随着培养时间的延长各个处理CO2释放量均逐渐减少。
|
图 2 不同浓度FA处理土壤CO2日排放量随培养时间的变化情况 Figure 2 Changes of CO2 emissions from soils treated with different concentrations of FA with culture time |
FA处理各组土壤呼吸强度均高于对照组,说明FA的添加促进了土壤的基础呼吸。但土壤基础呼吸高峰期与DnBP降解高峰期并不一致,分析其原因可能主要为:培养初期添加了富里酸、DnBP使土壤环境的稳定性发生变化,土壤微生物活动随之发生改变,而当微生物适应新的生存环境后,优势菌群大量繁殖,同时富里酸、DnBP及其代谢产物为土壤微生物的繁殖提供了碳源和能源,微生物活性增强,释放CO2的量随之上升,而培养后期随着DnBP的降解及可被微生物利用的碳源在土壤中的减少,微生物活动下降,其基础呼吸降低,逐渐趋于稳定。孟婷婷等[27]将含有较多天然腐植酸的褐煤添加到黑土中,其结果表明褐煤的加入促进了土壤的基础呼吸,与本文研究结果一致。
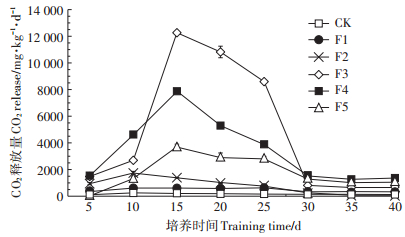
2.3 FA对土壤酶活性的影响 2.3.1 FA对土壤过氧化氢酶活性的影响土壤过氧化氢酶(CAT)是一种氧化还原酶,过氧化氢酶可促使H2O2分解为分子氧和水,清除过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一[28]。图 3为不同浓度FA处理各组土壤过氧化氢酶活性随培养时间的变化情况。如图 3所示,培养第5 d时,F1~F2(10~20 mg·g-1)处理组的过氧化氢酶活性显著高于对照处理组(P < 0.05),F3~F5(40~160 mg·g-1)处理组的过氧化氢酶活性显著低于对照处理组(P < 0.05);总体上表现出酶活性随FA处理浓度的增加而减小的特征。然而,随着培养时间的延长,除F4~F5(80~160 mg·g-1)处理组外(P < 0.05),其余FA处理组与对照处理之间的过氧化氢酶活性差异减小。FA处理各组过氧化氢酶活性随培养时间的变化趋势与对照处理相似,均表现为先增大再减小的趋势。
|
图 3 不同浓度FA处理土壤过氧化氢酶活性随培养时间的变化 Figure 3 Changes of catalase activity in soil treated with different concentrations of FA with culture time |
蔺浩然等[28]得出不同比例蚯蚓粪配施腐植酸对土壤过氧化氢酶有促进作用,但过量使用不一定得到理想的效果。符昌武等[29]研究结果表明,添加腐植酸能显著影响还原酶活性、转化酶活性及根系活力,这些研究结论与本文研究得出的结果相似。
2.3.2 FA对土壤脱氢酶活性的影响土壤脱氢酶是各种代谢反应的常用酶,借助于有机物的氧化反应制造能量,体现了土壤微生物的整体活性,可以评估微生物的氧化还原能力,能够反应出土壤微生物对有机物的降解能力的高低。图 4为不同浓度FA处理土壤脱氢酶活性随培养时间的变化情况。如图 4所示,培养第5 d时,FA处理各组与对照处理组之间差异显著(P < 0.05),在培养10~15 d,除F1~F2(10~20 mg·g-1)处理组外,其余FA处理组脱氢酶活性显著高于对照处理组(P < 0.05)。在培养第15 d时,FA处理各组脱氢酶活性达到最大,F1~F2(10~ 20 mg·g-1)处理组表现出酶活性随FA处理浓度的增加而增大的特征,而当FA用量进一步提高,即F3~F5(40~160 mg·g-1)处理时,土壤脱氢酶活性逐渐降低。随着培养时间的延长,FA处理组与对照处理组之间土壤脱氢酶活性的差异减小,这一变化趋势与FA浓度对土壤脱氢酶活性的影响规律相似。
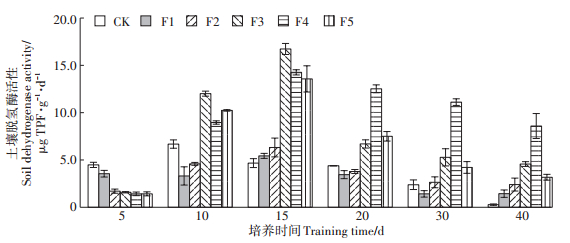
|
图 4 不同浓度FA处理土壤脱氢酶活性随培养时间的变化情况 Figure 4 Changes of soil dehydrogenase activity in different concentrations of FA treated with culture time |
刘晶晶等[30]研究结果也表明随着黄腐酸用量增加,脱氢酶活性呈先升高后降低的趋势。这说明土壤酶活性与FA之间具有明显的量效关系,适量施用FA对土壤酶活性的提高有利,而少量或过量施用并不能取得较为理想的效果。
2.4 FA用量、土壤酶活性及土壤呼吸强度与DnBP微生物降解的相关性由表 2可以看出,土壤中DnBP的降解率与土壤呼吸强度、土壤脱氢酶活性之间表现出显著正相关关系;而FA用量与土壤呼吸强度、土壤脱氢酶活性之间呈显著正相关关系,与土壤过氧化氢酶活性表现为显著负相关关系。土壤呼吸强度与土壤过氧化氢酶活性呈显著负相关关系,与土壤脱氢酶活性具有显著正相关关系。通径分析结果(表 3)显示,土壤呼吸强度与土壤中DnBP降解率之间的直接通径系数和综合通径系数均较大,说明其直接作用明显,并最终表现出强烈的综合正向作用。FA用量、土壤呼吸强度与土壤中DnBP降解率直接通径系数较大,说明其直接作用明显,促进了土壤中DnBP的降解,且主要通过过氧化氢酶活性表现出强烈的间接反向作用,说明FA用量、土壤呼吸强度与过氧化氢酶活性之间的间接作用对土壤中DnBP降解率影响较大;土壤脱氢酶直接通径系数较小,但通过其与FA用量、土壤呼吸强度、过氧化氢酶活性之间的相互作用最终表现为间接正向作用。
|
|
表 2 FA用量与土壤中DnBP降解率、土壤呼吸强度及土壤酶活性之间的相关系数 Table 2 Correlation coefficient between FA dosage and DnBP degradation rate, soil respiration rate and soil enzyme activity in soil |
|
|
表 3 土壤中DnBP降解率与FA用量、土壤呼吸强度、土壤酶活性之间的通径系数 Table 3 Path coefficient between DnBP degradation rate and FA dosage, soil respiration intensity and soil enzyme activity in soil |
上述分析结果说明FA的施加促进了土壤微生物活动,土壤脱氢酶活性和土壤呼吸强度的增加,使菌群的氧化还原能力增强,从而加快了土壤中DnBP的降解利用,缩短了DnBP在土壤中的半衰期。但随着FA用量的增加,会导致土壤pH降低,主要通过过氧化氢酶的强烈反向作用,影响DnBP在土壤中的降解过程[31]。这可能主要基于两方面原因:一方面,FA进入土壤后,土壤外源碳含量增加,外源碳的分解向土壤中的微生物提供了营养,促进了微生物的生命活动[32],从而促进了土壤中DnBP的降解;另一方面,FA的分子中存在大量羧基、醇羟基、酚羟基、醌型羟基和酮型羟基等活性官能团[12],这些活性官能团与土壤中DnBP能够发生吸附-解吸等相互作用[33],从而能够改善土壤微生物活性及其对土壤中DnBP的降解功能。如Chai等[34]报道腐殖质对PAEs的吸附能力与PAEs的性质有关,腐殖质与PAEs之间的吸附主要以非特异的疏水作用为主;宋娇艳等[35]研究发现富里酸对邻苯二甲酸二丁酯的吸附等温线符合Lagergren二级反应动力学模型,其主要吸附机制为物理吸附,其吸附能力随着温度和pH的上升而下降;万洋[33]研究表明腐植酸能够与DnBP形成复合物。
3 结论DnBP在土壤中的降解过程符合一级反应动力学方程,FA的添加加快了DnBP的降解过程,DnBP的降解半衰期缩短为原来的48.1%~67.7%。
FA的添加促进了土壤的基础呼吸;对过氧化氢酶活性表现出了低浓度促进、高浓度抑制的变化特征;土壤脱氢酶活性主要表现为促进作用,中高浓度FA处理对脱氢酶活性促进作用显著。
FA的添加与微生物活性间存在显著相关关系,FA与DnBP降解率之间通过与土壤呼吸强度、土壤脱氢酶活性、土壤过氧化氢酶活性之间的间接效应和直接效应影响土壤中DnBP的降解。
| [1] |
Wang J, Luo Y, Teng Y, et al. Soil contamination by phthalate esters in Chinese intensive vegetable production systerms with different modes of use of plastic film[J]. Environmental Pollution, 2013, 180(3): 265-273. |
| [2] |
Li B, Liu R X, Gao H J, et al. Spatial distribution and ecological risk assessment of phthalic acid esters and phenols in surface sediment from urban rivers in Northeast China[J]. Environmental Pollution, 2016, 219: 409-415. DOI:10.1016/j.envpol.2016.05.022 |
| [3] |
周生贤. 采取有效措施保障土壤环境安全和人体健康[J]. 生态与农村环境学报, 2006, 22(3): 1-2. ZHOU Sheng-xian. Take effective measures to ensure soil environmental safety and human health[J]. Journal of Ecology and Rural Environment, 2006, 22(3): 1-2. DOI:10.3969/j.issn.1673-4831.2006.03.003 |
| [4] |
Magdouli S, Daghrir R, Brar S K, et al. Di 2-ethylhexyl phtalate in the aquatic and terrestrial environment:A critical review[J]. Journal of Environmental Management, 2013, 127: 36-49. |
| [5] |
Wang J, Bo L, Li L, et al. Occurrence of phthalate esters in river sediments in areas with different land use patterns[J]. Science of the Total Environment, 2014, 500/501: 113-119. DOI:10.1016/j.scitotenv.2014.08.092 |
| [6] |
Tran B, Blanchard M, Alliot F, et al. Fate of phthalates and BPA in agricultural and non-agricultural soils of the Paris area(France)[J]. Environmental Science and Pollution Research, 2015, 22(14): 11118-11126. DOI:10.1007/s11356-015-4178-3 |
| [7] |
张慧芳, 苗艳明, 丁献华, 等. 邻苯二甲酸酯对小麦幼苗生理指标的影响[J]. 安徽农业科学, 2010, 38(7): 3374-3377. ZHANG Hui-fang, MIAO Yan-ming, DING Xian-hua, et al. Effect of phthalate on physiological indexes of wheat seedlings[J]. Anhui Agricultural Sciences, 2010, 38(7): 3374-3377. DOI:10.3969/j.issn.0517-6611.2010.07.029 |
| [8] |
陈波, 林建国, 陈清. 水环境中的邻苯二甲酸酯类污染物及其环境行为研究[J]. 环境科学与管理, 2009, 34(2): 71-75. CHEN Bo, LIN Jian-guo, CHEN Qing. Phthalate pollutants in water environment and their environmental behavior[J]. Environmental Science and Management, 2009, 34(2): 71-75. DOI:10.3969/j.issn.1673-1212.2009.02.018 |
| [9] |
刘敏, 林玉君, 曾锋, 等. 城区湖泊表层沉积物中邻苯二甲酸酯的组成与分布特征[J]. 环境科学学报, 2007, 27(8): 1377-1383. LIU Min, LIN Yu-jun, ZENG Feng, et al. Composition and distribution characteristics of phthalates in surface sediments of urban lakes[J]. Journal of Environmental Science, 2007, 27(8): 1377-1383. DOI:10.3321/j.issn:0253-2468.2007.08.025 |
| [10] |
Ofrichter M, Steinbachel A, Guo S R. Biopolymers[M]. Beijing: Chemical lndustory Press, 2004: 273-315.
|
| [11] |
Perminova I V, Hatfield K, Hertkern N. Use of humic substances to remediate polluted environments:From theory to practice[M]. 7th Edition. Netherlands: Springer, 2005.
|
| [12] |
Xu J, Zhao B, Chu W, et al. Chemical nature of humic substances in two typical Chinese soils(upland vs paddy soil):A comparative advanced solid state NMR study[J]. Science of the Total Environment, 2017, 576: 444-452. DOI:10.1016/j.scitotenv.2016.10.118 |
| [13] |
罗磊, 吕继涛, 许闯, 等. 近边X射线吸收精细结构光谱法研究土壤腐殖质组分含碳官能团组成及磷酸根影响[J]. 分析化学, 2013, 41(8): 1279-1282. LUO Lei, LÜ Ji-tao, XU Chuang, et al. Study on carbon functional group composition and phosphate effect of soil humus components by near-edge X-ray absorption fine structure spectroscopy[J]. Chinese Journal of Analytical Chemistry, 2013, 41(8): 1279-1282. |
| [14] |
Luc T, Jean P G. Distribution and biogeochemistry of sedimentary humic substances in the St. Lawrence estuary and the Saguenay Fjord, Québec[J]. Organic Geochemistry, 2007(38): 682-699. |
| [15] |
韦婧, 宋静, 黄玉娟, 等. 溶解性富里酸对土壤中多环芳烃迁移的影响[J]. 土壤学报, 2013, 50(2): 230-236. WEI Jing, SONG Jing, HUANG Yu-juan, et al. Effect of dissolved fulvic acid on the migration of polycyclic aromatic hydrocarbons in soil[J]. Journal of Soil Science, 2013, 50(2): 230-236. |
| [16] |
罗雪梅, 杨志峰, 何孟常, 等. 土壤/沉积物中天然有机质对疏水性有机污染物的吸附作用[J]. 土壤, 2005, 37(1): 25-31. LUO Xue-mei, YANG Zhi-feng, HE Meng-chang, et al. Adsorption of hydrophobic organic pollutants by natural organic matter in soil/sediment[J]. Soil, 2005, 37(1): 25-31. |
| [17] |
关卉, 王金生, 万洪福, 等. 雷州半岛典型区域土壤邻苯二甲酸酯(PAEs)污染研究[J]. 农业环境科学学报, 2007, 26(2): 622-628. GUAN Hui, WANG Jin-sheng, WAN Hong-fu, et al. Study on the pollution of soil phthalate(PAEs)in typical areas of Leizhou Peninsula[J]. Journal of Agro-Environment Science, 2007, 26(2): 622-628. DOI:10.3321/j.issn:1672-2043.2007.02.042 |
| [18] |
Xu G, Li F S, Wang Q H. Occurrence and degradation characteristics of dibutylphthalate(DBP)and di-(2-ethylhexyl)phthalate(DEHP) in typical agricultural soils of China[J]. Science of the Total Environment, 2008, 393: 333-340. DOI:10.1016/j.scitotenv.2008.01.001 |
| [19] |
陈佳祎, 李成, 栾云霞, 等. 北京设施蔬菜基地土壤中邻苯二甲酸酯的污染水平及污染特征研究[J]. 食品安全质量检测学报, 2016, 7(2): 473-477. CHEN Jia-yi, LI Cheng, LUAN Yun-xia, et al. Study on pollution level and pollution characteristics of phthalate in soil of Beijing facility vegetable base[J]. Journal of Food Safety and Quality, 2016, 7(2): 473-477. |
| [20] |
Alhaji B G. Microbial degradation of sparingly soluble diethyl phthalate(DEP)and dibutyl phthalate(DBP)by pure microbes using microcalorimetry[D]. Wuhan: China University of Geosciences, 2010: 182-186.
|
| [21] |
Maria F G, Angela L R, Wagener H, et al. Chapter 26-different forensic approaches for hydrocarbons sources identification in an urban cluster environment:Guanabara Bay[M]. Amsterdam: Elsevier, 2018: 7-24.
|
| [22] |
张英英, 蔡立群, 张仁陟, 等. 不同耕作措施对春小麦生育期内土壤酶活性的影响[J]. 干旱区资源与环境, 2016, 30(10): 88-92. ZHANG Ying-ying, CAI Li-qun, ZHANG Ren-zhi, et al. Effects of different tillage measures on soil enzyme activities during spring wheat growth period[J]. Journal of Arid Land Resources and Environment, 2016, 30(10): 88-92. |
| [23] |
王金燕, 孙华忠, 卜元卿, 等. 毒死蜱对紫金山森林土壤酶活力及微生物毒性影响研究[J]. 生态毒理学报, 2017, 12(4): 210-218. WANG Jin-yan, SUN Hua-zhong, BU Yuan-qing, et al. Effects of chlorpyrifos on soil enzyme activity and microbial toxicity in Zijin Mountain forest[J]. Journal of Ecotoxicology, 2017, 12(4): 210-218. |
| [24] |
王鑫宏. DBP/DEHP单一及与Pb复合污染对土壤微生物量碳及土壤酶的影响研究[D].长春: 东北师范大学, 2010: 30-36. WANG Xin-hong. Effects of DBP/DEHP single and Pb combined pollution on soil microbial biomass carbon and soil enzymes[D]. Changchun: Northeast Normal University, 2010.: 30-36. |
| [25] |
郭倩.沈阳设施土壤邻苯二甲酸酯污染及其微生物降解特征[D].沈阳: 沈阳大学, 2017: 26-34. GUO Qian. Characteristics of phthalate pollution and microbial degradation in Shenyang facilities[D]. Shenyang: Shenyang University, 2017: 26-34. |
| [26] |
李丽, 檀文炳, 王国安, 等. 腐殖质电子传递机制及其环境效应研究进展[J]. 环境化学, 2016, 35(2): 254-266. LI Li, TAN Wen-bing, WANG Guo-an, et al. Research progress on electron transport mechanism and environmental effects of humus[J]. Environmental Chemistry, 2016, 35(2): 254-266. |
| [27] |
孟婷婷, 张宇飞, 马昱萱, 等. 不同外源碳对退化黑土微生物量碳、土壤呼吸量及酶活性的影响[J]. 北方园艺, 2018(20): 113-119. MENG Ting-ting, ZHANG Yu-fei, MA Yu-xuan, et al. Effects of different exogenous carbon on microbial biomass carbon, soil respiration and enzyme activities in degraded black soil[J]. Northern Horticulture, 2018(20): 113-119. |
| [28] |
蔺浩然, 张立新. 不同比例蚯蚓粪配施腐植酸对土壤酶活性及苹果品质的影响[J]. 西部大开发(土地开发工程研究), 2017, 2(9): 19-23. LIN Hao-ran, ZHANG Li-xin. Effects of different proportions of humic acid on soil enzyme activity and apple quality[J]. West Development (Land Development Engineering Research), 2017, 2(9): 19-23. |
| [29] |
符昌武, 王祖富, 陆元, 等. 不同腐植酸含量基质对烟苗品质的影响[J]. 中国农学通报, 2017, 33(28): 38-43. FU Chang-wu, WANG Zu-fu, LU Yuan, et al. Effects of different humic acid content substrates on the quality of tobacco seedlings[J]. Chinese Agricultural Science Bulletin, 2017, 33(28): 38-43. |
| [30] |
刘晶晶, 刘晓霞, 彭玲, 等. 黄腐酸对肥料磷有效性及苹果砧木幼苗磷吸收利用的影响[J]. 安徽农业科学, 2018, 46(25): 122-124. LIU Jing-jing, LIU Xiao-xia, PENG Ling, et al. Effect of fulvic acid on phosphorus availability of fertilizer and phosphorus uptake and utilization of apple rootstock seedlings[J]. Anhui Agricultural Sciences, 2018, 46(25): 122-124. DOI:10.3969/j.issn.0517-6611.2018.25.036 |
| [31] |
Wang L, Chen Y, Du L, et al. Research on influencing factors for UV photolysis of benzotriazole[J]. Open Journal of Nature Science, 2015, 3(4): 105-112. DOI:10.12677/OJNS.2015.34014 |
| [32] |
尚杰, 耿增超, 王月玲, 等. 施用生物炭对(土娄)土微生物量碳、氮及酶活性的影响[J]. 中国农业科学, 2016, 49(6): 1142-1151. SHANG Jie, GENG Zeng-chao, WANG Yue-ling, et al. Effects of application of biochar on soil microbial biomass carbon, nitrogen and enzyme activities[J]. Chinese Agricultural Sciences, 2016, 49(6): 1142-1151. |
| [33] |
万洋.腐植酸对邻苯二甲酸二丁酯的吸附、降解影响特征研究[D].重庆: 西南大学, 2012: 26-38. WAN Yang. Characteristics of adsorption and degradation of humic acid on dibutyl phthalate[D]. Chongqing: Southwest University, 2012: 26-38. |
| [34] |
Chai X, Ji R, Wu J, et al. Abiotic association of PAEs with humic substances and its influence on the fate of PAEs in landfill leachate[J]. Chemosphere, 2010, 78(11): 1362-1367. DOI:10.1016/j.chemosphere.2009.12.073 |
| [35] |
宋娇艳, 刘大军, 万洋, 等. 腐植酸吸附邻苯二甲酸二丁酯动力学及红外光谱特征研究[J]. 西南大学学报(自然科学版), 2014, 36(3): 130-136. SONG Jiao-yan, LIU Da-jun, WAN Yang, et al. Kinetics and infrared spectral characteristics of dibutyl phthalate adsorbed by humic acid[J]. Journal of Southwest University(Natural Science), 2014, 36(3): 130-136. |
 2020, Vol. 39
2020, Vol. 39