2. 山东省滨州市农业局, 山东 滨州 256600
2. Shandong Binzhou Agricultural Bureau, Binzhou 256600, China
尿素是目前我国使用量最多的氮肥之一,但作为速效氮肥,其施入土壤后在很短的时间内就有约50%会通过气态、淋溶和径流等途径损失[1],这不仅造成作物当季氮肥利用率不足40%,还带来了一系列的环境问题[2]。减少氮素损失是目前急需解决的农业问题,提高植物对尿素的吸收利用以及增加尿素氮在土壤中的固存是减少氮素损失的方法。
蚯蚓是土壤动物中常见类群之一,被称为土壤的“生态系统工程师” [3],能够通过其一系列生命活动影响植物对土壤氮素的吸收利用及氮素在土壤中的转化过程。一方面,蚯蚓能够通过促进植物生长来提高植物对土壤氮素的吸收,进而提高土壤氮素利用率[4-5]。Wu等[6]发现,蚯蚓不仅提高了冬小麦-夏玉米种植体系的作物籽粒产量,也提高了籽粒中的总氮含量和粗蛋白含量。He等[7]则更进一步地揭示了蚯蚓-菌根真菌互作对提高植物氮吸收的促进作用。另一方面,蚯蚓活动会在短时间内大量增加或减少土壤微生物数量[3]。土壤微生物反应迅速,微生物量氮指示了土壤整体氮转化和储存能力。陈珊等[8]发现,氮素的微生物固持可以减少其以气态形式损失,有利于保肥,微生物体内的氮素会在后期被重新矿化释放出来供作物吸收利用。因此,蚯蚓可能通过调节微生物量使之成为氮素固存在土壤中的一个缓冲库。Pang等[9]发现,蚯蚓可以促进微生物量碳向可溶性有机碳的转移,从而产生活性更强的微生物,但与此同时,蚯蚓也可能通过取食微生物来增加土壤矿质氮的含量,从而产生大量供植株吸收的无机氮。
已有研究表明,蚯蚓既能够促进植物对氮的吸收利用,也能够通过影响微生物的生物量在氮素固持方面发挥一定作用,但这些研究结果并未区分蚯蚓对土壤氮及外源肥料氮的不同影响。作为速效氮肥,尿素施入土壤后在较短的时间内即可发生变化。在此期间,蚯蚓能否促进植物对尿素氮的吸收利用,能否通过调控微生物量形成尿素氮在土壤中的缓冲库,并不清楚。因此,本研究采用盆栽试验,通过施用15N尿素,对比有、无蚯蚓作用下尿素氮在植物中的含量及土壤微生物量氮的变化过程,以期探明蚯蚓对尿素氮吸收与转化的影响。研究结果对于提高作物产量和氮肥利用率,促进农业生产的可持续发展具有重要作用,亦有助于进一步揭示土壤生物在农业生产中对氮素转化的影响。
1 材料与方法 1.1 试验材料土壤和蚯蚓均采集自华中农业大学菜地0~20 cm土层。鲜土采回后剔除石块、大中型土壤动物及植物根茬,过5 mm筛,调整为61%的孔隙含水率备用(与采样点土壤含水率一致)。土壤pH为7.67±0.01,有机质含量15.78±0.17 g·kg-1,硝态氮含量8.34±0.36 mg·kg-1,铵态氮含量4.24±0.17 mg·kg-1。
蚯蚓为菜地中的优势种——威廉腔环蚓(Metaphire guillelmi),挑选性成熟且大小一致的个体作驯化处理备用,并于试验开始前1 d进行清肠。
以油麦菜(Lactuca sativavar longifoliaf. Lam)为试验作物,种子育苗至4片真叶后,选取茁壮且大小一致的幼苗备用。氮肥采用上海甄准生物有限公司生产的丰度为10%的15N尿素,含量≥99.0%。
1.2 培养试验采用温室盆栽的方法开展试验,共设接种蚯蚓与不接种蚯蚓(对照)两个处理。备用土壤按照80 mg· kg-1(以P2O5计)和160 mg·kg-1(以K2O计)的量混入磷肥和钾肥,装入长方形塑料盆(长×宽×高为49 cm× 20 cm×14 cm)中。每个塑料盆装入鲜土6 kg,随后选取2株幼苗进行移栽。待幼苗生长稳定后选取健壮且长势一致的8盆用于试验(每个处理4个重复)。按照试验设计,在需接种蚯蚓的处理盆中接种蚯蚓3条(密度约为采样点的2倍),待蚯蚓顺利进入土壤后施入尿素。尿素施入量为200 mg·kg-1(以纯N计)[10],将尿素溶于200 mL水后均匀施入,以保证能够润湿全部土壤但又不产生渗滤液,以便让尿素和土壤混合均匀且避免再次对土壤造成扰动。
随后,将所有盆置于大棚下进行培养,但依据实际天气变化(气温、降水量)进行灌溉。盆底部设置有小孔以防盆内积水。
1.3 样品采集和测定于施入尿素后的第5 d和第15 d利用微型土钻(直径2 cm)采集土样,每盆随机采集3个点后将土壤混匀作为一份样品。在第30 d进行破坏性取土,收获全部植株并统计蚯蚓存活率。
土壤样品采用靛酚蓝比色法测定土壤铵态氮(NH4+ -N)含量[11-12];采用紫外分光光度法测定土壤硝态氮(NO3- -N)含量[11];采用过硫酸钾氧化-紫外分光光度法测定土壤溶解性有机氮(DON)含量[12];土壤样品用去离子水浸提后采用TOC仪(德国元素公司vario)测定[13]溶解性有机碳(DOC)含量。植物样品采用烘干法测定干质量,全部植株混匀后用元素分析仪(Euro Vector EA3000型)测定植物氮含量[14];土壤风干后过100目筛,用元素分析仪(Euro Vector EA3000型)测定全氮(TN)含量[15];采用氯仿熏蒸法测定土壤微生物生物量氮(MBN)、微生物生物量碳(MBC)[9];植株、土壤及MBN中的15N丰度均用元素分析-同位素质谱联用仪测定[15]。
1.4 数据处理与分析土壤或植株中来源于肥料氮的百分比Ndff(%)=

植株从肥料中所吸收的氮累积量(g)=吸氮量(g)×Ndff(%)[17]
MBN中来自肥料氮的含量(mg·kg-1)=MBN的含量(mg·kg-1)×Ndff(%)
采用Microsoft Office Excel 2007进行数据整理,SPSS 20(IBM Corporation,USA)进行数据处理与独立样本T检验,Origin 8.6(Origin Lab Corporation,USA)作图,结果表示为均值±标准偏差。
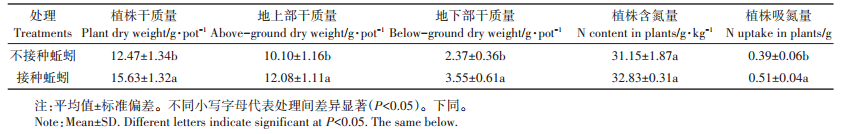
2 结果与讨论 2.1 蚯蚓活动对植株干质量及吸氮量的影响培养结束后,接种蚯蚓的处理中蚯蚓全部存活,未发现增殖情况;虽然与接种前相比蚯蚓生物量有所下降,但二者之间并无显著差异。表 1显示,培养结束后接种蚯蚓处理的植株干质量为15.63 g·pot-1,显著高于未接种蚯蚓处理(12.47 g·pot-1);同时,蚯蚓的活动显著增加了植株地上部干质量与地下部干质量。接种蚯蚓与未接种蚯蚓的植株含氮量分别为32.83 g·kg-1和31.15 g·kg-1,二者之间无显著差异。该结果与已有的研究一致,van Groenigen等[4]通过元分析发现,蚯蚓活动提高作物地上部生物量约23%,尤其是在扰动过的系统中(例如本研究中将土壤混合均匀后重新装盆),其作用效果可为未扰动土壤的两倍,但蚯蚓对作物体内的氮含量却无显著影响。Braga等[18]也指出蚯蚓可以增加作物产量,但是不会增加作物中的氮含量。在本研究中,虽然两处理植物含氮量无显著差异,但总体来看,蚯蚓通过增加植株生物量,显著提高了植株的吸氮量,与无蚯蚓处理相比,蚯蚓作用下植株总吸氮量提高了约30.8%。
|
|
表 1 蚯蚓活动对植株干质量及吸氮量的影响] Table 1 Effects of earthworm activities on dry weight and nitrogen uptake of plants |
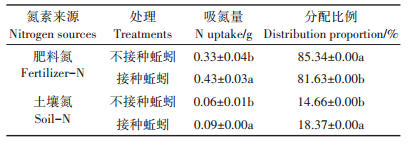
培养结束后,两处理植株中肥料氮的吸收量及比例均比土壤氮的吸收量及比例高,其肥料氮与土壤氮的吸收比例约为8:2,说明肥料氮是植株在整个生长发育过程中的主要氮源(表 2)。与对照相比,接种蚯蚓显著增加了植株对肥料氮和土壤氮的吸收。从分配比例上来看,与对照相比,接种蚯蚓显著增加了植物吸收土壤氮的比例(18.37%),却显著降低了植物吸收肥料氮的比例(81.63%)。本研究结果说明,蚯蚓增加了植株的吸氮量,但其增加部分主要来源于土壤氮,而非肥料氮。Liu等[19]和Hart等[20]发现,施用肥料增加了植物对土壤本底氮的吸收量,并用“Pool substitution”模型进行了解释,认为这一现象归结于氮肥施入后对植物本身的影响(如根系变长、菌根作用)。而蚯蚓对植物根系生物量的促进作用(表 1)可能加剧这一过程。
|
|
表 2 蚯蚓作用下不同氮素来源在植株中的吸收与分配 Table 2 Uptake and distribution of different nitrogen sources by earthworms in plants |
试验过程中,土壤TN含量在处理间和时间梯度上均无显著变化(图 1A),这可归结于较短的培养周期。但整个培养过程土壤TN中肥料氮的贡献逐渐降低(图 1B)。这与已有的研究结果一致,Bohlen等[21]研究发现,在施有无机氮肥的处理中,土壤表层土(0~5 cm)中的15N原子百分超随培养时间逐渐下降。值得注意的是,接种蚯蚓处理的土壤TN中来源于肥料的氮下降速度更快,并在第15 d和第30 d显著低于无蚯蚓的处理,说明蚯蚓活动促进了肥料氮在土壤中的损失。这与Bohlen等[21]和Fonte等[22]在表层土壤中观察到的结果一致,即蚯蚓存在时,土壤中无机氮肥的回收率更低。这可能与蚯蚓打洞导致的渗滤液增加有关[23],尤其是在本研究中,为防止淹水在盆栽底部设置的排水孔将成为肥料氮损失的一个主要途径。虽然也有研究认为,蚯蚓能够通过形成团聚体等方式提高氮素在土壤中的固持[24],但这一过程需要一定的时间累积。

|
同一取样时间点上不同小写字母表示两个处理之间差异显著(P<0.05)。下同 Different letters indicate significant differences between the two treatments at the same sampling time(P<0.05). The same below 图 1 蚯蚓活动对土壤TN(A)及土壤TN中肥料氮含量(B)的影响 Figure 1 The effect of earthworm activities on total soil N(A)and fertilizer nitrogen content in soil(B) |
两处理的MBC含量(图 2A)在整个试验过程中均先增加后降低。与未接种蚯蚓的处理相比,接种蚯蚓处理始终有较高的MBC含量,并在第15 d产生显著差异。蚯蚓对MBC的提高作用已得到了较多研究的证实,例如Demetrio等[25]发现与不接种蚯蚓对比,接种两条蚯蚓会使土壤中的MBC含量增加75%。

|
图 2 蚯蚓活动对土壤MBC(A)、MBN(B)、DOC(C)及MBN中肥料氮(D)含量的影响 Figure 2 The effect of earthworm activities on soil MBC(A), MBN (B), DOC (C)and fertilizer nitrogen content in MBN(D) |
土壤MBN含量是土壤微生物对氮素矿化与固持作用的综合反映[26]。本试验中土壤MBN的变化趋势与MBC存在较大差异(图 2B)。接种蚯蚓处理的MBN含量先快速下降,然后上升,而未接种蚯蚓处理的MBN含量下降后保持平缓。与对照相比,接种蚯蚓在培养第5 d时显著增加了MBN含量,而第15 d时则显著降低了MBN含量。这说明培养前期(第5 d)蚯蚓促进了土壤微生物对氮素的固持,在中期(第15 d)又将固持的氮素释放出来,即蚯蚓通过调节微生物量使之成为氮素固存在土壤中的一个缓冲库。这可能是因为培养前期,施入的尿素为土壤微生物和蚯蚓带来了大量的易利用氮源,丰富的氮源环境刺激蚯蚓对土壤中生物可利用碳的活化作用(图 2C),进而显著提高了培养前期(第5 d)的MBN含量。这一现象在Araujo等[27]和Groffman等[28]的研究中均有报道,即在森林生态系统中,外来入侵蚯蚓可能通过增加土壤中的矿质碳来使得微生物成为氮的“汇”,从而减缓土壤中氮的矿化和硝化进程,让氮能够留存在土壤之中。在培养后期,尿素氮快速损失(图 2D),蚯蚓对微生物的吞噬和消化以及植物迅速生长对养分的需求[29],可能是导致第15 d接种蚯蚓处理MBN显著低于无蚯蚓处理的原因。
值得注意的是,接种蚯蚓虽然在培养前期(第5 d)显著提高了MBN的含量,但在整个培养过程中,MBN中来源于肥料氮的部分始终显著低于无蚯蚓的处理(图 2D)。说明本研究中蚯蚓通过调节微生物生物量对氮素形成的缓冲库主要作用于土壤中本底氮,而非新施入的氮。这一结果可能与施入的氮肥类型有关。蚯蚓作为食腐动物,主要取食有机物质,促进有机氮向无机氮的转化[30],而单纯的施用化肥则可能对蚯蚓造成不利的影响[31]。若改为施用有机氮(如畜禽粪便),则可能得到相反的结果,但这需要未来进一步的研究进行验证。
土壤微生物量作为土壤养分的“库”和“源”,是土壤肥力的一个重要指标,与作物产量的形成密切相关。已有研究表明,土壤微生物量氮是土壤有效氮的重要组分,其消长反映了土壤的供氮特征,微生物吸收同化氮组成的微生物量氮,由蚯蚓吞噬和消化,其分解释放的氮绝大部分可被植物吸收利用[32-33]。微生物量氮在数量上低于或接近于作物的吸氮量,但微生物量氮周转率比土壤有机氮要快[34]。因此,本研究中,接种蚯蚓处理有更高的植物生物量和总吸氮量(表 1),这可部分归结于蚯蚓对MBN的调控作用,而MBN中显著降低的肥料氮含量(图 2D),则有助于解释植株体内更低的肥料氮分配比例(表 2)。
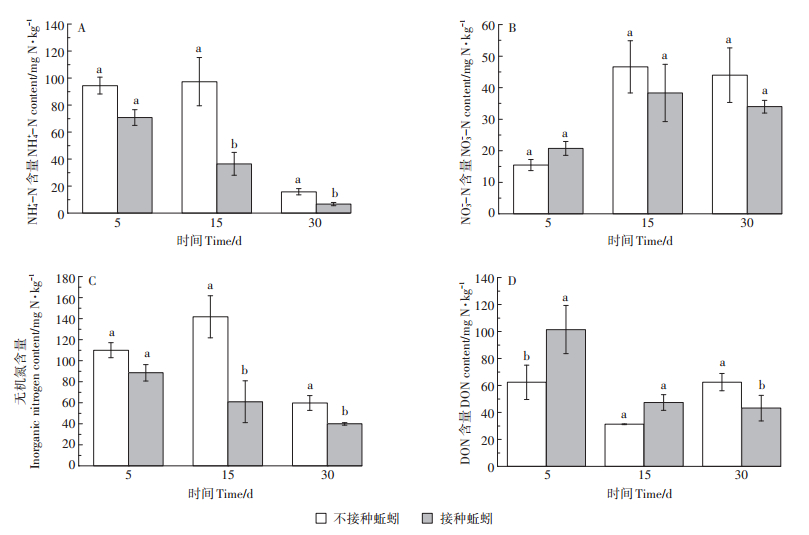
2.4 蚯蚓活动对土壤可溶性氮组分含量的影响试验过程中,两处理的NH4+ -N含量(图 3A)均表现为培养前期(第5 d)高,随后逐渐降低,而NO3- -N含量(图 3B)则表现为前期(第5 d)低,后期逐渐升高。这是因为尿素进入土壤后在脲酶的作用下3~5 d即转化成NH4+,NH4+又在微生物的作用下很快转化成硝酸盐和亚硝酸盐[35]。整个培养过程中的NH4+-N含量均为接种蚯蚓处理低于无蚯蚓的处理,并在第15 d和第30 d产生显著差异,说明蚯蚓促进了NH4+向硝酸盐和亚硝酸盐的转化(硝化过程)。与此同时,接种蚯蚓处理在培养中后期(第15 d及第30 d)较无蚯蚓处理有更低的NO3--N含量(图 3B),这可能归因于蚯蚓对NO3--N反硝化作用的促进。但无论是NH4+-N的硝化过程,还是NO3--N的反硝化过程,均会产生氮素的气态损失[36]。
|
图 3 蚯蚓活动对土壤NH4+ -N(A)、NO3- -N(B)、无机氮(C)及DON(D)含量的影响 Figure 3 Effects of earthworm activity on soil ammonium nitrogen(A), nitrate nitrogen (B), inorganic nitrogen (C)and DON (D)content |
土壤DON是土壤有机氮中最活跃的一部分,可被植物直接吸收利用,对植物生长及不同生态系统中氮素循环起到重要作用[37]。因具有水溶性的特点,土壤DON始终都处于一种动态变化的化学平衡状态,并受土壤中其他理化性质及生物因素的影响。本研究显示,在培养过程中,各处理的土壤DON均先下降后上升(图 3D),与MBN的变化趋势一致(图 2B)。这是因为土壤DON是土壤微生物氮的重要来源和储存库,Liang等[38]则更进一步证实了土壤MBN与土壤DON之间的显著关系。一般认为,新近凋落物和土壤腐殖质以及有机质分解的中间产物是土壤DON的主要来源[39],培养前期接种蚯蚓处理显著高于无蚯蚓处理的DON含量则可归结于蚯蚓对有机物质分解的促进作用。也有研究指出单纯化肥的施用也能够增加土壤中DON的含量[40],这有助于解释各处理在尿素施用后培养前期(第5 d)有较高的DON含量。培养末期(第30 d),与无蚯蚓处理相比,接种蚯蚓处理显著降低了DON含量可能是由于培养中后期(第15 d及第30 d)接种蚯蚓处理的微生物快速繁殖过程对DON的同化作用[41]。但本研究并未测定DON的同位素丰度,无法计算DON中来源于尿素氮的比例,也无法估计尿素施入后DON变化对微生物量氮的影响,未来进一步的研究将有助于揭示该问题。
本研究采用培养试验,接种蚯蚓和不接种蚯蚓的处理均施入了等量的尿素。研究结果显示,接种蚯蚓处理并未显著促进植物对肥料氮的吸收(表 1),也未能够让肥料氮留存在土壤中(图 1B),即接种蚯蚓增加了肥料氮的损失。这种损失可能来源于两方面:(1)N2O气态损失。前文提及,本研究中的蚯蚓促进了NH4+ -N的硝化过程,以及后续NO3--N的反硝化过程,从而导致尿素氮以N2O的形式排出土壤。这一观点亦可从接种蚯蚓处理有更低的无机氮含量(图 3C)得到证实。已有的研究亦指出,蚯蚓能够增加土壤30%~56%的N2O排放[42],Jenkinson等[43]发现肥料氮进入土壤之后可能会在特殊情况下发生反硝化作用,导致肥料氮的损失,发生“Pool substitution”现象。(2)渗滤液损失。在试验过程中观察到接种蚯蚓处理收集到更多的渗滤液,这可能让更多的尿素氮随渗滤液排出土壤。这一现象与Wang等[44]和Dominguez等[23]的研究结果一致。Wang等[44]指出这归结于蚯蚓对土壤大孔隙的形成及孔隙的上下贯通。
除了调控微生物形成临时性的氮“库”,促进作物吸收氮素外,蚯蚓还能通过多种生命活动影响土壤中的氮素循环。本研究通过15N尿素培养试验说明,蚯蚓存在并不能促进植物对尿素氮的吸收利用,也不能促进尿素氮在土壤中的留存。这或许与氮肥类型有关,秸秆氮、畜禽粪便氮施入后或许会有相反的结果,这将是下一步的研究重点。
3 结论(1)接种蚯蚓后,植株生物量与吸氮量均显著增加,但蚯蚓主要促进了植株对土壤氮的吸收,而非对尿素氮的吸收。
(2)蚯蚓活动显著增加了土壤全氮中尿素氮损失。
(3)蚯蚓可通过调节微生物生物量对氮素形成缓冲库来促进植物生长和对氮素的吸收,但这种调节主要作用于土壤中原有的氮,而非新施入的尿素氮。综上,在今后的农业生产中,可通过接种蚯蚓来促进植株对氮素的吸收;但是由于蚯蚓活动会增加土壤中尿素氮损失,因此可减少化肥氮的施入或将化肥和有机肥配施,以减少化肥氮的损失,提高氮肥利用率。
| [1] |
Saha B K, Rose M T, Wong V, et al. Hybrid brown coal-urea fertiliser reduces nitrogen loss compared to urea alone[J]. Science of the Total Environment, 2017, 601: 1496-1504. |
| [2] |
Xu X, Zhou L, Cleemput O V, et al. Fate of urea-15N in a soil-wheat system as influenced by urease inhibitor hydroquinone and nitrification inhibitor dicyandiamide[J]. Plant & Soil, 2000, 220(1/2): 261-270. |
| [3] |
曹佳, 王冲, 皇彦, 等. 蚯蚓对土壤微生物及生物肥力的影响研究进展[J]. 应用生态学报, 2015, 26(5): 1579-1586. CAO Jia, WANG Chong, HUANG Yan, et al. Effects of earthworm on soil microbes and biological fertility:A review[J]. Chinese Journal of Applied Ecology, 2015, 26(5): 1579-1586. |
| [4] |
van Groenigen J W, Lubbers I M, Vos H M J, et al. Earthworms increase plant production:A meta-analysis[J]. Scientific Reports, 2014, 4: 6365. |
| [5] |
Wu D, Liu M Q, Song X C, et al. Earthworm ecosystem service and disservice in an N-enriched agroecosystem:Increase of plant production leads to no effects on yield-scaled N2O emissions[J]. Soil Biology & Biochemistry, 2015, 82: 1-8. |
| [6] |
Wu Y P, Zhang N, Wang J, et al. An integrated crop-vermiculture system for treating organic waste on fields[J]. European Journal of Soil Biology, 2012, 51: 8-14. |
| [7] |
He X X, Chen Y Q, Liu S J, et al. Cooperation of earthworm and arbuscular mycorrhizae enhanced plant N uptake by balancing absorption and supply of ammonia[J]. Soil Biology & Biochemistry, 2018, 116: 351-359. |
| [8] |
陈珊, 丁咸庆, 祝贞科, 等. 秸秆还田对外源氮在土壤中转化及其微生物响应的影响[J]. 环境科学, 2017, 38(4): 1613-1621. CHEN Shan, DING Xian-qing, ZHU Zhen-ke, et al. Effect of straw application on the dynamics of exogenous nitrogen and microbial activity in paddy soil[J]. Environmental Science, 2017, 38(4): 1613-1621. |
| [9] |
Pang J Z, Qiao Y H, Sun Z J, et al. Effects of epigeic earthworms on decomposition of wheat straw and nutrient cycling in agricultural soils in a reclaimed salinity area:A microcosm study[J]. Pedosphere, 2012, 22(5): 726-735. |
| [10] |
宁建凤, 邹献中, 杨少海, 等. 有机无机氮肥配施对土壤氮淋失及油麦菜生长的影响[J]. 农业工程学报, 2007, 23(11): 95-100. NING Jian-feng, ZOU Xian-zhong, YANG Shao-hai, et al. Effects of combined application of organic and inorganic nitrogen fertilizer on the soil nitrogn leaching and the growth of leaf-used lettuce[J]. Transactions of the CSAE, 2007, 23(11): 95-100. |
| [11] |
赵洁, 王莉. 分光光度法快速测定硝、铵态氮的可行性研究[J]. 现代农业科技, 2011(6): 42, 45. ZHAO Jie, WANG Li. Feasibility study on NO3--N, NH4+-N determination by spectrophotometry method[J]. Modern Agricultural Science and Technology, 2011(6): 42, 45. |
| [12] |
Whalen J K, Parmelee R, McCartney D A, et al. Movement of N from decomposing earthworm tissue to soil, microbial and plant N pools[J]. Soil Biology & Biochemistry, 1999, 31(4): 487-492. |
| [13] |
杨金钰, 马雪琴, 唐光木, 等. 土壤研磨粒径和硫酸钾浸提浓度对可溶性有机碳测定的影响[J]. 新疆农业科学, 2015, 52(1): 151-156. YANG Jin-yu, MA Xue-qin, TANG Guang-mu, et al. Effects of particle size and leaching solution concentration on the analytical methods of soil dissolved organic carbon[J]. Xinjiang Agricultural Sciences, 2015, 52(1): 151-156. |
| [14] |
苗惠田, 吕家珑, 张文菊, 等. 潮土小麦碳氮含量对长期不同施肥模式的响应[J]. 植物营养与肥料学报, 2015, 21(1): 72-80. MIAO Hui-tian, LÜ Jia-long, ZHANG Wen-ju, et al. Response of carbon and nitrogen contents of winter wheat to long-term fertilization treatments in fluvo-aquic soil[J]. Journal of Plant Nutrition and Fertilizers, 2015, 21(1): 72-80. |
| [15] |
Liu Z Q, Cheng X Y, Sun D Q, et al. Maize stover biochar increases urea(N-15 isotope)retention in soils but does not promote its acquisition by plants during a 4-year pot experiment[J]. Chilean Journal of Agricultural Research, 2017, 77(4): 382-389. |
| [16] |
Wu C L, Shen Q R, Mao J D, et al. Fate of N-15 after combined application of rabbit manure and inorganic N fertilizers in a rice-wheat rotation system[J]. Biology and Fertility of Soils, 2010, 46(2): 127-137. |
| [17] |
Zheng H J, Zuo J C, Wang L Y, et al. N-15 isotope tracing of nitrogen runoff loss on red soil sloping uplands under simulated rainfall conditions[J]. Plant Soil and Environment, 2016, 62(9): 416-421. |
| [18] |
Braga L P P, Yoshiura C A, Borges C D, et al. Disentangling the influence of earthworms in sugarcane rhizosphere[J]. Scientific Reports, 2016, 6: 38923. |
| [19] |
Liu X J A, van Groenigen K J, Dijkstra P, et al. Increased plant uptake of native soil nitrogen following fertilizer addition-not a priming effect?[J]. Applied Soil Ecology, 2017, 114: 105-110. |
| [20] |
Hart P B S, Rayner J H, Jenkinson D S. Influence of pool substitution on the interpretation of fertilizer experiments with N-15[J]. Journal of Soil Science, 1986, 37(3): 389-403. |
| [21] |
Bohlen P J, Parmelee R W, Allen M F, et al. Differential effects of earthworms on nitrogen cycling from various nitrogen-15-labeled substrates[J]. Soil Science Society of America Journal, 1999, 63(4): 882-890. |
| [22] |
Fonte S J, Six J. Earthworms and litter management contributions to ecosystem services in a tropical agroforestry system[J]. Ecological Applications, 2010, 20(4): 1061-1073. |
| [23] |
Dominguez J, Bohlen P J, Parmelee R W. Earthworms increase nitrogen leaching to greater soil depths in row crop agroecosystems[J]. Ecosystems, 2004, 7(6): 672-685. |
| [24] |
Zhang W W, Wang C, Liu M L, et al. Integrated reclamation of saline soil nitrogen transformation in the hyphosphere by earthworms and arbuscular mycorrhizal fungus[J]. Applied Soil Ecology, 2019, 135: 137-146. |
| [25] |
Demetrio W C, Dionisio J A, Maceda A. Earthworms and root-knot nematodes:Effect on soil biological activity and tomato growth[J]. Semina-Ciencias Agrarias, 2017, 38(4): 2449-2462. |
| [26] |
赵俊晔, 于振文, 李延奇, 等. 施氮量对土壤无机氮分布和微生物量氮含量及小麦产量的影响[J]. 植物营养与肥料学报, 2006, 12(4): 466-472, 494. ZHAO Jun-ye, YU Zhen-wen, LI Yan-qi, et al. Effects of nitrogen application rate on soil inorganic nitrogen distribution, microbial biomass nitrogen content and yield of wheat[J]. Journal of Plant Nutrition and Fertilizers, 2006, 12(4): 466-472, 494. |
| [27] |
Araujo Y, Luizao F J, Barros E. Effect of earthworm addition on soil nitrogen availability, microbial biomass and litter decomposition in mesocosms[J]. Biology and Fertility of Soils, 2004, 39(3): 146-152. |
| [28] |
Groffman P M, Bohlen P J, Fisk M C, et al. Exotic earthworm invasion and microbial biomass in temperate forest soils[J]. Ecosystems, 2004, 7(1): 45-54. |
| [29] |
张宝贵, 李贵桐, 申天寿. 威廉环毛蚯蚓对土壤微生物量及活性的影响[J]. 生态学报, 2000, 20(1): 169-173. ZHANG Bao-gui, LI Gui-tong, SHEN Tian-shou. Influence of the earthworm Pheretima guillelmi on soil microbial biomass and activity[J]. Acta Ecologica Sinica, 2000, 20(1): 169-173. |
| [30] |
庞军柱.接种蚯蚓对有机物分解和碳氮动态的影响[D].北京: 中国农业大学, 2006. PANG Jun-zhu. Effects of earthworm inoculation on decomposition of organic matter and dynamics of carbon and nitrogen[D]. Beijing: China Agricultural University, 2006. |
| [31] |
Guo L Y, Wu G L, Li Y, et al. Effects of cattle manure compost combined with chemical fertilizer on topsoil organic matter, bulk density and earthworm activity in a wheat-maize rotation system in eastern China[J]. Soil & Tillage Research, 2016, 156: 140-147. |
| [32] |
Xu X F, Thornton P E, Post W M. A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems[J]. Global Ecology and Biogeography, 2013, 22(6): 737-749. |
| [33] |
胡锋, 王霞, 李辉信, 等. 蚯蚓活动对稻麦轮作系统中土壤微生物量碳的影响[J]. 土壤学报, 2005, 42(6): 965-969. HU Feng, WANG Xia, LI Hui-xin, et al. Effects of earthworms on soil microbial biomass carbon in rice-wheat rotation agro-ecosystem[J]. Acta Pedologica Sinica, 2005, 42(6): 965-969. |
| [34] |
王文锋, 李春花, 黄绍文, 等. 不同施肥模式对设施菜田土壤微生物量碳、氮的影响[J]. 植物营养与肥料学报, 2016, 22(5): 1286-1297. WANG Wen-feng, LI Chun-hua, HUANG Shao-wen, et al. Effects of different fertilization patterns on microbial biomass carbon and nitrogen in greenhouse vegetable soil[J]. Journal of Plant Nutrition and Fertilizers, 2016, 22(5): 1286-1297. |
| [35] |
Zhang S J, Chao Y, Zhang C L, et al. Earthworms enhanced winter oilseed rape(Brassica napus L.)growth and nitrogen uptake[J]. Agriculture Ecosystems & Environment, 2010, 139(4): 463-468. |
| [36] |
翟胜, 高宝玉, 王巨媛, 等.农田土壤N2O产生机理及影响因素研究[C].中国农业生态环境保护协会.第三届全国农业环境科学学术研讨会, 天津. 2009. ZHAI Sheng, GAO Bao-yu, WANG Ju-yuan, et al. Advance for mechanism and impact factors of N2O emissions from farmland[C]. China Society for Agricultural Eco-Environmental Protection. Third National Symposium on Agricultural Environmental Science. Tianjin. 2009. |
| [37] |
田飞飞, 纪鸿飞, 王乐云, 等. 施肥类型和水热变化对农田土壤氮素矿化及可溶性有机氮动态变化的影响[J]. 环境科学, 2018, 39(10): 4717-4726. TIAN Fei-fei, JI Hong-fei, WANG Le-yun, et al. Effects of various combinations of fertilizer, soil moisture, and temperature on nitrogen mineralization and soluble organic nitrogen in agricultural soil[J]. Environmental Science, 2018, 39(10): 4717-4726. |
| [38] |
Liang B, Yang X Y, He X H, et al. Effects of 17-year fertilization on soil microbial biomass C and N and soluble organic C and N in loessial soil during maize growth[J]. Biology and Fertility of Soils, 2011, 47(2): 121-128. |
| [39] |
曹阳阳.黄土丘陵区人工林草地土壤可溶性有机氮动态变化及土壤氮素矿化研究[D].延安: 延安大学, 2019. CAO Yang-yang. Dynamic change of soil soluble organic nitrogen and nitrogen mineralization in artificial forest and grassland in the Loess Plateau[D]. Yanan: Yanan University, 2019. |
| [40] |
Liang B, Kang L Y, Ren T, et al. The impact of exogenous N supply on soluble organic nitrogen dynamics and nitrogen balance in a greenhouse vegetable system[J]. Journal of Environmental Management, 2015, 154: 351-357. |
| [41] |
Jones D L, Shannon D, Murphy D V, et al. Role of dissolved organic nitrogen(DON)in soil N cycling in grassland soils[J]. Soil Biology & Biochemistry, 2004, 36(5): 749-756. |
| [42] |
Lubbers I M, van Groenigen K J, Fonte S J, et al. Greenhouse-gas emissions from soils increased by earthworms[J]. Nature Climate Change, 2013, 3(3): 187-194. |
| [43] |
Jenkinson D S, Fox R H, Rayner J H. Interactions between fertilizer nitrogen and soil-nitrogen:The so-called priming effect[J]. Journal of Soil Science, 1985, 36(3): 425-444. |
| [44] |
Wang X, Hu F, Li H X. Contribution of earthworm activity to the infiltration of nitrogen in a wheat agroecosystem[J]. Biology and Fertility of Soils, 2005, 41(4): 284-287. |
 2020, Vol. 39
2020, Vol. 39