在我国,果树产业的发展仅次于粮食和蔬菜的发展,我国果树总栽培面积和果品总产量皆居世界首位[1]。作为农业产业结构的重要组成部分,果树产业在促进区域经济发展、维持生态环境稳定、农业稳定发展以及农民持续增收等方面具有重要影响作用[2]。然而,目前我国果树生产仍以传统的清耕制管理模式为主,果园生态系统简化,物种单一,主要依靠化肥和农药的投入来提高果品产量和防治病虫草害,果园土壤退化、养分流失、环境污染、生物多样性减少等生态环境问题日益加剧[3],果园生态系统生物多样性和生态系统服务功能显著降低,这些都不利于农业的可持续发展。
覆盖作物是指目标作物以外的、人为种植的牧草或其他植物。研究表明,覆盖作物不仅可以为土壤微生物提供良好的生存环境[4-6],而且可以为土壤微生物提供物质和能量,促进微生物的繁殖和代谢,从而提高土壤微生物活性及土壤生态功能[7-8]。在果园生态系统中,种植覆盖作物可以产生诸多生态服务功能,如减少土壤侵蚀、养分流失[9],提高土壤质量[10],控制病虫草害[11-12],提高土壤微生物活性及群落多样性[13],提高果实产量、改善果实品质[4]等。在保护性耕作系统中,种植覆盖作物是提高土壤生态系统服务能力、减少土壤侵蚀的主要措施之一。目前,覆盖作物主要应用于苹果园、橄榄园和柑橘园[9, 14-15],并且以单一覆盖作物或2~3种覆盖作物为主,相关研究主要集中在覆盖作物对果园土壤质量、水肥流失、病虫害控制等方面[9-11]。土壤微生物是土壤中物质转化的动力,其群落结构组成是影响土壤中物质循环、能量流动及有机物质分解的主要因素[2, 16],是土壤地下食物网的重要组成部分,其多样性和活性是影响土壤生态系统功能的重要因素。同时,土壤微生物对土壤环境条件变化非常敏感,能够快速指示生态系统过程变化[17],可用于评价不同管理措施下土壤质量和健康状况[10, 18]。
Biolog-Eco技术是基于碳源底物利用情况来分析微生物生理代谢特征[19],广泛用于评价不同土壤管理措施[20-21]下土壤微生物群落功能多样性。有研究表明,苹果园间作三叶草、鸡脚草、小冠花可提高土壤微生物功能多样性和土壤微生物对碳源的利用能力[20];生草处理可提高葡萄园土壤微生物AWCD值和多样性指数,且提高了土壤微生物对6类碳源的利用强度[22]。但是,对于丹江口水源涵养区猕猴桃园增加覆盖作物多样性下土壤微生物群落功能变化的研究鲜见报道。本研究以丹江口水源涵养区代表性地区十堰市猕猴桃园为研究对象,利用Biolog微平板检测技术,研究不同覆盖作物处理(2、4、8种和清耕对照)对土壤微生物功能多样性的影响,旨在探讨猕猴桃园土壤微生物碳代谢特征对覆盖作物多样性的响应及土壤生态学过程的驱动机制,为全面分析和评估覆盖作物多样性的果园生态效应,指导果园的科学管理、生物多样性保护和退化果园生态恢复提供科学依据。
1 材料与方法 1.1 试验地概况试验地位于湖北省十堰市农业科学院柳陂基地(32°50′N,110°60′E),该地属亚热带季风气候,年均温度16 ℃,年均降雨量950 mm,平均海拔220 m,无霜期248 d。试验前土壤基本理化性质为有机质6.67 g·kg-1,全氮0.44 g·kg-1,全磷0.49 g·kg-1,pH 8.14。
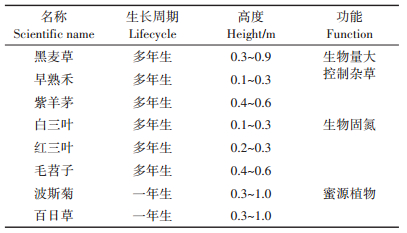
1.2 试验设计本试验于3年龄猕猴桃(Actinidia Chinensis)果园进行,栽植密度为每公顷800株,2016年9月开始种植覆盖作物。2018年调整覆盖作物种植模式:(1)2种覆盖作物混合(C2),黑麦草(Lolium perenne L.)、白三叶(Trifolium repens L.);(2)4种覆盖作物混合(C4),黑麦草、白三叶、早熟禾(Poa annua L.)、红三叶(T. pratense L.);(3)8种覆盖作物混合(C8),黑麦草、白三叶、早熟禾、红三叶、紫羊茅(Festuca rubra L.)、毛苕子(Vicia villosa Roth.)、波斯菊(Cosmos bipinnata Cav.)、百日草(Zinnia elegans Jacq.);(4)清耕对照(CK)。每处理重复3次,共12个小区,小区面积20 m×2 m。播前深翻整地,播种密度为2种覆盖作物250 kg · hm-2(黑麦草150 kg · hm-2、白三叶100 kg · hm-2),4种覆盖作物306 kg·hm-2(黑麦草90 kg·hm-2、白三叶60 kg·hm-2、早熟禾120 kg·hm-2、红三叶36 kg· hm-2),8种覆盖作物320 kg·hm-2(黑麦草45 kg·hm-2、白三叶30 kg·hm-2、早熟禾60 kg·hm-2、红三叶18 kg· hm-2、紫羊茅120 kg·hm-2、毛苕子14 kg·hm-2、波斯菊18 kg·hm-2、百日草15 kg·hm-2),每年刈割2~3次,覆盖于猕猴桃树行间自然腐解,清耕区定期进行人工除草。各处理区的生态条件和田间管理措施保持一致。覆盖作物园艺学特性见表 1。
|
|
表 1 田间试验中8种覆盖作物的园艺学特性 Table 1 Horticultural characteristics for eight cover crop species used in the field experiment |
2018年5月30日在覆盖作物刈割之前采集土壤样品,采用“S”型取样法,每个小区随机选取10个点,用直径3 cm土钻取0~20 cm土壤样品,剔除石块、植物残根等杂物,将同一小区土壤样品混合均匀后装入无菌袋内,置于冰盒中带回实验室。一部分样品于4 ℃冰箱中保存,用于土壤微生物群落功能分析;另一部分土样于室内自然风干后研磨过筛,用于土壤理化性状分析。
1.4 测定方法 1.4.1 土壤微生物功能多样性的测定称取相当于5 g烘干土质量的新鲜土样加入装有45 mL 0.9% NaCl的三角瓶中,振荡30 min,静置30 min,将上清液逐级稀释至10-3,用10-3稀释液接种Bi- olog-Eco微平板,每孔接种量为150 μL。将接种好的测试板加盖,在25 ℃下连续培养7 d,每隔24 h用Bio- log自动读数装置读数一次,并将590 nm和750 nm两个波长下的吸光度差值作为每个碳源孔的吸光值。
1.4.2 土壤理化性质及微生物量碳、氮的测定土壤有机碳采用重铬酸钾外加热法测定;土壤pH采用玻璃电极法(水土比2.5:1)测定;土壤含水量采用烘干法测定,105 ℃烘24 h后称质量得到质量含水量;土壤全氮、铵态氮、硝态氮采用全自动连续流动分析仪(AA3,Bran+Luebbe Corp.)测定[23];微生物量碳、氮采用氯仿熏蒸,硫酸钾浸提,TOC自动分析仪测定[24]。
1.5 数据处理微生物代谢强度采用平均颜色变化率(Average well color development,AWCD)描述。对Biolog微平板培养96 h的数据进行统计分析,采用Shannon-Wie- ner指数(H)、Pielou均匀度指数(E)和丰富度指数(S)表征土壤微生物群落多样性,计算公式如下:
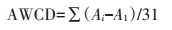
|
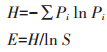
|
式中:Ai为所测定的第i个碳源孔的吸光值;A1为对照孔的吸光值;Pi为第i孔的相对吸光值与整个平板相对吸光值总和的比率;S为有颜色变化的孔的数目。
采用Excel 2007软件对数据进行统计分析,采用SPSS 22.0软件进行单因素方差分析(One-way ANO- VA)、相关性分析和主成分分析。
2 结果与分析 2.1 覆盖作物对土壤微生物碳源变化特征的影响AWCD表征土壤微生物对不同碳源的利用强度,可反映土壤微生物的代谢活性和微生物群落生理功能多样性[25]。培养开始后间隔24 h测AWCD值,并连续测定7 d,得到不同覆盖作物处理土壤微生物AWCD值的时间动态变化,结果如图 1所示,随培养时间的延长,不同覆盖作物处理下土壤微生物群落对31种碳源的利用量呈增加趋势。培养前24 h AWCD值增长速率变化不明显,24~96 h之间AWCD值呈现快速增长的趋势,微生物活性进入对数增长期,此阶段微生物代谢活性最高,对碳源的综合利用能力较强。96 h后AWCD继续升高,但增长率逐渐下降,微生物代谢活动逐渐减弱。覆盖作物处理AWCD高于对照处理,但是AWCD并没有随覆盖作物多样性的增加而持续增加,总体趋势表现为C4>C2>C8。上述结果表明,猕猴桃园增加覆盖作物可以提高土壤微生物代谢活性及其对碳源的利用能力。

|
图 1 不同覆盖作物处理土壤微生物群落平均颜色变化率 Figure 1 Average well color development of soil microbial community in different cover crop treatments |
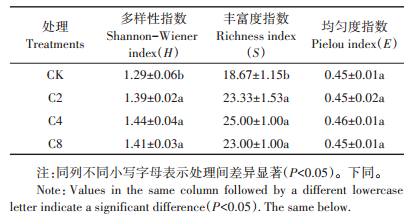
为进一步明确不同覆盖作物处理对土壤微生物群落功能的影响,根据不同处理土壤微生物对不同碳源的利用情况,综合考虑其变化趋势,选取96 h的AWCD值进行土壤微生物群落功能多样性分析,结果见表 2。覆盖作物处理Shannon-Wiener多样性指数和丰富度指数均高于清耕对照(P < 0.05),Pielou均匀度指数与对照之间无显著差异。覆盖作物处理之间各指数无显著差异,变化趋势与AWCD一致,均表现为C4>C2、C8。上述结果表明,猕猴桃园增加覆盖作物能显著提高土壤微生物功能多样性指数以及增加土壤微生物的碳源利用能力,有利于提高土壤微生物代谢活性和功能多样性。
|
|
表 2 不同覆盖作物处理对微生物功能多样性指数的影响 Table 2 Diversity indices of microbial community under different cover crop treatments |
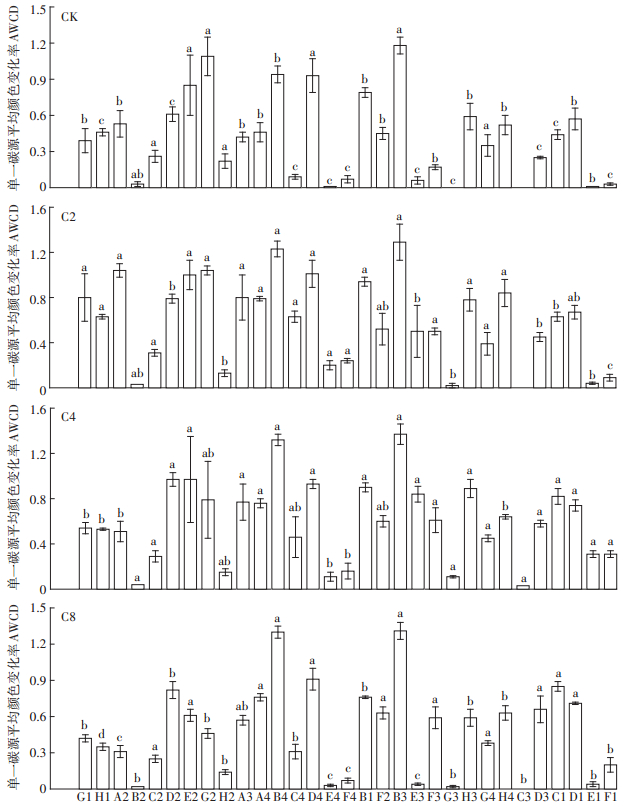
Biolog-Eco板含有31种碳源,包括7种糖类、9种羧酸类、6种氨基酸类、4种聚合物类、3种酚酸类和2种胺类。研究土壤微生物对微平板上不同碳源的利用能力,即Biolog代谢指纹图谱,有助于比较全面地了解微生物群落代谢功能特征[26]。由图 2可看出(以培养96 h为例),本研究中土壤微生物群落对糖类、羧酸类和氨基酸类的利用高于其他3种碳源,不同覆盖作物处理土壤微生物群落对碳源利用率存在差异。覆盖作物处理土壤微生物对31种碳源的利用能力大于清耕对照,C2处理土壤代谢指纹图谱中AWCD≥ 0.8[20]的碳源有10种(糖类4种、氨基酸类3种、羧酸类2种、胺类1种),占总碳源的53.16%;C4处理土壤有9种(糖类2种、氨基酸类2种、羧酸类4种、聚合物类1种),占总碳源的48.77%;C8处理土壤有5种(糖类1种、氨基酸类2种、羧酸类1种、聚合物类1种),占总碳源的35.23%;清耕对照土壤有5种(糖类2种、氨基酸类2种、羧酸类1种),占总碳源的39.08%。与清耕对照相比,C2处理土壤微生物碳源利用代谢功能差异显著的碳源有19种,C4处理有19种,C8处理有16种,说明猕猴桃园覆盖作物处理提高了土壤微生物群落的代谢活性,改变了土壤微生物对单一碳源的利用能力,其中C4处理对碳源种类影响较大,微生物对碳源的利用能力较强。此外,土壤微生物对D-甘露醇(D2)、L-精氨酸(A4)、L-天门冬酰胺(B4)、L-苯丙氨酸(C4)、γ-羟丁酸(E3)、α-丁酮酸(G3)、4-羟基苯甲酸(D3)、吐温40(C1)的利用能力显著高于清耕对照。同时,各处理土壤微生物对2-羟基苯甲酸基本不利用。
|
G1~A3:糖类;A4~F4:氨基酸类;B1~H3:羧酸类;C3~D3:胺类;G4~H4:酚酸类;C1~F1:聚合物类。AWCD值为Biolog板上3次重复的平均值。不同小写字母表示同一种碳源在不同覆盖作物处理下的比较差异显著(P<0.05) G1~A3: Carbohydrate; A4~F4: Amino acids; B1~H3: Carboxylic acids; C3~D3: Amines; G4~H4: Phenolic acids; C1~F1: Polymers. AWCD values are the means (n=3) ±the standard deviations of the mean in Biolog Micro Plate。The letter marked differently in the figure is a comparison of the same carbon source under different cover crop treatments(P<0.05) 图 2 土壤微生物生理碳代谢指纹图谱 Figure 2 Metabolic fingerprint of carbon physiological profiles of soil microbial community |
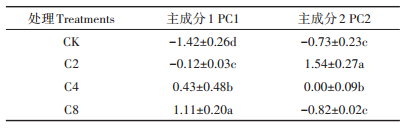
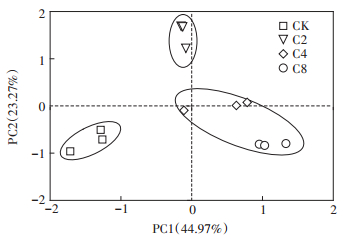
利用培养96 h的AWCD值,对不同覆盖作物处理土壤微生物利用单一碳源的特性进行主成分分析,在31个因子中共提取了5个主成分因子,累积方差贡献率达到90.14%,其中第一主成分(PC1)的方差贡献率为44.97%,特征根为13.94;第二主成分(PC2)的方差贡献率为23.27%,特征根为7.22;第三主成分(PC3)的方差贡献率为11.78%,特征根为3.65;其余4、5主成分贡献率均小于10%。从中选取累积方差贡献率达到68.24%的前两个主成分PC1和PC2来分析微生物群落功能多样性。从图 3可以看出,不同覆盖作物处理碳源利用在PC轴上差异显著,整体可分为C2、C4和C8、清耕对照3大类,可见PC1和PC2能区分不同处理土壤微生物的碳源代谢特征。在PC1轴上,C4和C8处理分布在轴的正方向,C2处理和清耕对照分布在轴的负方向。在PC2轴上,C2处理分布在轴的正方向,C4和C8处理、清耕对照分布在轴的负方向。对主成分进行方差分析可知,不同处理在PC1和PC2上得分系数差异显著(表 3),在PC1轴上,C2、C4、C8处理之间以及覆盖作物处理与清耕对照之间均差异显著;在PC2轴上,C2处理、C4和C8处理、清耕对照的差异达到显著水平。表明猕猴桃园增加覆盖作物改变了土壤微生物群落功能多样性。
|
图 3 不同覆盖作物处理土壤微生物碳代谢主成分分析 Figure 3 Principal component analysis for carbon utilization of soil microbial community in different cover crop treatments |
|
|
表 3 不同处理主成分得分系数 Table 3 PC scores under different treatments(mean±SD) |
为了找到对PC1和PC2影响较大的碳源种类,利用PC1和PC2得分系数与31种碳源吸光值进行相关性分析,得到相关系数,其绝对值越大,表示该碳源对主成分的影响越大[27]。从表 4可看出,与PC1达到显著相关的碳源有10种,即糖类(5种)、氨基酸类(3种)、羟酸类化合物(1种)、胺类化合物(1种)。而与PC2具有较高相关性的碳源有11种,分别糖类(3种)、氨基酸类(2种)、羟酸类化合物(2种)、酚酸类(1种)、聚合物类(3种)。表明糖类、氨基酸类、羧酸类是微生物利用的主要碳源,而胺类、酚酸类和聚合物类这3类碳源是区分清耕对照和覆盖作物处理间差异的敏感碳源。
|
|
表 4 31种碳源与PC1、PC2的相关系数 Table 4 The correlation coefficients of 31 carbon substrates with PC1 and PC2 |
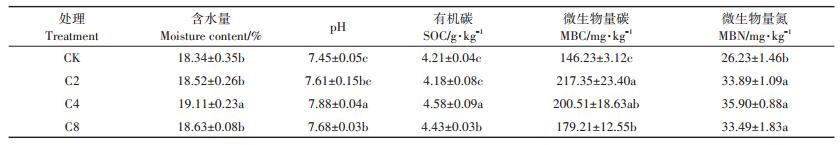
由表 5可知,覆盖作物处理土壤含水量有增加的趋势,且C4处理土壤含水量提高了4.2%(P < 0.05),高于对照和其他覆盖作物处理。C2、C4、C8处理土壤pH值分别提高了0.16、0.43(P < 0.05)、0.23(P < 0.05),表现为C4>C8、C2。C4、C8处理增加了土壤有机碳含量(P < 0.05),分别高于对照8.79%、5.23%。覆盖作物处理增加了土壤微生物量碳含量(P < 0.05),C2、C4、C8处理分别高于对照48.64%、37.12%和22.55%,表现为C2、C4>C8。覆盖作物处理增加了土壤微生物量氮含量(P < 0.05),C2、C4、C8处理分别高于对照29.20%、36.87%和27.68%,但是各覆盖作物处理间无显著差异。
|
|
表 5 覆盖作物处理对土壤理化性质及微生物量碳、氮的影响 Table 5 Soil properties and microbial biomass as affected by different cover crop treatments |
由表 6可知,土壤微生物群落功能ShannonWiener指数(H)、丰富度指数(S)与土壤含水量、有机碳、pH、微生物量碳、氮呈显著相关关系,可见土壤环境因子与微生物群落功能多样性密切相关,这也是覆盖作物处理造成土壤微生物功能多样性差异的重要因素。
|
|
表 6 土壤理化性质及微生物量碳与微生物群落功能多样性相关性分析 Table 6 Correlation analysis of soil properties and functional diversity of soil microbial community |
土壤微生物多样性能敏感地反映土壤环境的微小变化,可作为衡量土壤质量和评价土壤生态系统稳定的重要生物学指标[28-29]。AWCD通过土壤稀释液对碳源利用的吸光值变化来表征土壤微生物活性,能很好地反映微生物功能多样性,其值越高表明土壤微生物群落的代谢活性越强[25]。本研究中,不同种类覆盖作物处理土壤微生物对碳源的利用能力均高于清耕对照,表明增加覆盖作物种类可提高猕猴桃园土壤微生物活性和群落功能多样性。土壤生态环境改善原因可能是覆盖作物改善了土壤水热状况[5],降低了土壤容重,增加了土壤的孔隙度[4, 6],为土壤微生物的生长营造了良好的生存环境。此外,覆盖作物根系分泌物及作物残体为土壤微生物提供了物质和能量,促进微生物的繁殖和代谢,从而增加土壤微生物活性和多样性[7-8],与杜毅飞等[20]和司鹏等[22]的研究结果相似。但是由于覆盖作物种类不同,覆盖作物生物量、根系分泌物的差异会导致微生物生长过程中所利用的物质和能量产生差异,不同覆盖作物处理土壤微生物对碳源的利用能力不同[30]。
Shannon-Wiener指数反映土壤微生物群落物种变化度和差异度,指数值越大,表示微生物种类越多且分布越均匀。丰富度指数表示被利用碳源的总数目。Pielou指数反映了群落物种均一性[31]。不同的多样性指数反映了土壤微生物群落组成的不同方面,综合应用可分析土壤微生物种类和功能的差异[32]。本研究中,猕猴桃园种植覆盖作物土壤微生物多样性指数和丰富度指数均高于对照,表明猕猴桃园种植覆盖作物土壤微生物功能多样性优于清耕对照。李鑫等[26]和杜毅飞等[20]也报道了相似研究结果,桑树-大豆间作土壤微生物均匀度指数高于单作,苹果园种植覆盖作物显著提高土壤微生物多样性指数、丰富度指数、优势度指数。相关分析结果表明,土壤微生物多样性主要受土壤含水量、pH、碳、氮含量的影响,这与前人研究结果相似[33-34]。由此可见,猕猴桃园增加覆盖作物改变了土壤生态环境,促进养分的转换,进而影响土壤微生物代谢活性和功能多样性。
主成分分析表明,覆盖作物处理与清耕对照之间的微生物群落功能特征存在明显差异,不同覆盖作物土壤微生物对31种碳源底物的利用能力显著不同。PC1和PC2的累积贡献率为68.24%,解释了大部分的变异,覆盖作物处理与对照之间离散程度较大,表明增加覆盖作物多样性对猕猴桃园土壤微生物群落影响较大。碳源与PC1、PC2的相关分析表明,糖类、氨基酸类、羧酸类是微生物利用的主要碳源,而胺类、酚酸类和聚合物类是区分清耕对照和覆盖作物处理间差异的敏感碳源。碳代谢指纹图谱结果显示,覆盖作物处理土壤微生物对31种碳源的利用能力大于清耕对照,覆盖作物处理土壤微生物对D-甘露醇、L-精氨酸、L-天门冬酰胺、L-苯丙氨酸、γ-羟丁酸、α-丁酮酸、4-羟基苯甲酸、吐温40的利用能力显著高于清耕对照,表明覆盖作物处理土壤微生物群落具有特定的代谢特征,不同覆盖作物处理提高了土壤中利用糖类、氨基酸类、羧酸类、聚合物类碳源的微生物的代谢活性和多样性。原因可能是猕猴桃园覆盖作物残体和根系分泌物为土壤微生物提供了大量的糖类、氨基酸、羧酸和聚合物等碳源物质[35],促进了与相关碳源利用类型相对应的微生物的生长与繁殖,进而改变土壤微生物群落结构。
土壤微生物功能多样性能够反映土壤质量相关信息,可作为评价土壤质量变化的敏感指标。猕猴桃园增加覆盖作物,作物残体和根系分泌物的加入改变了土壤环境因子,影响土壤微生物群落的代谢活性和功能多样性。Biolog微平板技术能够快速测定土壤微生物群落功能代谢多样性,但该方法利用微生物生长代谢来衡量微生物多样性,只能对环境微生物群落活性与功能进行分析,无法直接获取微生物群落结构完整详细的信息。在未来研究中,综合应用分子生物学和代谢组学方法,分析覆盖作物多样性果园土壤微生物多样性和覆盖作物生物量、根系分泌物之间的关系,有望进一步揭示覆盖作物多样性果园土壤的生态学过程。
4 结论(1)覆盖作物处理能够提高土壤微生物的碳源利用能力,特别是糖类和氨基酸类碳源。
(2)覆盖作物能够通过改善土壤质量(土壤含水量、pH、有机碳、微生物量碳、氮)来提高土壤微生物的功能多样性。
(3)4种覆盖作物处理(白三叶、黑麦草、红三叶、早熟禾)对猕猴桃园土壤生态环境的影响优于2种和8种。
| [1] |
陈学森, 韩明玉, 苏桂林, 等. 当今世界苹果产业发展趋势及我国苹果产业优质高效发展意见[J]. 果树学报, 2010, 27(4): 598-604. CHEN Xue-sen, HAN Ming-yu, SU Gui-lin, et al. Discussion on today's world apple industry trends and the suggestions on sustainable and efficient development of apple industry in China[J]. Journal of Fruit Science, 2010, 27(4): 598-604. |
| [2] |
王艳廷, 冀晓昊, 吴玉森, 等. 我国果园生草的研究进展[J]. 应用生态学报, 2015, 26(6): 1892-1900. WANG Yan-ting, JI Xiao-hao, WU Yu-sen, et al. Research progress of cover crop in Chinese orchard[J]. Chinese Journal of Applied Ecology, 2015, 26(6): 1892-1900. |
| [3] |
周志翔, 李国怀, 徐永荣. 果园生态栽培及其生理生态效应研究进展[J]. 生态学杂志, 1997(1): 46-53. ZHOU Zhi-xiang, LI Guo-huai, XU Yong-rong. Orchard ecocultivation and the research advances of ecophysiological characteristics of fruit trees affected by ecocultivation practices[J]. Chinese Journal of Ecology, 1997(1): 46-53. |
| [4] |
Atucha A, Merwin I A, Brown M G, et al. Soil erosion, runoff and nutrient losses in an avocado(Persea americana Mill)hillside orchard under different groundcover management systems[J]. Plant and Soil, 2013, 368(1/2): 393-406. |
| [5] |
曹铨, 沈禹颖, 王自奎, 等. 生草对果园土壤理化性状的影响研究进展[J]. 草业学报, 2016, 25(8): 180-188. CAO Quan, SHEN Yu-ying, WANG Zi-kui, et al. Effects of living milch on soil physical and chemical properties in orchards:A review[J]. Acta Prataculturae Sinica, 2016, 25(8): 180-188. |
| [6] |
孙计平, 张玉星, 吴照辉, 等. 生草对梨园土壤物理特性的影响[J]. 水土保持学报, 2015, 29(5): 194-199. SUN Ji-ping, ZHANG Yu-xing, WU Zhao-hui, et al. Effect of planting herbage on soil physical properties of pear orchard[J]. Journal of Soil and Water Conservation, 2015, 29(5): 194-199. |
| [7] |
Jiao K, Qin S, Lyu D, et al. Red clover intercropping of apple orchards improves soil microbial community functional diversity[J]. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2013, 63(5): 466-472. |
| [8] |
Kowalchuk G A, Buma D S, de Boer W, et al. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms[J]. Antonie Van Leeuwenhoek, 2002, 81(1/2/3/4): 509-520. |
| [9] |
Gómez J A, Guzmán M G, Giráldez J V, et al. The influence of cover crops and tillage on water and sediment yield, and on nutrient, and organic matter losses in an olive orchard on a sandy loam soil[J]. Soil and Tillage Research, 2009, 106(1): 137-144. DOI:10.1016/j.still.2009.04.008 |
| [10] |
Mbuthia L W, Acosta-Martínez V, Debruyn J, et al. Long term tillage, cover crop, and fertilization effects on microbial community structure, activity:Implications for soil quality[J]. Soil Biology and Biochemistry, 2015, 89: 24-34. DOI:10.1016/j.soilbio.2015.06.016 |
| [11] |
Gómez J A, Campos M, Guzmán G, et al. Soil erosion control, plant diversity, and arthropod communities under heterogeneous cover crops in an olive orchard[J]. Environmental Science and Pollution Research, 2018, 25(2): 977-989. DOI:10.1007/s11356-016-8339-9 |
| [12] |
Blesh J. Functional traits in cover crop mixtures:Biological nitrogen fixation and multifunctionality[J]. Journal of Applied Ecology, 2018, 55(1): 38-48. DOI:10.1111/1365-2664.13011 |
| [13] |
Schmidt R, Gravuer K, Bossange A V, et al. Long-term use of cover crops and no-till shift soil microbial community life strategies in agricultural soil[J]. PLoS One, 2018, 13(2): 1-19. |
| [14] |
Zheng W, Zhao Z, Gong Q, et al. Effects of cover crop in an apple orchard on microbial community composition, networks, and potential genes involved with degradation of crop residues in soil[J]. Biology and Fertility of Soils, 2018, 54(6): 743-759. DOI:10.1007/s00374-018-1298-1 |
| [15] |
Mauro R P, Anastasi U, Lombardo S, et al. Cover crops for managing weeds, soil chemical fertility and nutritional status of organically grown orange orchard in Sicily[J]. Italian Journal of Agronomy, 2015, 10(2): 101-104. DOI:10.4081/ija.2015.641 |
| [16] |
Guan P, Zhang X, Yu J, et al. Soil microbial food web channels associated with biological soil crusts in desertification restoration:The carbon flow from microbes to nematodes[J]. Soil Biology and Biochemistry, 2018, 116: 82-90. DOI:10.1016/j.soilbio.2017.10.003 |
| [17] |
孙锋, 赵灿灿, 何琼杰, 等. 施肥和杂草多样性对土壤微生物群落的影响[J]. 生态学报, 2015, 35(18): 6023-6031. SUN Feng, ZHAO Can-can, HE Qiong-jie, et al. Effects of fertilization and diversity of weed species on the soil microbial community[J]. Acta Ecologica Sinica, 2015, 35(18): 6023-6031. |
| [18] |
于树, 汪景宽, 李双异. 地膜覆盖对土壤微生物群落结构的影响[J]. 土壤通报, 2008, 39(4): 904-907. YU Shu, WANG Jing-kuan, LI Shuang-yi. Soil microbial community structure responses to mulching with plastic film on brown earth[J]. Chinese Journal of Soil Science, 2008, 39(4): 904-907. DOI:10.3321/j.issn:0564-3945.2008.04.045 |
| [19] |
安韶山, 李国辉, 陈利顶. 宁南山区典型植物根际与非根际土壤微生物功能多样性[J]. 生态学报, 2011, 31(18): 5225-5234. AN Shao-shan, LI Guo-hui, CHEN Li-ding. Soil microbial functional diversity between rhizosphere and non-rhizosphere of typical plants in the hilly area of southern Nixia[J]. Acta Ecologica Sinica, 2011, 31(18): 5225-5234. |
| [20] |
杜毅飞, 方凯凯, 王志康, 等. 生草果园土壤微生物群落的碳源利用特征[J]. 环境科学, 2015, 36(11): 4260-4267. DU Yi-fei, FANG Kai-kai, WANG Zhi-kang, et al. Carbon source utilization characteristics of soil microbial community for apple orchard with interplanting herbage[J]. Environmental Science, 2015, 36(11): 4260-4267. |
| [21] |
黄雪娇, 王菲, 谷守宽, 等. 钾肥及与秸秆配施对紫色土作物产量和微生物群落结构的影响[J]. 生态学报, 2018, 38(16): 5792-5799. HUANG Xue-jiao, WANG Fei, GU Shou-kuan, et al. Effects of potassium sources and rates on crop yields and microbial community structure in a four-year experiment in purple soil[J]. Acta Ecologica Sinica, 2018, 38(16): 5792-5799. |
| [22] |
司鹏, 于会丽, 高登涛, 等. 生草对沙地葡萄园土壤微生物群落碳源利用特征的影响[J]. 干旱地区农业研究, 2017, 35(2): 247-254. SI Peng, YU Hui-li, GAO Deng-tao, et al. Effects of intercropping herbages on carbon source metabolism of soil microbial community in sandy vineyard[J]. Agricultural Research in the Arid Areas, 2017, 35(2): 247-254. |
| [23] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Third Edition. Beijing: China Agricultural Press, 2000. |
| [24] |
吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006. WU Jin-shui, LIN Qi-mei, HUANG Qiao-yun, et al. Method for measuring soil microbial biomass and its application[M]. Beijing: China Meteorological Press, 2006. |
| [25] |
米亮, 王光华, 金剑, 等. 黑土微生物呼吸及群落功能多样性对温度的响应[J]. 应用生态学报, 2010, 21(6): 1485-1491. MI Liang, WANG Guang-hua, JIN Jian, et al. Responses of black soil's microbial respiration and community functional diversity to temperature[J]. Chinese Journal of Applied Ecology, 2010, 21(6): 1485-1491. |
| [26] |
李鑫, 张景云, 张萌萌, 等. 化学除草剂不同施用方法对紫花苜蓿根际土壤微生物群落碳源利用的影响[J]. 草地学报, 2014, 22(1): 57-64. LI Xin, ZHANG Jing-yun, ZHANG Meng-meng, et al. Effects of chemical herbicide at different spraying ways on the carbon source metabolism of soil microbial community in alfalfa rhizosphere[J]. Acta Agrestia Sinica, 2014, 22(1): 57-64. |
| [27] |
时鹏, 高强, 王淑平, 等. 玉米连作及其施肥对土壤微生物群落功能多样性的影响[J]. 生态学报, 2010, 30(22): 6173-6182. SHI Peng, GAO Qiang, WANG Shu-ping, et al. Effects of continuous cropping of corn and fertilization on soil microbial community functional diversity[J]. Acta Ecologica Sinica, 2010, 30(22): 6173-6182. |
| [28] |
林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J]. 土壤学报, 2008, 45(5): 892-900. LIN Xian-gui, HU Jun-li. Scientific connotation and ecological service function soil microbial diversity[J]. Acta Pedologica Sinica, 2008, 45(5): 892-900. DOI:10.3321/j.issn:0564-3929.2008.05.016 |
| [29] |
van der Heijden M G A, Wagg C. Soil microbial diversity and agroecosystem functioning[J]. Plant and Soil, 2013, 363(1/2): 1-5. |
| [30] |
Eisenhauer N, Lanoue A, Strecker T, et al. Root biomass and exudates link plant diversity with soil bacterial and fungal biomass[J]. Scientific Reports, 2017, 7: 1-7. DOI:10.1038/s41598-016-0028-x |
| [31] |
李志斐, 谢骏, 郁二蒙, 等. 基于Biolog-ECO技术分析杂交鳢和大口黑鲈高产池塘水体微生物碳代谢特征[J]. 农业环境科学学报, 2014, 33(1): 185-192. LI Zhi-fei, XIE Jun, YU Er-meng, et al. Carbon metabolic diversity of microbial communities in intensive ponds for hybrid snakehead and largemouth bass based on biolog-ECO plates[J]. Journal of Agro-Environment Science, 2014, 33(1): 185-192. |
| [32] |
范瑞英, 杨小燕, 王恩姮, 等. 黑土区不同林龄落叶松人工林土壤微生物群落功能多样性的对比研究[J]. 北京林业大学学报, 2013, 35(2): 63-68. FAN Rui-ying, YANG Xiao-yan, WANG En-heng, et al. Comparative studies on functional diversity of soil microbial community of larch plantations with different ages in black soil region, northeastern China[J]. Journal of Beijing Forestry University, 2013, 35(2): 63-68. |
| [33] |
李飞, 刘振恒, 贾甜华, 等. 高寒湿地和草甸退化及恢复对土壤微生物碳代谢功能多样性的影响[J]. 生态学报, 2018, 38(17): 6006-6015. LI Fei, LIU Zhen-heng, JIA Tian-hua. Functional diversity of soil microbial community carbon metabolism with the degradation and restoration of alpine wetlands and meadows[J]. Acta Ecologica Sinica, 2018, 38(17): 6006-6015. |
| [34] |
吴则焰, 林文雄, 陈志芳, 等. 武夷山国家自然保护区不同植被类型土壤微生物群落特征[J]. 应用生态学报, 2013, 24(8): 2301-2309. WU Ze-yan, LIN Wen-xiong, CHEN Zhi-fang, et al. Characteristics of soil microbial community under different vegetation types in Wuyishan National Nature Reserve, east China[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2301-2309. |
| [35] |
吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310. WU Lin-kun, LIN Xiang-min, LIN Wen-xiong. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310. |
 2020, Vol. 39
2020, Vol. 39