近年来,由于设施农业的不合理开展以及工业化程度的逐步加深[1],致使农业土壤镉(Cd)污染问题日趋严重,许多农用地无法安全利用[2]。据全国土壤污染调查公报显示[3],我国土壤中Cd的点位超标率为7.0%,农田Cd污染面积高达2×104 hm2,已被确定为全国土壤污染首要污染物,而国务院颁布《土壤污染防治行动计划》中要求:到2020年,我国污染地块安全利用率需达到90%以上,因此Cd污染区农用土壤的安全利用已迫在眉睫[4]。Cd在农业环境中具有极高的生物累积性、毒性、环境移动性及持久性。因而极易危害土壤-植物系统,继而威胁食品安全及人类健康。据不完全统计,我国每年生产的Cd含量超标的农产品达“1.46×106 t,且呈逐年增长趋势[5]。
有研究表明,因地制宜地开展农作物高、低积累品种筛选可使轻度Cd污染农用地得到安全有效的利用,如污灌区小麦品种筛选[6]及高Cd积累水稻品种筛选[7]等,现均已证实其应用可行性。高、低积累作物品种的筛选工作我国早有开展[8],受试品种应具备优秀环境适应能力和稳定传代的积累特征[9]。叶菜类蔬菜种类多样,品种丰富,在我国广泛栽培。目前已知不同种类、不同品种叶菜类蔬菜对重金属胁迫存在明显不同的抗性和积累,如大白菜[10]、青菜[11]和菠菜[12]等蔬菜对重金属的吸收与积累存在物种、品种和同一作物不同器官间的显著差异,而普遍的叶菜类蔬菜特别是白菜(Brassica pekinensis L.)品种更易吸收Cd并受其影响[12]。因此,Cd耐受力强,明确积累能力的白菜品种更应适宜在轻度污染的中国北方推广。然而,黑土中较高的有机质和pH虽然能够限制Cd在环境中的迁移能力,但局域性积累却已然威胁到了食品安全[13]。由于黑土的这一特点,Cd在其中的威胁性常受忽视,目前尚缺乏针对北方典型黑土Cd污染环境中高、低Cd积累叶菜类蔬菜的研究。故本研究通过盆栽试验模拟典型黑土区温室栽培条件,针对20种东北地区主栽白菜品种的Cd耐受力及积累特征进行筛选。以期为轻度Cd污染农用地的安全利用及黑土资源保护提供数据支撑。
1 材料与方法 1.1 试验材料供试土壤类型系典型黑土,于2018年5月取自东北农业大学向阳实验基地试验温室区(44°04′N,125° 42′ E)0~20 cm耕层,过2 mm筛除去砾石等杂质,装袋、烘干、杀菌备用。同时取少量土壤用于土壤常规分析[14]及Cd含量测定[15],其土壤理化性质见表 1。
|
|
表 1 供试土壤理化性质 Table 1 Physical and chemical properties of the tested soil |
本试验于2018年5—8月在东北农业大学向阳实验基地温室区10号大棚内进行。为保证各处理间养分含量相同且满足植物生长需要,预先向供试土壤施入尿素、磷酸氢钙和氯化钾作为底肥(N:100 mg· kg-1、P:120 mg·kg-1、K:350 mg·kg-1),使各处理养分水平一致。供试土壤装于聚乙烯塑料盆(20 cm×15 cm×5 cm),每盆装土1.5 kg。共设7组Cd处理:0、0.05、0.1、0.15、0.3、0.6、1.2 mg·kg-1,向土壤中喷施外源Cd溶液(CdCl2·2.5H2O),待其风干后摊开混匀以加速其均质化进程,均质期40 d,期满后播种。供试品种信息见表 2。
|
|
表 2 供试白菜编号、品种及原产地 Table 2 The code, cultivar and origin of the tested cabbages |
将供试白菜种子用10% H2O2消毒15 min,后用去离子水冲净,挑选籽粒饱满的种子播种,每盆播种20粒,待植株长至3片真叶时,间苗至每盆6株,期间将土壤含水量保持在田间持水量的65%~70%,及时去除虫害、杂草(整个栽培过程仿照当地习惯栽培模式进行)。每品种、每处理均重复3次,种植30 d后取每品种、每处理长势一致的3株用于Cd剂量-效应分析,40 d后收获余下植株进行Cd积累量及氧化损伤等指标测定,收获时先用自来水将完整的白菜植株冲洗干净,再用EDTA-2Na浸泡植株根系30 min,以去除根系表面有效态Cd,并经去离子水冲洗后用吸水纸擦干,将白菜分为根和可食用部分(叶)分置于-80 ℃冰箱保存。
1.3 指标测定收获的白菜样品清理完毕后直接称质量,生物量以鲜质量计。土壤样品处置及Cd含量测定参照《土壤质量铅、镉的测定石墨炉原子吸收分光光度法》(GB/T 17141—1997)[15],植物根际土壤样品以抖落法收集500 g,四分法缩分至100 g风干,过2 mm筛除去砾石等杂质,研磨使其全部通过0.15 mm筛备用,其中5 g用于水分含量f的测定,另取待测土样0.2 g采用湿式消解法处理,利用石墨炉原子吸收分光光度计(Per⁃ see General,TAS-GF 990 super,中国)测定Cd含量WCd,其中f及WCd按下式计算
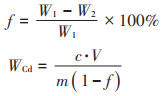
|
式中:f为土壤水分含量,%;W1为烘干前土壤质量,g;W2为烘干后土壤质量,g;WCd为土壤Cd含量,mg·kg-1;c为试液吸光度减去空白试验的吸光度,然后在校准曲线上查得Cd的含量,μg·L-1;V为试液定容体积,mL;m为称取试样质量,g。
植物样品Cd含量测定参照《食品安全国家标准食品中镉的测定》(GB 5009.15—2014)[16],植物各部分样品称质量后冷冻研磨,取0.50 g经湿式消解法处理,消解完成用1% HNO3定容至25 mL容量瓶中并做试剂空白,试液经12 000 r·min-1离心10 min后取20 μL上清液于石墨炉原子吸收分光光度计进行测定,同时以国家标准物质(GSB 04-1721—2004 188038-4,GBW 08502)进行分析质量控制,所有植物样品Cd回收率均大于95%。按下列公式计算白菜可食用部分(叶)及根中Cd含量W、植株相对生物量RFBs、可食用部分(叶)富集系数BCFs、迁移系数TFs及全株净化率ERs:
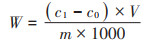
|

|
式中:W为植物样品Cd含量,mg·kg-1;c1为试样消化液Cd含量,ng·mL-1;c0为空白液Cd含量,ng·mL-1;V为消化液定容总体积,mL;m为称取试样质量,g;bT为处理组生物量,g;bCK为对照组生物量,g;WLeaf为可食用部分Cd含量,mg·kg-1;WRoot为根部Cd含量,mg· kg-1;b1为可食用部分鲜质量,g;b2为根部鲜质量,g;ms为根际土壤总质量,g。
白菜叶中的氧化损伤通过单位叶片鲜质量的过氧化氢(H2O2)、超氧阴离子(O2-)、丙二醛(MDA)、游离脯氨酸(FPRO)含量来评估,均需取0.5 g新鲜、清洁的叶片样品,在冷冻条件下制备成匀浆待测。过氧化氢含量测定采用硫酸钛-可见分光光度法[17],超氧阴离子含量测定采用盐酸羟胺-可见分光光度法[18],丙二醛含量测定采用硫代巴比妥酸(TBA)-可见分光光度法[19],游离脯氨酸含量测定采用酸性茚三酮-可见分光光度法[20]。
1.4 数据处理及分析 1.4.1 白菜品种Cd剂量效应分析有研究表明[21],逻辑斯蒂分布模型(Log-logistic distribution)可较好地拟合重金属对植物的剂量-效应关系,由此推知诸如植物的半数有效量(ED50)等剂量参数,且适用于单一物种的生物敏感性分布(Species sensitivity distributions,SSD),故本研究采用其对不同品种白菜镉胁迫剂量-效应曲线进行拟合,并对拟合结果进行外推,以评估供试白菜品种的Cd耐受力。Log-logistic模型如下:

|
式中:y为各Cd处理水平白菜相对生物量,%;a、k为拟合参数;x为各个Cd处理的浓度值,mg·kg-1;xc为EC50的自然对数值。
1.4.2 数据处理采用Excel 2016进行数据处理,Origin 2018软件进行绘图,应用SPSS 23.0统计分析软件对数据进行单因素方差分析(One-way ANOVA)和P < 0.05水平下的LSD检验、Tamhane检验。
2 结果与讨论 2.1 不同品种白菜Cd胁迫剂量-效应不同品种会因Cd剂量不同而产生生物效应上的差异。就白菜而言最直观的剂量-效应便是生物量的变化。如图 1,低Cd浓度下(0.05 mg·kg-1),除品种4、6、11、12、16、17、20外的13种白菜生长均表现出一定毒性刺激(Hormesis)效应,较对照生物量增幅0.57%~4.51%,这与Sidhu等[22]研究中发现低浓度Cd促使臭荠(Coronopus didymus L.)生物量增加的情况相似,这或许是植物在低Cd胁迫时的一种保护性“稀释”机制;而随浓度上升,各品种相对生物量均开始降低,此时Cd的毒性抑制对白菜生长产生影响;而土壤Cd浓度达到最大(1.2 mg·kg-1)时,Cd生物量抑制作用最明显。通过剂量效应曲线,可求算出供试白菜Cd的EC50及其95%置信区间,如表 3。Cd胁迫下20种白菜EC50的变化范围为0.469~1.204 mg·kg-1,且r2最低为0.983,优于Wang等[23]以印度芥菜亚细胞积累表征的研究结果。其中品种18(JF)EC50值最高,为1.204 mg·kg-1;品种20(QT)EC50值最低,为0.469 mg· kg-1,二者相差2.57倍。

|
图 1 不同品种白菜Cd胁迫-剂量效应曲线 Figure 1 Dose-effect curves of different cabbage cultivars under Cd stress |
|
|
表 3 白菜Cd半抑制毒性阈值浓度(EC50,mg·kg-1)及其95%置信区间 Table 3 Toxicity thresholds of Cd to cabbage cultivars(EC50, mg·kg-1)and their 95% confidence intervals |
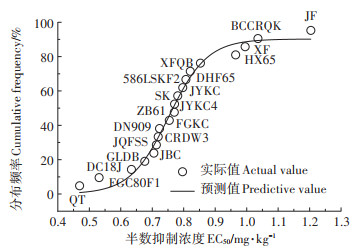
由于盆栽试验环境较为恒定,可排除多数干扰因素,如pH、盐效应等的干扰,因此可通过Log-logistic模型拟合白菜品种生物量,衡量不同品种Cd耐受能力[24]。基于不同品种白菜生物量进行拟合的半数抑制浓度结果可知,黑土栽培过程中供试白菜Cd耐受能力由高到低依次为:JF、BCCRQJ、XF、HX65、XFQB、DHF65、586LSKF2、JYKC、SK、JYKC4、ZB61、FGKC、DN909、CRDW3、JQFSS、JBC、GLDB、DC18J、FGC80F1、QT,品种Cd耐性差异明显,将半数抑制浓度进行对数变换后,继续采用Log-logistic模型对其进行物种敏感性分析(SSD),分布曲线如图 2,基于半数抑制浓度的拟合结果较好,r2=0.982 1,大部分品种的实际值大于或接近预测值,但耐性最佳品种JF和最差品种QT有较高预测值,这同Ding等[25]在白菜-土壤系统上建立SSD以评价土壤Cd阈值的结果类似,或许说明其可能在其他环境下具备较高耐Cd潜力。
|
图 2 不同白菜品种基于半数抑制浓度的物种敏感性分布曲线 Figure 2 Cumulative frequencies of species sensitivity distributions(SSD)of the different cabbage cultivars based on EC50 |
土壤中Cd污染程度不同会造成白菜的积累差异,而白菜可食部分(叶)中的Cd积累是评定其食用安全性的重要参数[10]。不同程度Cd污染土壤中供试品种叶积累量分布如图 3,对于同一程度Cd污染,20种白菜品种叶中Cd积累量符合正态分布,品种间差异明显,按Cd积累量离散程度由小到大分别为0.1、0.05、0.15、0.3、0.6、1.2 mg·kg-1,其中Cd投加浓度为0.6 mg·kg-1和1.2 mg·kg-1的土壤中有过半数的供试品种超过或接近《食品安全国家标准食品中污染物限量》(GB 2762—2017)中叶菜类农产品Cd检出限0.2 mg·kg-1[26],而其他投加浓度下叶Cd积累量较小,难以作为特征积累品种的筛选依据,且0.6 mg·kg-1和1.2 mg·kg-1的土壤Cd添加浓度为《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)中[27]推荐农用地土壤Cd污染风险筛选值(0.6 mg·kg-1,pH>7.5)的1倍和2倍,可供指导实际筛选工作。因此,为准确切合东北典型黑土耕作环境,筛选出安全可靠的白菜品种,本试验确定以土壤Cd投加浓度0.6 mg·kg-1和1.2 mg·kg-1作为筛选浓度,测定供试品种各部位Cd积累量,以鉴定高、低Cd积累白菜品种。
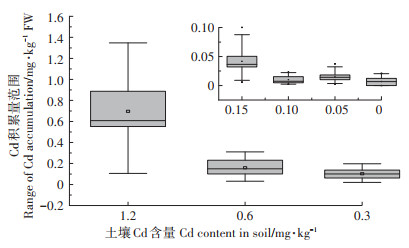
|
图 3 不同程度Cd污染土壤中白菜品种的积累量范围 Figure 3 Accumlation range of cabbage cultivars in soil of different Cd level |
白菜品种间各部位Cd积累能力也存在差异,而不同部位Cd积累量差异决定了品种独特的积累特征和植物-土壤效应[28],供试白菜各部分Cd积累量如图 4,当土壤外源Cd含量为1.2 mg·kg-1时(图 4A),叶Cd积累最高品种为DHF65(品种15),积累量达1.348 mg·kg-1 FW;最低为JF(品种18),积累量仅0.106 mg· kg-1 FW,也是试验中唯一一种在1.2 mg·kg-1筛选浓度下Cd积累量低于0.2 mg·kg-1 FW国家食品安全标准限值的供试品种。根Cd积累最高品种为BCCRQJ(品种13),积累量达3.128 mg·kg-1 FW;最低品种为JF(品种18),积累量为0.614 mg·kg-1 FW。大部分叶菜类蔬菜叶Cd积累均保持较高水平,这与张泽锦等[29]的研究相似。而当土壤外源Cd含量为0.6 mg· kg-1时(图 4B),叶Cd积累从高到低依次为品种1、5、15、7、3、10、2、9、14、6、4、13、12、8、19、16、17、20、11、18,其中30%超出了国家食品安全标准限值。根Cd积累由高到低依次为品种10、5、1、15、7、9、13、8、3、2、14、20、19、6、4、12、18、16、11、17。由于筛选浓度已经接近或降至品种的耐受浓度,同高浓度组相比,一些品种(如FGC80F1)的Cd积累量有了较大变化,相关研究认为[30]这是由于植物根系在Cd积累中起着主控作用。

|
不同小写字母表示不同处理间存在显著差异(P < 0.05)。下同 Different lowercase letters indicate significant differences among treatments(P < 0.05). The same below 图 4 供试白菜品种不同部位Cd积累量 Figure 4 Cd accumulation in different parts of tested cabbage cultivars |
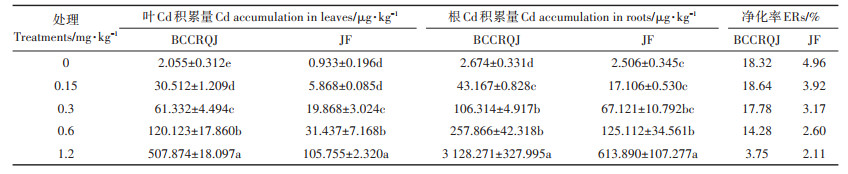
植物Cd积累特征可通过富集系数(BCFs)、迁移系数(TFs)来描述,而根际土壤Cd含量和植物净化率可反映植物-土壤体系中的相互作用,有助于选取适当植物控制土壤污染[31]。供试品种根际土壤Cd含量、富集系数、迁移系数、净化率如表 4,1.2 mg·kg-1筛选浓度下,品种间根际土壤Cd含量差异明显(P < 0.05),CRDW3(品种1)具有最强的叶Cd富集能力,是最弱品种QT(品种20)的10.8倍,FGC80F1(品种17)根叶间Cd迁移最强,为最弱品种JF(品种18)和QT(品种20)的5.0倍,BCCRQJ(品种13)单株净化能力最佳,是最低品种XFQB(品种19)的11.7倍;0.6 mg·kg-1筛选浓度下的品种间根际土壤Cd含量差异也十分明显(P < 0.05),但品种积累特征并不同于高浓度(1.2 mg·kg-1),BCCRQJ(品种13)叶Cd富集能力最高,是最低品种JF(品种18)的5.7倍,JYKC(品种6)根叶间Cd迁移能力最高,为最低品种JF(品种18)的4.2倍,BCCRQJ(品种13)在0.6 mg·kg-1筛选浓度下也具有最高Cd净化率,为14.28%,最低的QT(品种20)与之相差5.6倍。相关研究认为[32]低积累植物可食用部分迁移系数和富集系数应小于1,且系数越小越说明污染物难向可食用部分积累,而高积累植物迁移系数和富集系数则越大越好,也有学者[33]发现青葙(Celosia argentea Linn.)等Cd超积累植物叶积累能力高于根系。不仅如此高积累植物更看重对污染物的净化率,净化率越高,单株净化能力越强,吴志超[34]也据此完成对高、低Cd积累油菜的筛选。
|
|
表 4 供试白菜品种根际土Cd含量、富集系数、迁移系数及净化率 Table 4 Cd content in rhizosphere, bioconcentration factors(BCFs), translocation factors(TFs), and extraction rates(ERs)of tested cabbage cultivars |
可投入实际生产的高、低Cd积累品种需具备耐受力强,积累特征稳定且显著的特点,而其积累量也与生物量存在联系[35]。由于95%的供试品种在1.2 mg·kg-1筛选下生长不良,仅JF在此浓度下有较高生物量,结合各品种半数抑制浓度(表 3),BCCRQJ(品种13)Cd耐受力仅次于JF,且净化率最高,仅根部积累量就达3.128 mg·kg-1 FW,可作为高Cd积累品种适用于≤0.6 mg·kg-1Cd污染地区,而JF(品种18)叶Cd积累量低,Cd富集、迁移因子均小于1,0.6 mg·kg-1筛选条件下JF叶仅含Cd 0.031 mg·kg-1 FW,可保证食用安全,可作为低Cd积累品种应用于≤0.6 mg·kg-1Cd污染地区。对比二者随土壤外源Cd含量变化的积累能力发现(表 5),两品种叶、根的Cd积累量均显著增高(P < 0.05),其中BCCRQJ(品种13)叶、根积累量在1.2 mg· kg-1下最高,分别为JF的4.8倍和5.1倍。而对比二者净化率可发现(表 5),土壤外源Cd浓度增加会降低两品种净化效率,但即使在高浓度下(1.2 mg·kg-1),BCCRQJ净化率也高于唐皓等[7]研究中高Cd积累品种的净化率。低浓度下(0.15 mg·kg-1)BCCRQJ净化率有所升高,这可能是由于低浓度Cd刺激了BCCRQJ的吸收与体内输送[36]。不过,虽然BCCRQJ有较高单株净化率,但积累量较低,远不及龙葵[37]等超积累植物的净化能力。
|
|
表 5 不同浓度外源Cd胁迫下两种白菜的Cd积累 Table 5 Accumulation of two cabbage cultivars under different exogenous Cd concentrations |
Cd胁迫会导致白菜积累过氧化氢、超氧阴离子等活性氧(ROS),造成氧化损伤产生大量丙二醛和游离脯氨酸[35],且氧化损伤的程度受Cd浓度影响[38]。Cd诱导不同品种白菜产生的氧化应激反应与基因型有关,不同外源Cd浓度下,两白菜品种叶中的过氧化氢、超氧阴离子、丙二醛及游离脯氨酸含量如图 5所示。
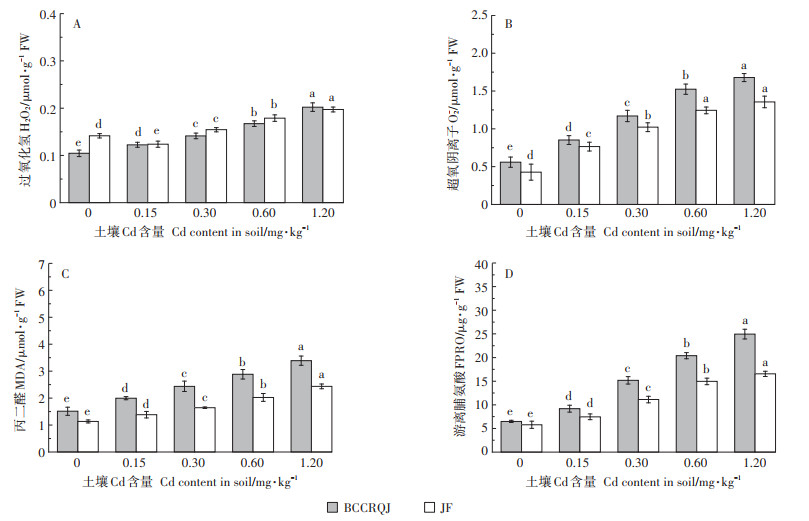
|
图 5 不同浓度外源Cd胁迫下两种白菜氧化损伤指标 Figure 5 Oxidative damage factors of two cabbage cultivars under different exogenous Cd concentrations |
正常植物体内过氧化氢(H2O2)、超氧阴离子(O2-)等活性氧的产生和清除维持着动态平衡,Cd胁迫会打破该平衡,致使其瞬时积累继而氧化损伤细胞膜结构,其含量是表征植物氧化损伤程度的重要指标,如图 5A、图 5B。外源Cd含量与两种白菜叶中H2O2含量及O2-含量均呈显著正相关(P < 0.05),但BCCRQJ中H2O2增长率高于JF,而O2-增长率则低于JF:当土壤中Cd浓度达到1.2 mg·kg-1时,BCCRQJ的H2O2含量较对照(0 mg·kg-1)增长了94.2%,而JF增长了38.7%;BCCRQJ的O -2含量较对照增长了200.2%,而JF增长了217.8%。当植物遭受Cd胁迫,O2-的动态平衡会率先被打破,大量O-2的积累会加速细胞衰亡,而H2O2作为植物自身O2-清除反应的中间体,也会大量积累[39]。当低浓度Cd(0.15 mg·kg-1)胁迫JF时,其H2O2含量有所降低,这可能是由于JF自身抗氧化能力提高所致,这同Singh等[40]对于Cd胁迫番茄幼苗的研究结果类似。
丙二醛是脂质过氧化的重要产物,而游离脯氨酸通常伴随植物盐胁迫而激增,正常状况下含量极低,二者均可作为评价Cd诱导植物产生氧化损伤程度的重要指标[41],如图 5C和图 5D。两白菜品种MDA、FPRO含量均随土壤Cd含量升高而显著增高(P < 0.05),同对照相比,1.2 mg·kg-1土壤Cd浓度下,BCCRQJ的MDA含量增长了124.1%,FPRO含量增长了284.9%,JF则分别增长了114.4%和186.4%。Mzoughi等[42]也将MDA作为反映植物Cd诱导氧化损伤程度的指标,发现了Cd胁迫菠菜组织MDA大量积累;同样Ozfidan-Konakci等[43]认为FPRO含量增加可视作胁迫发生标志,观察到Cd处理7 d小麦幼苗中FPRO含量显著升高。另外,当外源Cd增至最高(1.2 mg· kg-1),BCCRQJ中H2O2、O2-、MDA、及FPRO含量水平均高于JF,除O2-外,BCCRQJ各指标增幅也高于JF,孙园园等[44]对于高Cd积累植物黑麦草的研究中也发现,随Cd含量升高脯氨酸、MDA含量有所上升,细胞质、膜过氧化明显。这意味着在较高的污染水平下高Cd积累白菜品种或许会比低Cd积累白菜品种承受更严重的氧化胁迫。
3 结论(1)20种白菜对于Cd胁迫的敏感性分布具有显著差异,其中JF具有最强Cd耐性,耐受阈值为1.204 mg·kg-1,BCCRQJ次之,为1.036 mg·kg-1,QT Cd耐性最差,仅为0.469 mg·kg-1。
(2)不同土壤Cd浓度下20种白菜可食用部分积累量差异均明显,其中土壤外源Cd含量为1.2 mg· kg-1时种间差异最大,0.6 mg·kg-1时次之。此两浓度下:JF可食用部分Cd积累量均最低,低于国家食品安全标准限值0.2 mg·kg-1(叶菜类产品);迁移、富集系数均小于1,说明其可作为在东北地区安全生产的低Cd积累品种。而BCCRQJ净化率最高,为18.64%,说明其有较好Cd吸收作用,为高Cd积累品种,具有一定植物修复潜力。
(3)JF和BCCRQJ叶、根Cd积累量与土壤Cd含量呈显著正相关,净化率与之显著负相关(P < 0.05)。且随Cd胁迫程度加剧,二者氧化损伤越严重,过氧化氢、超氧阴离子、丙二醛、游离脯氨酸含量均随土壤外源Cd含量上升而显著增加(P < 0.05),但BCCRQT除超氧阴离子外的氧化损伤指标增幅均高于JF,说明高Cd积累品种能承受更高的氧化损伤风险,而低积累Cd品种JF能更好地抵抗Cd诱导的氧化胁迫。
| [1] |
Zhao F J, Ma Y B, Zhu Y G, et al. Soil contamination in China:Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. |
| [2] |
Halwani D A, Jurdi M, Abu S F K, et al. Cadmium health risk assessment and anthropogenic sources of pollution in Mount-Lebanon Springs[J]. Exposure and Health, 2019(1): 1-16. |
| [3] |
中华人民共和国生态环境部, 中华人民共和国自然资源部. 全国土壤污染状况调查公报[J]. 北京:中华人民共和国生态环境部, 中华人民共和国自然资源部, 2014, 1-5. |
| [4] |
中华人民共和国国务院.土壤污染防治行动计划[EL/OL].[2016-5-31]. http://www.gov.cn/zhengce/content/2016-05/31/content_5078377.htm State Council of PRC. Soil pollution prevention and control action plan[EL/OL].[2016-5-31]. http://www.gov.cn/zhengce/content/2016-05/31/content_5078377.htm |
| [5] |
谢晓梅, 方至萍, 廖敏, 等. 低积累水稻品种联合腐植酸、海泡石保障重镉污染稻田安全生产的潜力[J]. 环境科学, 2018, 39(9): 4348-4358. XIE Xiao-mei, FANG Zhi-ping, LIAO Min, et al. Potential to ensure safe production from rice fields polluted with heavy cadmium by combining a rice variety with low cadmium accumulation, humic acid, and sepiolite[J]. Environmental Science, 2018, 39(9): 4348-4358. |
| [6] |
孟楠, 安平, 王萌, 等. 基于典型污灌区土壤筛选耐盐、Cd低吸收小麦品种[J]. 农业环境科学学报, 2018, 37(3): 409-414. MENG Nan, AN Ping, WANG Meng, et al. Screening low-Cd wheat cultivars characterized with high salinity tolerance for typical sewage irrigation soils[J]. Journal of Agro-Environment Science, 2018, 37(3): 409-414. |
| [7] |
唐皓, 李廷轩, 张锡洲, 等. 水稻镉高积累材料的筛选及其镉积累特征研究[J]. 生态环境学报, 2015, 24(11): 1910-1916. TANG Hao, LI Ting-xuan, ZHANG Xi-zhou, et al. Screening of rice cultivars with high cadmium accumulation and its cadmium accumulation characterists[J]. Ecology and Environmental Sciences, 2015, 24(11): 1910-1916. |
| [8] |
Sun Y, Zhou Q, Diao C. Effects of cadmium and arsenic on growth and metal accumulation of Cd-hyperaccumulator Solanum nigrum L.[J]. Bioresource Technology, 2008, 99(5): 1103-1110. |
| [9] |
唐琳.设施农业土壤镉-硝酸盐复合污染边生产边修复过程研究[D].杭州: 浙江大学, 2017. TANG Lin. Processes of phytoremediation coupled with agro-production of cadmium and nitrate co-contaminated soils[D]. Hangzhou: Zhejiang University, 2017. |
| [10] |
杜志鹏, 向丹, 苏德纯. 不同Cd积累能力大白菜吸收转运Cd的差异性[J]. 生态环境学报, 2018, 27(11): 2150-2155. DU Zhi-peng, XIANG Dan, SU De-chun. Difference in absorption and transform of Cd by Brassica pekinensis L. with different Cd accumulation ability[J]. Ecology and Environmental Sciences, 2018, 27(11): 2150-2155. |
| [11] |
杜小平, 康靖全, 吕金印. 镉低积累青菜品种筛选及硫对镉胁迫下青菜镉含量和品质影响[J]. 农业环境科学学报, 2018, 37(8): 1592-1601. DU Xiao-ping, KANG Jing-quan, LÜ Jin-yin. Selection for low-Cdaccumulating cultivars of pakchoi(Brassica chinensis L.), effects of sulfur on Cd content, and quality characters under Cd stress[J]. Journal of Agro-Environment Science, 2018, 37(8): 1592-1601. |
| [12] |
陈小华, 沈根祥, 白玉杰, 等. 不同作物对土壤中Cd的富集特征及低累积品种筛选[J]. 环境科学, 2019(10): 1-10. CHEN Xiao-hua, SHEN Gen-xiang, BAI Yu-jie, et al. Accumulation characteristics of Cd in different crops and screening of low-Cd accumulation cultivars[J]. Environmental Science, 2019(10): 1-10. |
| [13] |
Xia X Q, Yang Z F, Cui Y J, et al. Soil heavy metal concentrations and their typical input and output fluxes on the southern Song-nen Plain, Heilongjiang Province, China[J]. Journal of Geochemical Exploration, 2014, 139: 85-96. |
| [14] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2015. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Beijing: China Agriculture Press, 2015. |
| [15] |
中华人民共和国国家卫生健康委员会.土壤质量铅、镉的测定石墨炉原子吸收分光光度法(GB/T 17141-1997)[S].北京: 中华人民共和国国家卫生健康委员会, 1998: 1-4. National Health Commission of PRC. Soil quality-determination of lead, cadmium-graphite furnace atomic absorption spectrophotometry (GB/T 17141-1997)[S]. Beijing: National Health Commission of PRC, 1998: 1-4. |
| [16] |
中华人民共和国国家卫生健康委员会.食品安全国家标准食品中镉的测定(GB 5009.15-2014)[S].北京: 中华人民共和国国家卫生健康委员会, 2015: 1-4. National Health Commission of PRC. National food safety standarddetermination of cadmium in foods(GB 5009.15-2014)[S]. Beijing: National Health Commission of PRC, 2015: 1-4. |
| [17] |
Patterson B D, MacRae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium(Ⅳ)[J]. Analytical Biochemistry, 1984, 139(2): 487-492. DOI:10.1016/0003-2697(84)90039-3 |
| [18] |
Wu Q S, Zou Y N, Liu W, et al. Alleviation of salt stress in citrus seedlings inoculated with mycorrhiza:Changes in leaf antioxidant defense systems[J]. Plant Soil & Environment, 2010, 56(10): 470-475. |
| [19] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. LI He-sheng. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2000. |
| [20] |
He J L, Li H, Luo J, et al. A transcriptomic network underlies microstructural and physiological responses to cadmium in Populus x canescens[J]. Plant Physiology, 2013, 162(1): 424-439. |
| [21] |
刘克.我国主要小麦产地土壤镉和铅的安全阈值研究[D].杨凌: 西北农林科技大学, 2016. LIU Ke. Soil threshold of cadmium and lead in major Chinese wheatproducing areas[D]. Yangling: Northwest A&F University, 2016. |
| [22] |
Sidhu G P S, Singh H P, Batish D R, et al. Tolerance and hyperaccumulation of cadmium by a wild, unpalatable herb Coronopus didymus (L.)Sm.(Brassicaceae)[J]. Ecotoxicology and Environmental Safety, 2017, 135: 209-215. |
| [23] |
Wang Y P, Huang J, G ao, Y Z. Subcellular accumulation of different concentrations of cadmium, nickel, and copper in Indian mustard and application of a sigmoidal model[J]. Journal of Environmental Quality, 2013, 42(4): 1142-1150. |
| [24] |
Haanstra L, Doelman P, Voshaar J. The use of sigmoidal dose response curves in soil ecotoxicological research[J]. Plant and Soil, 1985, 84(2): 293-297. |
| [25] |
Ding C F, Ma Y B, Li X G, et al. Determination and validation of soil thresholds for cadmium based on food quality standard and health risk assessment[J]. Science of the Total Environment, 2018, 619: 700-706. |
| [26] |
中华人民共和国国家卫生健康委员会.食品安全国家标准食品中污染物限量(GB 2762-2017)[S].北京: 中华人民共和国国家卫生健康委员会, 2017: 1-17. National Health Commission of PRC. National food safety standardquantity of pollutants in food(GB 2762-2017)[S]. Beijing: National Health Commission of PRC, 2017: 1-17. |
| [27] |
中华人民共和国生态环境部, 国家市场监督管理总局.土壤环境质量农用地土壤污染风险管控标准(GB 15618-2018)[S].北京: 中华人民共和国生态环境部, 国家市场监督管理总局, 2018: 1-4. Ministry of Ecology and Environment of PRC, State Administration for Market Regulation. Soil environmental quality-risk control standard for soil contamination of agricultural land(GB 15618-2018)[S]. Beijing: Ministry of Ecology and Environment of PRC, State Administration for Market Regulation, 2018: 1-4. |
| [28] |
霍文敏, 邹茸, 王丽, 等. 间作条件下超积累和非超积累植物对重金属镉的积累研究[J]. 中国土壤与肥料, 2019(3): 165-171. HUO Wen-min, ZOU Rong, WANG Li, et al. Study on the accumulating characteristics of heavy metal cadmium by hyperaccumulator and non-hyperaccumulator under intercropping[J]. Soil and Fertilizer Sciences in China, 2019(3): 165-171. |
| [29] |
张泽锦, 唐丽, 李跃建, 等. 四川地区低镉富集蔬菜品种分析及安全性评估[J]. 西南农业学报, 2016, 29(10): 2483-2487. ZHANG Ze-jin, TANG Li, LI Yue-jian, et al. Analysis of low cadmium collection capacity vegetables and food safety assessment of vegetables in Sichuan Province[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(10): 2483-2487. |
| [30] |
侯丹迪.超积累植物东南景天根系对重金属的吸收积累及根际细菌群落特征[D].杭州: 浙江大学, 2017. HOU Dan-di. Root uptake and accumulation of heavy metals and rhizosphere bacteria community of hyperaccumulator Sedum alfredii Hance[D]. Hangzhou: Zhejiang University, 2017. |
| [31] |
刘勇, 刘燕, 杨丹, 等. 三叶草(Trifolium repens)用于土壤镉污染的修复潜力[J]. 农业环境科学学报, 2017, 36(11): 2226-2232. LIU Yong, LIU Yan, YANG Dan, et al. Remediation potential of Trifolium repens used in cadmium-contaminated soils[J]. Journal of AgroEnvironment Science, 2017, 36(11): 2226-2232. |
| [32] |
秦世玉.甘蓝型油菜钼高低积累品种的筛选及其生理分子机制研究[D].武汉: 华中农业大学, 2016. QIN Shi-yu. Screening of high/low molybdenum accumulation Brassica napus cultivars and research on the physiological and molecular mechanisms[D]. Wuhan: Huazhong Agricultural University, 2016. |
| [33] |
吴惠瑾, 刘杰. 三种富集植物对广西兴源铅锌矿区周边Cd污染农田土壤修复性能研究[J]. 工业安全与环保, 2016, 42(2): 1-4. WU Hui-jin, LIU Jie. Study of three accumulators for phytoremediation of paddy soil contaminated by cadmium at Pb-Zn mining district in Guangxi[J]. Industrial Safety and Environmental Protection, 2016, 42(2): 1-4. |
| [34] |
吴志超.高低镉积累油菜品种筛选及其生化机制研究[D].武汉: 华中农业大学, 2015. WU Zhi-chao. Screening of high/low cadmium accumulation Brassica napus cultivars and research on the biochemical mechanisms[D]. Wuhan: Huazhong Agricultural University, 2015. |
| [35] |
Rizwan M, Ali S, Adrees M, et al. A critical review on effects, tolerance mechanisms and management of cadmium in vegetables[J]. Chemosphere, 2017, 182: 90-105. |
| [36] |
Uraguchi S, Mori S, Kuramata M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany, 2009, 60: 2677-2688. |
| [37] |
方楚凝, 吴剑, 侯涛. 不同管理模式下龙葵对Cd污染土壤的修复效果试验研究[J]. 安全与环境工程, 2016, 23(1): 47-50. FANG Chu-ning, WU Jian, HOU Tao. Phytoremediation efficiency of Solanum nigrum for Cd polluted soil with various management methods[J]. Safety and Environmental Engineering, 2016, 23(1): 47-50. |
| [38] |
Zhang Y R, Jiang C Y, Wang J J, et al. Oxidative stress and mitogenactivated protein kinase pathways involved in cadmium-induced BRL 3A cell apoptosis[J]. Oxidative Medicine and Cellular Longevity, 2013, 1-12. DOI:10.1155/2013/516051 |
| [39] |
Li Q, Wang G, Wang Y R, et al. Foliar application of salicylic acid alleviate the cadmium toxicity by modulation the reactive oxygen species in potato[J]. Ecotoxicology and Environmental Safety, 2019, 172: 317-325. |
| [40] |
Singh S, Singh A, Srivastava P K, et al. Cadmium toxicity and its amelioration by kinetin in tomato seedlings vis-a-vis ascorbate-glutathione cycle[J]. Journal of Photochemistry and Photobiology B:Biology, 2018, 178: 76-84. |
| [41] |
Chen W W, Guo C, Hussain S, et al. Role of xylo-oligosaccharides in protection against salinity-induced adversities in Chinese cabbage[J]. Environmental Science and Pollution Research, 2016, 23: 1254-1264. |
| [42] |
Mzoughi Z, Souid G, Timoumi R, et al. Partial characterization of the edible Spinacia oleracea polysaccharides:Cytoprotective and antioxidant potentials against Cd induced toxicity in HCT116 and HEK293 cells[J]. International Journal of Biological Macromolecules, 2019, 136: 332-340. |
| [43] |
Ozfidan-Konakci C, Yildiztugay E, Bahtiyar M, et al. The humic acid-induced changes in the water status, chlorophyll fluorescence and antioxidant defense systems of wheat leaves with cadmium stress[J]. Ecotoxicology and Environmental Safety, 2018, 155: 66-75. |
| [44] |
孙园园, 关萍, 何杉, 等. 镉胁迫对多花黑麦草镉积累特征、生理抗性及超微结构的影响[J]. 草业科学, 2016, 33(8): 1589-1597. SUN Yuan-yuan, GUAN Ping, HE Shan, et al. Effects of Cd stress on Cd accumulation, physiological response and ultrastructure of Lolium multiflorum[J]. Pratacultural Science, 2016, 33(8): 1589-1597. |
 2020, Vol. 39
2020, Vol. 39