铜是植物生长的必需元素,但超量的铜元素会对植物生长、呼吸、光合等生理过程产生明显的抑制作用,进而影响作物的生长与产量[1],并严重威胁农产品的质量安全[2-3]。近年来,随着工农业生产的快速发展,铜矿的过度开采、工业“三废”的排放以及含铜杀菌剂和化肥等在农业生产过程中的频繁使用造成了土壤中铜元素的大量累积,铜污染已成为严重的土壤环境污染问题之一[4]。
目前,对铜污染的生态恢复研究,主要通过物理与化学技术、生物技术及农业生态技术进行污染综合治理和生态修复[5],但是这些方法也面临投资昂贵、所需设备复杂、时间长久等问题。已有大量研究表明,通过添加外源物质柠檬酸[6]、硫硅配施[7]、水杨酸[8]、油菜素内酯[9]等可以提高作物对铜污染的耐受性。这种方法投入成本低,对土壤环境干扰破坏小,因此在治理铜污染土壤方面具有广阔的应用前景。
江西是铜矿大省,铜产量位居全国榜首[10],但过度的开采和废物的排放也造成了严重的土壤环境污染[11],大量研究表明在铜矿开采区域,土壤、水体中的铜元素显著超标,给水稻等作物的安全生产造成了很大的影响。有研究表明,多糖具有一定的抗氧化能力和提高生物活性能力,同时其含有大量功能基团可以吸附环境中的重金属,在应对农业重金属污染方面具有广阔的前景,但相关研究国内外尚未见报道。因此,本研究以茶树菇菌糠多糖为试验材料,研究其对铜离子胁迫下水稻种子萌发的影响,并通过形态学观察、酶活测定等方法初步阐明茶树菇菌糠多糖诱导水稻缓解铜离子毒害的作用机理,为外源天然物质应用于重金属污染区域农作物生产提供理论依据。
1 材料与方法 1.1 试验材料五优308水稻种子由湖南隆平种业有限公司提供,种子经84消毒液(稀释200倍)浸泡15 min,然后用蒸馏水冲洗4~6次至无消毒液气味,备用。
茶树菇菌糠由抚州市黎川县江西利康绿色农业有限公司提供,经烘干、粉碎、过筛、热水浸提、浓缩、乙醇浸提、冻干得到茶树菇菌糠多糖[12]。
1.2 试验设计 1.2.1 不同铜离子浓度溶液对水稻种子处理消毒后的种子用蒸馏水浸泡1 d,挑选颗粒饱满的种子铺在含两层滤纸的平皿上,每皿100粒,用不同浓度的铜离子溶液0(CK)、2、4、6、8、10 mg·L-1浸泡,设置3次重复。培养皿放置于28 ℃培养箱进行黑暗处理,每2 d换1次培养液,培养至第8 d收集备用。
1.2.2 铜离子胁迫下茶树菇菌糠多糖对水稻种子处理设茶树菇菌糠多糖浓度分别为0、1、10、100、1000、2000 mg·L-1。将浸泡消毒后的水稻种子分别放入不同浓度的茶树菇菌糠多糖溶液中,于室温下浸种24 h,铺在含两层滤纸的平皿上,每皿100粒,用6 mg·L-1的铜离子溶液浸泡,以无胁迫处理为对照组(CK),设置3次重复。培养皿放置于28 ℃培养箱进行黑暗处理,每2 d换1次培养液,培养至第8 d收集备用。
1.3 测定项目与方法 1.3.1 形态指标的测定培养期间每日记录水稻种子萌发数量,第3 d统计种子发芽势,第8 d统计种子发芽率并测定水稻幼苗的根长、芽长、根鲜质量和芽鲜质量。按照下列公式计算发芽势和发芽率:

|
铜离子吸收量的测定[13]:取水稻根系浸入25 mmol·L-1EDTA-Na溶液中交换15 min,以解吸根系表面吸附的金属离子,再用去离子水冲洗并用滤纸吸干水分,然后分别于105 ℃杀青2 h,75 ℃烘干至恒质量,采用HNO3-HClO4(4:1,V:V)消化后用原子吸收光谱仪测定铜含量。
质膜透性的测定[14]:分别剪取大小和部位相同的水稻幼芽和根,先用蒸馏水洗净,再用去离子水冲洗,然后用滤纸吸干表面水分,将幼芽和根剪成长度适宜的长条,测定相对电导率。
质膜完整性的测定[15]:质膜完整性检验采用Evans blue染色的方法。从铜离子胁迫后的培养皿里取长度为2 cm左右的水稻幼苗根尖,每个浓度3~5根,放于4 ℃冷处理的0.5 mmol·L-1 CaCl2(pH 4.5)溶液中浸泡5 min,然后用蒸馏水洗净吸干,再将根浸泡于4 mL 0.025%伊文思蓝溶液(伊文思蓝溶于100 μmol· L-1 pH 5.6的CaCl2溶液)中30 min,取出后用蒸馏水冲洗,再在蒸馏水中浸泡15 min,最后在光学显微镜下观察拍照,以测定原生质膜的完整性。
可溶性蛋白和糖的测定[16]:称取0.5 g水稻幼芽置于研钵中,加入pH 5.6的柠檬酸缓冲液,磨成匀浆后倒入10 mL离心管中,用缓冲液定容至刻度,混匀后在20 ℃下放置15~20 min,期间每隔3 min振荡一次。然后经4 ℃、4000 r·min-1离心15 min,取上清液备用。采用考马斯亮蓝法测定可溶性蛋白,采用硫酸-蒽酮法测定可溶性糖。
MDA含量的测定:采用硫代巴比妥酸(TBA)法[17]测定MDA含量。取幼芽0.5 g,与10 mL 10%的三氯乙酸和少量石英砂在冰浴中研磨成匀浆,4 ℃、4000 r·min-1离心10 min,上清液即为提取液,于4 ℃保存,用于MDA含量的测定。
抗氧化酶活性的测定[18]:称取幼芽0.5 g于预冷的研钵中,加入5 mL预冷的0.05 mol·L-1磷酸缓冲液(pH 7.8,2%聚乙烯吡咯烷酮PVP)及少量石英砂,冰浴研磨成浆,4 ℃下10 000 r·min-1离心15 min,上清液即为粗酶液,用缓冲液定容至10 mL。采用双氧水法测定过氧化氢酶(CAT)活性,采用愈创木酚法测定过氧化物酶(POD)活性,采用氮蓝四唑(NBT)比色法测定超氧化物歧化酶(SOD)活性。
1.4 数据处理采用Origin 8.5、DPS 7.5软件进行统计分析和差异显著性检验,对不同处理的数据进行单因素方差分析和Duncan多重比较。表中数值均为平均值±标准差,图、表中不同小写字母表示不同处理间在α=0.05水平上差异显著,表示差异显著性的字母按照从大到小的顺序标记,即最大平均数标记为a。
2 结果与分析 2.1 不同浓度铜离子对水稻种子萌发及生理特性的影响 2.1.1 对水稻种子萌发的影响由表 1可知,铜处理对水稻种子的发芽势、发芽率和根长均有显著的抑制效果。随着铜离子浓度的增加,抑制效果也增加,当铜离子浓度为10 mg·L-1时,对水稻种子的发芽势、发芽率和根长的抑制率分别达到了53.08%、33.79%、65.39%。
|
|
表 1 不同浓度铜离子对水稻种子萌发的影响 Table 1 Effects of different concentrations of copper ion on seed germination of rice |
从表 2的结果可以看出,随着铜离子浓度的不断增加,根和芽的铜离子浓度都呈先上升后下降的趋势,当铜离子浓度为6 mg·L-1时,根的吸收量最大;当铜离子浓度为8 mg·L-1时,芽的吸收量最大。由于根和芽的铜离子吸收量增大,导致根和芽的质膜透性受损,相对电导率增大(表 2)。
|
|
表 2 不同浓度铜离子对水稻种子铜离子吸收量和质膜透性的影响 Table 2 Effects of different concentrations of copper ion on copper ion uptake and plasma membrane permeability on seed germination of rice |
MDA是膜脂过氧化的最终分解产物,是植物细胞膜质过氧化程度的体现,其含量可以反映植物遭受逆境伤害的程度。由表 3可知,铜离子添加会提高水稻幼芽中MDA含量,且随着铜离子浓度的增加,MDA含量不断上升。当铜离子浓度为10 mg·L-1时,与对照相比,丙二醛含量提高了296.98%。
|
|
表 3 不同浓度铜离子对水稻MDA含量和抗氧化酶活性的影响 Table 3 Effects of different concentrations of copper ion on rice MDA and the effects of antioxidant enzymes |
抗氧化酶(CAT、POD、SOD)是细胞内清除活性氧系统中的重要酶,能有效阻止氧离子(O2-)和过氧化氢(H2O2)在植物体内的积累。从表 3的结果可以看出,铜离子胁迫条件下,水稻中CAT、SOD、POD 3种抗氧化酶的活性均小于对照组,且除POD变化不大外,CAT和SOD的活性均随铜离子浓度的增加而持续降低。当铜离子浓度为10 mg·L-1时,与对照相比,CAT活性下降了49.50%,SOD活性下降了28.49%,POD活性下降了38.24%。
2.2 铜离子胁迫下茶树菇菌糠多糖对水稻种子萌发及生理特性的影响 2.2.1 对水稻种子萌发的影响茶树菇菌糠多糖对铜离子胁迫下水稻种子的萌发具有促进作用。由表 4可知,随着茶树菇菌糠多糖浓度的增加,种子的发芽势和发芽率均先增加后降低,其中1000 mg·L-1茶树菇菌糠多糖对种子的发芽势和发芽率促进作用最为显著,与铜离子胁迫下不添加茶树菇菌糠多糖相比,分别提高了51.76%和10.01%,接近CK组的生长指标。
|
|
表 4 不同浓度茶树菇菌糠多糖对铜离子胁迫下水稻种子萌发的影响 Table 4 Effects of different concentrations of agrocybe cylindracea spent mushroom substrate polysaccharide on rice seed germination under copper ion stress |
由图 1和图 2可知,茶树菇菌糠多糖对铜离子胁迫下水稻幼芽生长促进效果不显著,但对根系生长的促进效果显著。随着茶树菇菌糠多糖浓度的增加,其对水稻幼根生长促进效果也逐渐增强,与不添加茶树菇菌糠多糖相比,分别提高了15.02%、40.77%、34.33%、96.14%、54.94%,但与CK相比存在一定的差距。

|
不同小写字母表示处理间差异显著(P < 0.05)。下同 The different lowercase letters indicate significant differences among treatments at P < 0.05 levels. The same below 图 1 不同浓度茶树菇菌糠多糖对铜离子胁迫下水稻根长、芽长、根鲜重和芽鲜质量的影响 Figure 1 Effects of different concentrations of agrocybe cylindracea spent mushroom substrate polysaccharide on root length, shoot length, root fresh weight, shoot fresh weight of rice under copper ion stress |

|
图 2 不同浓度茶树菇菌糠多糖对铜离子胁迫下水稻种子萌发的影响 Figure 2 Effects of different concentrations of agrocybe cylindracea spent mushroom substrate polysaccharide on rice seed germination under copper ion stress |
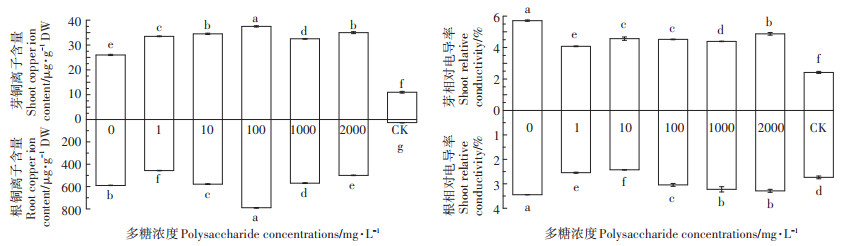
由图 3可知,随着茶树菇菌糠多糖浓度的增加,水稻幼苗根部和幼芽的铜离子含量呈先上升后下降的趋势,其中当多糖浓度为100 mg·L-1时,根部和幼芽铜离子的含量最高。不同浓度的茶树菇菌糠多糖均可以显著降低根和芽的相对电导率,降低铜离子对植物细胞膜的损伤。
|
图 3 不同浓度茶树菇菌糠多糖对铜离子胁迫下水稻种子铜离子吸收量和质膜透性的影响 Figure 3 Effects of different concentrations of agrocybe cylindracea spent mushroom substrate polysaccharide on copper ion uptake and plasma membrane permeability of rice under copper ion stress |
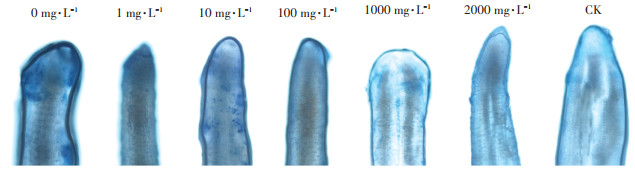
伊文思蓝染色法可以很好地观察植物细胞的质膜损伤情况。由图 4可知,通过伊文思蓝染色法对铜离子胁迫下添加茶树菇菌糠多糖对水稻种子根尖进行染色分析发现,铜离子添加会显著增加细胞的染色深入,而随着菌糠多糖的添加,其染色强度会逐步下降,说明添加不同浓度的茶树菇菌糠多糖对水稻种子根尖质膜有一定的保护作用。
|
图 4 发芽第8 d不同浓度茶树菇菌糠多糖对铜离子胁迫下水稻根尖质膜完整性的影响 Figure 4 Effects of different concentrations of agrocybe cylindracea spent mushroom substrate polysaccharide in the rice root tip cells at eighth day under copper ion stress |
由图 5可以看出,铜离子胁迫且添加茶树菇菌糠多糖下水稻种子可溶性糖与可溶性蛋白呈现大致相同的变化趋势。与CK相比,铜离子胁迫条件下可溶性糖与可溶性蛋白均有提高,提高量分别为47.36%和25.81%。在添加不同浓度茶树菇菌糠多糖的条件下,可溶性糖与可溶性蛋白都有一定程度的下降,其中10 mg·L-1时效果最佳,与未添加多糖处理相比,可溶性糖与可溶性蛋白分别下降了40.95%和33.84%。

|
图 5 铜离子胁迫下茶树菇菌糠多糖对水稻种子可溶性糖和蛋白的影响 Figure 5 Effects of different concentrations of agrocybe cylindracea spent mushroom substrate polysaccharide on soluble sugar and protein of rice under copper ion stress |
铜离子胁迫下添加茶树菇菌糠多糖可以缓解铜离子对水稻种子的毒害作用,降低MDA含量,显著提高抗氧化酶的活性。由图 6可知,与CK相比,未添加多糖处理下MDA含量提高了349.66%,而添加不同浓度茶树菇菌糠多糖与未添加多糖处理相比,分别下降了10.20%、10.52%、29.02%、45.75%、53.91%;与CK相比,未添加多糖处理下抗氧化酶(CAT、POD、SOD)活性分别下降了34.5%、33.79%、9.27%,而添加不同浓度茶树菇菌糠多糖与未添加多糖处理相比,CAT活性分别提高了44.66%、58.78%、66.41%、87.79%、59.16%;POD活性分别提高了22.52%、69.21%、61.92%、57.62%、45.70%;SOD活性分别提高了6.94%、10.40%、12.99%、17.46%、15.53%。
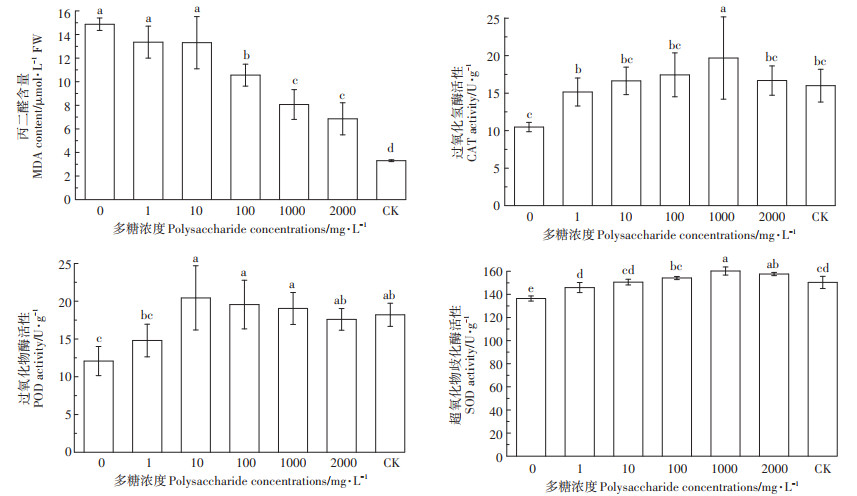
|
图 6 不同浓度茶树菇菌糠多糖对铜离子胁迫下水稻种子MDA含量和抗氧化酶活性的影响 Figure 6 Effects of different concentrations of agrocybe cylindracea spent mushroom substrate polysaccharide on MDA and the effects of antioxidant enzymes of rice under copper ion stress |
茶树菇是一种极具开发潜力的珍稀食药用菌,其栽培数量和产品市场占有率目前已超过香菇[19]。菌糠是真菌收获后的培养基剩余物,含有大量的食用菌菌丝体,富含多糖等活性成分。现有研究表明,茶树菇菌糠多糖是一种具有良好抗氧化性[20-21]及免疫调节[22]活性的大分子物质,可用于动物免疫添加剂等领域。这不仅可以解决废弃菌糠对环境的污染问题,还能实现菌糠的资源化利用[23]。目前研究表明,植物多糖[24]、动物多糖[25]、微生物多糖[26]等均能够增加植物的抗逆性,提高作物在逆境条件下的生长特性。本研究结果表明,添加茶树菇菌糠多糖能显著提高铜离子胁迫条件下水稻种子的发芽势和发芽率,促进根系的生长,修复根部细胞的质膜损伤,抑制MDA的含量,提高抗氧化酶活性,这一效应在水稻幼苗根部体现得尤为突出。上述结论与Katiyar等[27]的研究成果以及本课题组前期工作结果是相一致的。
多糖通过何种途径改善胁迫条件下作物生长特性目前尚无统一结论。从现有研究来看,目前较为公认的有以下几种途径:(1)通过一氧化氮和过氧化氢信号传导途径增强抗氧化酶系统活性,从而增强植物抵御伤害的防御系统能力[28]。Zou等[29]发现紫斑拟南芥多糖可以调节小麦幼苗体内的抗氧化酶活性和细胞内离子的浓度,从而保护小麦免受盐胁迫的伤害;Zong等[30]通过在镉胁迫下的油菜生长过程中添加外源壳聚糖,发现壳聚糖提高了油菜叶片中POD、SOD、CAT活性,降低了叶片内MDA和镉含量,增强了油菜对镉的耐受性。(2)多糖可作用于植物细胞,诱导合成与渗透调节、应激信号传递和能量代谢相关的有机酸、糖、氨基酸及其他代谢产物,进而增强植物生理反应并减轻胁迫下的不利后果[31]。李莉等[32]发现,经海藻糖预处理过的小麦在NaCl胁迫条件下生长时,其细胞电解质渗透率和脯氨酸含量显著降低,而叶绿素含量、根系活力、干物质积累量和生长速度则均有提高,表明海藻糖可以提高作物幼苗对高盐的抗逆能力。(3)多糖可以作为重金属的吸附剂,与环境中的重金属形成络合物,从而降低重金属的毒害作用[33]。Tao等[34]研究了不同胞外多糖对铜和锌的生物吸附能力,结果表明各种多糖对铜离子都有良好的吸附效果,而且其吸附作用主要是通过羟基、羧基和酰胺等化学基团来完成;Hou等[35]比较了野生型和突变型金氏中华根瘤菌所产胞外多糖对铜离子的吸附能力,结果表明多糖可以通过表面的官能团吸附铜离子,而且吸附能力与其结构有关,表面粗糙且具有蜂窝状结构的胞外多糖对铜离子吸附能力更强。
水稻根部是吸收铜等金属离子的首要器官,其铜离子含量相对于芽部来说可高出20倍以上,因此也是受重金属胁迫最为严重的部位[36]。过量的铜会导致植株细胞结构受损,诱导植株体内ROS的形成,从而激活自身的抗氧化系统,并对铜诱导的氧化应激表现出适应性反应[37],严重影响水稻的生理代谢。本研究结果表明,随着铜离子浓度的升高,根和芽的铜离子含量均先增后降,这与徐健程等[38]的研究结果一致,而高浓度铜离子条件下水稻体内重金属含量的降低,可能与重金属离子严重抑制了水稻的生理代谢活力有关。Kamari等[39]在黑麦草和油菜籽培养时添加壳聚糖,研究其对植物吸收Pb、Zn、Cu效率的影响,结果发现在黑麦草生长过程中添加低浓度多糖可以提高重金属吸收率,而高浓度多糖则降低了重金属吸收率,但在油菜籽生长过程中添加低浓度多糖降低了重金属Cu吸收率,高浓度多糖则提高了重金属Cu的吸收率,而对重金属Pb、Zn的吸收率却随着多糖浓度的升高而降低。上述结果表明多糖影响重金属吸收效率可能会随着植物种类的变化而产生不同的效果。
在重金属胁迫条件下的水稻生长过程中添加多糖后,重金属的毒害作用会显著下降。本研究通过伊文思蓝染色可以清晰地看出,随着多糖浓度的升高,水稻根部细胞受到的伤害会减弱,并在多糖的诱导作用下细胞功能得到一定的恢复。随着多糖浓度的持续升高,水稻细胞的渗透压也相应上升,可溶性蛋白和糖含量降低,这可能是水稻所产生的铜结合蛋白等大分子物质的数量减少所造成的[40],这一结果与前人[40-41]研究的结论相一致。同时,对水稻体内抗氧化系统的活力测定结果表明,铜胁迫会导致水稻幼芽的抗氧化酶活性不同程度地降低,同时显著提高水稻幼芽MDA含量,而经菌糠多糖浸种后,胁迫条件下水稻幼芽中的MDA含量显著降低,CAT、POD、SOD活性均显著提高,这与张文平等[12]的研究结果一致,说明多糖的添加在一定程度上缓解了重金属对水稻所造成的氧化伤害。伊文思蓝染色结果也表明菌糠多糖可以显著降低细胞膜脂过氧化,减少活性氧的产生,缓解铜胁迫对水稻的过氧化伤害,这与Yang等[42]研究一致。
4 结论(1)铜胁迫条件下水稻种子的萌发会受到显著抑制,同时其正常生理代谢也会受到严重影响,其中水稻根部的结构与功能受铜离子添加的影响尤为显著。
(2)添加不同浓度茶树菇菌糠多糖可以在一定程度上缓解铜离子对水稻种子萌发过程的毒害作用,提高铜离子胁迫条件下水稻种子的发芽势和发芽率,促进水稻根的生长,修复细胞质膜损伤,降低可溶性糖和可溶性蛋白的含量,提高抗氧化系统活性,最终缓解铜离子对水稻幼苗的毒害作用。
| [1] |
王晓维, 黄国勤, 徐健程, 等. 铜胁迫和间作对玉米抗氧化酶活性及丙二醛含量的影响[J]. 农业环境科学学报, 2014, 33(10): 1890-1896. WANG Xiao-wei, HUANG Guo-qin, XU Jian-cheng, et al. Effects of copper stresses and intercropping on antioxidant enzyme activities and malondialdehyde contents in maize[J]. Journal of Agro-Environment Science, 2014, 33(10): 1890-1896. |
| [2] |
Muyumba D K, Liénard A, Mahy G, et al. Characterization of soil-plant systems in the hills of the copper belt in Katanga:A review[J]. Biotechnologie Agronomie Société Et Environnement, 2015, 19(2): 204-214. |
| [3] |
Shahid M, Shamshad S, Rafiq M, et al. Chromium speciation, bioavailability, uptake, toxicity and detoxification in soil-plant system:A review[J]. Chemosphere, 2017, 178: 513-533. |
| [4] |
王萌, 李杉杉, 李晓越, 等. 我国土壤中铜的污染现状与修复研究进展[J]. 地学前缘, 2018, 25(5): 311-319. WANG Meng, LI Shan-shan, LI Xiao-yue, et al. An overview of current status of copper pollution in soil and remediation efforts in China[J]. Earth Science Frontiers, 2018, 25(5): 311-319. |
| [5] |
王确, 张今大, 陈哲晗, 等. 重金属污染土壤修复技术研究进展[J]. 能源环境保护, 2019, 33(3): 5-9. WANG Que, ZHANG Jin-da, CHEN Zhe-han, et al. Advances in remediation technology of heavy metal contaminated soil[J]. Energy Environmental Protection, 2019, 33(3): 5-9. |
| [6] |
于敏, 王文国, 王胜华, 等. 外源柠檬酸对水稻铜毒害的缓解效应[J]. 应用与环境生物学报, 2010, 16(5): 617-621. YU Min, WANG Wen-guo, WANG Sheng-hua, et al. Alleviative effect of exogenous citric acid on rice under copper toxicity[J]. Chinese Journal of Applied & Environmental Biology, 2010, 16(5): 617-621. |
| [7] |
卢志红, 谭雪明, 朱美英, 等. 硫硅配施对土壤铜形态和水稻吸收铜的影响[J]. 农业环境科学学报, 2013, 32(9): 1806-1813. LU Zhi-hong, TAN Xue-ming, ZHU Mei-ying, et al. Effect of sulfur and silicon on the forms of soil copper and absorption of copper in rice[J]. Journal of Agro-Environment Science, 2013, 32(9): 1806-1813. |
| [8] |
葛淑芳.外源水杨酸对烟草耐铜性的调控机制研究[D].金华: 浙江师范大学, 2015: 20-31. GE Shu-fang. Regulating mechanism of exogenoussalicylic acid on copper resistance in Nicotiana taba[D]. Jinhua: Zhejiang Normal University, 2015: 20-31. |
| [9] |
尹博.外源油菜素内酯对番茄铜胁迫的缓解效应[D].泰安: 山东农业大学, 2012: 46. YIN Bo. Exogenous EBR alleviating the copper stress in tomato seedlings[D]. Taian: Shandong Agricultural University, 2012: 46. |
| [10] |
李旭辉, 李星强, 陈力, 等. 江西铜矿资源储量分布及开发利用现状与建议[J]. 有色金属(矿山部分), 2014, 66(3): 29-32. LI Xu-hui, LI Xing-qiang, CHEN Li, et al. Resource distribution and present utilization situation of copper mines in Jiangxi Province[J]. Nonferrous Metals, 2014, 66(3): 29-32. |
| [11] |
王小玲, 王歆, 刘腾云, 等. 江西主要类型重金属污染现状及修复实践[J]. 江西科学, 2014, 32(5): 594-599. WANG Xiao-ling, WANG Xin, LIU Teng-yun, et al. Contaminated situation and remediation practice of the main types by heavy metals in Jiangxi Province[J]. Jiangxi Science, 2014, 32(5): 594-599. |
| [12] |
张文平, 杨臻, 吴佩佳, 等. 乳酸菌胞外多糖对逆境胁迫下水稻种子萌发及幼苗生长的影响[J]. 核农学报, 2017, 33(1): 138-147. ZHANG Wen-ping, YANG Zhen, WU Pei-jia, et al. Effect of exopolysaccharides of lactic acid bacteria on seed germination and seedling growth of rice under different stress[J]. Journal of Nuclear Agricultural Sciences, 2017, 33(1): 138-147. |
| [13] |
李燕, 杨可明, 王敏, 等. 铜胁迫下玉米光谱变化的奇异性诊断指数与污染甄别[J]. 农业环境科学学报, 2019, 38(1): 14-21. LI Yan, YANG Ke-ming, WANG Min, et al. Singularity diagnostic index pollution identification of corn spectral variations under copper stress[J]. Journal of Agro-Environment Science, 2019, 38(1): 14-21. |
| [14] |
Liu C, Liu Y G, Ke G, et al. Effect of drought on pigments, osmotic adjustment and antioxidant enzymes in six woody plant species in karst habitats of southwestern China[J]. Environmental & Experimental Botany, 2011, 71(2): 174-183. |
| [15] |
赵雅曼, 陈顺钰, 张韵, 等. 酸、Cd胁迫对宽叶雀稗种子萌发、幼苗生长及亚细胞结构的影响[J]. 农业环境科学学报, 2019, 38(1): 60-69. ZHAO Ya-man, CHEN Shun-yu, ZHANG Yun, et al. Effects of acid and cadmium stresses on seed germination, seedling growth, and subcellular structure of Paspalum wettsteinii[J]. Journal of Agro-Environment Science, 2019, 38(1): 60-69. |
| [16] |
张志良, 翟伟箐. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003. ZHANG Zhi-liang, ZHAI Wei-qing. Plant physiology experiment instruction[M]. Beijing: Higher Education Press, 2003. |
| [17] |
王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2003. WANG Xue-kui. Principles and techniques of physiological and biochemical experiments on plants[M]. Beijing: Higher Education Press, 2003. |
| [18] |
Zhang H J, Zhang N, Yang R C, et al. Melatonin promotes seed germination under high salinity by regulating antioxidant systems, ABA and GA4 interaction in cucumber(Cucumis sativus L.)[J]. Journal of Pineal Research, 2015, 57(3): 269-279. |
| [19] |
王恒生, 陈克龙, 李怡, 等. 茶树菇的经济价值及开发应用[J]. 中国园艺文摘, 2015, 31(2): 42-44, 131. WANG Heng-sheng, CHEN Ke-long, LI Yi, et al. Economic value and the development application of Agrocybe aegerita[J]. Chinese Horticulture Abstract, 2015, 31(2): 42-44, 131. |
| [20] |
Jing H J, Zhang Q, Liu M, et al. Polysaccharides with antioxidative and antiaging activities from enzymatic-extractable mycelium by Agrocybe aegerita(Brig.) Sing[J]. Evidence-based Complementary and Alternative Medicine, 2018(1): 1-11. DOI:10.1155/2018/1584647 |
| [21] |
Jing H J, Li J, Zhang J J, et al. The antioxidative and anti-aging effects of acidic and alkalic-extractable mycelium polysaccharides by Agrocybe aegerita(Brig.)Sing[J]. International Journal of Biological Macromolecules, 2018, 106: 1270-1278. |
| [22] |
Yang Q, Yin Y L, Pan Y F, et al. Anti-metastatic activity of Agrocybe aegerita galectin(AAL)in a mouse model of breast cancer lung metastasis[J]. Journal of Functional Foods, 2018, 41: 163-170. |
| [23] |
连永权, 张颖, 曾艳. 茶树菇菌糠多糖提取物对肉鸡生长性能和免疫功能的影响[J]. 饲料博览, 2016, 2: 15-20. LIAN Yong-quan, ZHANG Ying, ZENG Yan. Effect of polysaccharide extract from agrocybe cylindracea spent mushroom substrate on the growth performance and immune functions of broilers[J]. Feed Review, 2016, 2: 15-20. |
| [24] |
Klosterhoff R R, Juliana M B, Nícolas M G, et al. Structure and intracellular antioxidant activity of pectic polysaccharide from acerola (Malpighia emarginata)[J]. International Journal of Biological Macromolecules, 2018, 106: 473-480. |
| [25] |
Parada R Y, Egusa M, Aklog Y F, et al. Optimization of nanofibrillation degree of chitin for induction of plant disease resistance:Elicitor activity and systemic resistance induced by chitin nanofiber in cabbage and strawberry[J]. International Journal of Biological Macromolecules, 2018, 118: 2185-2192. |
| [26] |
Vardharajula S, Ali S Z. Exopolysaccharide production by drought tolerant Bacillus spp. and effect on soil aggregation under drought stress[J]. Journal of Microbiology Biotechnology & Food Sciences, 2018, 4(1): 51-57. |
| [27] |
Katiyar D, Hemantaranjan A, Singh B. Chitosan as a promising natural compound to enhance potential physiological responses in plant:A review[J]. Indian Journal of Plant Physiology, 2015, 20(1): 1-9. |
| [28] |
Li W J, Jiang X, Xue P H, et al. Inhibitory effects of chitosan on superoxide anion radicals and lipid free radicals[J]. Chinese Science Bulletin, 2002, 47(11): 887-889. |
| [29] |
Zou P, Lu X L, Jing C L. Low-molecular-weightt polysaccharides from pyropia yezoensis enhance tolerance of wheat seedlings(Triticum aestivum L.)to salt stress[J]. Frontiers in Plant Science, 2018, 9: 427-443. DOI:10.3389/fpls.2018.00427 |
| [30] |
Zong H Y, Li K, Liu S, et al. Improvement in cadmium tolerance of edible rape(Brassica rapa L.)with exogenous application of chitooligosaccharide[J]. Chemosphere, 2017, 181: 92-100. |
| [31] |
Hidangmayum A, Dwivedi P, Katiyar D, et al. Application of chitosan on plant responses with special reference to abiotic stress[J]. Physiology and Molecular Biology of Plants, 2019, 25(2): 313-326. |
| [32] |
李莉, 黄群策, 秦广雍. 海藻糖在提高植物抗逆性方面的研究进展[J]. 生物学通报, 2003(6): 6-7. LI Li, HUANG Qun-ce, QIN Guang-yong. Research progress of trehalose in improving plant stress resistance[J]. Bulletin of Biology, 2003(6): 6-7. |
| [33] |
黄依佳, 吴剑荣, 朱莉, 等. 太湖蓝藻多糖应用于重金属离子吸附[J]. 生物加工过程, 2019, 17(2): 214-219. HUANG Yi-jia, WU Jian-rong, ZHU Li, et al. Adsorption of heavy metal by polysaccharide of cyanobacteria from Taihu Lake[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(2): 214-219. |
| [34] |
Tao Q Q, Liu Z R, Dai Y, et al. Biosorption properties of extracellular polymeric substances towards Zn(Ⅱ)and Cu(Ⅱ)[J]. Desalination and Water Treatment, 2012, 45(1/2/3): 40-47. |
| [35] |
Hou W J, Ma Z Q, Sun L L, et al. Extracellular polymeric substances from copper-tolerance Sinorhizobium meliloti immobilize Cu2+[J]. Journal of Hazardous Materials, 2013, 261(20): 614-620. |
| [36] |
Cui J L, Zhao Y P, Lu Y J, et al. Distribution and speciation of copper in rice(Oryza sativa L.)from mining-impacted paddy soil:Implications for copper uptake mechanisms[J]. Environment International, 2019, 126: 771-726. |
| [37] |
Thounaojam T C, Panda P, Mazumdar P, et al. Excess copper induced oxidative stress and response of antioxidants in rice[J]. Plant Physiology & Biochemistry, 2012, 53: 33-39. |
| [38] |
徐健程, 王晓维, 聂亚平, 等. 不同铜浓度下玉米间作豌豆对土壤铜的吸收效应研究[J]. 农业环境科学学报, 2015, 34(8): 1508-1514. XU Jian-cheng, WANG Xiao-wei, NIE Ya-ping, et al. Effect of maizepea intercropping on crop copper accumulation under different copper concentrations[J]. Journal of Agro-Environment Science, 2015, 34(8): 1508-1514. |
| [39] |
Kamari A, Pulford I D, Hargreaves J S J. Metal accumulation in Lolium perenne and Brassica napus as affected by application of chitosans[J]. International Journal of Phytoremediation, 2012, 14(9): 894-907. |
| [40] |
王晓维, 徐健程, 孙丹平, 等. 生物炭对铜胁迫下红壤地油菜苗期叶绿素和保护性酶活性的影响[J]. 农业环境科学学报, 2016, 35(4): 640-646. WANG Xiao-wei, XU Jian-cheng, SUN Dan-ping, et al. Effects of biochar on chlorophyll and protective enzyme activity of rape seedlings in red soil under copper stress[J]. Journal of Agro-Environment Science, 2016, 35(4): 640-646. |
| [41] |
夏雪姣, 菅明阳, 韩玉翠, 等. 镉胁迫对小麦形态发育及生理代谢的影响[J]. 农业生物技术学报, 2018, 26(9): 1494-1503. XIA Xue-jiao, JIAN Ming-yang, HAN Yu-cui, et al. Effects of cadmium stress on morphological development and physiological metabolism in wheat(Triticum aestivum)[J]. Journal of Agricultural Biotechnology, 2018, 26(9): 1494-1503. |
| [42] |
Yang H X, Deng J J, Yuan Y, et al. Two novel exopolysaccharides from Bacillus amyloliquefaciens C-1:Antioxidation and effect on oxidative stress[J]. Current Microbiology, 2015, 70(2): 298-306. DOI:10.1007/s00284-014-0717-2 |
 2020, Vol. 39
2020, Vol. 39