2. 南方红壤区水土保持国家林业与草原局重点实验室, 福州 350002;
3. 福建长汀红壤丘陵生态系统国家定位观测研究站, 福建 长汀 366300
2. Key Laboratory of Soil and Water Conservation State Forestry and Grassland Administration, Southern Red Soil Region, Fuzhou 350002, China;
3. National Positioning Observation and Research Station For Fujian Changting Red Soil Hill Ecosystem, Changting 366300, China
伴随工业的发展,许多富含重金属的污染物随着未经处理的废气废水排放到环境中。Pb作为常见重金属污染物之一,随大气沉降、废液渗漏等进入土壤。根据2014年公布的《全国土壤污染调查公报》,Pb在土壤的污染点位超标率达到1.1%,是耕地、工业用地、矿区等土壤的主要污染物[1]。作为一种生物体非必需微量元素,Pb在土壤中过量累积会严重影响土壤质量,使土壤生化活性降低。Pb会随着食物链在生物体中累积并对生物体产生危害[2],因此亟需寻找可修复Pb污染土壤的科学有效的方法。植物修复技术由于所需费用低,对所需修复场地破坏力小,易于控制等优点,已成为重要的重金属污染土地修复手段。类芦作为一种优良的南方土地修复植物,其环境适应性强、生物量大,在Pb污染严重的矿区也能生长良好,对Pb具有一定的耐性与富集作用[3]。据研究报道,一株类芦的根部能吸附Pb达4 687.87 mg·kg-1,其中根细胞壁中Pb占总吸附量的90.43%[4]。但目前对于类芦耐Pb的机制,特别是根系对Pb阻隔的关键作用还不够明确。
根尖细胞壁是植物最初接触到重金属离子的部位,是有毒金属阳离子跨膜进入植物体内的第一道屏障。其对重金属胁迫的响应信号能够直接干扰植物代谢过程,进而影响重金属解毒效果和植物修复目标的实现[5]。植物根细胞壁能通过吸收、累积重金属离子来提升植物对重金属的耐受性[6],根细胞壁通过增加根部对重金属的固存量与降低吸收率,成为植物积累重金属、降低重金属对整株植物毒害的主要器官[7]。研究表明,小麦根细胞壁吸附Al占植株总吸附量的77%[8],香蒲在不同生长期中,根部对As的吸附量均远高于地上部分[9]。由构成骨架的纤维素,填充于胞间层的果胶,和含有的蛋白质、木质素等物质共同构成的植物细胞壁结构复杂。细胞壁中多糖上的氨基、羟基、磷酸基等基团[10]为带负电的官能团,其能主动将重金属阳离子固定于细胞壁上,并改变重金属在植物细胞内的形态,从而起到隔离作用[11]。应对重金属毒害时,细胞壁各组分运用不同机制抵御,如带有负电荷的细胞壁质膜会吸附带正电荷的重金属离子以减少重金属离子进入细胞质内[12],木质素通过产生不同的酶来参与抵御[13]。此外,有研究表明,不同品种的玉米根细胞壁中,果胶能吸附55.6%~79.5%的Pb[14],Al胁迫下小麦细胞壁多糖显著增加,甲基化水平下降,使得小麦细胞壁中果胶的Al结合能力增强,耐Al性增强[15]。因此,植物根细胞壁可通过固定重金属提升对重金属的耐性,起到降低重金属对植物体原生质体的毒害作用。关于Pb2+吸附固定过程中类芦根细胞壁哪些组分及组分中哪些官能团起到了关键性作用等问题并不清楚,这极大制约了我们对类芦Pb胁迫下的耐性和解毒机制的认知。
本研究通过对细胞壁进行不同化学改性,并通过吸附动力学实验探究Pb吸附过程中起到具体作用的官能团。利用傅里叶变换红外光谱(FTIR)表征类芦细胞壁内的聚合物和官能团信息,定量分析Pb吸附前后细胞壁中组分及化学基团的信息与作用,揭示细胞壁内各官能团参与应对Pb毒害的特征与机制。本研究为Pb对植物的毒害作用和植物对Pb的耐性及解毒机制提供研究思路,也为类芦应用于Pb污染土壤的修复和治理提供相关参考。
1 材料与方法 1.1 实验材料首先将类芦种子在福建农林大学的温室大棚中进行土培,每日用去离子水进行浇灌,数日后挑选长势一致(20 cm左右)的幼苗移至直径为11 cm的不透光塑料容器中,并用800 mL Hoagland培养液进行水培。营养液配方为5.0 mmol·L-1 KNO3、2.0 mmol·L-1 MgSO4·7H2O、5.0 mmol·L-1 Ca(NO3)2 ·4H2O、1 mmol· L-1 Fe-EDTA、46.3 mmol · L-1 H3BO3、0.3 mmol · L-1 CuSO4·5H2O、0.8 mmol·L-1 ZnSO4·7H2O、9.1 mmol·L-1 MnCl2·4H2O和0.4 mmol·L-1 H2MoO4[16],每5株种植于一个容器内,置于人工气候培养箱中,光照时间为14 h,昼温25 ℃,夜温20 ℃。试验植株分为空白组(CK)和Pb处理组,空白组溶液中不含有Pb,处理组溶液中Pb浓度为50 μmol·L-1,每日更换一次胁迫液,以维持Pb的浓度。14 d后植株根系用洗脱液解析15 min并用蒸馏水洗净擦干,再用液氮固定后保存于-75 ℃冰箱。
1.2 类芦根细胞壁的提取分离将空白组与Pb处理组的根系样品分别剪碎置于陶瓷研钵,放入液氮磨碎成粉末后进行浸提,浸提顺序如下:先加入75%冰乙醇浸提20 min,随后5000 g离心10 min,抽去上悬液,该操作重复3次;在离心得到的沉淀物中依次加入体积比为1:1的冷丙酮与三氯甲烷混合液(体积与根质量比例为7:1)和甲醇进行浸提,然后离心20 min,将得到的沉淀物冰冻后进行冻干,即得到根细胞壁,置于4 ℃保存[17]。
1.3 类芦根细胞壁的化学改性对未经过处理的空白组类芦根细胞壁粉末进行果胶酶改性、酯化改性和氨基甲基化改性[18]。
果胶酶改性即使细胞壁中果胶在果胶甲酯酶作用下被酶解,再对去除果胶质后的细胞壁研究其重金属吸附能力。处理方法如下:取2 g类芦根细胞壁的粉末于离心管内,加120 mL 1%的果胶酶。为保持果胶酶的活性以及稳定性,再加入1%的BSA(Bovine serum albumin)作为稳定剂,充分混合后置于30 ℃水浴消化30 min,离心后的沉淀物用去离子水洗涤3次,冻干,并置于4 ℃环境下保存备用。
细胞壁上的羧基在酯化改性后被部分去除,可以通过对改性后细胞壁进行重金属吸附分析来探究羧基的作用。处理方法如下:称取2 g类芦根细胞壁的粉末于离心管内,加入140 mL无水甲醇,并加入120 mL浓HCl做反应催化剂。离心管在125 r·min-1速度下旋转振荡12 h使其充分反应。离心去除上清液,用去离子水洗涤沉淀物3次后冻干,并置于4 ℃保存备用。
细胞壁经过甲基化处理,能去除部分氨基,以探究氨基基团在根细胞壁Pb吸附过程中的作用。处理方法如下:称取2 g类芦根细胞壁粉末于离心管中,加入40 mL甲醛,再加入80 mL甲酸作为还原剂,混合均匀后125 r·min-1速度下旋转振荡反应6 h,结束后混合物离心分离,沉淀物用去离子水洗涤3次,冷冻干燥后置于4 ℃保存备用。
1.4 根细胞壁Pb吸附动力学试验分别取空白组与经过不同化学改性后的根细胞壁粉末0.05 g装入交换柱中,上下滤头有导管链接。将吸附液[5 mg·L-1 Pb(NO3)2+0.01 mol·L-1 NaNO3]从上导管注入,下导管与自动收集器连接。将解吸液以5 mL·10 min-1的流速吸出,自动收集器10 min收集一管直到无液体流出。用原子吸收分光光度计测定流出液中Pb2+浓度。该实验重复3次,得出的数据计算平均值并作图(因标准差小于5%,为保证图清晰故未标出)[18]。
1.5 根细胞壁的傅里叶红外光谱表征对经过不同化学改性、空白组以及在Pb处理前后的根细胞壁用傅里叶变换红外光谱仪进行红外光谱表征。FTIR能记录样品4000~400 cm-1范围的光谱信号信息,光谱分辨率为4 cm-1。制作检测样品方法如下:分别称取1 mg冻干备用的样品,再以1:100比例加入碎晶型溴化钾(KBr)充分混合,放入玛瑙研钵研磨充分后压片进行FTIR测定。
1.6 统计分析相关数据使用SPSS20进行分析,所有数据进行方差齐性检验和正态性检验。
多组间比较采用单因子方差分析(ANOVA),组间差异分析使用SNK法,显著性水平设定为α=0.05。作图使用Origin 2018。
2 结果与分析 2.1 化学改性前后红外光谱分析根据类芦根细胞壁改性前后的FTIR图(4000~400 cm-1,图 1)可看出不同改性处理后细胞壁官能团发生的变化,对其主要的吸光度值进行解析后得到前后变化的信息见表 1。FTIR图像反映出根细胞壁中不同官能团在Pb吸附中的作用。通过观察吸收峰位置的偏移与峰形变化,能够判断参与反应的具体基团。

|
图 1 化学改性前后类芦根细胞壁傅里叶光谱图 Figure 1 The FTIR spectra of the root cell wall of Neyraudia reynaudiana before and after chemical modification |
|
|
表 1 化学改性前后类芦根细胞壁傅里叶光谱分析 Table 1 Analysis of FTIR spectra of the Neyraudia reynaudiana root cell wall before and after chemical modification |
根据图 1与表 1,可得到空白对照组的类芦根细胞壁的特征峰:3429 cm-1处羟基(-OH)的对称伸缩峰和氨基(-NH)的不对称伸缩振动峰;2922 cm-1处甲基(-CH3)的对称伸缩振动峰;1720 cm-1处酯基(-C=O)的不对称伸缩振动峰;1626 cm-1处酰胺Ⅰ带(-C=O)的伸缩振动峰;1605 cm-1处酰胺Ⅱ带(-CONH)的伸缩振动峰;1186 cm-1处硫酸酯(C-O-S)或羧基(C-O)或磷酸盐(C-O-P)的伸缩振动峰;1053 cm-1处纤维素糖链(-C-H)或-C-C或-C-O振动峰。
酯化改性后,类芦根细胞壁中羟基(-OH)在酯化改性后向低频移动了14 cm-1,表明细胞壁中的部分羟基基团已经与甲醇发生了酯化反应被去除。1626 cm-1处酰胺Ⅰ带(-C=O)与1605 cm-1处酰胺Ⅱ带(- CONH)代表了细胞壁中蛋白质的特征光谱,果胶酶改性后,两者分别向高频移动,表明蛋白质中果胶在改性后被去除;此外,1186 cm-1处硫酸酯(C-O-S)的伸缩振动峰出现了降低,表明果胶中含有的部分羧基(C-O)在改性后被去除,1053 cm-1处纤维素糖链(-C-H)的伸缩振动峰均降低,推断纤维素中的果胶在改性处理后被去除,表明果胶改性成功。氨基甲基化改性后,3429 cm-1处氨基(-NH)与2922 cm-1处甲基的伸缩振动峰均出现下降,氨基基团在改性后明显下降;此外,根据图 1,在1626 cm-1处酰胺Ⅰ带(-C=O)与1605 cm-1处酰胺Ⅱ带(-CONH)的峰高明显下降,N-H减少,氨基发生变化,表明对细胞壁的氨基甲基化改性成功。
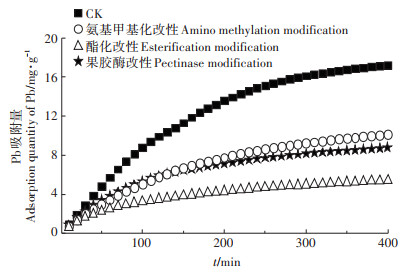
2.2 铅吸附动力学及吸附位点分析不同改性处理后细胞壁对Pb的吸收率(图 2)能反映参与Pb吸附的官能团位点。在初始阶段,根细胞壁对Pb的吸收速率较大,400 min左右吸附达到平衡。经酯化改性去除部分羟基后,根细胞壁对Pb的吸附能力下降幅度最大,达到68.1%。果胶酶改性后的根细胞壁中果胶上对重金属离子吸附位点减少,对Pb的吸附能力降低48.9%。氨基甲基化改性后吸附能力相对下降41.1%。
|
图 2 类芦根细胞壁化学改性前后吸附Pb的变化 Figure 2 The effect of Pb absorbed by cell wall of root of Neyraudia reynaudiana with chemical modification |
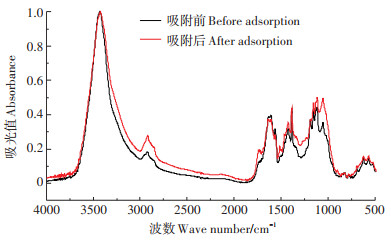
对类芦幼苗用50 μmol·L-1 Pb营养液水培14 d,水培前后分别提取根细胞壁进行FTIR分析(图 3)。当官能团与Pb2+发生结合时,吸收峰会向低频移动。结合表 2,能看出3429 cm-1处羟基与2922 cm-1处甲基在吸附Pb后伸缩振动峰向低处偏移,说明羟基与甲基化合物出现了缔合现象,羟基与甲基均参与了Pb的吸附。酯基、酰胺Ⅰ带与酰胺Ⅱ带均出现了吸收峰值的上升,其附近峰形也发生较明显变化,1186 cm-1处硫酸酯特征峰出现下降,说明吸收Pb后细胞壁硫酸酯化程度降低。1115 cm-1处果胶特征峰变化显著,说明果胶在Pb吸附中发挥重要作用。以上变化说明各官能团在类芦根细胞壁中对Pb离子均起到了吸附作用。
|
图 3 处理组类芦根细胞壁Pb吸附前后红外光谱图 Figure 3 FTIR spectra of the Neyraudia reynaudiana root cell wall before and after Pb adsorption |
|
|
表 2 处理组类芦根细胞壁Pb吸附前后的傅里叶光谱分析 Table 2 Quantitative analysis of FTIR spectra of the Neyraudia reynaudiana root cell wall before and after treatments |
用CK与5 μmol·L-1 Pb的营养液分别对类芦幼苗进行水培,14 d后提取其根细胞壁用FTIR分析。对照组与Pb胁迫组细胞壁FTIR结果见表 3和图 4。可看到3429 cm-1处羟基的特征峰下降,且偏移量较大,在图 4中反应的特征峰也明显与CK相比更窄更尖,说明Pb2+与羟基基团发生了交互作用。酰胺Ⅰ带与酰胺Ⅱ带均向高频移动13 cm-1,表明蛋白质与亲水脂分子在Pb吸附中起重要作用。羧酸盐与多糖结构的C-H或C-O以及纤维素糖链的伸缩振动峰向低频方向移动,且峰值强度下降。

|
图 4 空白组与Pb处理组类芦根细胞壁的红外光谱图 Figure 4 The FTIR spectra of the root cell wall of Neyraudia reynaudiana under different Pb treatments |
|
|
表 3 Pb胁迫处理下类芦根细胞壁红外光谱分析 Table 3 Analysis of FTIR spectra of the root cell wall of Neyraudia reynaudiana under different treatments |
植物细胞壁是植物生长发育及应对各种逆境胁迫的重要器官,植物细胞壁通过隔离机制或主动增加细胞组分来抵御重金属对植物体产生的毒害。研究表明细胞壁中含有羟基、羧基和氨基等主要基团,它们可与重金属阳离子结合,从而降低重金属对植物的毒害。但是不同植物的细胞壁组分对不同重金属的吸附或络合等过程的贡献及其机制存在明显的差异性。本实验表明,类芦对Pb2+的吸附能力主要来自于根细胞壁对阳离子的交换能力,-OH、-NH2、-COOH等主要基团组成的细胞壁多糖,能与金属阳离子结合[19]。本实验中根细胞壁在不同改性处理后对Pb2+的吸附量均有不同程度的降低,表现为酯化改性>果胶酶改性>氨基甲基化改性。
酯化改性主要让细胞壁中的羧基与外来物的羟基发生酯化反应,使类芦细胞壁上的羧基减少,从而分析羧基在细胞壁上与重金属吸附的能力。酯化改性后的根细胞壁对Pb2+的吸附量下降了68.1%,这说明类芦细胞壁中的羧基在与Pb2+的吸附中起着重要作用。张虹等[20]的研究表明,小飞蓬根细胞壁在酯化改性后,对Cd2+的吸附量相对降低了39.7%。郭军康等[21]的研究也表明,番茄根细胞壁酯化后,Cd吸附量降低了49.51%。以上说明酯化改性能减少细胞壁中羧基含量,是根细胞壁上重金属离子的重要吸附位点。
果胶可通过带有的负电荷来调节细胞壁中的离子平衡。果胶类多糖的最基本组成结构有Ⅰ型鼠李半乳糖醛酸聚糖(Rhamnogalacturonan-Ⅰ,RG-Ⅰ)、Ⅱ型鼠李半乳糖醛酸聚糖(Rhamnogalacturonan-Ⅱ,RG-Ⅱ)和同聚半乳糖醛酸聚糖(Homogalacturonan,HGAs)[22]。HGAs因能发生甲酯化而使果胶带负电荷,使其与金属结合能力增强[23]。Konno等[24]对剑叶舌叶藓研究发现其细胞壁中43%的Cu结合于果胶中的HGAs中。本研究中根细胞壁在果胶酶改性后,对Pb的吸附量降低了48.9%。与此类似的研究有:Eticha等[25]研究不同玉米植株根尖果胶含量显示,根尖细胞壁中果胶含量越高,细胞壁对Al的吸附量越高。对植物根细胞壁使用含有1%浓度的果胶酶溶液处理30 min后,细胞壁对Al的吸附降低了50%[26]。以上表明果胶中的多糖物质具有螯合金属的能力,说明其在细胞壁对Pb的吸收中发挥了重要作用。
此外,本研究中根细胞壁在氨基甲基化改性后,对Pb的吸附量降低了41.1%。相似研究如海州香薷根细胞壁在氨基甲基化改性后,对Cu2+吸附量降低了79.4%[27]。说明氨基甲基化反应能抑制氨基与部分重金属离子结合,从而使重金属离子对细胞壁的吸附能力降低,氨基是类芦根细胞壁上重要的Pb吸附基团,但其对其他种类重金属离子的吸附能力仍需进一步讨论与研究。
3.2 根细胞壁Pb处理红外光谱定性分析由FTIR谱图中细胞壁在吸附Pb前后各官能团峰值的偏移量,可判断在Pb吸附中各官能团的作用。本实验中,3429 cm-1处为羟基(-OH)基团,经Pb处理后类芦根细胞壁FTIR图中-OH吸收峰与空白组对比向低频移动,高浓度Pb胁迫导致羟基化合物出现缔合作用。结合酯化改性后根细胞壁在FTIR图中羟基的吸收峰向低频迁移量达到14 cm-1,认为羟基是Pb吸附的重要官能团。1720 cm-1处酯基(C=O)在Pb处理后吸收峰值向高频偏移,说明Pb胁迫下,类芦细胞壁中果胶的甲基酯化程度降低,使得带负电荷的游离羧基含量上升,对Pb的吸附能力增强,这被看作是类芦根细胞对于Pb胁迫环境的一种应对行为。与Clemens[28]研究结果一致,植物细胞壁的果胶质内的大部分羧基都以甲基酯的形式存在,通过降低果胶甲基化程度,使羧基以游离酸和盐的形式存在,以促使细胞壁能吸附更多的金属阳离子。Schmol等[29]研究结果中证实植物根尖细胞的Al积累程度与果胶甲基化水平成反比。细胞壁中纤维素、半纤维素、果胶中含有丰富的羟基与羧基,从而也证实了类芦根细胞壁中果胶与纤维素在Pb吸附中的重要作用。
FTIR谱图中,1626 cm-1附近的酰胺Ⅰ带(-C= O)与1605 cm-1处的酰胺Ⅱ带(-CONH)在Pb处理后与空白相比,吸收峰均向高处偏移13 cm-1,因为两者均为细胞壁上蛋白质的特征谱带,推测由于Pb胁迫使类芦根细胞壁分泌蛋白类物质,蛋白质二级结构中肽键间氢键结合能力增强[4],结构更为稳定。细胞壁蛋白也能与果胶多糖链通过协作共同吸附重金属物质以达到减轻毒害的目的[30]。凤眼莲根细胞壁在Cd胁迫处理后酰胺Ⅰ带与酰胺Ⅱ带在FTIR谱图中的特征峰均上升[31],刘婷婷等[32]的研究表明海州香薷在受到Cu胁迫时,其根细胞壁蛋白能提供结合位点。苜蓿在Cd胁迫下酰胺Ⅰ带、酰胺Ⅱ带均发生位移,表明其蛋白质结构改变[33],以上说明大部分植物在受到不同重金属胁迫下,在植物耐性范围内其细胞壁会伸展蛋白含量来增强对重金属离子的结合能力,同时协同果胶等物质增强细胞壁的稳定性。类芦根细胞壁中的果胶C-C或C-O以及纤维素糖链-C-H弯曲或-CC、-C-O伸缩振动峰在Pb胁迫后的峰值出现降低,峰形也出现位移,认为是类芦根细胞壁在Pb胁迫环境下诱导合成多糖类物质,包括纤维素、果胶、碳水化合物等[34]。可见Pb胁迫会对类芦根细胞壁的多糖类物质含量产生影响以降低重金属毒害的影响。在Pb胁迫试验中发现,类芦在50 μmol·L-1 Pb胁迫处理时,根系生长受到抑制,但植株未出现明显毒害症状。综上,说明类芦对Pb具有一定耐受性。在受到Pb胁迫时,类芦能通过调节果胶、多糖和蛋白质等物质以及羟基、羧基、氨基等官能团的含量,来不断提高自身适应Pb胁迫能力。
4 结论(1)类芦根细胞壁对Pb具有较高固定能力,Pb胁迫时其会通过改变自身细胞壁各结构的组分以缓解重金属毒害的影响。
(2)羧基官能团是根细胞壁进行Pb吸附时的主要官能团。羟基与氨基也在Pb吸附中发挥一定作用。
(3)通过FTIR谱图表征的Pb处理后根细胞壁上的吸附位点信息,细胞壁内纤维素、半纤维素与果胶提供大量羟基、羧基以提高对Pb的结合能力,根细胞壁还会通过诱导生成蛋白质、碳水化合物等物质提升对Pb的耐性。
| [1] |
环境保护部, 国土资源部.全国土壤污染状况调查公报[R].北京: 环境保护部, 国土资源部, 2014. Ministry of Environmental Protection, Ministry of Land and Resources. The report on the national general survey of soil contamination[R]. Beijing: Ministry of Environmental Protection, Ministry of Land and Resources, 2014. |
| [2] |
Wieczorek J, Baran A, Urbański K, et al. Assessment of the pollution and ecological risk of lead and cadmium in soils[J]. Environmental Geochemistry & Health, 2018, 40(6): 2325-2342. |
| [3] |
黄玫英, 罗洁文, 黄彩凤, 等. Pb在类芦组织和亚细胞中的分布规律和毒害效应[J]. 农业环境科学学报, 2016, 35(11): 2077-2085. HUANG Mei-ying, LUO Jie-wen, HUANG Cai-feng, et al. The distribution and toxic effects of Pb at the levels of the tissue and sub-cellular in Neyraudia reynaudiana[J]. Journal of Agro-Environment Science, 2016, 35(11): 2077-2085. DOI:10.11654/jaes.2016-0627 |
| [4] |
罗洁文, 黄玫英, 殷丹阳, 等. 类芦对铅镉的吸收动力特性及亚细胞分布规律研究[J]. 农业环境科学学报, 2016, 35(8): 1451-1457. LUO Jie-wen, HUANG Mei-ying, YIN Dan-yang, et al. Uptake kinetic characteristics and subcellular distribution of Pb2+ and Cd2+ in Neyraudia reynaudiana[J]. Journal of Agro-Environment Science, 2016, 35(8): 1451-1457. |
| [5] |
Li X S, Liu S Lin, Na Z Y, et al. Adsorption, concentration, and recovery of aqueous heavy metal ions with the root powder of Eichhornia crassipes[J]. Ecological Engineering, 2013, 60(6): 160-166. |
| [6] |
Lux A, Martinka M, Vaculík M, et al. Root responses to cadmium in the rhizosphere:A review[J]. Journal of Experimental Botany, 2011, 62(1): 21-37. DOI:10.1093/jxb/erq281 |
| [7] |
Lal N. Molecular mechanisms and genetic basis of heavy metal toxicity and tolerance in plants[M]//Plant adaptation and phytoremediation. Springer Netherlands, 2010.
|
| [8] |
Ma J F, Shen R, Nagao S, et al. Aluminum targets elongating cells by reducing cell wall extensibility in wheat roots[J]. Plant & Cell Physiology, 2004, 45(5): 583-589. |
| [9] |
任伟, 倪大伟, 刘云根, 等. 砷污染生境下挺水植物香蒲对砷的积累与迁移特性[J]. 环境科学研究, 2019, 32(5): 848-856. REN Wei, NI Da-wei, LIU Yun-gen, et al. Accumulation and transportation of arsenic to wetland plant Typha angustifolia L. in the herbaceous plants grown in arsenic-contaminated habitat[J]. Research of Environmental Sciences, 2019, 32(5): 848-856. |
| [10] |
Lamhamdi M, El Galiou O, Bakrim A, et al. Effect of lead stress on mineral content and growth of wheat(Triticum aestivum)and spinach (Spinacia oleracea)seedlings[J]. Saudi Journal of Biological Sciences, 2013, 20(1): 29-36. DOI:10.1016/j.sjbs.2012.09.001 |
| [11] |
刘清泉, 陈亚华, 沈振国, 等. 细胞壁在植物重金属耐性中的作用[J]. 植物生理学报, 2014, 50(5): 605-611. LIU Qing-quan, CHEN Ya-hua, SHEN Zhen-guo, et al. Roles of cell wall in plant heavy metal tolerance[J]. Plant Physiology Journal, 2014, 50(5): 605-611. |
| [12] |
Maestri E, Marmiroli M, Visioli G, et al. Metal tolerance and hyperaccumulation:Costs and trade-offs between traits and environment[J]. Environmental and Experimental Botany, 2010, 68(1): 1-13. DOI:10.1016/j.envexpbot.2009.10.011 |
| [13] |
段德超, 于明革, 施积炎. 植物对铅的吸收、转运、累积和解毒机制研究进展[J]. 应用生态学报, 2014, 25(1): 287-296. DUAN De-chao, YU Ming-ge, SHI Ji-yan. Research advances in uptake, translocation, accumulation and detoxification of Pb in plants[J]. Chinese Journal of Applied Ecology, 2014, 25(1): 287-296. |
| [14] |
沈奕昕, 李元, 祖艳群, 等. 不同玉米(Zea mays L.)品种根细胞壁多糖对Pb胁迫的响应[J]. 生态环境学报, 2018, 27(5): 950-956. SHEN Yi-xin, LI Yuan, ZU Yan-qun, et al. Responses of polysaccharide in root cell wall of maize(Zea mays L.)cultivars to Pb stress[J]. Ecology and Environment Sciences, 2018, 27(5): 950-956. |
| [15] |
Sun C, Lu L, Yu Y, et al. Decreasing methylation of pectin caused by nitric oxide leads to higher aluminium binding in cell walls and greater aluminium sensitivity of wheat roots[J]. Journal of Experimental Botany, 2016, 67(3): 979-989. DOI:10.1093/jxb/erv514 |
| [16] |
Zhou C F, Jiang W J, Li Y, et al. Morphological plasticity and phosphorus uptake mechanisms of hybrid Eucalyptus roots under spatially heterogeneous phosphorus stress[J]. Original Paper, 2017, 28(4): 713-724. |
| [17] |
徐劼, 保积庆. 芹菜根细胞壁对镉的吸附固定机制及其FTIR表征研究[J]. 环境科学学报, 20158, 35(8): 2605-2612. XU Jie, BAO Ji-qing. Adsorption and fixation mechanism of cadmium on celery(Apium graveolens L.)root cell wall and the analysis of FTIR spectra[J]. Acta Scientiae Circumstantiae, 20158, 35(8): 2605-2612. |
| [18] |
徐劼, 保积庆, 于明革, 等. 茶树根细胞壁对铅的吸附作用[J]. 应用生态学报, 2014, 25(2): 427-432. XU Jie, BAO Ji-qing, YU Ming-ge, et al. Lead adsorption by the root cell wall of tea plant[J]. Chinese Journal of Applied Ecology, 2014, 25(2): 427-432. |
| [19] |
Krzesłowska M. The cell wall in plant cell response to trace metals:Polysaccharide remodeling and its role in defense strategy[J]. Acta Physiologiae Plantarum, 2011, 33(1): 35-51. DOI:10.1007/s11738-010-0581-z |
| [20] |
张虹, 罗洁文, 胡华英, 等. 基于细胞壁吸附固定特性的小飞蓬耐Cd机制研究[J]. 农业环境科学学报, 2019, 38(5): 980-990. ZHANG Hong, LUO Jie-wen, HU Hua-ying, et al. Cadmium tolerance mechanism of Conyza canadensis based on cell wall adsorption and fixation characteristics[J]. Journal of Agro-Environment Science, 2019, 38(5): 980-990. |
| [21] |
郭军康, 周冉, 任心豪, 等. 不同年限设施菜地番茄细胞壁果胶Cd累积的研究[J]. 农业环境科学学报, 2018, 37(1): 45-51. GUO Jun-kang, ZHOU Ran, REN Xin-hao, et al. Accumulation of Cd in cell wall pectin of tomato plants grown in greenhouse soil of different planting years[J]. Journal of Agro-Environment Science, 2018, 37(1): 45-51. |
| [22] |
Wgt W, Knox J P, Mikkelsen J D. Pectin:New insights into an old polymer are starting to gel[J]. Trends in Food Science & Technology, 2006, 17(3): 97-104. |
| [23] |
Caffall K H, Mohnen D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides[J]. Carbohydrate Research, 2009, 344(14): 1879-1900. DOI:10.1016/j.carres.2009.05.021 |
| [24] |
Konno H, Nakashima S, Katoh K. Metal-tolerant moss Scopelophila cataractae accumulates copper in the cell wall pectin of the protonema[J]. Journal of Plant Physiology, 2010, 167(5): 358-364. DOI:10.1016/j.jplph.2009.09.011 |
| [25] |
Eticha D, Stass A, Horst W J. Cell-wall pectin and its degree of methylation in the maize root-apex:Significance for genotypic differences in aluminium resistance[J]. Plant Cell & Environment, 2005, 28(11): 1410-1420. |
| [26] |
Zheng S J, Tang C. The kinetics of aluminum adsorption and desorption by root cell walls of an aluminum resistant wheat(Triticum aestivum L.)cultivar[J]. Plant and Soil, 2004, 261(1): 85-90. |
| [27] |
武贝.海州香薷Cu耐性与积累机制研究[D].杭州: 浙江大学, 2009. WU Bei. Study of mechanisms for Cu tolerance and accumulation in Elsholtzia splendens[D]. Hangzhou: Zhejiang University, 2009. |
| [28] |
Clemens S. Molecular mechanisms of plant metal tolerance and homeostasis[J]. Planta, 2001, 212(4): 475-486. DOI:10.1007/s004250000458 |
| [29] |
Schmohl N, Pilling J, Fisahn J, et al. Pectin methylesterase modulates aluminium sensitivity in Zea mays, and Solanum tuberosum[J]. Physiologia Plantarum, 2000, 109(4): 419-427. DOI:10.1034/j.1399-3054.2000.100408.x |
| [30] |
Didierjean L, Frendo P, Nasser W, et al. Heavy-metal-responsive genes in maize:Identification and comparison of their expression upon various forms of abiotic stress[J]. Planta, 1996, 199(1): 1-8. |
| [31] |
张晓斌, 刘鹏, 李丹婷, 等. 铬诱导植物根细胞壁化学成分变化的FTIR表征[J]. 光谱学与光谱分析, 2008, 28(5): 1067-1070. ZHANG Xiao-bin, LIU Peng, LI Dan-ting, et al. FTIR spectroscopic characterization of chromium-induced changes in root cell wall of plants[J]. Spectroscopy and Spectral Analysis, 2008, 28(5): 1067-1070. DOI:10.3964/j.issn.1000-0593.2008.05.026 |
| [32] |
刘婷婷, 彭程, 王梦, 等. 海州香薷根细胞壁对铜的吸附固定机制研究[J]. 环境科学学报, 2014, 34(2): 514-52. LIU Ting-ting, PENG Chen, WANG Meng, et al. Mechanism of fixation and adsorption of copper on root cell wall of Elsholtzia splendens[J]. Acta ScientiaeCircumstantiae, 2014, 34(2): 514-52. |
| [33] |
Wei Z L, Dong L, Tian Z H. Fourier transform infrared spectometrystudy on early stage of cadmium stress in clover leaves[J]. PakistanJournal Botaty, 2009, 41(4): 1743-1750. DOI:10.1127/0029-5035/2009/0089-0263 |
| [34] |
裴惠娟, 张满效, 安黎哲. 非生物胁迫下植物细胞壁组分变化[J]. 生态学杂志, 2011, 30(6): 1279-1286. PEI Hui-juan, ZHANG Man-xiao, AN Li-zhe. Changes of plant cell wall components under abiotic stresses:A review[J]. Chinese Journal of Ecology, 2011, 30(6): 1279-1286. |
 2020, Vol. 39
2020, Vol. 39