2. 四川省自然资源科学研究院, 成都 610041
2. Natural Resources Research Institute of Sichuan Province, Chengdu 610041, China
铜(Cu)是动植物必需的微量营养元素之一,但也是一种环境污染元素[1-3],过量的Cu会对植物、动物、人体造成危害。土壤Cu污染不仅会降低土壤营养成分,打破土壤植物和微生物的生态平衡,还会通过食物链的富集作用危害人体健康[2, 4-5]。近年来,随着工农业的快速发展,土壤Cu污染问题突出,而有效的土壤Cu污染修复技术的研究与应用相对较少。
微生物-植物联合修复既能克服单植物修复缓慢和单微生物修复有风险的缺点,还具有修复成本低、效率高的优点,因而成为研究热点[1, 6-7]。其中,植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)[8]与植物联合修复土壤重金属污染土壤的协同作用体现在两方面:第一,PGPR通过分泌铁载体、生物表面活性剂、诱导植物系统抗性、激活抗氧化酶活性等作用,直接促进植物生长和增强植物对重金属的抗性,强化重金属污染土壤植物修复效率;第二,PGPR通过改变植物所处土壤环境中重金属的形态和迁移率,间接减缓土壤重金属离子对植物的毒害作用[9-13]。
目前,已被发现且能应用于重金属污染修复的超富集植物约400多种[14]。蒲儿根(Sinosenecio oldhamianus)是蒲儿根属两年生草本植物,具有生命力旺盛、易于存活、生长繁殖速度较快的优点,且其在修复重金属污染过程中具有投入成本低、效率高、无二次污染等优势[15-19]。张世熔等[20]研究发现,蒲儿根由于根系发达,可以在矿区土壤和污泥中存活的同时富集大量的Cu,并将其转移到地上部分,有效修复Cu污染土壤。为了进一步研究PGPR是否可以强化蒲儿根修复Cu污染土壤,本研究通过开展多功能PGPR混合菌剂-蒲儿根联合修复不同Cu含量土壤的盆栽模拟试验,分析多功能PGPR混合菌剂对蒲儿根生长、富集Cu效率及土壤性质的影响,评估多功能PGPR混合菌剂在蒲儿根富集土壤中Cu的强化作用,为进一步应用蒲儿根-PGPR联合高效修复Cu污染土壤提供依据。
1 材料与方法 1.1 试验材料盆栽土壤是将蛭石和泥炭土以1:2的比例混匀后按土壤质量和试验处理浓度加入CuSO4·5H2O,每盆分装混匀后的土壤5 kg,并浇灌足量的水稳定40 d后获得[21]。盆栽土壤理化性质:pH=7.2、有机质含量22.23 g·kg-1、全磷含量13.55%、有效磷含量34.77 mg· kg-1、全氮含量0.67%、水解氮含量401.45 mg·kg-1、全钾含量1.26%、速效钾含量905.00 mg·kg-1;蒲儿根幼苗购买自温江花鸟市场;PGPR混合菌剂菌株来自四川农业大学资源学院,由一株解钾菌WDGJ-11(GenBank序列号:KJ733990)、一株溶磷菌WDN-5(GenBank序列号:KJ733968)、一株苍白杆菌MGJ11(GenBank序列号:KX929163)混合组成,已进行拮抗实验验证三株菌之间不产生拮抗反应。
1.2 试验方法 1.2.1 菌株活化及功能验证采用牛肉膏培养基(牛肉膏:3.0 g;蛋白胨:10.0 g;NaCl:5.0 g;琼脂:20 g;水:1000 mL;pH:7.4~7.6)活化菌株。采用Salkowski法测定菌株产吲哚乙酸(indoleacetic acid,IAA)能力[22],采用硅酸盐培养法测定菌株的解钾能力[23],采用菌碟法测定菌株的解磷能力[24],同时测定三株菌对重金属Cu的最高耐受浓度[25]。菌剂采用牛肉膏液体培养基制备。
1.2.2 盆栽试验将植物育苗、移栽。选取CuSO4·5H2O作为供试药品,设置6个处理水平分别为0、200、400、600、800、1000、1200 mg·kg-1,每个水平分别设立添加PGPR混合菌剂(PGPR)和不添加PGPR混合菌剂(CK)2个试验组互为对照。分别取每株细菌培养的新鲜菌悬液50 mL(约1011 cfu·mL-1)混合均匀后稀释到2 L,浇灌盆栽蒲儿根,再用无菌的石英砂覆盖盆栽土。为排除菌剂中的培养基营养成分的影响,CK组施用等量不含菌株的牛肉膏液体培养基150 mL稀释到2 L。每个试验组设置5次重复。于恒温25 ℃、光照12 h·d-1的光照培养室培养3个月后采集植物样品和土壤样品进行理化性质和重金属等指标测试。
1.2.3 测试指标蒲儿根生长状况测定:采集植物样品洗净后置于干净平台上,用卷尺测量每一株蒲儿根的株高以及根长;植物样品氮磷钾测定:105 ℃杀青2 h后80 ℃烘干,磨细混匀保存。植物样品采用H2SO4-H2O2消煮法消解,植物全氮采用靛酚蓝比色法、全磷采用钒钼黄比色法、全钾采用火焰光度法进行测定[22];土壤理化性质的测定:采集盆栽土壤,自然风干,磨细混匀保存。土壤有机质采用重铬酸钾容量法、pH值采用电位法测定、全氮采用凯氏定氮法、全磷采用酸溶-钼锑抗比色法、全钾采用NaOH-火焰光度法、碱解氮采用碱解扩散法、有效磷采用0.5 mol·L-1 NaHCO3浸提-钼锑抗比色法、速效钾采用1 mol·L-1中性NH4OAc浸提-火焰光度法进行测定[26];土壤酶活的测定:采集盆栽新鲜土样测定土壤酶活性,脲酶采用靛酚比色法、蔗糖酶采用3,5-二硝基水杨酸比色法、过氧化氢酶采用邻苯三酚比色法、磷酸酶采用磷酸苯二钠法[27];植物重金属含量测定:植物样经混酸(VHNO3: VHClO4=4: 1)消解后ICP-OES上机测定重金属含量,以国家标准重金属溶液作参比。
1.3 数据处理本试验的数据采用Excel 2010、SPSS 22.0进行分析处理。
2 结果与分析 2.1 PGPR的促生活性验证和耐Cu测试对三株菌进行促生活性验证,在产IAA能力检测中,培养3 d后苍白杆菌MGJ11、解钾菌WDGJ-11、溶磷菌WDN-5产IAA的量分别为83.05、44.13、38.50 mg·mL-1。另外,解钾菌WDGJ-11培养6 d后分泌产生的有效钾浓度为31.32 μg·mL-1,溶磷菌WDN-5培养7 d后分泌产生的有效磷浓度为64.89 μg·mL-1。对三株菌进行耐Cu测试,确保菌株能在后续试验条件下存活。不同浓度含Cu培养基培养3 d后检测菌株存活状况,苍白杆菌MGJ11、解钾菌WDGJ11、溶磷菌WDN5对重金属Cu的最小抑制浓度(Minimal inhibit concentration,MIC)分别为100、200、200 mg·kg-1,最小致死浓度(Minimum lethal concentration,MLC)分别为1350、1300、1400 mg·kg-1。
2.2 蒲儿根植株生长生物指标及金属富集特征由图 1可知在Cu胁迫下随着土壤Cu含量上升蒲儿根根长、株高都大致呈现先升后降的趋势,且可以明显观察到施加PGPR混合菌剂的植株长势均优于未加PGPR混合菌剂的植株,加入PGPR混合菌剂的植株比CK组的植株株高平均高7.45 cm,根长平均长2.72 cm。与土壤Cu含量为0 mg·kg-1的处理相比,其余处理下的蒲儿根长势皆比其优,这是因为Cu作为植物生长必需元素之一,能促进植物的生长,促生作用在土壤Cu含量为600 mg·kg-1时达到最佳。由此可知,蒲儿根对于土壤Cu具有较高的耐受性,PGPR混合菌剂的加入可以促进植物生长并增强其对土壤Cu的耐受性。
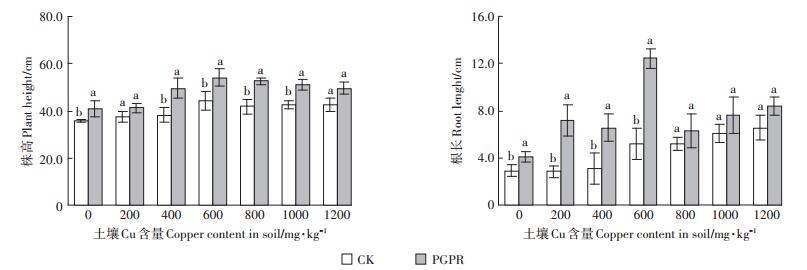
|
CK和PGPR处理间不同小写字母表示差异显著(P < 0.05)。下同 The different lowercase letters between CK and PGPR mean significant difference(P < 0.05). The same below 图 1 不同处理的蒲儿根生长状况 Figure 1 Plant growth condition of Sinosenecio oldhamianus of different treatments |
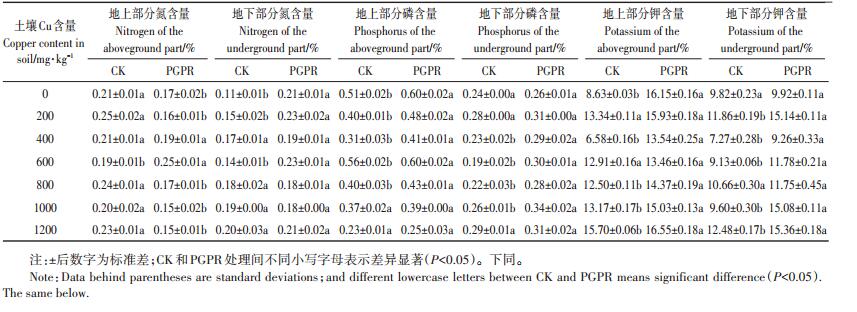
由表 1可见,与不加入PGPR混合菌剂的处理相比,加入PGPR混合菌剂处理的植株各部分磷、钾含量均升高,且大部分显著提高(P < 0.05),但PGPR组植株地上部分氮含量仅在土壤Cu含量为0~600 mg· kg-1时显著提高,植株地下部分氮含量在土壤Cu含量为0、200、600 mg·kg-1时显著(P < 0.05)高于CK组。结合蒲儿根生长状况,植物营养元素含量均在土壤Cu含量为600 mg·kg-1时达到最高值。在土壤Cu含量低于800 mg·kg-1时,PGPR混合菌剂的促生作用明显,在土壤Cu含量大于800 mg·kg-1的高浓度胁迫下,微生物和植物的生长均受到了一定程度的限制,所以PGPR混合菌剂对植物生长的促进作用有所降低。
|
|
表 1 不同处理的蒲儿根氮、磷、钾含量 Table 1 The nitrogen, phosphorus and potassium content of Sinosenecio oldhamianus of different treatments |
由图 2可知,两个处理下蒲儿根对Cu的富集量均随土壤Cu含量的升高呈现增长趋势,对Cu的富集作用主要集中在根系,只有约18%转移到地上部分,地上部分差异不明显,表明PGPR菌剂的加入对植物根部吸收土壤Cu有很大的促进作用,对地上部分影响不大。CK组地下部分Cu含量在土壤Cu含量200~ 1200 mg·kg-1都没有太大区别,稳定在60 mg·kg-1左右。施加混合菌剂处理的地下部分Cu含量均高于CK组,在土壤Cu含量为800 mg·kg-1的时候蒲儿根地下部分重金属含量达到了176.17 mg·kg-1,表明PGPR混合菌剂的加入不仅对蒲儿根生长有促进作用,且使得植株地下部分吸收土壤Cu的能力有很大提高,在0~800 mg·kg-1范围内土壤Cu含量越高,促进作用越明显。在土壤Cu含量为800~1200 mg·kg-1时,植物体内重金属含量由于高浓度Cu胁迫呈现下降趋势。
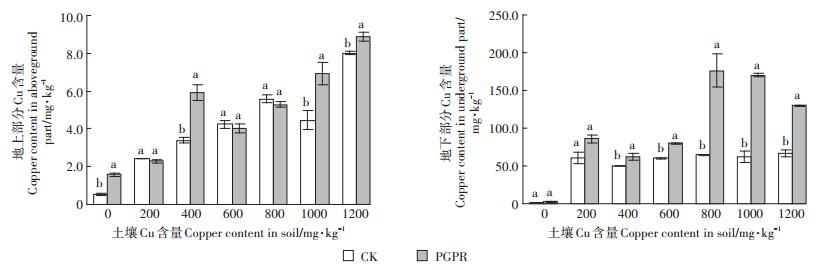
|
图 2 不同处理的蒲儿根Cu富集量 Figure 2 Copper accumulation of Sinosenecio oldhamianus of different treatments |
进一步计算蒲儿根对土壤重金属的富集系数。富集系数表示植物累积Cu的能力,计算植物体内Cu富集系数来评估不同处理下蒲儿根的富集能力,计算公式如下:

|
图 3显示了蒲儿根在不同Cu含量处理下的富集系数,总体而言,PGPR组的蒲儿根对Cu的富集系数皆高于CK组,可见,PGPR混合菌剂的加入可以明显提高蒲儿根对土壤中Cu的富集能力。土壤Cu含量为200 mg·kg-1时,蒲儿根的富集系数达到了44.36%,比未加菌剂的处理提高了12.93%,其后有一个降低的趋势,而在800 mg·kg-1的时候达到了22.72%,是整个试验中的第二个高点,比未加菌剂处理的富集系数提高14.01%。结合蒲儿根的生长趋势,土壤中的Cu含量在低浓度时可以促进植物生长发育,在高浓度胁迫下,PGPR混合菌剂不但促进了植物的生长和对重金属Cu的耐受性,还提高了植物对重金属Cu的吸收量。
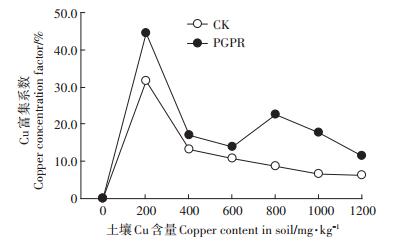
|
图 3 不同处理的蒲儿根铜富集系数 Figure 3 Copper concentration factor of Sinosenecio oldhamianus of different treatments |
测定不同Cu浓度处理下的土壤pH值,均在7.1~ 7.4,变化不明显。
由图 4可知,加入PGPR混合菌剂后土壤有机质显著提高,在土壤Cu含量0、600、800、1000 mg·kg-1的时候有机质含量显著(P < 0.05)高于同浓度不加菌剂的处理,且在整个试验浓度中呈现先增后减的趋势,这与植物生长状况变化有一定相似性。

|
图 4 不同处理的土壤有机质含量 Figure 4 Organic matter content of different treatments |
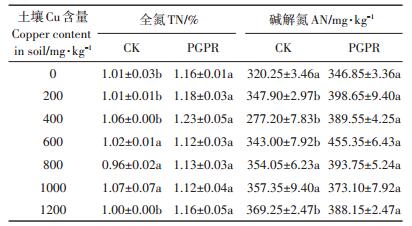
由表 2可知,施加PGPR混合菌剂的土壤全氮、碱解氮的含量均高于未施加菌剂的处理,且土壤全氮含量在土壤Cu含量为0、200、400、1200 mg·kg-1的时候显著(P < 0.05)高于对照组,土壤碱解氮含量在土壤Cu含量为200、400、600、1200 mg·kg-1时达到显著(P < 0.05),在土壤Cu含量为800、1000 mg·kg-1的时候,施加PGPR混合菌剂的土壤全氮、碱解氮含量高于未施加的处理但未达到显著水平(P < 0.05)。可见PGPR混合菌剂的加入一定程度上提高了土壤全氮和碱解氮的含量,且在土壤高含量Cu处理下依旧发挥作用。
|
|
表 2 不同处理的土壤氮含量 Table 2 Soil nitrogen content of different treatments |
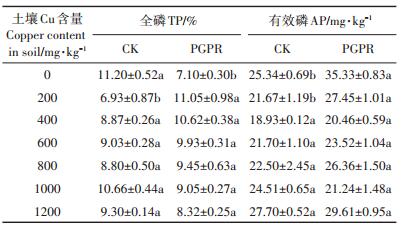
如表 3所示,除了土壤Cu含量0 mg·kg-1的处理,其余条件下施加PGPR混合菌剂处理土壤的全磷、有效磷含量均高于CK组,且在土壤Cu含量为200 mg· kg-1的时候达到显著(P < 0.05)。在土壤Cu含量为0 mg·kg-1的处理中,施加PGPR混合菌剂处理的全磷含量显著低于(P < 0.05)CK组,但是有效磷的含量显著高于未接菌的处理(P < 0.05),可能是因为植物根际促生菌在土壤Cu含量为0 mg·kg-1的时候活性最高,将土壤中的全磷大量转为植物可吸收利用的有效磷导致。
|
|
表 3 不同处理的土壤磷含量 Table 3 Soil phosphorus content of different treatments |
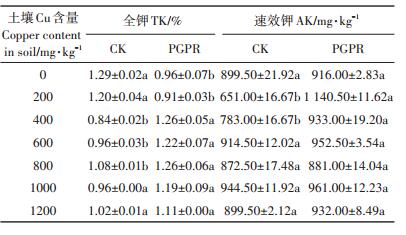
如表 4所示,施加PGPR混合菌剂处理的土壤速效钾含量均高于CK组,且在土壤Cu含量为200、400 mg·kg-1的时候达到显著水平(P < 0.05)。与土壤磷含量变化趋势相近,土壤全钾含量在土壤Cu含量为0、200 mg·kg-1时,施加PGPR混合菌剂的土壤全钾含量显著低于(P < 0.05)CK组,但是速效钾的含量高于未接菌的处理,表明在土壤Cu含量较低条件下PGPR活性很高,将大量的难溶性钾盐转化为可被植物吸收的速效钾,土壤中的钾被植物吸收转移,故全钾含量有所变化。在土壤Cu含量大于400 mg·kg-1的时候,PGPR组的土壤速效钾含量大于CK组,推测原因为微生物混合菌剂的加入降低了土壤中钾素的流失,使原本容易随水分流失的钾离子被固定。
|
|
表 4 不同处理的土壤钾含量 Table 4 Soil potassium content of different treatments |
不同土壤Cu含量处理下土壤的各种功能性酶活性如图 5所示。土壤过氧化氢酶活性在不同处理下不存在显著性差异,均在0.55~0.57 g·kg-1;在土壤Cu含量为0、200、400、1000 mg·kg-1的时候,施加PGPR混合菌剂的土壤脲酶活性显著高于CK组,而在其他浓度条件处理下(600、800、1200 mg·kg-1)施加混合菌剂的盆栽土壤脲酶活性高于CK组但未达到显著水平;施加PGPR混合菌剂的土壤蛋白酶活性均高于同浓度的不施加菌剂的处理,且在Cu含量为0、1200 mg·kg-1时差异显著;在各个土壤Cu含量浓度处理下,施加PGPR混合菌剂处理的土壤蔗糖酶活性皆高于同浓度不施加菌剂的处理,且在土壤Cu浓度为0、400、800 mg·kg-1的时候达到显著;施加PGPR混合菌剂处理的土壤磷酸酶活性皆高于不施肥加菌剂的处理,且在土壤Cu含量为0、400 mg·kg-1的时候达到显著。
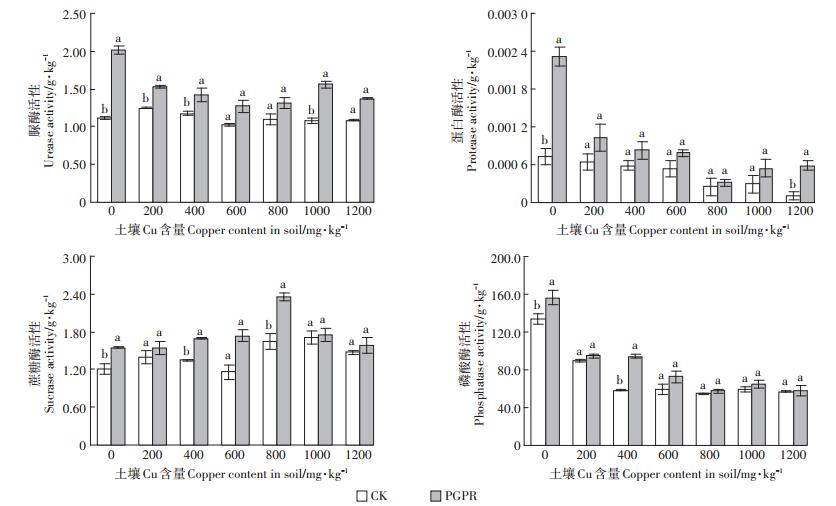
|
图 5 不同处理的土壤酶活性 Figure 5 Soil enzyme activities of different treatments |
总体而言,PGPR混合菌剂的加入,提升了土壤中的各种功能性酶的活性,使得土壤中部分原本不能够被植物吸收利用的养分转化为对植物生长有利的养分,从而促进植物的生长发育,进一步提升植物富集土壤中Cu的能力。
3 讨论本研究结果表明,植物根际促生菌与蒲儿根联合修复土壤Cu污染效果显著优于单一植物修复,且蒲儿根对Cu的富集作用主要集中在根系,这与张世熔等[20]研究的植株中大部分富集的重金属Cu转移至地上部分不符合,推测产生这种情况的原因是PGPR混合菌剂的加入极大地促进了蒲儿根地下部分的富集能力,导致大量的Cu累积在蒲儿根根部,结合其他学者[17, 20]的研究结果蒲儿根还具有较强的迁移能力,推测随时间推移,累积在根部的Cu会向地上部分转移。
施用了PGPR混合菌剂的蒲儿根株高、根长以及氮、磷、钾含量均优于未施加菌剂的对照组,表明植物根际促生菌的加入可以提高植物的生物量,再结合土壤氮、磷、钾等养分含量变化分析,施加PGPR混合菌剂土壤中的植物可利用养分含量得到了很大程度提高,例如碱解氮、有效磷、速效钾均有所增加。表明植物根际促生菌可以通过产生利于植物生理活动的有关物质或将土壤中部分难以利用的物质转换为植物可利用的形态,提高植物可利用营养元素水平[10-12, 25],土壤速效养分的提高使得植物生长条件更优越,且PGPR混合菌剂在土壤高浓度Cu的胁迫下依旧产生作用。施加PGPR混合菌剂处理的蒲儿根对土壤中高浓度Cu的耐受性和富集量皆高于未施加混合菌剂的处理,各个处理下Cu的富集系数均高于相应对照组,特别是植物根部的富集系数显著高于未添加菌剂的处理,推测是因为植物根际促生菌的加入增强了蒲儿根对土壤中Cu的抗性和吸附能力,某些对重金属有较强耐受性的植物根际促生菌,可以通过吸收、淋滤等作用改变环境中金属离子的形态,从而减轻了重金属对植物的毒害作用[28-29]。
土壤酶是一种生物活性物质,在土壤中碳的转化、养分循环和微生物丰度中起到关键作用,与土壤微生态环境息息相关,同时也是反映土壤肥力的重要指标之一[30-31]。加入植物根际促生菌处理的土壤脲酶、蛋白酶、蔗糖酶、磷酸酶活性都显著提高,活性增加最高分别为80.28%、217.11%、43.26%、61.89%。土壤脲酶酶促反应的产物为氨,其活性代表着土壤氮从有机态向有效态转化的能力[32-33],土壤蛋白酶也与植物氮源相关,其参与土壤中氨基酸、蛋白质以及其他含蛋白质氮的有机化合物的转化[33]。施加PGPR混合菌剂处理的土壤脲酶和蛋白酶活性均高于CK组,且土壤碱解氮含量有了显著提高,表明PGPR菌剂的加入很好地促进了土壤脲酶和蛋白酶的酶活性。蔗糖酶可以表征土壤生物活性强度[34]。土壤磷酸酶可以水解土壤中的有机磷酯,将土壤中的有机磷转化为植物可吸收的无机磷[32]。PGPR混合菌剂的加入对土壤蔗糖酶和磷酸酶活性的促进作用在土壤Cu含量0~ 600 mg·kg-1时表现为显著,在土壤Cu含量800 mg· kg-1的时候蔗糖酶活性促进作用表现为显著,磷酸酶无明显差异,在土壤Cu含量1000~1200 mg·kg-1时均无明显差异,结合土壤有效磷含量在土壤Cu含量低浓度时显著提高,表明PGPR混合菌剂在土壤Cu含量低于600 mg·kg-1时对蔗糖酶和磷酸酶活性的促进作用较好。试验结果表明,接种PGPR混合菌剂后土壤微环境得到改善,土壤酶活的提升使土壤中可被植物利用的营养物质明显增加,有效促进了蒲儿根的生长。
另外Cu是多种酶的组成成分,唐伟[35]研究发现低浓度的Cu可以激活土壤酶活,本试验结果中脲酶和蔗糖酶的活性在不接菌的处理中出现了先增后减的趋势,表明一定条件下,Cu对酶活性有激活作用。而Cu对土壤酶活性的抑制有两方面:一是Cu与酶分子活性部位结合跟底物产生竞争,二是Cu抑制了土壤微生物的生长,从而减少微生物对酶的合成[36]。本试验中土壤Cu对蛋白酶和磷酸酶出现了明显的抑制作用,但对蔗糖酶几乎没有抑制作用,且体现不同程度的激活作用。土壤Cu对脲酶的影响在所有CK处理组中不显著,在PGPR处理组中出现了抑制作用,可能是由于加入的PGPR菌剂受到了Cu的胁迫。
本研究试验土壤Cu含量0~1200 mg·kg-1范围中整个修复体系的营养元素指标以及重金属富集量均呈现先增后减的趋势,且在600 mg·kg-1的时候达到最高值,推测是因为Cu本身是植物生长所必需的元素之一,但过量的Cu依旧会损害植物的生长。在整个试验过程中,未出现蒲儿根由于土壤重金属含量过高而死亡的情况,验证了蒲儿根是一种具有高耐受性的超富集植物,在土壤重金属污染研究方面具有很大的潜力。
综上所述,植物根际促生细菌联合蒲儿根修复土壤Cu污染的效果明显优于单纯的植物修复,具有可行性。因此,蒲儿根-微生物共生体系可以在不同Cu含量土壤上进行稳定的修复,为Cu污染土壤的修复体系提供了依据,可作进一步研究与推广。
4 结论(1)植物根际促生菌与蒲儿根建立互利共生的关系,PGPR混合菌剂的加入可以改善重金属胁迫下蒲儿根的长势,改变蒲儿根对土壤中重金属的富集特性,由将富集的Cu大部分转移到地上部分改变为富集更多的Cu累积在根部,对蒲儿根富集Cu的能力有很大提升。
(2)PGPR混合菌剂的加入可以改善土壤环境,提高土壤中有效养分(碱解氮、有效磷、速效钾)和有机质的含量,还能不同程度地提高土壤脲酶、蛋白酶、蔗糖酶、磷酸酶活性。
(3)Cu作为植物生长必需的微量元素之一和某些酶的组成成分,土壤Cu含量低的时候对植物生长表现出一定的促进作用,Cu还激活了土壤中的蔗糖酶活性。
| [1] |
王萌, 李杉杉, 李晓越, 等. 我国土壤中Cu的污染现状与修复研究进展[J]. 地学前缘, 2018, 25(5): 305-313. WANG Meng, LI Shan-shan, LI Xiao-yue, et al. An overview of current status of copper pollution in soil and remediation efforts in China[J]. Earth Science Frontiers, 2018, 25(5): 305-313. |
| [2] |
Ghazaryan K, Movsesyan H, Ghazaryan N, et al. Copper phytoremediation potential of wild plant species growing in the mine polluted areas of Armenia[J]. Environmental Pollution, 2019, 249: 491-501. DOI:10.1016/j.envpol.2019.03.070 |
| [3] |
霍宾, 吴婷, 肖华, 等. 铜污染草地对放牧乌蒙半细毛羊矿物质元素代谢的影响[J]. 生态毒理学报, 2019, 14(6): 1-9. HUO Bin, WU Ting, XIAO Hua, et al. Effect of copper contaminated pasture on mineral metabolism in the Wumeng semi-fine wool sheep[J]. Asian Journal of Ecotoxicology, 2019, 14(6): 1-9. |
| [4] |
Kalinovic J V, Serbula S M, Radojevic A A, et al. Assessment of As, Cd, Cu, Fe, Pb, and Zn concentrations in soil and parts of Rosa spp. sampled in extremely polluted environment[J]. Environmental Monitoring and Assessment, 2018, 191(1): 15-29. |
| [5] |
邹佳佳, 孟梅, 张云, 等. 农田土壤铜污染评价和油菜铜积累特征研究[J]. 土壤通报, 2015, 46(3): 621-627. ZOU Jia-jia, MENG Mei, ZHANG Yun, et al. Evaluation on copper pollution status of soil and copper accumulation features of rapes in farmland[J]. Chinese Journal of Soil Science, 2015, 46(3): 621-627. |
| [6] |
任海彦, 胡健, 胡毅飞. 重金属污染土壤植物修复研究现状与展望[J]. 江苏农业科学, 2019, 47(1): 5-11. REN Hai-yan, HU Jian, HU Yi-fei. Research progress and prospect of phytoremediation of heavy metal contaminated soils[J]. Jiangsu Agricultural Sciences, 2019, 47(1): 5-11. |
| [7] |
Li X, Wang X, Chen Y, et al. Optimization of combined phytoremediation for heavy metal contaminated mine tailings by a field-scale orthogonal experiment[J]. Ecotoxicology and Environmental Safety, 2019, 168: 1-8. DOI:10.1016/j.ecoenv.2018.10.012 |
| [8] |
郭军康, 董明芳, 丁永祯, 等. 根际促生菌影响植物吸收和转运重金属的研究进展[J]. 生态环境学报, 2015, 24(7): 1228-1234. GUO Jun-kang, DONG Ming-fang, DING Yong-zhen, et al. Effects of plant growth promoting rhizobacteria on plants heavy metal uptake and transport:A review[J]. Ecology and Environmental Sciences, 2015, 24(7): 1228-1234. |
| [9] |
李交昆, 余黄, 曾伟民, 等. 根际促生菌强化植物修复重金属污染土壤的研究进展[J]. 生命科学, 2017, 29(5): 434-442. LI Jiao-kun, YU Huang, ZENG Wei-min, et al. Research progress on plant growth promoting rhizobacteira and their role in phytoremediation of heavy metal-contaminated soil[J]. Chinese Bulletin of Life Sciences, 2017, 29(5): 434-442. |
| [10] |
Ju W L, Liu L, Fang L C, et al. Impact of co-inoculation with plantgrowth-promoting rhizobacteria and rhizobium on the biochemical responses of alfalfa-soil system in copper contaminated soil[J]. Ecotoxicology and Environmental Safety, 2019, 167: 218-226. DOI:10.1016/j.ecoenv.2018.10.016 |
| [11] |
Kanika K, Vijay L J, Anket S, et al. Supplementation with plant growth promoting rhizobacteria(PGPR) alleviates cadmium toxicity in Solanum lycopersicum by modulating the expression of secondary metabolites[J]. Chemosphere, 2019, 230: 628-639. DOI:10.1016/j.chemosphere.2019.05.072 |
| [12] |
黄明煜, 章家恩, 全国明, 等. 土壤重金属的超富集植物研发利用现状及应用入侵植物修复的前景综述[J]. 生态科学, 2018, 37(3): 194-203. HUANG Ming-yu, ZHANG Jia-en, QUAN Guo-ming, et al. Review on research and utilization current status of hyperaccumulation plants for heavy metal contaminated soils and the phytoremediation application prospective of invasive plants[J]. Ecological Science, 2018, 37(3): 194-203. |
| [13] |
Tu C, Liu Y, Wei J, et al. Characterization and mechanism of copper biosorption by a highly copper-resistant fungal strain isolated from copper-polluted acidic orchard soil[J]. Environmental Science and Pollution Research International, 2018, 25(25): 24965-24974. DOI:10.1007/s11356-018-2563-4 |
| [14] |
Glibota N, Grande B M J, Gálvez A, et al. Copper tolerance and antibiotic resistance in soil bacteria from olive tree agricultural fields routinely treated with copper compounds[J]. Journal of the Science of Food and Agriculture, 2019, 99(10): 4677-4685. DOI:10.1002/jsfa.9708 |
| [15] |
马贵党, 李崇华, 王飞, 等. 一株铜抗性细菌的分离鉴定及其耐铜机制[J]. 应用与环境生物学报, 2019, 25(2): 392-398. MA Gui-dang, LI Chong-hua, WANG Fei, et al. Isolation and identification of a Cu-resistant bacterial strain and its Cu resistance mechanism[J]. Chinese Journal of Applied and Environmental Biology, 2019, 25(2): 392-398. |
| [16] |
Asensio V, Flórido F G, Ruiz F, et al. The potential of a technosol and tropical native trees for reclamation of copper-polluted soils[J]. Chemosphere, 2019, 220: 892-899. DOI:10.1016/j.chemosphere.2018.12.190 |
| [17] |
王琼瑶.镉、铜、铅胁迫下蒲儿根生理特性和富集特征研究[D].成都: 四川农业大学, 2011. WANG Qiong-yao. Research on physiology and accumulation characteristics of Sinosenecio oldhamianus under cadmium, copper and lead stress[D]. Chengdu: Sichuan Agricultural University, 2011. http://d.wanfangdata.com.cn/Thesis/Y2073045 |
| [18] |
Napoli M, Cecchi S, Grassi C, et al. Phytoextraction of copper from a contaminated soil using arable and vegetable crops[J]. Chemosphere, 2019, 219: 122-129. DOI:10.1016/j.chemosphere.2018.12.017 |
| [19] |
Zhang S R, Chen M Y, Li T, et al. A newly found cadmium accumulator-Malva sinensis Cavan[J]. Journal of Hazardous Materials, 2009, 173(1): 705-709. |
| [20] |
张世熔, 王琼瑶, 徐小逊, 等.蒲儿根在修复矿山土壤及污泥的重金属铜污染中的应用[P]. 200910309124.7, 2010-03-17. ZHANG Shi-rong, WANG Qiong-yao, SUN Xiao-xun, et al. Application of Sinosenecio oldhamianus in the restoration of copper pollution in mine soil and sludge[P]. 200910309124.7, 2010-03-17. http://d.wanfangdata.com.cn/Patent_CN200910309124.7.aspx |
| [21] |
邱志敬, 邹纯清, 史正军, 等. 不同栽培基质对苦苣苔科植物生长的影响[J]. 广东农业科学, 2013, 40(17): 31-33, 47. QIU Zhi-jing, ZOU Chun-qing, SHI Zheng-jun, et al. Effects of different substrate composition on growth of Gesneriaceae plants[J]. Guangdong Agricultural Sciences, 2013, 40(17): 31-33, 47. DOI:10.3969/j.issn.1004-874X.2013.17.011 |
| [22] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796. DOI:10.1128/AEM.61.2.793-796.1995 |
| [23] |
姜霁航, 彭霞薇, 颜振鑫, 等. 苹果树根际高效解钾菌的筛选及鉴定[J]. 中国农业气象, 2017, 38(11): 738-748. JIANG Ji-hang, PENG Xia-wei, YAN Zhen-xin, et al. Isolation and identification of potassium-solubilizing bacteria from rhizosphere soil of apple tree[J]. Chinese Journal of Agrometeorology, 2017, 38(11): 738-748. DOI:10.3969/j.issn.1000-6362.2017.11.006 |
| [24] |
林欣, 王立立, 杨平, 等. 一株溶磷菌对盐地碱蓬修复盐渍土Cd污染的促进效应[J]. 农业环境科学学报, 2018, 37(5): 883-891. LIN Xin, WANG Li-li, YANG Ping, et al. The promoting effect of phosphorus-solubilizing bacteria on remediation of cadmium-contaminated saline soil by Suaeda salsa[J]. Journal of Agro-Environment Science, 2018, 37(5): 883-891. |
| [25] |
Yu X M, Li Y M, Zhang C, et al. Culturable heavy metal-resistant and plant growth promoting bacteria in V-Ti magnetite mine tailing soil from Panzhihua, China[J]. PLoS One, 2014, 9(9): 1-8. |
| [26] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2008. BAO Shi-dan. Soil agricultural chemistry analysis[M]. 3rd Edition. Beijing: China Agriculture Press, 2008. |
| [27] |
关松荫. 土壤酶及其研究法[M]. 北京: 中国农业出版社, 1986: 274-329. GUAN Song-yin. Soil enzyme and its study method[M]. Beijing: China Agriculture Press, 1986: 274-329. |
| [28] |
袁金玮, 陈笈, 陈芳, 等. 强化植物修复重金属污染土壤的策略及其机制[J]. 生物技术通报, 2019, 35(1): 120-130. YUAN Jin-wei, CHEN Ji, CHEN Fang, et al. The augmentation strategies and mechanisms in the phytoremediation of heavy metal-contaminated soil[J]. Biotechnology Bulletin, 2019, 35(1): 120-130. |
| [29] |
Liu Z F, Ge H G, Li C, et al. Enhanced phytoextraction of heavy metals from contaminated soil by plant co-cropping associated with PGPR[J]. Water, Air and Soil Pollution, 2015, 226(29): 1-10. |
| [30] |
边雪廉, 岳中辉, 焦浩, 等. 土壤酶对土壤环境质量指示作用的研究进展[J]. 土壤, 2015, 47(4): 634-640. BIAN Xue-lian, YUE Zhong-hui, JIAO Hao, et al. Soil enzyme indication on soil environmental quality[J]. Soils, 2015, 47(4): 634-640. |
| [31] |
Igalavithana A D, Farooq M, Kim K H, et al. Determining soil quality in urban agricultural regions by soil enzyme-based index[J]. Environmental Geochemistry and Health, 2018, 40(1): 1531-1544. |
| [32] |
Adetunji A T, Lewu F B, Mulidzi R, et al. The biological activities of beta-glucosidase, phosphatase and urease as soil quality indicators[J]. Journal of Soil Science and Plant Nutrition, 2017, 17(3): 794-807. DOI:10.4067/S0718-95162017000300018 |
| [33] |
Kuscu I S K. Changing of soil properties and urease-catalase enzyme activity depending on plant type and shading[J]. Environmental Monitoring and Assessment, 2019, 191(3): 1-8. |
| [34] |
于德良, 雷泽勇, 赵国军, 等. 土壤酶活性对沙地樟子松人工林衰退的响应[J]. 环境化学, 2019, 38(1): 97-105. |
| [35] |
唐伟.铜污染对土壤呼吸和酶活性的影响[D].武汉: 湖北大学, 2014. TANG Wei. Effects of copper pollution on soil respiration and enzyme activities[D]. Wuhan: Hubei University, 2014. |
| [36] |
郭卓杰, 杨继飞, 李涛, 等. 不同肥料不同作物对铜污染土壤中酶活性的影响[J]. 天津农业科学, 2013, 19(11): 9-11. GUO Zhuo-jie, YANG Ji-fei, LI Tao, et al. Effect of different fertilizer and plants on copper contaminated soil enzyme activity[J]. Tianjin Agricultural Sciences, 2013, 19(11): 9-11. DOI:10.3969/j.issn.1006-6500.2013.11.003 |
 2020, Vol. 39
2020, Vol. 39