磺胺类抗生素(Sulfonamides,SAs)是一类以对氨基苯磺酰胺为母体结构的药品总称,因其具有广谱抗菌性和便于长期保存的特性,而被广泛应用于人类医疗、畜牧水产养殖等行业[1]。研究表明,抗生素在进入人和动物体内后不能全部被机体吸收,会有40%~90%以原药或初级代谢产物的形式随粪便和尿液排出体外[2]进入环境。进入环境的抗生素不仅会造成严重的化学污染,还会诱导环境中的微生物产生耐药性,生成抗性基因,以此加速在环境中的扩散和传播,从而危害人类健康,对生态系统造成潜在威胁[3]。目前,处理抗生素残留的方法包括高级氧化法、活性炭吸附法、低温等离子体技术、膜处理法[4]和生物处理等[5]。但这些方法存在成本高、管理复杂、处理不完全等缺点[6]。
利用微生物燃料电池(Microbial fuel cells,MFCs)技术处理有机污染物,可以同时实现污染物治理和电能的产生[7]。MFCs具有可利用多种有机底物、操作条件温和、无二次污染、污染物利用率高等特点[8],越来越成为污染治理研究中的一个重要方向。Miran等[9]采用磺胺甲恶唑(Sulfamethoxazole,SMX)驯化培养MFCs,通过制备不同浓度SMX的废水,对MFCs在发电和SMX降解中的性能进行评价,结果表明,生物降解是去除SMX的主要过程。宋虹[10]通过构建双室方型MFCs,采用MFCs处理磺胺模拟废水,研究了以葡萄糖和磺胺混合溶液作为阳极底物条件下,MFCs处理磺胺废水的效果及产电性能,结果表明磺胺的去除率可达到90%,且MFCs的产电性能良好。Wang等[11]从MFCs操作、降解产物、反应机理等方面探讨了MFCs中磺胺嘧啶(Sulfadiazine,SDZ)的去除,结果表明SDZ对反应器微生物的活性有很大影响,在MFCs中对SDZ进行生物降解需要长时间的驯化,MFCs在24 h内对初始浓度为10 mg·L-1的磺胺嘧啶的降解率达到80%。
在磺胺类抗生素中,近年来畜禽养殖生产中使用量最大的磺胺间甲氧嘧啶(Sulfamonomethoxine,SMM)[12]研究较少。本文构建了单室微生物燃料电池,通过改变电极材料、菌种条件、抗生素浓度以及腐植酸含量,探究MFCs对溶液中SMM的降解效果及其产电性能的变化。为实现水体环境中磺胺类抗生素的高效低耗处理及MFCs产电性能的提高提供科学依据。
1 材料与方法 1.1 MFCs装置构造试验装置如图 1所示,反应液的总体积为120 mL,将18 mmol·L-1乳酸钠作为电子供体溶于磷酸盐缓冲液(Phosphate buffer solution,PBS)。磷酸盐缓冲液由Na2HPO4·12H2O 10.32 g·L-1、NaH2PO4·2H2O 3.32 g·L-1、NH4Cl 0.31 g·L-1、KCl 0.13 g·L-1及微量元素和维生素[13-14]组成。阳极采用面积为22.5 cm2的碳材料(碳毡、碳纸、石墨棒),用电极夹固定,参比电极为Ag/AgCl,阴极为铂丝对极,外接电阻1000 Ω。

|
图 1 MFCs装置示意图 Figure 1 Schematic diagram of the microbial fuel cell |
磺胺间甲氧嘧啶(SMM),纯度大于99%;腐植酸(Humic acid,HA),纯度大于90%;DL-乳酸钠溶液(60%水溶液)购自美国阿拉丁试剂公司。
试验菌种为Shewanella putrefaciens和Shewanella oneidensis MR-1,购自中国海洋微生物菌种保藏管理中心(MCCC),菌种保藏编号分别为ATCC 8071和ATCC 700550。
MFCs的阳极用电极夹(JJ 110,上海越磁)固定,参比电极为Ag/AgCl(CHI 111,上海辰华),阴极为铂丝对极(CHI 115,上海辰华),外接电阻为直流电阻器(ZX98A,上海正阳)。试验主要仪器为:电化学工作站(CHI660E,上海辰华);Agilent 1220型高效液相色谱分析仪(美国安捷伦公司);液相色谱三重四极杆串联质谱仪(Agilent 1290+G6460);723PC紫外分光光度计(上海菁华科技仪器有限公司)。
1.3 MFCs的微生物接种与运行 1.3.1 微生物接种方法菌体接种至LB培养基(牛肉浸膏5.0 g·L-1、蛋白胨10.0 g·L-1、NaCl 5.0 g·L-1),30 ℃、150 r·min-1摇床中培养,菌体在OD600测定,光密度达到1.5左右后,以4000 r·min-1,离心10 min[15-16],离心后的菌体用生理盐水洗涤3次,按比例混合湿菌体和无菌生理盐水,制得菌体浓度为109 cells·mL-1的菌悬液备用。用电解质(95% PBS和5% LB,18 mol·L-1乳酸钠)重新悬浮细菌至所需浓度(107 cells·mL-1)后将电解质接种于MFCs。不同菌种条件保持相同的接菌量,且分别设置3个平行,试验pH均为7.0。
1.3.2 MFCs启动接种后的MFCs运行15 h后观察到电压稳定上升,运行至电压下降时更换电极液,持续运行到电压再次下降时继续更换电极液,重复3次,观察到输出电压随时间正弦波动后MFCs正式启动。
1.4 测定方法与数据处理 1.4.1 电化学测定本研究测定MFCs的输出电压采用开路电位-时间曲线法(Open circuit potential-Time,OCPT)。
当MFCs装置的输出电压达到高点时,用电化学工作站测量该MFCs体系的循环伏安(Cyclic voltammetry,CV)曲线,用来分析MFCs中微生物的电化学活性[17]。电压范围为-1.0~1.0 V,扫描速度设置为0.01 V·s-1。
测定MFCs的内阻利用交流阻抗法,初始电压为开路电压,频率设置为0.01~100 000 Hz,利用电化学工作站完成,得出的数据用等效电路[18]拟合出Nyquist图[19-20],以定量评价电阻。
测量功率密度与极化曲线时,先将MFCs断开3 h,外接电阻分别设置为30、25、20、15、10、5.1、2.4、1 kΩ和510、200、100 Ω,接入电阻后,每个电阻运行10 min,待电压稳定后,记录稳定值,更换至下一组电阻,从而得到由高到低的一系列电压值。
由欧姆定律可知:
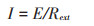
|
(1) |
式中:Rext为每次调节的外电阻电阻值;E为该电阻值对应测得的开路电压;I为电流密度,由电流除以阳极电极面积得到。
功率曲线是不同电流密度所对应的功率密度的曲线。系统为开路状态时无电流输出,因此输出功率为0。当系统处于闭路状态,随着电流密度的增加,功率密度增加至顶点。输出功率计算公式:
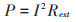
|
(2) |
单位面积电流计算的功率即为功率密度。通常用功率曲线的最高点来表明系统得到的最大功率。系统内阻由极化曲线斜率除以阳极面积计算得到。所有的电化学测量均由电化学工作站完成。
1.4.2 细菌数量测定利用稀释涂布法,取适量菌液用生理盐水制成10-4、10-5、10-6、10-7、10-8、10-9等一系列稀释菌液,充分混匀后吸取1 mL稀释后的菌液分别接种至LB固体培养基(每个稀释度设置3个平行),用无菌刮铲将菌液在平板上涂抹均匀。将涂抹好的平板平放于桌上,待菌液渗透入培养基后,倒转平板,30 ℃条件下保温培养,至长出菌落后即可计数。
1.4.3 SMM测定研究不同SMM浓度下S. putrefaciens对SMM的降解能力及MFCs的电压输出时,SMM初始浓度设置为0、10、20、30、40 mg·L-1,每个浓度的MFCs启动后测量电压变化,当电压开始下降时更换下一个SMM浓度,SMM浓度变化由低到高。研究腐植酸浓度对MFCs降解SMM的影响时,SMM初始浓度为10 mg·L-1,加入一定量腐植酸储备液使其初始浓度分别为0、5、15、30、60 mg·L-1,每个腐植酸浓度的MFCs启动后测量电压变化,当电压开始下降时更换下一个腐植酸浓度,浓度变化由低到高。其他的试验初始SMM浓度均为10 mg·L-1,所有试验设置3个平行。
利用高效液相色谱法测定溶液中SMM的含量,取1 mL样品用适量甲醇洗涤,超声振荡,离心后取上清液过0.22 μm水相滤膜,取滤液进行液相测定。色谱柱:Agilent HC-C18,Analytical 4.6×250 mm;检测波长270 nm;流速1.0 mL·min-1;进样量20 μL;柱温40 ℃。液相测定流动相A为0.4%乙酸,B为乙腈。梯度洗脱程序:0~7 min,70% A;7~8 min,60% A;8 min,70% A;后运行1 min。在梯度洗脱程序条件下,SMM分离效果良好,保留时间为5.873 min。
SMM降解产物利用LC-MS进行分析,通过LCMS检测到的质荷比以及对目标离子的二级碎裂,推测可能的中间产物和相应的降解途径。采用C18柱(2.1 mm×100 mm,1.7 μm),流动相(乙腈:0.4%乙酸=30:70),流速0.3 mL·min-1,电喷雾电离正离子模式,毛细管电压3.0 kV,喷雾压力0.276 MPa,气体温度350 ℃,质荷比(m/z)值直接读出。
1.4.4 数据处理与分析使用一级动力学模型拟合生物降解曲线并预估S. putrefaciens的SMM降解能力:
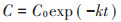
|
(3) |
式中:C0为SMM的初始浓度;C为SMM的实测值;k为SMM降解速率常数,d-1,t为培养时间,d。
数据分析与标准差的计算采用Excel 2010与Origin 8.5软件。
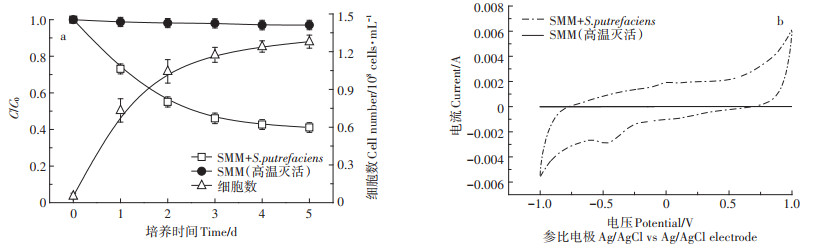
2 结果与分析 2.1 MFCs中产电菌生长及其对SMM的降解动力学为了排除菌体对SMM吸附的影响,设置高温灭活组作为对照,阳极材料选用碳毡。由图 2a可知,S. putrefaciens在培养1 d后直接进入对数生长期,后3 d进入生长平缓期;在MFCs条件下S. putrefaciens对SMM的降解率为58.92%,菌体数量约为1.28 × 108 cells·mL-1;在高温灭活对照组中S. putrefaciens对SMM的去除率非常低,说明菌体本身对SMM的吸附作用不强。由图 2b可知,在SMM存在条件下以S. putrefaciens为产电菌种,MFCs的电化学活性良好。在高温灭活对照组中MFCs几乎没有电化学活性,说明SMM的降解以及MFCs电能的产生主要是因为MFCs中活菌的存在。
|
图 2 MFCs条件下S. putrefaciens的生长曲线与SMM的降解曲线(a)及CV曲线(b) Figure 2 Growth curve of S. putrefaciens and degradation curves of SMM (a) and the CV curves of MFCs (b) |
以S. putrefaciens为试验菌种,分别考察了以碳毡、碳纸、石墨棒为阳极材料的MFCs,以及没有形成电池的纯培养条件对SMM的降解能力,每组试验设置3个平行。纯培养条件下SMM的降解率仅为27.27%,明显低于MFCs条件。图 3a中,3种不同阳极材料条件下,MFCs对SMM的降解率分别为:碳毡58.92%、碳纸50.31%、石墨棒33.55%。
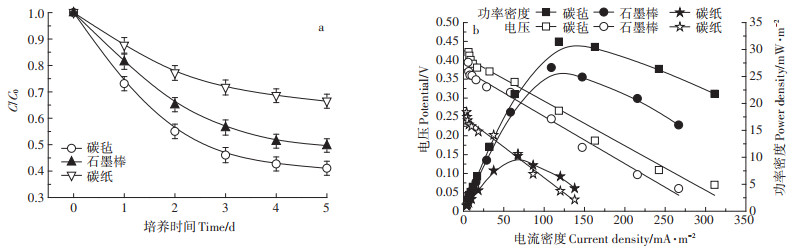
|
图 3 不同阳极材料的MFCs条件下SMM的降解曲线(a)及MFCs功率密度曲线、极化曲线(b) Figure 3 Degradation curve of SMM under different anode materials(a)and power density curves and polarization curves(b)of MFCs |
由图 3b可知,MFCs的输出功率与阳极材料有较大的相关性,其中以碳毡为阳极材料时MFCs的最大输出功率最大,达到31.47 mW·m-2,其次是碳纸(26.67 mW·m-2),最后是石墨棒(10.25 mW·m-2)。由极化曲线计算可知,3种电极材料条件下MFCs的内阻分别为:碳毡525.38 Ω、碳纸556.36 Ω、石墨棒723.73 Ω。试验结果表明,以碳毡为阳极材料时SMM的降解率最高,MFCs的产电性能最好,因此后续试验以碳毡作为阳极材料。
2.3 产电菌种类对MFCs降解SMM及产电性能的影响为考察菌种种类对SMM的降解能力及MFCs的电化学活性,试验选择两种不同产电菌,分别为S. putrefaciens和S. oneidensis MR-1。由图 4a可知,相同MFCs运行条件下S. putrefaciens的细菌数要高于S. oneidensis MR-1,且S. putrefaciens对SMM的降解率达到58.92%,高于S. oneidensis MR-1对SMM的降解率46.48%。

|
图 4 S. putrefaciens和S. oneidensis MR-1条件下MFCs对SMM的降解曲线(a)及MFCs功率密度曲线、极化曲线(b) Figure 4 Degradation curves of SMM by MFCs(a)and power density curves and polarization curves(b)under the inoculation of S. putrefaciens or S. oneidensis MR-1 |
由图 4b可知,以S. putrefaciens为菌种条件下MFCs的最大输出功率达到31.47 mW·m-2,高于S. oneidensis MR-1(24.96 mW·m-2)。由极化曲线计算可知,以S. oneidensis MR-1为菌种条件的MFCs内阻为645.96 Ω,比S. putrefaciens的MFCs内阻高出120.57 Ω。由此可知,S. putrefaciens条件下MFCs装置内阻较低,装置性能较好,从而提高了产电性能,且此菌种条件下SMM的降解率较高,因此后续试验以S. putrefaciens作为试验菌种。
2.4 初始SMM浓度对MFCs降解SMM及产电性能的影响由图 5a可知,初始SMM浓度为10、20、30、40 mg·L-1时的降解率分别为58.92%、30.89%、18.44%、12.05%,表明随着SMM初始浓度增加,SMM的降解率逐渐降低。由图 5b可知,SMM的添加对MFCs的输出电压有负面影响。当未添加SMM时MFCs的电化学活性良好,最大输出电压可达0.422 6 V;当添加10 mg·L-1的SMM时,MFCs的最大输出电压下降到0.418 1 V,且添加的SMM浓度越高,MFCs的输出电压下降越明显,SMM浓度为20、30、40 mg·L-1时,MFCs的最大输出电压分别下降到0.396 5、0.367 1、0.346 2 V。说明SMM初始浓度不仅对SMM的降解率有很大影响,同时能影响MFCs的产电性能。
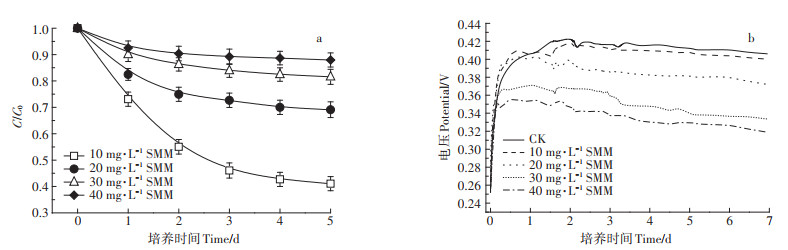
|
图 5 不同初始SMM浓度条件下MFCs对SMM的降解曲线(a)和输出电压曲线(b) Figure 5 Degradation curves of SMM at different initial SMM concentrations in MFCs(a)and output voltage curves(b) |
添加不同浓度腐植酸的MFCs运行5 d,SMM降解率变化如图 6a所示。MFCs运行到第3 d时SMM的降解基本趋于平缓,随着添加腐植酸浓度增大,SMM的去除率增大,加入腐植酸浓度为5、15、30、60 mg·L-1时SMM的降解率分别为69.64%、73.93%、79.94%、80.96%。添加腐植酸能够促进MFCs体系中SMM的去除,但当腐植酸浓度从30 mg·L-1增加到60 mg·L-1时,对SMM的去除影响较小。
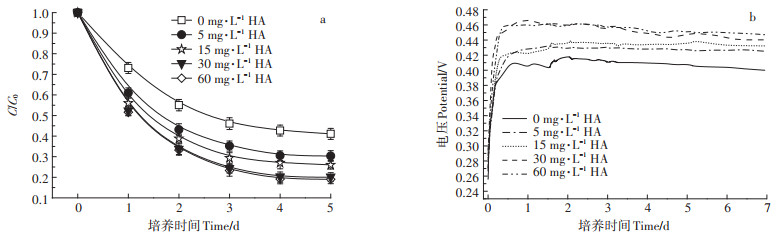
|
图 6 不同初始腐植酸浓度条件下MFCs对SMM的降解曲线(a)及电压曲线(b) Figure 6 SMM degradation curves(a)and output voltage curves(b)of MFCs at different initial HA concentration |
由图 6b可知,腐植酸的添加利于MFCs的电压输出。随着腐植酸浓度增加,MFCs的输出电压逐渐升高;当腐植酸浓度从5 mg·L-1增加到15 mg·L-1时,MFCs电压略有增加;当腐植酸浓度从15 mg·L-1增加到30 mg·L-1时,MFCs的最大输出电压从0.439 1 V增加到0.458 4 V;当腐植酸浓度从30 mg·L-1增加到60 mg·L-1时,MFCs最大输出电压变化不明显。
由图 7可知,MFCs的欧姆电阻Rs以及极化电阻Rp1随着腐植酸浓度的增加变化较小,扩散阻抗Rp2受腐植酸浓度的影响较大,随着腐植酸浓度增加,MFCs的扩散内阻增大。
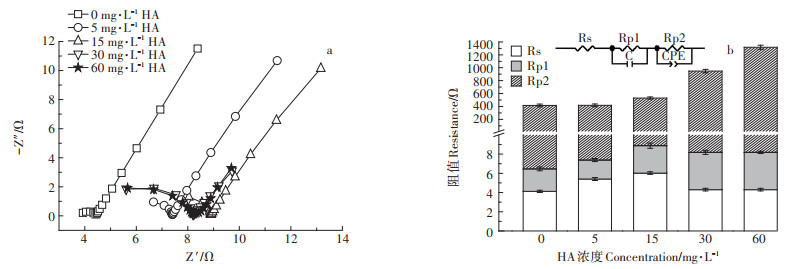
|
图 7 不同初始腐植酸浓度条件下MFCs阳极Nyquist图(a)及内部电阻分析图(b) Figure 7 Nyquist plot (a)and internal resistor component analysis diagrams(b)of MFCs at different initial HA concentrations |
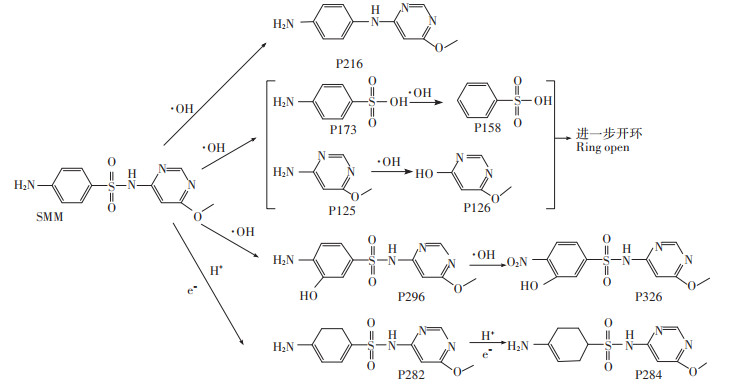
在MFCs体系下,通过对母体及降解产物的分子式及质荷比进行分析,提出几种主要降解中间产物于表 1,这些产物已被证实是SMM的降解产物[21-22]。SMM的降解途径如图 8所示,主要有4条:(a)SMM中的磺酰基中SO2被移除[23],生成产物P216;(b)由于NS键不稳定[22],易被·OH攻击,生成P173和P125,再分别脱除-NH2及氧化生成P158和P126,P158和P126可进一步开环而被完全矿化;(c)SMM可被体系中存在的·OH氧化生成中间产物P296和P326;(d)在微生物及MFCs体系的电子及H+的还原作用下SMM可降解形成中间产物P282,然后进一步生成P284。
|
|
表 1 MFCs体系中SMM降解的主要中间产物 Table 1 Degradation products of SMM in MFCs system |
|
图 8 SMM的可能降解途径 Figure 8 The probable pathway of SMM degradation |
抗生素可作为MFCs的碳源,同时实现抗生素的降解及MFCs的产电[24]。Wang等[11]研究了MFCs中微生物群落与磺胺嘧啶去除的相关性,得出磺胺嘧啶对MFCs中微生物活性有较大负面影响,降低了MFCs的产电性能和磺胺嘧啶的降解效率。Hartl等[25]通过MFCs对COD和氨氮的处理效率研究得出产电微生物活性越好,污染物降解率越高,产电性能越好。本研究中,相同MFCs条件下S. putrefaciens的活性要高于S. oneidensis MR-1,因此以S. putrefaciens为菌种条件的MFCs的产电性能及SMM降解性能要高于S. oneidensis MR-1为菌种的MFCs。此外,随着初始SMM浓度增大,SMM降解率降低的同时MFCs的产电性能也降低。这与已报道的MFCs降解其他难降解有机物的结果一致[9, 26]。
除微生物活性以外,MFCs的内阻也是影响污染物降解以及MFCs产电性能的重要因素。阳极材料的高孔隙率、高比表面积特性以及菌体在阳极的附着情况会使MFCs的内阻发生变化[27-29]。内阻的增加会降低MFCs的输出功率[30-32]。因此,在阳极材料为碳毡时,SMM的降解率最高,MFCs的产电性能最好。此外,图 7b中,MFCs体系扩散内阻随腐植酸浓度增加而增加,当腐植酸浓度小于15 mg·L-1时,扩散内阻变化不明显,当腐植酸浓度从15 mg·L-1增加到60 mg·L-1时,MFCs扩散内阻明显增加,这是因为当添加高浓度的腐植酸时,由于阳极对腐植酸的吸附,导致MFCs的传质阻力增加[33]。此外,腐植酸可以作为一种电子穿梭体,使得微生物与胞外电子受体之间的电子传递速率加快[34],促进MFCs的氧化还原反应,提高SMM的降解效率以及MFCs的产电性能。因此,腐植酸的添加利于SMM的降解及MFCs的产电;当腐植酸浓度过高时,扩散内阻对MFCs阳极性能的负面影响,会使SMM的降解效率及MFCs产电性能受电子穿梭体的正面影响减弱,这与Huang等[35]的研究结果一致。
本研究从微生物活性及MFCs内阻变化方面对影响SMM降解及MFCs产电性能的因素进行了探讨,并发现以碳毡为阳极材料、S. putrefaciens为菌种条件下SMM的降解率及MFCs的产电性能最高,此外腐植酸的添加利于SMM的降解及MFCs的产电,为实现SMM的高效降解及MFCs产电性能的提高提供了科学依据。关于SMM降解与S. putrefaciens电子传递相互作用的机制,还有待深入研究。
4 结论(1)MFCs运行条件下对SMM的降解效率高于微生物纯培养条件;以碳毡为阳极材料、S. putrefaciens为菌种条件下SMM的降解率及MFCs的产电性能最高;随着SMM初始浓度的增加,SMM降解率逐渐减弱,MFCs的产电性能逐渐降低;随着添加腐植酸浓度增加,SMM的降解率逐渐提高,MFCs的产电性能逐渐增强。
(2)MFCs阳极性能影响SMM的降解效果。外源腐植酸浓度升高,MFCs阳极逐渐受负面影响而使MFCs内阻增大,从而导致SMM的降解效率逐渐降低。内阻是影响MFCs产电性能的一个重要因素,内阻增大,MFCs产电性能受电子穿梭体的正面影响变小。
| [1] |
Boxall A B A, Fogg L A, Blackwell P, et al. Veterinary medicines in the environment[J]. Reviews of Environment Contamination and Toxicology, 2004, 180(6): 1-91. |
| [2] |
Kumar K, Gupta S C, Chander Y, et al. Antibiotic use in agriculture and its impact on the terrestrial environment[J]. Advances in Agronomy, 2005, 87: 1-54. |
| [3] |
沈怡雯, 黄智婷, 谢冰. 抗生素及其抗性基因在环境中的污染、降解和去除研究进展[J]. 应用与环境生物学报, 2015, 21(2): 181-187. SHEN Yi-wen, HUANG Zhi-ting, XIE Bing. Advances in research of pollution, degradation and removal of antibiotics and antibiotic resistance genes in the environment[J]. Chinese Journal of Applied & Environmental Biology, 2015, 21(2): 181-187. |
| [4] |
罗玉, 黄斌, 金玉, 等. 污水中抗生素的处理方法研究进展[J]. 化工进展, 2014, 33(9): 2471-2477. LUO Yu, HUANG Bin, JIN Yu, et al. Research progress in the degradation of antibiotics wastewater treatment[J]. Chemical Industry and Engineering Progress, 2014, 33(9): 2471-2477. |
| [5] |
Maki T, Hasegawa H, Kitami H, et al. Bacterial degradation of antibiotic residues in marine fish farm sediments of Uranouchi Bay and phylogenetic analysis of antibiotic-degrading bacteria using 16S rDNA sequences[J]. Fisheries Science, 2006, 72(4): 811-820. |
| [6] |
刘元望, 李兆君, 冯瑶, 等. 微生物降解抗生素的研究进展[J]. 农业环境科学学报, 2016, 35(2): 212-224. LIU Yuan-wang, LI Zhao-jun, FENG Yao, et al. Research progress in microbial degradation of antibiotics[J]. Journal of Agro-Environment Science, 2016, 35(2): 212-224. |
| [7] |
Logan B E, Hamelers B, Rozendal R A, et al. Microbial fuel cells: Methodology and technology[J]. Environmental Science & Technology, 2006, 40(17): 5181-5192. |
| [8] |
龚小波.微生物燃料电池高效电极与界面设计强化产电特性研究[D].哈尔滨: 哈尔滨工业大学, 2016. GONG Xiao-bo. Research on electricity production enhanced by designing of efficient electrode and interface in microbial fuel cells[D]. Harbin: Harbin Institute of Technology, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D01102233 |
| [9] |
Miran W, Jang J, Nawaz M, et al. Biodegradation of the sulfonamide antibiotic sulfamethoxazole by sulfamethoxazole acclimatized cultures in microbial fuel cells[J]. Science of the Total Environment, 2018, 627: 1058-1065. |
| [10] |
宋虹.微生物燃料电池处理抗生素模拟废水实验研究[D].新乡: 河南师范大学, 2014. SONG Hong. Research on degradation of antibiotics simulated wastewater by microbial fuel cell[D]. Xinxiang: Henan Normal University, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2550483 |
| [11] |
Wang L, You L X, Zhang J M, et al. Biodegradation of sulfadiazine in microbial fuel cells:Reaction mechanism, biotoxicity removal and the correlation with reactor microbes[J]. Journal of Hazardous Materials, 2018, 360: 402-411. |
| [12] |
Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. |
| [13] |
司荣炜.基于希瓦氏菌反向电子传递的全细胞生物电化学传感器的构建、原理及其应用研究[D].镇江: 江苏大学, 2016. SI Rong-wei. Whole-cell electrochemical biosensor based on bacterial inward electron flow: System development, principle and application[D]. Zhenjiang: Jiangsu University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10299-1016728268.htm |
| [14] |
Zhang P, Liu J, Qu Y P, et al. Enhanced Shewanella oneidensis MR-1 anode performance by adding fumarate in microbial fuel cell[J]. Chemical Engineering Journal, 2017, 328(1): 697-702. |
| [15] |
Xu Y S, Zheng T, Yong X Y, et al. Trace heavy metal ions promoted extracellular electron transfer and power generation by Shewanella in microbial fuel cells[J]. Bioresource Technology, 2016, 211: 542-547. |
| [16] |
Yu Y Y, Guo C X, Yong Y C, et al. Nitrogen doped carbon nanoparticles enhanced extracellular electron transfer for high-performance microbial fuel cells anode[J]. Chemosphere, 2015, 140: 26-33. |
| [17] |
Khater D Z, El-khatib K M, Hassan R Y A. Exploring the bioelectrochemical characteristics of activated sludge using cyclic voltammetry[J]. Applied Biochemistry and Biotechnology, 2017, 184(1): 92-101. |
| [18] |
Tommasi T, Sacco A, Armato C, et al. Dynamical analysis of microbial fuel cells based on planar and 3D-packed anodes[J]. Chemical Engineering Journal, 2016, 288(1): 38-49. |
| [19] |
Margaria V, Tommasi T, Pentassuglia S, et al. Effects of pH variations on anodic marine consortia in a dual chamber microbial fuel cell[J]. International Journal of Hydrogen Energy, 2017, 42: 1820-1829. |
| [20] |
Rikame S S, Mungray A A, Mungray A K. Modification of anode electrode in microbial fuel cell for electrochemical recovery of energy and copper metal[J]. Electrochimica Acta, 2018, 275: 8-17. |
| [21] |
Yan J C, Lei M, Zhu L H, et al. Degradation of sulfamonomethoxine with Fe3O4, magnetic nanoparticles as heterogeneous activator of persulfate[J]. Journal of Hazardous Materials, 2011, 186(2/3): 1398-1404. |
| [22] |
张洋, 付兴明, 罗敏, 等. 电子束辐照降解水体中磺胺间甲氧嘧啶[J]. 中国环境科学, 2018, 38(7): 2520-2526. ZHANG Yang, FU Xing-ming, LUO Min, et al. Degradation of sulfamethoxan in water by electron beam irradiation[J]. Chinese Journal of Environmental Sciences, 2018, 38(7): 2520-2526. |
| [23] |
Boreen A, Arnold W, Mcneill K. Photochemical fate of sulfa drugs in the aquatic environment:Sulfa drugs containing five-membered heterocyclic groups[J]. Environment Science & Technology, 2004, 38(14): 3933-3940. |
| [24] |
Zhou Y, Zhu N W, Guo W Y, et al. Simultaneous electricity production and antibiotics removal by microbial fuel cells[J]. Journal of Environmental Management, 2018, 217: 565-572. |
| [25] |
Hartl M, Bedoya-Ríos D F, Fernández-Gatell M, et al. Contaminants removal and bacterial activity enhancement along the flow path of constructed wetland microbial fuel cells[J]. Science of the Total Environment, 2019, 652: 1195-1208. |
| [26] |
Wu W G, Lesnik K L, Xu S T, et al. Impact of tobramycin on the performance of microbial fuel cell[J]. Microbial Cell Factories, 2014, 13(1): 91. |
| [27] |
Wang W, You S J, Gong X B, et al. Bioinspired nanosucker array for enhancing bioelectricity generation in microbial fuel cells[J]. Advanced Materials, 2016, 28(2): 270-275. |
| [28] |
鹿钦礼, 李亮, 刘金亮, 等. 微生物燃料电池的应用研究进展[J]. 环境工程, 2019, 37(8): 95-100. LU Qin-li, LI Liang, LIU Jin-liang, et al. Research progress in application of microbial fuel cells[J]. Environmental Engineering, 2019, 37(8): 95-100. |
| [29] |
Mayer F, Stockl M, Krieg T, et al. Adsorption of Shewanella oneidensis MR-1 to the electrode material activated carbon fabric[J]. Journal of Chemical Technology Biotechnology, 2018, 93: 3000-3010. |
| [30] |
Wen Q, Kong F Y, Zheng H T, et al. Simultaneous processes of electricity generation and ceftriaxone sodium degradation in an air-cathode single chamber microbial fuel cell[J]. Journal of Power Sources, 2011, 196(5): 2567-2572. |
| [31] |
Wen Q, Kong F Y, Zheng H T, et al. Electricity generation from synthetic penicillin wastewater in an air-cathode single chamber microbial fuel cell[J]. Chemical Engineering Journal, 2011, 168(2): 572-576. |
| [32] |
Yan W F, Xiao Y, Yan W D, et al. The effect of bioelectrochemical systems on antibiotics removal and antibiotic resistance genes:A review[J]. Chemical Engineering Journal, 2019, 358(1): 1421-1437. |
| [33] |
Yang W L, Watson V J, Logan B E. Substantial humic acid adsorption to activated carbon air cathodes produces a small reduction in catalytic activity[J]. Environmental Science & Technology, 2016, 50(16): 8904-8909. |
| [34] |
李丽, 檀文炳, 王国安, 等. 腐殖质电子传递机制及其环境效应研究进展[J]. 环境化学, 2016, 35(2): 254-266. LI Li, TAN Wen-bing, WANG Guo-an, et al. Electron transfer mechanisms of humic substances and their environmental implications:A review[J]. Environmental Chemistry, 2016, 35(2): 254-266. |
| [35] |
Huang B, Lai C C, Dai H, et al. Microbially reduced humic acid promotes the anaerobic photodegradation of 17α-ethinylestradiol[J]. Ecotoxicology and Environmental Safety, 2019, 171: 313-320. |
 2020, Vol. 39
2020, Vol. 39



