2. 浙江省农业科学院植物保护与微生物研究所, 杭州 310021
2. Institute of Plant Protection and Microbiology, Zhejiang Academy of Agriculture Science, Hangzhou 310021, China
随着我国生猪养殖规模不断扩大,养殖过程中产生的大量粪便和污水对环境造成了严重污染。作为一种将生猪养殖与发酵床分开的绿色生态养殖技术,异位发酵床技术能从源头上实现粪便和污水的零排放,极大降低对环境的污染[1]。但在实际生产应用过程中,砻糠、木屑等常规垫料原材料的需求量巨大但又地域分布不均,导致经济成本较大[2]。
作为农业大国,我国每年产生大量的秸秆农业废弃物;在我国广大的农村地区,秸秆的传统处理方法是在田间随意堆放或直接燃烧,这不仅造成了环境污染,而且导致秸秆中营养成分的损失[3]。若以农业秸秆作为垫料进行粪污的异位发酵床处理[4],并通过好氧高温发酵腐熟形成生物肥料,既可以实现粪尿和秸秆无害化处理和资源化利用,又能降低发酵床的成本。
垫料中的微生物群落对于发酵床的发酵进程起到决定性作用,是发酵床的研究重点。赵国华等[5]利用传统的分离培养法研究了发酵床垫料中的微生物群落多样性。但垫料中可培养微生物不到1%,传统的微生物培养技术难以了解发酵进程中功能微生物的群落组成和演替。郑雪芳等[6]通过磷脂脂肪酸生物标记法研究生猪发酵床发现,发酵程度越深,垫料的微生物群落结构越稳定。随着高通量技术发展,其能够全面、快速地检测发酵进程中微生物群落结构变化并分析优势菌群的动态分布。陈倩倩等[7]基于宏基因组方法分析出夏季发酵床细菌群落结构比冬季更加丰富。宦海琳等[8]发现,随着养殖时间的延长垫料中硝态氮的含量显著增加,同时功能微生物丰度显著降低。发酵床垫料微生物的研究多侧重于不同发酵阶段的微生物演替,而关于不同秸秆垫料微生物群落及优势菌群的动态却少有研究。本研究以不同的秸秆垫料异位发酵床为研究对象,通过高通量测序技术研究发酵进程中微生物菌群的丰度和优势菌群变化,结合垫料理化指标分析,为探索发酵床秸秆垫料合理组合和垫料微生物的演替规律提供理论基础。
1 材料与方法 1.1 试验材料与设计垫料组成成分:木屑、砻糠(稻壳)、油菜秸秆和水稻秸秆粉碎成0.5~2 cm小段。发酵床菌剂:本实验室自研发菌剂[9];试验用猪粪取自浙江省农业科学院猪场。本研究将粉碎后的垫料成分按油菜秸秆或水稻秸秆:木屑:砻糠=2.5:3:4.5的体积比混合成体积为3 L的垫料组合,将其添加到发酵容器中(直径15 cm,高20 cm,体积3.50 L),并设置木屑:砻糠=4:6的体积比例垫料作为对照,每个组合设置3个重复,试验组别设置见表 1。粪污添加量按实际生产中异位发酵床消纳量成比例缩小[9],在第0、3、6、9、12 d添加200 g猪粪污并手动搅拌均匀,并维持垫料的初始含水率为50%~60%。
|
|
表 1 试验组别设置 Table 1 Experimental group setting |
每日定时测定发酵床中心处温度。在发酵过程的12 d中,分别在第0、3、6、9 d和12 d对3个重复组采样并-20 ℃保存,采样前要将垫料搅拌均匀。通过文献[10-11]中的方法测定pH值、水分含量(MC)、EC值。铵态氮采用水杨酸-次氯酸盐分光光度法测定[12],硝态氮采用氯化钾浸提-紫外分光光度法测定[13]。有机质碳用重铬酸钾容量法测定[14],总氮含量通过AJ分析仪MULTIN/C3100测定。
1.3 细菌群落总DNA的提取及高通量测序取低温冷藏的样品,使用QIEGEN DNeasy PowerSoil kit试剂盒提取DNA,并通过0.8%琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量。采用原核生物16S rRNA基因V3-V4区引物338F(5′ -ACT CCT ACG GGA GGC AGC AG-3′)和806R(5′ -GGA CTA CHV GGG TWT CTA AT-3′)对各垫料样本总DNA进行PCR扩增,PCR反应设置3个平行。目的条带大小正确,则进行上机测序。测序系统为Illumina MiSeq平台,测序公司为上海派森诺生物科技有限公司。
1.4 生物信息学数据分析通过高通量测序后,利用FLASH软件(v1.2.7)对原始序列进行过滤组合。随后,通过QIIME软件(v1.8.0)调用USEARCH(v5.2.236)检查并剔除嵌合体序列。使用QIIME软件,调用UCLUST这一序列比对工具对前述获得的序列按97%的序列相似度进行归并和OTU划分,对于每个OTU的代表序列,在QIIME软件中使用默认参数,通过将OTU代表序列与对应数据库的模板序列相比对,获取每个OTU所对应的分类学信息。使用QIIME软件分别对每个样本计算ACE、Chao1、Shannon和Simpson等多样性指数。使用QIIME软件,获取各样本在门、纲、目、科、属分类水平上的组成和丰度分布表,并通过柱状图呈现分析结果。16S功能预测是通过PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)将现有的16S rRNA基因测序数据与KEGG(http://www.genome.jp/kegg/pathway.html)、COG(https://www.ncbi.nlm.nih.gov/COG/)和Rfam(http://rfam.xfam.org)功能谱数据库相对比,从而实现对微生物群落代谢功能的预测。通过使用Canoco for Windows(版本4.5)的冗余分析(RDA)技术分析了细菌群落与环境参数之间的关系。
1.5 试验数据处理使用WPS 2019进行数据的整理作图,SPSS 21.0进行方差分析,分析方法为Tukey多重比较法。
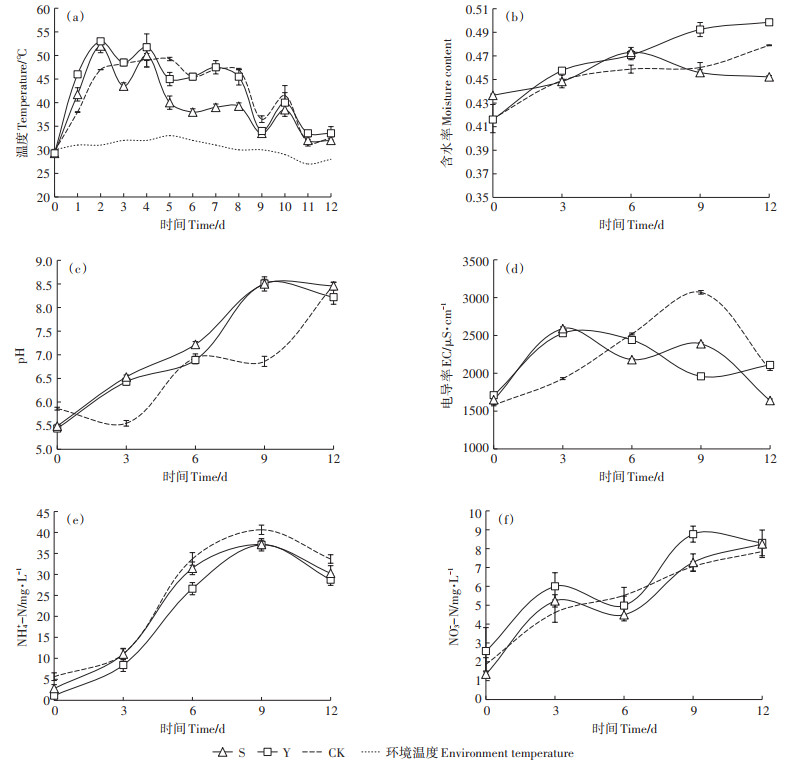
2 结果与分析 2.1 异位发酵床进程中垫料理化指标变化图 1(a)为不同垫料组合异位发酵床发酵12 d进程中垫料的温度变化。在发酵初期,Y组和S组相比CK升温更加迅速且升温更高,第2 d Y组就达到最高温度53 ℃;从第2 d开始进入嗜温期,Y组和CK组在40~55 ℃的嗜热阶段均维持了8 d,且Y组最高温度达53 ℃,且有2 d在50 ℃以上,而CK组温度一直在50 ℃以下;从第9 d开始,3组温度逐渐下降到环境温度。综上研究发现,Y组升温更加迅速,最高温度更高,嗜温期更长。图 1(b)为3组0~12 d发酵进程中垫料水分含量变化。CK、Y、S 3组垫料初始含水率分别为41.71%、41.63%和43.69%,随着发酵的进行CK组和Y组垫料含水率不断上升,而S组先上升,到第6 d后有所下降,到第12 d时,CK、Y、S组垫料含水率分别为47.94%、49.90%、45.25%。
|
图 1 不同垫料组合异位发酵床发酵进程中垫料温度、水分、pH、EC及铵态氮、硝态氮含量的变化 Figure 1 The changes of temperature, moisture, pH, electrical conductivity and the content of ammonium nitrogen and nitrate nitrogen in the fermentation process of different litter combination EFSs |
图 1(c)显示在发酵初期,3组垫料的pH都呈弱酸性,随着发酵的进行3组的pH不断升高,S组pH上升速率最快,Y组次之,CK组最慢。发酵到第12 d时,CK组的pH为8.47,Y组pH为8.22,S组pH为8.46。本研究进程中,3组pH都保持在5.5~8.5这一范围内。电导率(EC)可以反映垫料中可溶性总盐的含量,如图 1(d)所示,垫料中的EC值先有所上升然后缓慢下降,发酵进行到第12 d时CK组EC值为2050 μS·cm-1,Y组EC值为2110 μS·cm-1,S组EC值为1640 μS·cm-1。添加水稻秸秆、油菜秸秆的垫料组合EC值一直保持较低水平。
如图 1(e)所示,随着发酵的进行,垫料中铵态氮含量不断增加,在第9 d到达最高值后开始下降;CK组铵态氮含量最高达40.64 mg·L-1,Y组最高36.91 mg·L-1,S组最高为37.13 mg·L-1;第12 d 3组铵态氮值分别下降到33.68、28.75、30.27 mg·L-1。从图 1(f)中发现发酵开始垫料中硝态氮含量在不断升高,但升高速率较缓慢并在第6 d有下降的趋势;第12 d CK、Y、S组硝态氮含量分别达到7.84、8.30、8.25 mg·L-1,其中Y组硝态氮含量最高,CK组硝态氮含量最低。
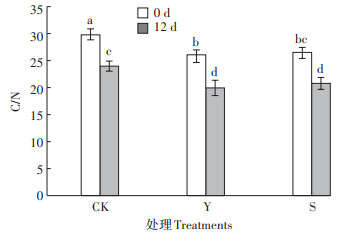
微生物活动必须有碳源和氮源,C/N是发酵进程中重要的影响因素。如图 2所示,不同垫料组合发酵床的C/N比值随着发酵的进行呈下降的趋势。第0 d时CK、Y、S组C/N分别为29.76、26.07、26.52,第12 d时C / N分别为23.97、19.94、20.77,分别降低了19.45%、23.50%、21.65%。
|
图中不同小写字母表示在0.05水平上差异显著 Different lowercase letters in the figure indicate significant differences at 0.05 level 图 2 不同垫料组合异位发酵床发酵进程的C/N变化 Figure 2 C/N changes during fermentation of different litter combination EFSs |
为研究不同垫料组合异位发酵床中不同时期微生物群落组成变化和相互之间的差异,对获得的垫料微生物序列按97%的序列相似度进行归并和OTU划分,并选取每个OTU中丰度最高的序列作为该OTU的代表序列。图 3为不同垫料组合异位发酵床不同时期OTU划分和分类地位鉴定统计结果,从图中可以明显看出3种垫料组合中微生物的OTU数量在不同分类水平上的差异。CK组不同时期的OTU数量要明显低于S组和Y组,其中Y12的OTU数量最高,达到7409。与第3 d相比,第12 d S组的OTU数量减少了566,CK组减少了1042,而Y组增加了444。
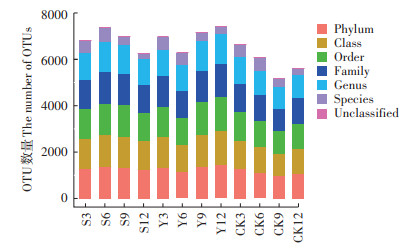
|
图中3、6、9、12表示发酵第3、6、9、12 d。下同 3, 6, 9 and 12 in the figure are the 3, 6, 9 and 12 days of fermentation. The same below 图 3 不同垫料组合异位发酵床不同时期OTU划分和分类地位鉴定结果统计图 Figure 3 Statistical diagram of OTU classification and classification status identification results of different litter combination EFSs in different periods |
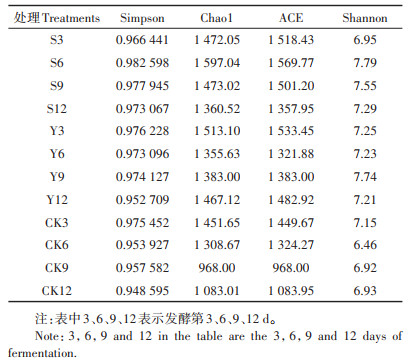
Chao1或ACE指数越大,表明群落的丰富度越高。Simpson或Shannon指数值越高,表明群落的多样性越高。Simpson多样性指数是评价群落多样性的常用指数之一。一般而言,Shannon指数对群落的丰富度以及稀有OTU更敏感,而Simpson指数对均匀度和群落中的优势OTU更敏感。3种不同垫料组合中菌群微生物多样性分析结果见表 2。不同垫料组合第12 d的Chao1或ACE指数与发酵初期第3 d相比都在降低,其中CK组Chao1和ACE指数分别降低了25.39%和25.23%,Y组分别降低了3.04%、3.30%,S组分别降低了7.58%、10.57%。从表中可以发现,在整个发酵进程中,3组的Simpson指数在0.948 595~0.982 598之间,第6、9、12 d的Shannon指数CK组要明显低于S组和Y组。
|
|
表 2 菌群微生物多样性指数 Table 2 Microbial diversity index |
根据OTU划分和分类地位鉴定结果,可以获得每个样本在各分类水平的具体组成。选取分类水平上丰度排名前21位的门和属绘制丰度柱形图。如图 4(a)所示,垫料主要菌群由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)等组成。其中,变形菌门、厚壁菌门、拟杆菌门合计占总丰度的96.5%,占据绝对的优势地位。变形菌门的相对丰度在发酵进程中呈下降的趋势,其中CK组降低了75%,S组降低了38%,Y组降低了23.2%。

|
图 4 在发酵进程中不同垫料组合异位发酵床中细菌群落组成在门水平(a)和属水平(b)的分类群的相对丰度 Figure 4 Relative abundance of the taxonomic group at the gate level(a)and genus level (b)of the different litter combination EFSs in the fermentation process |
从图 4(b)中看出,在属的分类水平上不同发酵时期优势菌群在不断变化。嗜温期主要的属有芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、鞘铵醇杆菌属(Sphingobacterium)、假单胞菌属(Pseudomonas)等。其中,CK组芽孢杆菌属相对丰度最高为36.8%,乳杆菌属最高为12.9%,假单胞菌属最高为3.8%;S组芽孢杆菌属相对丰度最高为16.9%,乳杆菌属最高为8.1%,假单胞菌属最高为9.8%;Y组芽孢杆菌属相对丰度最高为40.5%,乳杆菌属最高为6.5%,假单胞菌属最高为6.1%。从图 4(b)可发现,随着发酵的不断深入,能引起细菌感染的菌属的相对丰度大幅降低。从发酵第3 d到第12 d,CK组中克雷伯氏菌属(Klebsiella)由28.7%下降到0.4%,肠杆菌属(Enterobacter)由40.8%下降到0,大肠杆菌属-志贺氏菌属(Escherichia-Shigella)由7.9%下降到0.1%;而S组克雷伯氏菌属由13.6%下降到0.2%,肠杆菌属由12.1%下降到0.4%,大肠杆菌属-志贺氏菌属由4%下降到0.1%;Y组克雷伯氏菌属由36.9%下降到0.7%,肠杆菌属由29.3%下降到1.7%,大肠杆菌属-志贺氏菌属由9.3%下降到0.3%。
2.4 异位发酵床功能微生物代谢相关基因的差异根据PICRUSt预测3种不同垫料组合异位发酵床主要有机物降解途径,分析细菌群落对脂类、氨基酸和碳水化合物代谢的相关基因拷贝数的差异性。在整个发酵进程中,3组中不同的代谢相关基因变化相似,随着发酵的进行,脂类、氨基酸和碳水化合物代谢的相关基因拷贝数不断减少呈下降趋势(图 5);从发酵第3 d到第12 d,脂类、氨基酸和碳水化合物代谢的相关基因拷贝数CK组减少了65.82%、69.95%、76.73%,Y组减少了42.88%、45.52%、60.31%,S组减少了39.87%、41.73%、57.72%。第3 d脂类、氨基酸和碳水化合物代谢的相关基因拷贝数最高,其中CK组分别为2 099 003、6 235 987、7 890 496,Y组分别为2 108 131、6 248 879、8 032 987,S组分别为1 950 342、5 776 472、7 447 289;3组不同垫料组相比,Y组3种代谢相关基因拷贝数最高,相关有机物代谢最为活跃。
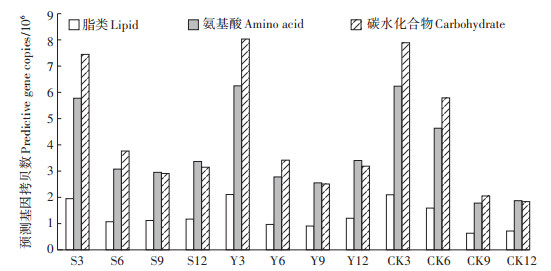
|
图 5 不同垫料组合异位发酵床脂类、氨基酸和碳水化合物代谢的相关基因差异 Figure 5 Gene differentials related to lipid, ammonium acid and carbohydrate metabolism in different litter combinations in EFSs |
本试验通过冗余分析来分析细菌群落与环境因素之间的相关性。冗余分析(图 6)中带有箭头的蓝色线条表示不同的环境因子,线条越长对样本微生物群落的影响越大。蓝色线条与红色小三角形所代表的不同微生物物种成锐角表示这些物种与环境因子呈正相关,成钝角表示负相关。如图 6所示,pH、MC和NH4+-N浓度是影响微生物群落组成的主要因素。结合图 4(b)的结果,芽孢杆菌属和乳杆菌属与EC值有较强的正相关性;鞘铵醇杆菌属、假单胞菌属等与pH、MC和NH4+-N浓度呈现较强的正相关性。另外,处在第四象限的垫料中能引起细菌感染的克雷伯氏菌属、肠杆菌属、大肠杆菌属-志贺氏菌属与GI值(种子发芽指数)正相关,与pH、MC和NH4+-N浓度负相关。
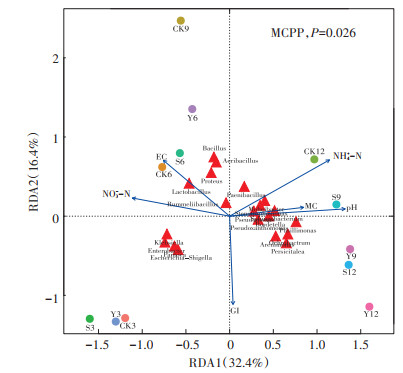
|
环境因素为蓝色线条,细菌群落为红色三角形,样本为圆圈 Environmental factors:blue lines; Bacterial communities:red triangles; Samples:circles 图 6 微生物群落与环境因素之间的关联性分析 Figure 6 Correlation analysis between microbial community and environmental factors |
异位发酵床发酵是根据微生态理论和生物发酵理论,在猪舍外利用稻壳木屑等建立一定厚度的发酵床,猪所排出的粪尿在发酵床上经过特殊的微生物菌群发酵迅速降解消化,从而实现粪尿完全降解的无污染和零排放养殖的一种技术,是通过微生物的代谢作用将垫料和粪污中的有机质不断消化腐熟的过程。发酵床垫料为微生物提供碳源、氮源,保持孔隙率,对发酵进程中温度、水分含量、pH等理化因素都有显著影响。温度是评价发酵效果的关键指标,能够准确反映发酵床的发酵效率和微生物群落活性[15-16]。通过与砻糠和木屑组成的传统垫料组合进行对比,发现添加水稻秸秆和油菜秸秆的垫料组合前期升温迅速,这可能是由易降解的有机化合物被发酵床微生物群落迅速降解导致的[17]。3组处理的嗜温期都保持在40~55 ℃之间,符合前人研究中得出粪肥发酵的最佳温度为40~65 ℃[18]这一结论。在整个发酵进程中,Y组升温更快,且高温维持期久,这可能与不同的垫料组成造成发酵床的曝气量、保水性、营养组成不同有关。水分含量是发酵进程中的重要参数。含水量过高会导致垫料中的气体扩散速率下降,使得氧气含量无法满足微生物的代谢需求[19]。整个发酵过程中,不同垫料组合的发酵床的水分含量一直维持在40%~50%。发酵前期床体水分含量较低,通过每隔3 d添加猪粪尿补充水分使得垫料中水分有所上升,促进了发酵的进行。垫料中的pH能够影响发酵进程中的微生物活性[20]。3组垫料组合的pH变化趋势相似,都是从弱酸性不断升高为弱碱性,但添加油菜秸秆和水稻秸秆组合的pH上升速率更快。发酵前期垫料pH呈弱酸性可能是由于发酵床中含有大量的有机酸,而微生物分解速率还较低。添加油菜秸秆和水稻秸秆组合相比CK组结构更加疏松、曝气率更高,更高的氧气含量使好氧微生物分解有机酸的速率更快。有研究指出5.5~8.5是发酵的最佳pH范围[21-22],此范围内更有利于微生物的代谢活动。EC值表示发酵床的总盐含量,发酵进程中随着微生物群落代谢活动增强,分解有机质并产生大量的盐离子,如铵离子和磷酸盐导致EC值增加[23];而EC值的减少可能是由于发酵进程中氨的挥发和矿物盐的沉淀[24]。EC值过高的垫料不适于植物的生长,无法作为成熟的有机肥,Y、S组垫料EC值一直保持较低水平。发酵进程中随着温度不断升高进入嗜温期,此时垫料中占据主导作用的氨化作用将有机氮转化为铵态氮。高温会抑制硝化细菌进行硝化作用产生硝态氮[25],导致硝态氮增加缓慢且含量不高。在整个发酵进程中,Y组铵态氮含量最低,硝态氮含量最高,说明Y组能够更多地保留氮元素,使得粪污发酵腐熟形成有机肥。在发酵床中,C作为微生物群落的能量来源,N作为组成细菌结构必要元素,直接影响微生物生长繁殖。有研究指出调整垫料C/N为25~30:1,能保持微生物最大生物活性,有利于发酵进程的加快[24, 26]。发酵进程中,微生物活动不断增强使垫料中的有机质不断分解导致C/N不断降低,这与张苗等[27]在发酵床熟化垫料肥料化发酵特性的研究中得到的结果相似。水稻秸秆垫料组合和油菜秸秆垫料组合与传统的垫料组合理化指标变化相似,油菜垫料组合更有利于形成有机肥。
垫料组成在影响发酵理化指标的同时影响微生物群落的活性。通过分析不同垫料组合发酵进程中微生物的OUT变化和菌群微生物多样性,发现添加水稻秸秆和油菜秸秆的垫料组合中微生物丰度和多样性要高于对照组合,而随着发酵的进行,各组处理微生物群落的丰富度逐渐降低,这个结果与黄雅楠等[28]研究结果相似。3组垫料组合异位发酵床的细菌群落在门和属的分类水平上组成相似但含量变化差别明显。在门的分类水平上,变形菌门、厚壁菌门、拟杆菌门3个门占据着绝对的优势地位,这也与之前的一些研究结果相似[29-30],养猪发酵床垫料菌群主要是由变形菌门、厚壁菌门、放线菌门(Actinobacteria)、拟杆菌门、芽单孢菌门(Gemmatimondetes)、绿弯菌门(Cholroflexi)等组成。在属水平上,芽孢杆菌属、乳杆菌属、鞘铵醇杆菌属、假单胞菌属等占据嗜温期的主导地位。芽孢杆菌属、假单胞菌属微生物具有耐热性,是常见的从环境中分离得到的木质纤维素降解微生物[31];水稻、油菜秸秆中的木质纤维素被纤维素降解菌群利用分解,从而释放大量的热量使发酵床温度升高。乳杆菌属微生物能够利用垫料中木质纤维素,并分解粪便中的氨气、硫化氢等有毒臭味气体,且乳杆菌发酵产生的乳酸具有较强的杀菌能力,有显著抑制有害微生物活动的作用[32-33]。随着发酵的进行,垫料中能引起细菌感染的克雷伯氏菌属、肠杆菌属、大肠杆菌属-志贺氏菌属的相对丰度大幅减少。这与陈倩倩等[34]研究结果相似,他们通过检测不同等级的发酵床垫料中的致病菌群发现随着垫料的逐步腐熟,大肠杆菌、志贺氏菌、魏氏梭菌和副猪嗜血杆菌等致病菌含量不断降低。这表明秸秆垫料异位发酵床发酵过程中微生物群落能快速降解猪粪尿中有机质,并抑制有害微生物的活动。
3组垫料组合的异位发酵床中发酵前期脂类、氨基酸和碳水化合物代谢的相关基因拷贝数最高,可能与发酵前期温度较高有关,较高温度使嗜热微生物相关基因代谢活动更加活跃。Song等[35]研究了微生物对食物垃圾堆肥进程中碳水化合物代谢的影响,结果发现碳水化合物的降解主要发生在嗜热阶段。S组与CK组的脂类、氨基酸和碳水化合物代谢的相关基因丰度相似,而Y组脂类、氨基酸和碳水化合物代谢的相关基因丰度比CK更高,代谢更加活跃。Zhou等[36]研究了生物炭影响稻草堆肥进程中微生物群落的演替和代谢功能,发现生物炭的添加显著增加了与氨基酸代谢和碳水化合物代谢相关的序列的丰度,并提高了堆肥产品的成熟度和肥力。上述结果说明了水稻秸秆和油菜秸秆部分替换传统发酵床垫料,加快了微生物的代谢,更有利于异位发酵床垫料的腐熟。异位发酵床好氧发酵过程中,涉及一系列细菌群落和环境因素的变化,环境因素是微生物群落变化的主要驱动力[37]。此次试验中,pH、MC和NH4+-N浓度是影响微生物群落组成的主要因素,这与一些研究结果相似,通常温度、pH、MC和NH4+-N浓度被认为是影响发酵床微生物群落的主要环境指标[38]。
4 结论(1)油菜秸秆垫料组前期升温速率更快、发酵高温期相同并且最高温度更高,说明油菜秸秆垫料组更有利于发酵床的高温运行。
(2)油菜秸秆垫料组能够更多地保留氮元素,更有利于粪污发酵腐熟形成有机肥。
(3)不同垫料组合的主要微生物群落组成及演替趋势相似,但秸秆垫料组的微生物丰富度和多样性均高于对照组,且油菜秸秆组脂类、氨基酸和碳水化合物相关代谢更加活跃。
| [1] |
胡锦艳, 刘春雪, 刘小红, 等. 发酵床养猪技术的现状、调研与分析[J]. 家畜生态学报, 2015, 36(4): 74-81. HU Jin-yan, LIU Chun-xue, LIU Xiao-hong, et al. Investigation and analysis of fermentation bed application in pig raising in China[J]. Journal of Domestic Animal Ecology, 2015, 36(4): 74-81. |
| [2] |
蓝江林, 刘波, 唐建阳, 等. 基于微生物发酵床养猪模式的生态安全探讨[J]. 中国农学通报, 2010, 26(19): 324-326. LAN Jiang-lin, LIU Bo, TANG Jian-yang, et al. Discussion on ecological security of microbial fermentation bed in pig farming[J]. Chinese Agricultural Science Bulletin, 2010, 26(19): 324-326. |
| [3] |
张玉凤, 田慎重, 边文范, 等. 牛粪和玉米秸秆混合堆肥好氧发酵菌剂筛选[J]. 中国土壤与肥料, 2019, 22(3): 172-178. ZHANG Yu-feng, TIAN Shen-zhong, BIAN Wen-fan, et al. Screening of aerobic fermentation microbial agents mixed with cow dung and corn straw[J]. Soil and Fertilizer Sciences in China, 2019, 22(3): 172-178. |
| [4] |
Zang X, Liu M, Fan Y, et al. The structural and functional contributions of β-glucosidase-producing microbial communities to cellulose degradation in composting[J]. Biotechnology for Biofuels, 2018, 11(2): 51. |
| [5] |
赵国华, 方雅恒, 陈贵. 生物发酵床养猪垫料中营养成分和微生物群落研究[J]. 安徽农业科学, 2015, 43(8): 98-101. ZHAO Guo-hua, FANG Ya-heng, CHEN Gui. Study on the nutritional components and microbial community in the beddings of pig raising by bio-fermentation bed[J]. Journal of Anhui Agricultural Sciences, 2015, 43(8): 98-101. |
| [6] |
郑雪芳, 刘波, 朱育菁, 等. 养猪发酵床不同发酵程度垫料微生物群落结构特征的PLFA分析[J]. 中国生态农业学报, 2019, 27(1): 42-49. ZHENG Xue-fang, LIU Bo, ZHU Yu-jing, et al. Analysis of microbial community structure of litter with different fermentation levels in pigon-litter system using phospholipid fatty acid biomarkers[J]. Chinese Journal of Eco-Agriculture, 2019, 27(1): 42-49. |
| [7] |
陈倩倩, 刘波, 王阶平, 等. 基于宏基因组方法分析养猪发酵床微生物组季节性变化[J]. 农业环境科学学报, 2018, 37(6): 1240-1247. CHEN Qian-qian, LIU Bo, WANG Jie-ping, et al. Seasonal variation, based on metagenomic analysis, in the bacterial community of a microbial fermentation-bed used for pig-raising[J]. Journal of Agro-Environment Science, 2018, 37(6): 1240-1247. |
| [8] |
宦海琳, 顾洪如, 张霞, 等. 养猪发酵床垫料不同时期碳氮和微生物群落结构变化研究[J]. 农业工程学报, 2018, 34(增刊1): 27-34. HUAN Hai-lin, GU Hong-ru, ZHANG Xia, et al. Change research of carbon, nitrogen and microbial community structure in different periods of fermentation bed for pig[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(Suppl 1): 27-34. |
| [9] |
Shen Q, Sun H, Yao X H, et al. A comparative study of pig manure with different waste straws in an ectopic fermentation system with thermophilic bacteria during the aerobic process:Performance and microbial community dynamics[J]. Bioresource Technology, 2019, 281(6): 202-208. |
| [10] |
Sun Z Y, Zhang J, Zhong X Z, et al. Production of nitrate-rich compost from the solid fraction of dairy manure by a lab-scale composting system[J]. Waste Management, 2016, 51(5): 55-64. |
| [11] |
董立婷, 朱昌雄, 张丽, 等. 微生物异位发酵床技术在生猪养殖废弃物处理中的应用研究[J]. 农业资源与环境学报, 2016, 33(6): 540-546. DONG Li-ting, ZHU Chang-xiong, ZHANG Li, et al. Research and application of ectopic microbial fermentation system in processing piggery waste[J]. Journal of Agricultural Resources and Environment, 2016, 33(6): 540-546. |
| [12] |
卢玉棋. 水杨酸盐-次氯酸盐分光光度法测定水中氨氮[J]. 环境与健康杂志, 1999, 16(5): 296-298. LU Yu-qi. Determination of ammonia nitrogen in water by salicylatehitrite spectrophotometry[J]. Journal of Environment and Health, 1999, 16(5): 296-298. |
| [13] |
Zhang L, Sun X. Changes in physical chemical and microbiological properties during the two-stage co-composting of green waste with spent mushroom compost and biochar[J]. Bioresource Technology, 2014, 171(1): 274. |
| [14] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000: 30-33. BAO Shi-dan. Soil agrochemical analysis[M]. 3th Edition. Beijing: China Agriculture Press, 2000: 30-33. |
| [15] |
Chen R, Wang Y, Wang W, et al. N2O emissions and nitrogen transformation during windrow composting of diary manure[J]. Journal of Environmental Management, 2015, 160(6): 121-127. |
| [16] |
Rich N, Bharti A, Kumar S. Effect of bulking agents and cow dung as inoculant on vegetable waste compost quality[J]. Bioresource Technology, 2018, 252(3): 83-90. |
| [17] |
Rashad F M, Saleh W D, Moselhy M A. Bioconversion of rice straw and certain agro-industrial wastes to amendments for organic farming systems:1. Composting, quality, stability and maturity indices[J]. Bioresource Technology, 2010, 101(15): 5952-5960. |
| [18] |
Rich N, Bharti A. Assessment of different types of in-vessel composters and its effect on stabilization of MSW compost[J]. International Journal of Engineering Research & Technology, 2015, 2(3): 1-6. |
| [19] |
Mohammad M, Alam M, Kabbashi N A, et al. Effective composting of oil palm industrial waste by filamentous fungi:A review[J]. Resources Conservation & Recycling, 2012, 58(9): 69-78. |
| [20] |
Chan M, Selvam A, Wong J W C. Reducing nitrogen loss and salinity during'struvite'food waste composting by zeolite amendment[J]. Bioresource Technology, 2016, 200(1): 838-844. |
| [21] |
Miller F C. Composting as a process based on the control of ecologically selective factors[J]. Soil Microbial Ecology, 1992, 21(7): 515-544. |
| [22] |
Zhang H, Li G, Gu J, et al. Influence of aeration on volatile sulfur compounds(VSCs)and NH3 emissions during aerobic composting of kitchen waste[J]. Waste Management, 2016, 58(7): 369-375. |
| [23] |
Smårs S, Gustafsson L, Beck-Friis B, et al. Improvement of the composting time for household waste during an initial low pH phase by mesophilic temperature control[J]. Bioresource Technology, 2002, 84(3): 237-241. |
| [24] |
Huang G F, Wong J W C, Wu Q T, et al. Effect of C/N on composting of pig manure with sawdust[J]. Waste Management, 2004, 24(8): 805-813. |
| [25] |
Pagans E, Barrena R, Font X, et al. Ammonia emissions from the composting of different organic wastes. Dependency on process temperature[J]. Chemosphere, 2006, 62(9): 1534-1542. |
| [26] |
沈琦, 叶世豪, 孙宏, 等. 畜禽异位发酵床中垫料和微生物的研究概述[J]. 浙江农业科学, 2019, 60(3): 476-479. SHEN Qi, YE Shi-hao, SUN Hong, et al. Research progress of litters and functional microbes in ectopic fermentation system[J]. Journal of Zhejiang Agricultural Sciences, 2019, 60(3): 476-479. |
| [27] |
张苗, 刘丽珠, 严少华, 等. 发酵床熟化垫料肥料化发酵特性[J]. 江苏农业科学, 2017, 45(21): 297-301. ZHANG Miao, LIU Li-zhu, YAN Shao-hua, et al. Fermentation system matured litter fertilizer fermentation characteristics[J]. Jiangsu Agricultural Sciences, 2017, 45(21): 297-301. |
| [28] |
黄雅楠, 王晓慧, 曹琦, 等. 高通量测序技术分析猪粪堆肥进程中微生物群落结构变化[J]. 微生物学杂志, 2018, 38(5): 21-26. HUANG Ya-nan, WANG Xiao-hui, CAO Qi, et al. Analysis of microbial community changes in pig excrement during compost process based on high-throughput sequencing technology[J]. Journal of Microbiology, 2018, 38(5): 21-26. |
| [29] |
Antunes L P, Martins L F, Pereira R V, et al. Microbial community structure and dynamics in thermophilic composting viewed through metagenomics and metatranscriptomics[J]. Scientific Reports, 2016, 6(12): 38915. |
| [30] |
Wei H, Wang L, Hassan M, et al. Succession of the functional microbial communities and the metabolic functions in maize straw composting process[J]. Bioresource Technology, 2018, 256(5): 333-341. |
| [31] |
Guo Y P, Zhang G Q, Chen Q J, et al. Analysis on bacterial community structure in mushroom(Agaricus bisporus)compost using PCR-DGGE[J]. Agricultural Science & Technology, 2015, 20(8): 1778-1784. |
| [32] |
崔国艳.耐高温乳酸菌的选育及应用研究[D].西安: 西北大学, 2007. CUI Guo-yan. Breeding and application of high temperature-resistant lactic acid bacteria[D]. Xi′an: Northwest University, 2017. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1090880 |
| [33] |
Chen Q Q, Liu B, Wang J P, et al. Diversity and dynamics of the bacterial community involved in pig manure biodegradation in a microbial fermentation bed system[J]. Annals of Microbiology, 2017, 67(7): 491-500. |
| [34] |
陈倩倩, 刘波, 王阶平, 等. 微生物发酵床猪舍垫料主要病原菌空间分布的研究[J]. 家畜生态学报, 2016, 37(4): 68-73. CHEN Qian-qian, LIU Bo, WANG Jie-ping, et al. Spatial distribution of porcine pathogens in the microbial-fermentation bed of piggery[J]. Acta Ecologae Animalis Domastici, 2016, 37(4): 68-73. |
| [35] |
Song C H, Li M X, Qi H, et al. Impact of anti-acidification microbial consortium on carbohydrate metabolism of key microbes during food waste composting[J]. Bioresource Technology, 2018, 259(3): 1-9. |
| [36] |
Zhou G X, Xu X F, Qiu X W, et al. Biochar influences the succession of microbial communities and the metabolic functions during rice straw composting with pig manure[J]. Bioresource Technology, 2019, 272(1): 10-18. |
| [37] |
Maeda K, Hanajima D, Morioka R, et al. Characterization and spatial distribution of bacterial communities within passively aerated cattle manure composting piles[J]. Bioresource Technology, 2010, 101(24): 9631. |
| [38] |
Tanmoy K, Indira S, Ranjit K, et al. Composting of cow dung and crop residues using termite mounds as bulking agent[J]. Bioresource Technology, 2014, 169(10): 731-741. |
 2020, Vol. 39
2020, Vol. 39