2. 中国科学院大气物理研究所大气边界层物理和大气化学国家重点实验室, 北京 100029;
3. 中国科学院大学地球与行星科学学院, 北京 100049
2. State Key Laboratory of Atmospheric Boundary Layer Physics and Atmospheric Chemistry, Institute of Atmospheric Physics, Chinese Academy of Sciences, Beijing 100029, China;
3. College of Earth and Planetary Sciences, University of Chinese Academy of Sciences, Beijing 100049, China
植被覆盖度大于5%、灌木覆盖度小于40%,地被植物以草本或半灌木为主的土地称为草地,包括人工和天然草地[1]。我国人工草地面积仅为2.09 × 105 km2[2];天然草地则广泛分布于东北的西部、内蒙古、西北山地和青藏高原,依据气候带、植被型组和优势种,可划分为9类,即温性草原类、高寒草原类、温性荒漠类、高寒荒漠类、暖性灌草丛类、热性灌草丛类、低地草甸类、山地草甸类和高寒草甸类,及175个草地型[1],天然草地具有畜牧生产、水源涵养、多样性保护、侵蚀控制、养分贮存等多种生产和生态功能,并通过陆地-大气界面气体交换过程对气候变化产生各种正负反馈效应。
我国天然草地特别是草地土壤是陆地重要碳库[(25.4±1.5)×1015 g C][3],土地利用和管理方式改变(草地开垦、放牧强度和方式变化、“退牧还草”工程等)及气候变化(增温、降水变异和氮沉降增加)等因素叠加,使得草地表现为碳中性或弱碳汇[3-4]。草原类和荒漠类草地(天然草地中的面积占比过半)集中分布在年降水量小于500 mm的干旱、半干旱和半湿润区,该气候条件有利于大气甲烷(CH4)向土壤的传输和土壤好氧环境形成,因此,我国天然草地总体表现为大气CH4吸收汇[(465~488)×109 g CH4-C·a-1][5-6],约占全球草地CH4吸收量的近1/5[7]。相对于碳循环的气候效应,草地氮循环和氧化亚氮(N2O)排放的气候效应研究具有较大的不确定性,基于面积外推方法(即交换通量乘以草地面积)估算的我国天然草地N2O排放量变幅很大[(40~210)×109 g N2O-N·a-1][8-9];基于过程模型评估的排放量变幅收窄,DNDC[10]、DLEM[5]和DyN-LPJ模型[11]估算的我国天然草地N2O排放量分别为77×109、100×109、90×109 g N2O-N·a-1,约占全国自然土壤排放总量[(335~460)×109 g N2O-N·a-1[11]]的17%~30%,然而,3个模型研究所采用的草地面积差异巨大(分别为3.37×106、1.73×106~1.74×106、3.70× 106 km2),导致3个研究估算的天然草地N2O平均排放通量变动范围达到2倍以上(分别为0.23±0.04、0.58±0.06、0.24±0.23 kg N2O-N·hm-2·a-1)[5, 10-11],当前亟待对天然草地面积、N2O排放水平和排放总量进行准确定量。
除草地面积及其动态变化外,还有诸多因素影响草地N2O排放的准确定量。首先,草地排放通量测量使用了差异化的观测方法(如:不同的气相色谱载气设置方法)和方案(如:不同的观测周期和频率)[12],这会对草地排放水平和周年累积排放量的估算造成多大影响尚不清楚。其次,天然草地在冬春转换冻融期可能发生脉冲式排放并主导全年排放水平,这种脉冲排放的触发机制和主导微生物过程尚待明确,冻融过程是否广泛促进草地N2O排放尚存在争议[13-14]。再次,放牧过程对草地区域N2O排放的影响是多方面的,以往都侧重于对单个排放源(如草地、粪尿斑块和家畜圈舍)的研究[15-16],缺乏对整个放牧系统排放总量的评估。最后,未来气候变化和人类活动将如何协同影响草地氮素循环和N2O排放过程尚未明确。本文就以上几个方面对草地N2O排放研究的潜在影响进行了初步分析。
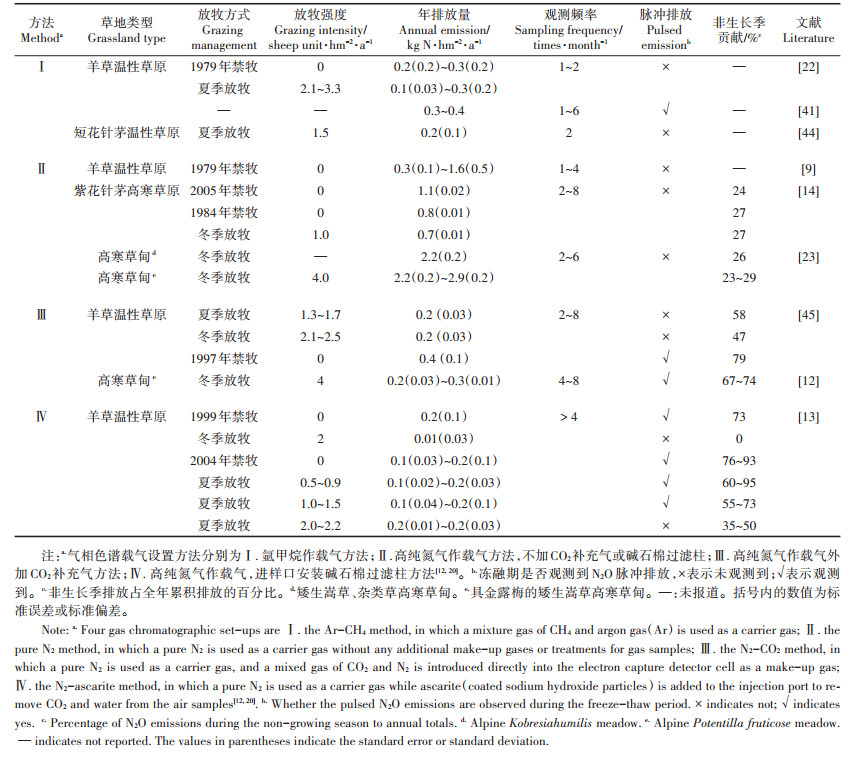
1 交换通量度量方法影响度量陆地-大气界面气体交换通量常用方法有密闭箱法、涡动相关法和土壤浓度梯度法,草地N2O排放通量大多低于现有涡动相关技术通量检测下限[17],浓度梯度法所需的土壤气体传输参数难以原位测量且时空变异巨大[18],因此,密闭箱法如静态暗箱采样-气相色谱分析方法成为我国及全球最普遍使用的草地温室气体交换通量度量方法,其原理是采用气相色谱分析测定静态暗箱内温室气体浓度随罩箱时间的变化速率,以此计算交换通量[19]。在我国开展的静态暗箱-气相色谱法度量草地N2O排放通量的研究中,包括了4种气相色谱载气设置方法:Ⅰ.氩甲烷作载气方法;Ⅱ.高纯氮气作载气方法,不加二氧化碳(CO2)补充气或碱石棉过滤柱;Ⅲ.高纯氮气作载气外加CO2补充气(CO2在高纯氮气中的体积百分比约为10%)方法;Ⅳ.高纯氮气作载气,进样口安装碱石棉过滤柱(去除气体样品中的CO2,避免其干扰电子捕获检测器测定N2O)方法(表 1)。因氩甲烷价格昂贵以及在偏远地区不易获得,第Ⅰ种方法应用较少;上世纪九十年代末至本世纪初的20年间,第Ⅱ种方法应用普遍;2010年后,第Ⅲ种方法逐步替代第Ⅱ种方法得到普及应用;第Ⅳ种方法截至目前只在一个研究区域开展应用(表 1)。在农田生态系统开展的气相色谱载气设置方法影响N2O排放通量监测的评估表明,相对于第Ⅰ、Ⅲ和Ⅳ种方法,第Ⅱ种方法因气相色谱的预分离柱不能完全分离和排除气体样品中的CO2,残留CO2干扰了电子捕获检测器对N2O浓度的测量,该方法显著高估农田N2O排放量,对于弱排放源生态系统(< 10 kg N2O-N·hm-2·a-1)不建议使用该分析方法[20]。我国天然草地正属于这类弱排放源生态系统(表 1),目前尚未开展第Ⅱ种方法获得N2O通量数据的可靠性评估,本文从两个角度研判该方法可能同样高估草地排放通量。
|
|
表 1 中国草地N2O排放通量周年观测 Table 1 Review of year-round N2O flux measurements over grasslands in China |
首先,现有的草地排放通量周年观测显示,第Ⅰ、Ⅲ和Ⅳ种方法获得的我国天然草地排放量为0.01~ 0.4 kg N2O-N·hm-2·a-1(均值±标准偏差:0.2±0.1 kg N·hm-2·a-1,表 1),这表明天然草地整体为较弱的N2O排放源。而基于第Ⅱ种方法获得的周年累积排放量变动范围很大(0.3~2.9 kg N2O-N·hm-2·a-1),已报道的极高排放量(>1.0 kg N2O-N·hm-2·a-1)唯一来自于该分析方法,个别研究报道的累积排放量甚至超过农田背景排放水平(全国平均为1.4 kg N2O-N·hm-2· a-1[21])。其次,在温性草原类和高寒草甸类草地,不同研究者应用前3种分析方法在同一样地开展了N2O排放通量监测,如:Du等[9]和Liu等[22]分别应用第Ⅱ和第Ⅰ种方法,在内蒙古锡林郭勒草原生态系统国家野外科学观测研究站的1979年禁牧羊草草原样地,开展了5周年(1995、1998以及2001—2003年)和2周年(2005—2006年)N2O排放通量监测,前者报道的年均排放量为0.7± 0.5 kg N2O-N·hm-2·a-1,个别年份高达1.6 ± 0.5 kg N2O-N·hm-2·a-1,后者报道的年排放量仅为0.2~0.3 kg N2O-N hm-2·a-1。再如:Du等[23]和Fu等[12]分别应用第Ⅱ和第Ⅲ种方法,在青海海北高寒草地生态系统国家野外科学观测研究站附近具金露梅的矮生嵩草高寒草甸,开展了4周年(2003—2006年)和3周年(2012—2015年)排放通量监测,前者在未观测到土壤冻融对N2O排放激发效应的条件下,报道的年排放量高达2.2~2.9 kg N2O-N·hm-2·a-1,后者即使观测到冬春转换期土壤冻融过程对N2O排放的激发效应,计算的年累积排放量也仅为0.2~0.3 kg N2O-N· hm-2·a-1。尽管不同分析方法测量结果的差异包含年代际变异,但天然草地这类典型“贫氮”自然生态系统排放量的年际变异通常难以达到数量级水平,此外,北半球不施肥自然草地极罕见第Ⅱ种方法如此高排放通量(> 2 kg N2O-N·hm-2·a-1)的报道[24]。未来应在草地生态系统开展这四种分析方法的直接对比观测研究,进一步明确不同分析方法获取数据的可比性及第Ⅱ种方法高估草地排放通量的程度,当前草地N2O排放清单估算应慎重使用第Ⅱ种方法获得的通量数据。
2 土壤冻融激发效应与非生长季高频观测的必要性土壤冻融交替指由于温度的季节变化和日变化,表层土壤反复冻结与融化的过程,从而影响土壤物理、化学、水文和生物特性及养分循环过程,是中高纬和高海拔地区的典型自然现象,主要发生在秋冬和冬春转换期。经过漫长冬季土壤的长期冻结,冬春转换期冻融交替对土壤属性和养分循环影响更加明显,一般以表层(5~10 cm)土壤温度划分冬春转换冻融期开始和结束的时间,表层土壤日最大温度大于0 ℃冻融期开始,表层土壤日最小温度大于0 ℃冻融期结束[12]。土壤水分冬季冻结和冬春转换期固液相态的交替变化,导致部分植物根系和土壤微生物的死亡、土壤团聚体结构和稳定性的破坏、土壤生物残体的碎化分解,进而加速有机质的矿化、增加土壤溶液可溶性养分浓度及元素损失风险如N2O排放[25]。
我国天然草地大都分布于中高纬度和高海拔地区,土壤冻融交替现象普遍存在,然而,对于土壤冻融交替是否会激发草地N2O排放存在不同观点[13-14],这主要有两方面原因:首先,我国北方天然草地冬春转换期土壤冻融交替过程大约持续近2个月的时间(3月初至4月底),但冻融期脉冲式N2O排放仅维持几天至2周时间[12-13, 26]。这主要是由于土壤冻融交替能够影响的土壤碳氮库的量是有限的,冻融期土壤碳氮转化过程底物主要来自于冬季长期冻结导致的少量养分释放,这部分速效养分快速消耗后,N2O排放峰随即消失。现有草地N2O排放通量周年观测研究不但稀少,且大部分研究非生长季的观测频率极低,如1次·月-1(表 1),如此低的观测频率极有可能错过和无法捕捉到短暂的、脉冲式排放峰。其次,冻融期草地土壤养分的释放、转化和损失过程受土壤冻结温度和时间、积雪厚度、土壤水分条件、土壤和植被类型、草地管理方式等多重因素影响,表观上脉冲式排放随机闪现,但表观现象背后的实质是缺乏对脉冲式N2O排放触发机制的深入研究。在羊草温性草原和具金露梅的矮生嵩草高寒草甸,有些样地和年份观测到脉冲排放,有些则没有,综合分析管理和环境信息就会发现放牧强度和冻融期前一个生长季的降水量分别是影响该类型草地N2O脉冲排放是否发生的先决条件[12-13],未来应加强冻融期脉冲排放触发机理和主导微生物过程的研究。
异养微生物的反硝化过程通常被认为是自然生态系统冻融期产生N2O的主导微生物过程[27],冬春转换期积雪融化叠加土壤冻融交替过程促进草地土壤微生物反硝化及其N2O排放的机制包括:(1)积雪融化增加土壤水分、降低土壤气体通透性,形成有利于微生物反硝化的厌氧环境;(2)土壤溶液中可溶性碳氮养分浓度增加促进反硝化异养微生物的活性;(3)N2O还原过程需要较高的活化能,其还原酶对低温的敏感性会增加冻融期反硝化过程N2O的产物比[22]。然而,在持续低土壤无机氮含量的天然草地,冻融期反硝化底物硝酸和亚硝酸盐的来源尚不清楚,最新的研究表明,土壤微生物反硝化过程虽主导放牧天然草地冬春转换冻融期N2O产生,但冻融期土壤微生物硝化速率的抬升为反硝化过程提供了关键的无机氮底物,硝化-反硝化耦合机制而非单一反硝化过程主导“贫氮”天然草地冻融期N2O脉冲排放[28]。
罗列一下中国草地N2O排放通量周年观测研究(表 1)就可以看出,凡是观测到冻融期脉冲排放峰的研究都在冬春转换期进行了加密观测,如至少每周观测1次;另外,一旦有脉冲排放峰,非生长季排放就在周年累积排放中占主导(> 50%),即使未观测到冻融期脉冲排放峰,长达7个月之久的非生长季对全年累积排放的贡献范围也在0~58%,其中多数的贡献率高于25%。因此,冬春转换期高频通量观测和非生长季连续观测对于脉冲排放触发机理研究以及周年累积排放的准确定量都是十分重要的。
3 评估放牧系统排放的重要性对于不施肥的天然草地,生物固氮和大气沉降是主要的外源氮素输入途径,放牧家畜采食、刈割、风蚀、径流损失和气态氮排放是主要的氮素损失途径,放牧天然草地特别是中重度放牧草地氮素损失远大于外源氮输入,成为氮素负盈余和“贫氮”生态系统(以持续低土壤无机氮含量为特征)[29]。放牧和刈割对植物氮素的移除、持续低土壤无机氮含量、植物与微生物养分竞争、干旱半干旱气候和漫长非生长季持续低温等因素都会限制微生物氮素转化及N2O产生,多数野外原位观测(高纯氮气作载气,不加CO2补充气或碱石棉过滤柱的分析方法Ⅱ结果除外,天然草地年累积排放0.01~0.43 kg N2O-N·hm-2·a-1,平均0.20± 0.09 kg N2O-N·hm-2·a-1,表 1)和过程模型评估(DNDC和DyN-LPJ模型:0.23 ± 0.04 kg N2O-N·hm-2·a-1和0.24 ± 0.23 kg N2O-N·hm-2·a-1 [10-11])均表明我国天然草地为弱N2O排放源。然而,放牧家畜摄食的植物氮素,少部分被家畜吸收,其余大部分以排泄物形式遗留在草地和圈舍,草地粪尿斑块和家畜圈舍贮存丰富的易分解营养物质又会促进草地和草地区域N2O的排放[15-16, 30-31]。
采用静态箱法度量放牧草地N2O排放应增加空间重复数量,确保能够反映放牧家畜粪尿斑块造成的排放通量空间异质性。此外,当评估草地N2O排放及放牧影响时,应考虑放牧系统特点,综合研究整个放牧系统和草地区域的排放量。以具金露梅的矮生嵩草高寒草甸放牧系统为例[30],为维持高的放牧强度,牧户要种植燕麦草为家畜提供冬季饲草,化肥施用使种植饲草农田成为N2O排放热点,其排放通量通常为草地排放通量的2~6倍。家畜圈舍积累大量粪尿排泄物,充足底物和厌氧环境使圈舍成为极强的排放点源,其排放通量较草地高两个数量级。圈舍积累的家畜粪便风干后,成为牧民做饭和取暖的燃料,粪便燃烧过程又会产生N2O。调查数据显示,具金露梅的矮生嵩草高寒草甸典型区域的平均放牧强度为4 sheep unit·hm-2·a-1,该区域内种植饲草的农田面积相当于草地面积的17%,家畜圈舍面积占草地面积的0.07%,以单位草地面积折算的高寒草甸、饲草农田、家畜圈舍和粪便燃烧排放通量分别为0.27 ± 0.06、0.17 ± 0.04、0.05 ± 0.01、0.004 ± 0.001 kg N2O - N · hm-2·a-1,4种排放源累加的排放量为0.50 ± 0.07 kg N2O-N·hm-2·a-1,接近高寒草甸这一单一排放源强度的2倍。以羊草温性草原为例[31],在较低的放牧强度水平下(1 sheep unit·hm-2·a-1),放牧羊草温性草原生长季N2O的排放量仅为0.03 ± 0.01 kg N2O-N·hm-2,若考虑其他放牧相关排放源如家畜圈舍和粪堆的排放,整个草地区域的排放量达到0.06 ± 0.02 kg N2ON·hm-2,亦为单一温性草原排放源强度的2倍,并且随着放牧强度的增加整个草地区域放牧相关排放源强度大幅增加。因此,仅考虑放牧对草地单一排放源影响显然具有局限性,会明显低估整个放牧系统和草地区域N2O排放。
4 气候变化影响气候变化和人类活动总是协同影响草地生态系统氮素循环,随着中国居民膳食中动物性食物消费逐年增加,牛羊畜产品产量需要维持不断增长的态势,可以预见相当长时间内我国天然草地仍将维持较高放牧强度及氮素负盈余和土壤“贫氮”的特征。“贫氮”天然草地土壤低无机氮底物可利用性限制了N2O产生能力,分析未来气候变化对草地N2O排放影响应首先考虑该气候因子的变化是否能够缓解土壤无机氮底物对N2O生产的限制性。
目前开展的草地气候变化情景模拟试验中,主要包括增温、大气氮沉降增加和降水量变化3种气候要素模拟。我国天然草地主要分布于中高纬度和高海拔地区,这些区域的增温幅度至少是全球平均增幅的2倍[32-33],土壤氮循环包含一系列温度敏感性过程如分解、矿化、硝化和反硝化等,草地区域的快速升温必将影响其土壤氮素转化和N2O释放。然而,增温对多年冻土和季节性冻土区草地土壤氮素转化和N2O排放的影响可能存在明显差异,对于多年冻土区,温度快速升高使多年冻土消融和活动层融深增加,原本封存在永冻层的有机氮加速向无机氮的分解矿化并促进N2O释放[34-35]。对于季节性冻土区,气温升高不会改变生长季植物与微生物间养分竞争关系及土壤无机氮底物限制N2O产生的基本特征,但是,非生长季温度增加、季节性冻土冻结深度和冻结时间明显减少[36],可能降低冬季土壤团聚体破坏程度和死亡生物残体数量[37],进而降低冬春转换冻融期N2O脉冲排放的水平和发生概率。利用开顶箱和红外加热技术,我国已开展了一些增温对天然草地N2O排放影响的评估[38-39],但这些研究全部集中于季节性冻土区,且观测周期仅为植物生长季,尚不清楚增温对季节性冻土区非生长季特别是冬春转换冻融期以及多年冻土区草地N2O排放的影响。
在我国已开展了大量模拟降水和氮沉降增加对草地N2O排放影响研究,研究结论一致,即水分和氮营养元素增加,会不同程度促进草地排放[40-42]。我国面积半数以上的天然草地(草原类和荒漠类草地)分布在干旱、半干旱和半湿润区,水分是限制草地生产力的关键要素[40],降水量增加无疑会促进这些区域草地净初级生产力,增加植物残体、根系分泌物等有机质供应,进而促进土壤有机氮向无机氮的矿化分解,水分和氮沉降增加能够缓解硝化和反硝化微生物无机氮底物可利用性限制,进而促进草地N2O排放。受季风气候影响,我国草地区域年降水大部分集中于生长季,生长季丰沛降水有利于增加入冬时土壤水分条件,入冬时高土壤水分含量,一方面促进土壤团聚体破坏,增加死亡生物残体数量,另一方面有利于冬春转换冻融期土壤厌氧环境形成和反硝化过程N2O生产,因此,前一个生长季降水量可能是触发冬春转换冻融期N2O脉冲排放的关键[12],未来应加强研究生长季降水和大气氮沉降增加对冬春转换冻融期草地N2O脉冲排放的影响。此外,最近关于大气氮沉降趋势的研究表明,我国大气湿沉降量从2000年后出现趋缓和下降态势,但干沉降在总沉降中的贡献逐步增加,占比近一半,干沉降中氧化态氮的贡献明显上升[43],以往草地氮沉降效应研究全部模拟湿沉降过程,未来应加强干沉降增加和干沉降组分变化的影响评估。
5 结论与展望静态箱-气相色谱法被广泛应用于我国草地N2O排放通量监测,4种气相色谱载气设置方法中(Ⅰ.氩甲烷作载气方法;Ⅱ.高纯氮气作载气方法,不加CO2补充气或碱石棉过滤柱;Ⅲ.高纯氮气作载气外加CO2补充气方法;Ⅳ.高纯氮气作载气,进样口安装碱石棉过滤柱方法),Ⅰ、Ⅲ和Ⅳ 3种方法研究结果表明天然草地为弱排放源(0.01~0.4 kg N2O-N·hm-2·a-1),而第Ⅱ种方法极可能高估草地这类弱排放源生态系统的排放量,草地N2O排放清单研究应慎重使用第Ⅱ种方法获得的通量数据。
土壤冻融交替是天然草地冬春转换期的典型自然现象,冻融期短暂的脉冲式N2O排放一旦发生,就会主导全年累积排放水平,应加强非生长季特别是冻融期的排放通量观测频率,避免因低频观测无法捕捉到脉冲式排放峰而大幅低估周年累积排放量。
放牧家畜对植物氮素的迁移转化,导致放牧相关排放源,如遗留草地的粪尿斑块、家畜圈舍和饲草农田成为排放热点,应综合评估放牧系统和草地区域各种排放源的贡献。
天然草地氮素负盈余和土壤“贫氮”的特点,限制草地N2O生产,同时决定了气候变化影响N2O排放的效力,未来应加强评估增温和降水变化对多年冻土区排放和冬春转换冻融期排放的影响,以及大气干沉降和干沉降组分变化的影响。
| [1] |
中华人民共和国农业部.草地分类(NY/T 2997-2016)[S].北京: 中国农业出版社, 2016. Ministry of Agriculture of the PRC. Grassland classification(NY/T 2997-2016)[S]. Beijing: China Agriculture Press, 2016. |
| [2] |
沈海花, 朱言坤, 赵霞, 等. 中国草地资源的现状分析[J]. 科学通报, 2016, 61(2): 139-154. SHEN Hai-hua, ZHU Yan-kun, ZHAO Xia, et al. Analysis of current grassland resources in China[J]. Chinese Science Bulletin, 2016, 61(2): 139-154. |
| [3] |
Tang X L, Zhao X, Bai Y F, et al. Carbon pools in China's terrestrial ecosystems:New estimates based on an intensive field survey[J]. Proceedings of the National Academy of Sciences, 2018, 115(16): 4021-4026. DOI:10.1073/pnas.1700291115 |
| [4] |
Fang J Y, Yang Y H, Ma W H, et al. Ecosystem carbon stocks and their changes in China's grasslands[J]. Science China Life Sciences, 2010, 53(7): 757-765. DOI:10.1007/s11427-010-4029-x |
| [5] |
Tian H Q, Xu X F, Lu C Q, et al. Net exchanges of CO2, CH4, and N2O between China's terrestrial ecosystems and the atmosphere and their contributions to global climate warming[J]. Journal of Geophysical Research, 2011, 116: G02011. |
| [6] |
Wang Y F, Chen H, Zhu Q, et al. Soil methane uptake by grasslands and forests in China[J]. Soil Biology & Biochemistry, 2014, 74(74): 70-81. |
| [7] |
Yu L J, Huang Y, Zhang W, et al. Methane uptake in global forest and grassland soils from 1981 to 2010[J]. Science of the Total Environment, 2017, 607/608: 1163-1172. DOI:10.1016/j.scitotenv.2017.07.082 |
| [8] |
Huang B, Chen G X, Huang G H, et al. Nitrous oxide emission from temperate meadow grassland and emission estimation for temperate grassland of China[J]. Nutrient Cycling in Agroecosystems, 2003, 67(1): 31-36. DOI:10.1023/A:1025131229285 |
| [9] |
Du R, Lu D, Wang G C. Diurnal, seasonal, and inter-annual variations of N2O fluxes from native semi-arid grassland soils of Inner Mongolia[J]. Soil Biology & Biochemistry, 2006, 38(12): 3474-3482. |
| [10] |
Zhang F, Qi J, Li F M, et al. Quantifying nitrous oxide emissions from Chinese grasslands with a process-based model[J]. Biogeosciences, 2010, 7(6): 2039-2050. |
| [11] |
Xu R, Wang Y S, Wang Y H, et al. Estimating N2O emissions from soils under natural vegetation in China[J]. Plant & Soil, 2018, 434(1/2): 271-287. |
| [12] |
Fu Y F, Liu C Y, Lin F, et al. Quantification of year-round methane and nitrous oxide fluxes in a typical alpine shrub meadow on the Qinghai-Tibetan Plateau[J]. Agriculture Ecosystems & Environment, 2018, 255: 27-36. |
| [13] |
Wolf B, Zheng X H, Brüggemann N, et al. Grazing-induced reduction of natural nitrous oxide release from continental steppe[J]. Nature, 2010, 464(7290): 881-884. |
| [14] |
Li K H, Gong Y M, Song W, et al. No significant nitrous oxide emissions during spring thaw under grazing and nitrogen addition in an alpine grassland[J]. Global Change Biology, 2012, 18(8): 2546-2554. |
| [15] |
Cai Y J, Wang X D, Tian L L, et al. The impact of excretal returns from yak and Tibetan sheep dung on nitrous oxide emissions in an alpine steppe on the Qinghai-Tibetan Plateau[J]. Soil Biology & Biochemistry, 2014, 76: 90-99. |
| [16] |
Liu Y, Yan C Y, Matthew C, et al. Key sources and seasonal dynamics of greenhouse gas fluxes from yak grazing systems on the Qinghai-Tibetan Plateau[J]. Scientific Reports, 2017, 7: 40857. DOI:10.1038/srep40857 |
| [17] |
Wang K, Zheng X H, Pihlatie M, et al. Comparison between static chamber and tunable diode laser-based eddy covariance techniques for measuring nitrous oxide fluxes from a cotton field[J]. Agricultural and Forest Meteorology, 2013, 171-172: 9-19. |
| [18] |
Wolf B, Chen W W, Brüggemann N, et al. Applicability of the soil gradient method for estimating soil-atmosphere CO2, CH4, and N2O fluxes for steppe soils in Inner Mongolia[J]. Journal of Plant Nutrition and Soil Science, 2011, 174(3): 359-372. |
| [19] |
Zhang W, Liu C, Zheng X H, et al. The increasing distribution area of zokor mounds weaken greenhouse gas uptakes by alpine meadows in the Qinghai-Tibetan Plateau[J]. Soil Biology & Biochemistry, 2014, 71: 105-112. |
| [20] |
Zheng X H, Mei B L, Wang Y H, et al. Quantification of N2O fluxes from soil-plant systems may be biased by the applied gas chromatograph methodology[J]. Plant & Soil, 2008, 311(1/2): 211-234. |
| [21] |
Gu J X, Zheng X H, Wang Y H, et al. Regulatory effects of soil properties on background N2O emissions from agricultural soils in China[J]. Plant & Soil, 2007, 295(1/2): 53-65. |
| [22] |
Liu X R, Dong Y S, Qi Y C, et al. N2O fluxes from the native and grazed semi-arid steppes and their driving factors in Inner Mongolia, China[J]. Nutrient Cycling in Agroecosystems, 2010, 86(2): 231-240. |
| [23] |
Du Y G, Cui Y G, Xu X L, et al. Nitrous oxide emissions from two alpine meadows in the Qinghai-Tibetan Plateau[J]. Plant & Soil, 2008, 311(1/2): 245-254. |
| [24] |
Dangal S R S, Tian H, Xu R, et al. Global nitrous oxide emissions from pasturelands and rangelands:Magnitude, spatiotemporal patterns, and attribution[J]. Global Biogeochemical Cycles, 2019, 33: 200-222. |
| [25] |
Matzner E, Borken W. Do freeze-thaw events enhance C and N losses from soils of different ecosystems? A review[J]. European Journal of Soil Science, 2008, 59(2): 274-284. |
| [26] |
Holst J, Liu C Y, Yao Z S, et al. Fluxes of nitrous oxide, methane and carbon dioxide during freezing-thawing cycles in an Inner Mongolian steppe[J]. Plant & Soil, 2008, 308(1/2): 105-117. |
| [27] |
de Bruijn A M G, Butterbach-Bahl K, Blagodatsky S, et al. Model evaluation of different mechanisms driving freeze-thaw N2O emissions[J]. Agriculture, Ecosystems & Environment, 2009, 133: 196-207. |
| [28] |
Hu X X, Liu C Y, Zheng X H, et al. Annual dynamics of soil gross nitrogen turnover and nitrous oxide emissions in an alpine shrub meadow[J]. Soil Biology & Biochemistry, 2019, 138: 107576. |
| [29] |
Giese M, Brueck H, Gao Y Z, et al. N balance and cycling of Inner Mongolia typical steppe:A comprehensive case study of grazing effects[J]. Ecological Monographs, 2013, 83(2): 195-219. DOI:10.1890/12-0114.1 |
| [30] |
付永峰.青藏高原高寒草甸放牧系统CH4和N2O排放过程研究[D].北京: 中国科学院大学, 2017. FU Yong-feng. The study of CH4 and N2O emissions from a typical grazing system of alpine meadows in the Qinghai-Tibetan Plateau[D]. Beijing: University of Chinese Academy of Sciences, 2017. |
| [31] |
Holst J, Liu C Y, Yao Z S, et al. Importance of point sources on regional nitrous oxide fluxes in semi-arid steppe of Inner Mongolia, China[J]. Plant & Soil, 2007, 296(1/2): 209-226. |
| [32] |
Chen H, Zhu Q, Peng C H, et al. The impacts of climate change and human activities on biogeochemical cycles on the Qinghai-Tibetan Plateau[J]. Global Change Biology, 2013, 19(10): 2940-2955. DOI:10.1111/gcb.12277 |
| [33] |
Vaughan D G, Comiso J C, Allison I, et al. Observations:Cryosphere[M]//Stocker T F, Qin D, Plattner G-K, et al. Climate change 2013:The physical science basis, Contribution of Working Group Ⅰ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge, United Kingdom and New York, New York:Cambridge University Press, 2013:362-364.
|
| [34] |
Repo M E, Susiluoto S, Lind S E, et al. Large N2O emissions from cryoturbated peat soil in tundra[J]. Nature Geoscience, 2009, 2: 189-192. |
| [35] |
Voigt C, Marushchak M E, Lamprecht R E, et al. Increased nitrous oxide emissions from arctic peatlands after permafrost thaw[J]. Proceedings of the National Academy of Sciences, 2017, 114: 6238-6243. |
| [36] |
Li X, Jin R, Pan X D, et al. Changes in the near-surface soil freezethaw cycle on the Qinghai-Tibetan Plateau[J]. International Journal of Applied Earth Observation and Geoinformation, 2012, 17: 33-42. DOI:10.1016/j.jag.2011.12.002 |
| [37] |
Song Y, Zou Y C, Wang G P, et al. Altered soil carbon and nitrogen cycles due to the freeze-thaw effect:A meta-analysis[J]. Soil Biology & Biochemistry, 2017, 109: 35-49. |
| [38] |
Hu Y G, Chang X F, Lin X W, et al. Effects of warming and grazing on N2O fluxes in an alpine meadow ecosystem on the Tibetan Plateau[J]. Soil Biology & Biochemistry, 2010, 42(6): 944-952. |
| [39] |
Zhao Z Z, Dong S K, Jiang X M, et al. Effects of warming and nitrogen deposition on CH4, CO2 and N2O emissions in alpine grassland ecosystems of the Qinghai-Tibetan Plateau[J]. Science of the Total Environment, 2017, 592: 565-572. DOI:10.1016/j.scitotenv.2017.03.082 |
| [40] |
Liu C Y, Holst J, Brüggemann N, et al. Effects of irrigation on nitrous oxide, methane and carbon dioxide fluxes in an Inner Mongolian steppe[J]. Advances in Atmospheric Sciences, 2008, 25(5): 748-756. |
| [41] |
Peng Q, Qi Y C, Dong Y S, et al. Soil nitrous oxide emissions from a typical semiarid temperate steppe in Inner Mongolia:Effects of mineral nitrogen fertilizer levels and forms[J]. Plant & Soil, 2011, 342(1/2): 345-357. |
| [42] |
Chen W W, Zheng X H, Chen Q, et al. Effects of increasing precipitation and nitrogen deposition on CH4 and N2O fluxes and ecosystem respiration in a degraded steppe in Inner Mongolia, China[J]. Geoderma, 2013, 192: 335-340. DOI:10.1016/j.geoderma.2012.08.018 |
| [43] |
Yu G, Jia Y, He N, et al. Stabilization of atmospheric nitrogen deposition in China over the past decade[J]. Nature Geoscience, 2019, 12(6): 424-429. |
| [44] |
Wang Z W, Hao X Y, Shan D, et al. Influence of increasing temperature and nitrogen input on greenhouse gas emissions from a desert steppe soil in Inner Mongolia[J]. Soil Science and Plant Nutrition, 2011, 57(4): 508-518. DOI:10.1080/00380768.2011.591283 |
| [45] |
Yang X M, Chen H Q, Gong Y S, et al. Nitrous oxide emissions from an agro-pastoral ecotone of northern China depending on land uses[J]. Agriculture Ecosystems & Environment, 2015, 213: 241-251. |
 2020, Vol. 39
2020, Vol. 39