自工业革命以来,大气[CO2]持续攀升,尤其是20世纪50年代后,由于化石燃料的大量使用,大气中[CO2]急剧增加。其中在2001—2011年间,[CO2]以2 μL·L-1·a-1的速率增加,远大于1960—1992年间的0.7 μL·L-1·a-1 [1]。2013年,人类第一次监测到大气中[CO2]超过400 μL·L-1(http://www/esrl.noaa.gov/gmd/ccgg/trends/),根据最新的[CO2]观测数据,2019年大气[CO2]超过了415 μL·L-1(2019年5月达到了415.7 μL· L-1) [2]。与气候变化其他因子如气温、降水等存在明显时空变化不同,全球大部分区域大气[CO2]都面临着持续的攀升。[CO2]升高,对作物光合速率、生长发育以及产量都有很大的影响,因此,未来[CO2]的持续升高,也将会持续影响全球农作物的生长与生产[3-5]。为了总结国内外[CO2]升高对农作物影响的研究现状和结论,本文首先描述了目前农作物对[CO2]升高响应的主要研究手段,然后梳理出作物应对[CO2]升高的生理响应及其机制分析,最后对[CO2]升高对农作物产量及营养品质的影响进行了总结。
1 农作物对[CO2]升高响应的研究方法[CO2]升高对农业的影响已经受到广泛的关注,为保证研究结果的可靠性和准确性,根据不同试验目的,需要采用不同的研究方法。一种是通过人工模拟试验方法对作物在高[CO2]条件下的响应进行评估,另一种方法是利用模型来模拟作物对高[CO2]的响应。目前主要试验手段有封闭式或开顶式CO2控制系统和开放式CO2控制系统(Free - air CO2 enrichment, FACE)等。
1.1 试验方法 1.1.1 封闭式与开顶式CO2控制系统作物对大气[CO2]持续攀升导致的气候变化的响应研究始于野外观测,最早可以追溯到20世纪中期[6-8],但是由于自然环境条件复杂,随着对单因子变化和更加定量化机理研究的深入,野外观测越来越难以满足要求。到20世纪80年代,研究人员开始将环境控制试验作为主要研究手段,主要包括酸雨模拟试验、粉尘试验、臭氧试验和CO2增加等试验,其中CO2增加试验是规模最大的模拟全球气候变化的控制试验[9-13]。
试验形式主要是设立封闭或者顶部开放的温室,其中封闭控制系统具有目标环境因子容易定量化和环境因子在系统中比较均匀等优点,但是其缺点也比较明显。在封闭环境下,形成的微环境是静态的,与外界的大气环境有明显区别,作物在封闭控制系统中对CO2增加的响应结果,很难应用到实际自然环境中种植的作物中[14-15]。顶部开放的温室被称为开顶式气室(Open-top chamber, OTC),相比封闭控制系统,由于开顶式气室系统顶部是开放的,所以该温室的光照、气温以及湿度等都与大气环境比较接近[16-17],但是风速、病虫害状况等因素仍然与自然环境存在差异[18-20]。
1.1.2 开放式CO2控制系统(FACE)为了解决上述封闭环境控制气室和开顶式气室存在的问题,研究人员尝试发展在无封闭的自然环境条件下控制[CO2]的技术。20世纪80年代,美国、欧洲和日本的生态学家们开始采用FACE系统(自由大气CO2气体施肥试验)开展相应的研究。FACE系统通过改变作物生长的微气候环境来模拟未来气候变化对作物的影响,该系统主要由CO2气体供应装置(主要包括储气罐、液态CO2汽化装置、送气管道和放气管道等部件)和控制系统(主要包括主控计算机、放气控制系统和CO2采样分析系统等)组成;一圈水平或者垂直的管道将CO2直接通入田间,形成一个高[CO2]的区域,控制系统根据测定的[CO2],对区域内的[CO2]进行实时调节,使其保持在设定值。由于FACE系统没有任何隔离装置,气体可以自由流通,相比封闭式和开顶式气室系统,FACE系统通风、光照、温度以及湿度等环境因子与自然条件非常接近,因此,在该系统下获取的[CO2]升高的作物模拟试验也更接近于真实情况[21-23]。
早在1989年,美国亚利桑那州马里科帕的研究人员就对棉花作物进行了FACE [CO2]升高的响应试验,随后将FACE技术应用到对其他作物如小麦[24-25]、水稻[26-28]和大豆[29-30]等的研究中。目前,大型FACE平台已经在全球五大洲对各种作物开展了试验研究,全球大部分FACE系统设定的[CO2]增加幅度在525~ 645 μL·L-1之间,全球主要作物FACE站点空间分布如图 1所示。从图中可以看到,全球主要作物FACE站点主要分布在北半球中纬度地区,在南半球巴西和澳大利亚有三个站点,详细信息如表 1所示。其中,小麦作为FACE试验中被研究最多的作物,已经在如中国、美国、德国和澳大利亚等国家进行了相应的试验,美国和德国等研究人员对C4作物玉米进行了研究;对于水稻的[CO2]增加响应试验,主要是中国和日本两个国家的研究人员进行了研究[31-38]。
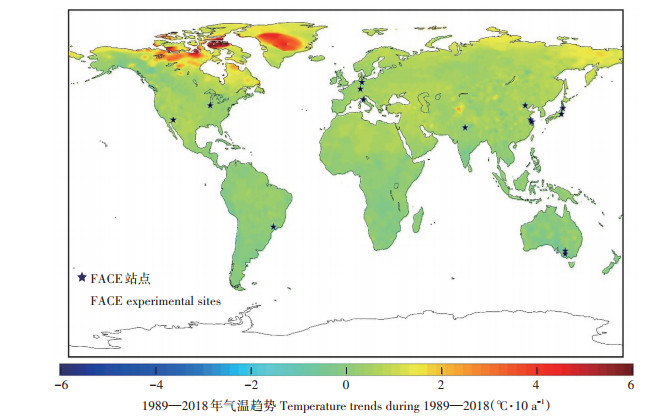
|
背景图为近30年平均气温变化趋势图,数据来源于美国国家海洋和大气管理局:https://www.esrl.noaa.gov/psd/data/gridded/data.ghcncams.html The temperature data is from the NOAA: https://www.esrl.noaa.gov/psd/data/gridded/data.ghcncams.html 图 1 全球主要作物FACE站点分布示意图 Figure 1 Locations of global main crops FACE experimental sites |
|
|
表 1 全球主要作物FACE站点位置及试验详细信息 Table 1 Location and details of global main crops FACE experimental sites |
随着大气[CO2]的升高,其他气候变化因子也在相应发生变化,比如气温的升高以及降水的变化,因此很多研究人员研究了作物在不同气候条件下对[CO2]升高的响应[39]。自然环境千变万化,存在着很多室内试验不能考虑的变数,而由于FACE试验系统是一个开放系统,有利于发现室内试验所不能观察到的新现象,因此其仍然是目前公认的研究作物对高[CO2]响应的最理想手段,这些试验结果也被用来对已经建立的作物模型进行验证和改进。FACE系统相比封闭式或者半封闭式系统,虽然作物生长的除[CO2]以外的其他条件与自然环境条件更加接近,但目前大部分FACE系统采用的[CO2]增幅与历史[CO2]增加幅度不匹配。大部分FACE系统设置的[CO2]增幅在100~300 μL·L-1,远大于1960—1992年间的0.7 μL·L-1·a-1以及2001—2011年间的2 μL·L-1·a-1[40-41],因此,在未来的研究中,应该进一步研究FACE系统如何模拟和考虑真实情况下[CO2]逐渐增加对作物产生的影响。
1.2 模型模拟作物生长模型是基于农作物的生理过程机制,将气象条件、土壤以及作物品种和管理措施等因素作为一个整体进行考虑的数值模拟系统[42]。1970年,荷兰学者de Wit开发了第一个作物生长动力学模型ELCROS(Elementary crop simulator),比较详细地从机理上描述了植被冠层光合作用以及呼吸作用等过程,但是该模型对植被和土壤中的很多基础过程很少涉及[43]。随后,20世纪80年代,在该模型的基础上发展形成了BACROS(Basic crop simulation)和SUCROS (Simple and universal crop simulator)等综合的作物模型。综合作物模型描述的植被物理和生理过程适用于不同环境条件,因此对于不同种类的作物具有通用性,该工作主要是由荷兰Wageningen的研究人员在第一个作物模型ELCROS基础上完成的,统称为Wageningen作物生长模型[44-46]。在20世纪80年代后期,作物生长模型研究迅速发展,其可以模拟作物完整的生长过程,荷兰Wageningen的研究人员在ELCROS基础上进一步开发出了适合半湿润热带作物的MACROS模型(Modules of an annual crop simulator),并研发了专门针对水稻的专用模型ORYZA,在1997年,ORYZA首次与大气环流模型(General circulation models, GCMs)进行结合,以用来评估气候变化对亚洲水稻的影响[47-51]。
与此同时,美国和澳大利亚等研究人员也相继研发了对应的作物模拟系统。其中,美国研制的CERES模型(Crop environment resource synthesis)在机理性、综合性和应用性方面都有很大的提高,而且与荷兰Wageningen模型作物通用性有所区别的是,CERES模型针对不同作物分别开发了如CERES-小麦、CERES-水稻、CERES-玉米等不同的模型[52-55]。美国研究人员研发的另外一个模型为CROPGRO(Crop growth),主要是用来模拟豆类作物生长发育等过程。在CERES和CROPGRO等模型和数据库的基础上,IBSNAT(International benchmark sites network for agrotechnological transfer)建立了一个农业技术转移决策系统DSSAT(Decision support system for agrotechnology transfer),被称为DSSAT系列模型。DSSAT系列模型可以模拟作物营养生长和生殖生长等发育过程以及作物光合作用、干物质分配、植株生长和衰老等生理生态过程[54]。澳大利亚研究人员也研发了一个与DSSAT类似的平台,APSIM(Agricultural production systems simulator)模型,该模型可以应用到种植制度、作物管理、气候变化、作物育种等方面[47]。我国的作物模型研发也开始于20世纪80年代,包括水稻栽培模拟优化决策系统RCSODS和包含经济评价模型的水稻计算机模拟模型等[55]。
作物模型从20世纪80年代最初的单一模型实际应用研究阶段,到20世纪90年代对模型的进一步完善,一直到和其他模型如GCM的结合应用阶段[47-48],其已被越来越广泛地应用到农业研究中。[CO2]升高对作物生长发育过程影响显著,很多模型被用来模拟[CO2]升高对作物生长和生产的影响。在20世纪70年代,Acock等[49-50]第一个提出考虑[CO2]参数在叶片尺度的作物模型。此后,越来越多的模型研究开始考虑[CO2]对作物的影响[51-53],将作物模型从叶片尺度发展到冠层尺度,并考虑了[CO2]和其他气象因子如温度以及水分等的协同影响[54-55]。随着[CO2]的持续攀升以及气候变化的全球化趋势愈加明显,许多模型研究开始在区域以及全球尺度上模拟和预测[CO2]升高对农作物生长和生产的影响,但由于[CO2]升高对作物的影响在不同区域以及对于不同的作物类型等都有较大区别,且作物模型在对空间变化这一因素进行考虑时,需要得到大量参数如土壤属性(土壤湿度等)、植被冠层状态(叶面积指数、生物量和氮含量等)以及气象数据等在空间上的连续分布,而这些因子的估算不确定性会给作物模型带来更大误差[56]。随着遥感技术的发展以及越来越多遥感数据的积累,研究人员可以更加准确和可靠地在大尺度甚至全球尺度估算以上参数。数据同化方法被用来将遥感数据和作物模型进行结合,使得研究人员可以同时利用作物生长模型能揭示作物生长发育内在机理和卫星遥感具有空间连续和时间动态变化的优势,实现两者的优势互补,在大区域上对作物的生长进行监测并实现气候变化对作物影响的区域尺度模拟[57-60]。然而,由于大部分作物模型所需输入参数与当前遥感数据在时间分辨率等参数上存在不匹配等问题,使得作物模型仍然不能很精确地在大区域尺度上对作物的生长以及生产进行模拟,未来对于作物模型的进一步改进以及更多高时空分辨率遥感数据的出现,将会进一步改善作物模型在大区域尺度上模拟的精度。
2 农作物对[CO2]升高的生理响应机制研究CO2作为植物光合作用的必要原材料,大气[CO2]升高会直接影响作物的两个生理过程:碳同化效率(A)和气孔导度(Gs)。[CO2]升高,提高了作物Rubisco的羧化速率,抑制了Rubp的氧化,最终提高了作物的光合速率[61]。大量研究表明,当大气[CO2]从工业化前的280 μL·L-1开始升高时,C3作物如水稻、小麦、大豆等的光合速率立即得到了提升,即CO2施肥效应显著,其中作物在光饱和状态下的叶片光合速率(Asat)平均提高了31%,Gs平均下降了20%[62-64]。根据Farquhar等[65]在1980年提出的适用于C3作物的生化模型,即当作物细胞间[CO2]较低时(Ci:50~280 μL·L-1),A主要由Rubisco羧化效率决定。对于C3作物来说,Ci一般为大气[CO2]的0.7倍,在目前大气[CO2]下,C3作物Ci大约为280 μL·L-1,Rubisco没有出现饱和,A随着[CO2]的升高快速增加[66]。此外,试验表明,当大气中[CO2]升高时,C3作物的光呼吸过程受到抑制,减少了对光合产物的氧化,进一步增加了作物光合产物[67-68]。
以上作物光合速率在高[CO2]条件下增加的试验结果,大部分是基于短期的试验研究。随着作物对高[CO2]响应试验研究周期的延长,有研究表明,当作物长期处于高[CO2]条件下时,CO2对作物光合速率的提高会随着时间的延长而逐渐减缓,即所谓的光合适应现象[69]。此时,作物Rubisco含量下降,对CO2的羧化能力降低,尤其是其他营养条件未进行对应的调整,导致作物发生如氮胁迫时,会使得作物对[CO2]的光合适应现象更加明显。当作物氮供应不足时,作物Rubisco最大羧化速率Vcmax下降幅度要大于氮供应充足时的下降幅度,从而限制作物产生新的碳汇,加速作物生长中的C-N代谢不平衡[70-71]。
作物在长期高[CO2]条件下出现光合适应现象的原因是什么?有研究表明,作物长期处在高[CO2]条件下时,叶片中淀粉和蔗糖的累积量逐渐增加,当作物不能全部利用在高[CO2]下增加的碳水化合物(如淀粉)时,作物通过反馈抑制,使得叶片光合速率下降[72-73]。而且,当作物生长受到氮的限制时,叶片内对氮素会进行重新分配,氮被更多地分配到新叶或者更早发生衰老的叶片中,导致叶片蛋白质含量整体下降,植物的Rubisco含量下降[74]。
此外,不同氮来源的供应,会对作物[CO2]升高的响应产生影响。当以铵(NH4+)形式对小麦进行氮的供应时,相比以硝酸盐(NO3-)的形式进行供应,小麦将会具有更大的叶面积指数,叶片蛋白质的含量下降幅度更小[75]。除了氮的供应和吸收会影响作物对高[CO2]的响应外,其他环境因子如气温也会对作物的响应产生影响。当作物处于较高温度环境下时(气温>25 ℃),作物Asat增加幅度要大于其处于较低温度环境下(气温 < 25 ℃) [76-77]。
农作物对高[CO2]的响应,C3作物与C4作物也存在明显差异,根据光合作用的机理分析以及对应的光合理论假设,[CO2]升高对C4作物的促进作用不显著[78]。但Wand等[79]试验结果表明,[CO2]升高对于C3和C4作物的光合速率都有促进作用,其中C3作物的光合速率提高了33%,C4作物光合速率提高了25%;Ainsworth等通过对相关的FACE试验结果进行整合分析,结果表明[CO2]升高对C3作物的促进作用是C4作物的3倍左右,一些C4作物类型在当前[CO2]下,出现了光合适应现象,但[CO2]升高对C3和C4作物Gs的影响无明显差异,两种不同光合途径作物的Gs都出现了下降[21, 79]。此外,对于光合适应现象,由于作物叶片的解剖结构和光合酶系统不同,C3作物和C4作物对应的大气[CO2]阈值也有所差别,C4作物光合适应现象对应的[CO2(]与目前大气[CO2]接近,约400 μg·L-1)要远低于C3作物出现光合适应现象对应的[CO2(]约1000 μL·L-1,浓度与作物类型和生长环境有关) [80]。
3 [CO2]升高对作物产量和营养品质的影响大气[CO2]升高,在提高农作物生物量和产量的同时,也会对作物的营养品质产生影响。
3.1 作物产量在高[CO2]条件下,C3作物A增加和Gs下降提高了作物的水分利用效率,使得C3作物生物量和产量得到增加,但是增加的幅度会随着不同作物品种以及试验条件不同而发生相应改变[81-82]。根据早期开顶式气室OTC相关的[CO2]增加试验,高[CO2]将会显著增加作物产量,增加幅度为28%~35%[83-85]。然而,后续的FACE试验结果表明,高[CO2]条件下作物产量平均增加幅度为17%左右[86]。其中C3作物(如小麦和大麦等)在氮和水分充足条件下,[CO2]升高对于平均产量的增幅为19%,当作物处于水分胁迫时,作物平均产量增加幅度有所提高,大约为22%。但总体上,高[CO2]对于C3作物产量的增加幅度均小于25%,小于OTC试验结果展示的作物产量增加幅度[87]。分析原因,可能是由于FACE系统控制的[CO2]波动造成的[88],但目前仍然缺少综合的机理性研究。
近10年中国和日本相关的水稻FACE试验结果表明,有部分水稻品种对[CO2]升高的响应更加明显,远大于早期大部分FACE试验得到的[CO2]升高对作物产量的增加幅度。其中日本的水稻FACE试验结果显示,不同水稻品种对高[CO2]响应有很大差异,其中有部分品种产量增加幅度高达36%[37, 89]。中国的FACE试验结果显示,高[CO2]显著增加了籼稻和部分杂交水稻品种的产量,平均增产大约为34%,高于其他FACE试验得到的增加幅度[90-93]。以上结果表明,在未来采用相关技术,有望培育出对全球[CO2]持续攀升响应更加显著、增产幅度更大的农作物品种,以增加粮食产量,应对气候变化带来的粮食安全问题。
大气[CO2]升高引起的气候变化通常会伴随着其他气候因子如气温和降水等的变化。因此,在考虑大气[CO2]升高对作物产生的影响时,必须同时考虑作物对高[CO2]和其他胁迫因子如高温或者干旱的协同响应。根据C3作物对[CO2]升高的机理研究分析,相比正常条件下生长的作物,在水分不足或者高温条件下,高[CO2]对C3作物的光合速率、生物量和产量的增加比率更大[94]。位于美国亚利桑那州的小麦FACE试验结果显示,当小麦处于水分胁迫环境时,高[CO2]使得小麦产量提高了23%,远高于在水分充足条件下小麦产量的提升比率(10%) [95]。通过整合分析全球18个开顶式气室试验和11个FACE试验的数据,Bishop等[96]发现,作物产量对[CO2]增加的响应与作物供水存在负相关,但是与温度的升高无明显相关性。玉米和高粱在水分充足情况下,对于大气[CO2]的升高,虽然其光合速率或者产量均没有出现明显的响应,但是与水分的协同试验结果表明,当玉米和高粱遭受干旱胁迫时,大气[CO2]的升高,相比正常[CO2]下的玉米和高粱,最终产量得到提升[97-98]。为了验证C4作物在高[CO2]条件和冠层温度升高时的响应情况,研究人员在FACE试验中将[CO2]升高200 μL·L-1,整个玉米生长季的平均冠层温度增加2.7 ℃ (计划增温3.5 ℃),最终结果表明,[CO2]的升高没有增加玉米的光合速率、地上生物量和产量,而高温导致光合速率和籽粒产量均发生下降,高[CO2]没有抵消掉高温造成的玉米减产[99]。
3.2 作物营养品质从20世纪80年代开始,各种地面试验表明大气[CO2]升高,会增加大部分C3作物的产量。到20世纪末,有研究发现,除了少部分豆科作物和C4作物,[CO2]升高会对大部分C3作物的籽粒、谷粒和块茎的品质产生影响,其中主要是降低氮以及锌、铁等的含量[4, 85, 100]。蛋白质作为许多作物中重要的营养物质之一,很多试验对[CO2]升高影响作物中氮含量进行了研究。在最初的氮含量下降研究过程中,有研究指出作物中氮含量的下降也许是由于作物种植于盆中对根系造成限制导致的[3],但是后期在田间以及OTC的试验进一步表明,当[CO2]升高时,作物中氮含量也显著下降,而且,无论土壤中或者所施的氮肥量高或低,作物中氮含量均下降[101-103]。
[CO2]升高造成作物中氮含量下降的原因是什么?有地面试验结果表明,大气[CO2]升高有利于作物生物量的累积,从而“稀释”了作物中可食用部分氮的含量[104-105]。但是在其他相关研究结果中,当[CO2]升高,作物的生物量没有出现增长时,作物中氮含量依然出现了下降[106]。因此,该机理分析不能完全解释为什么作物在高[CO2]条件下氮含量下降的现象。
研究表明,在高[CO2]下,相比依靠扩散来进行根部营养吸收的植物,依靠蒸腾拉力进行营养吸收的植物氮含量下降幅度更大。因此,高[CO2]造成作物中氮含量下降的原因可能是:随着大气[CO2]升高导致的作物Gs下降,致使作物蒸腾拉力下降,土壤中营养物质流向作物体内的效率下降[106-107]。但是,也有研究表明,高[CO2]条件下,当C3和C4植物的Gs都发生下降时,只有C3植物中氮含量有所下降[108]。因此,[CO2]升高导致蒸腾拉力下降可能也不是解释[CO2]升高导致大部分非豆科C3作物氮含量下降的唯一机理性原因。上述关于[CO2]升高造成作物中氮含量下降的机理研究分析表明,目前还没有一个机理分析可以完整地解释作物在高[CO2]下氮含量下降的所有情况,因此作物氮含量下降有可能是几个因素共同影响所产生的结果。在将来的研究中,对于作物在高[CO2]下氮含量下降,仍然需要更多综合性、机理性的地面试验研究。
大气中[CO2]的升高,不仅造成大部分非豆科C3作物氮含量下降,作物叶片中其他元素含量如铁、锌、硫和铜等也明显下降[109]。Erbs等[34]研究了高[CO2]对小麦和大麦矿质元素吸收的影响,结果显示,大气[CO2]升高,导致作物中大部分大量元素和微量元素如钙、镁、铁和锌等含量均出现下降。世界卫生组织公布的健康报告显示,目前全球大约有2亿人缺乏维生素和矿物质,主要包括铁、锌以及维生素A等,全球每年大约有6300万人由于维生素和矿物质缺乏而丧生[110]。而这些缺乏维生素和矿物质含量的人群,其维生素和矿物质来源主要是谷物和豆类食物,由于大气[CO2]的升高导致的谷物中维生素和矿物质含量的进一步减少,将会加剧这一现象。
因此,针对[CO2]升高造成作物营养品质下降机理研究的不足,在未来需要更多相关地面机理性试验,以缓解在全球大气[CO2]持续攀升背景下,[CO2]升高可能对作物造成的如蛋白质含量下降等的负面影响。
4 结论与展望(1) 相比封闭式或半封闭式环境控制试验系统,开放式试验系统(FACE)由于其能更加真实地模拟自然条件下作物对未来高[CO2]的响应和适应情况,被公认为是目前研究作物对高[CO2]响应的最理想手段。目前全球主要农作物FACE站点主要分布在北半球中纬度地区,在南半球巴西和澳大利亚有少量站点分布,主要研究的作物类型包括小麦、大麦、水稻、大豆以及玉米和高粱等。但目前大部分FACE系统采用的[CO2]增幅与历史[CO2]增加幅度不匹配,因此,在未来的研究中,应该进一步研究FACE系统如何模拟和考虑真实情况下[CO2]逐渐增加对作物产生的影响。
(2) 作物生长模型由于其不仅能够模拟作物生长发育的动态过程,还能系统地评价作物生长状态与环境要素的关系,因此,也被广泛应用到[CO2]升高对作物的影响研究中。然而,由于作物生态系统本身的复杂性,农作物模型对于作物的模拟仍然存在很大的不确定性,尤其是在区域尺度上评价高[CO2]和其他环境因子对农业生产的影响,降尺度等因素将会给作物模型引入更大的不确定性。今后,地面试验对作物生长机理过程的探索,以及与遥感数据同化技术的结合,将会进一步促进作物生长模型更广泛和更准确地应用。
(3) 大气高[CO2]会提高C3作物光合速率,增加农作物生物量和产量,但在不同气象条件和对不同作物类型的增产幅度有所差别。当作物长期暴露在高[CO2]条件下时,会产生光合适应现象,高[CO2]对作物的促进作用会逐渐减弱,目前对于光合适应现象背后的机理仍然缺乏系统的研究。近10年来中国和日本的水稻FACE试验结果表明,有部分水稻品种如籼稻和杂交稻对高[CO2]出现了高应答,相比早期的农作物[CO2]升高响应结果,其光合速率和产量增加幅度更大。此外,高[CO2]增加了作物产量,同时也明显降低了大部分非豆科C3作物中蛋白质和其他营养物质如锌、铁和维生素等的含量,这会加重目前全球2亿人由于维生素和矿物质元素等营养缺乏导致的健康问题。因此,未来研究应该重点关注如何通过相关技术手段如合理的营养补给和基因技术等,在提高作物产量对高[CO2]的响应前提下,减缓高[CO2]对作物可能造成的如蛋白质等营养品质下降的负面影响。
| [1] |
Hartmann D L, Albert M G, Matilde R, et al. Observations: Atmosphere and surface. In climate change 2013 the physical science basis: Working group I contribution to the fifth assessment report of the intergovernmental panel on climate change[M]. England: Cambridge University Press, 2013: 159-254.
|
| [2] |
Imster E, Deborah B. Atmospheric CO2 hits record high in May 2019[R]. America: NOAA, 2019.
|
| [3] |
Arp W. Effects of source-sink relations on photosynthetic acclimation to elevated CO2[J]. Plant, Cell & Environment, 1991, 14(8): 869-875. |
| [4] |
Taub D R, Brian M, Holly A. Effects of elevated CO2 on the protein concentration of food crops:A meta-analysis[J]. Global Change Biology, 2008, 14(3): 565-575. |
| [5] |
Thomey M L, Rebecca A S, Iris H K, et al. Yield response of fieldgrown soybean exposed to heat waves under current and elevated[CO2][J]. Global Change Biology, 2019, 25(12): 4352-4368. |
| [6] |
McIntosh M. Analysis of combined experiments[J]. Agronomy Journal, 1983, 75(1): 153-155. |
| [7] |
Mendelsohn R, William N, Daigee S. Climate impacts on aggregate farm value:accounting for adaptation[J]. Agricultural and Forest Meteorology, 1996, 80(1): 55-66. |
| [8] |
Matar A. Yields and response of cereal crops to phosphorus fertilization under changing rainfall conditions 1[J]. Agronomy Journal, 1977, 69(5): 879-881. |
| [9] |
Carpenter S R, Sallie W C, Charles J K, et al. Ecosystem experiments[J]. Science, 1995, 269(5222): 324-327. |
| [10] |
Hirano T, Kiyota M, Aiga I. Physical effects of dust on leaf physiology of cucumber and kidney bean plants[J]. Environmental Pollution, 1995, 89(3): 255-261. |
| [11] |
Reich P B, Schoettle A, Stroo H, et al. Effects of O3, SO2, and acidic rain on mycorrhizal infection in northern red oak seedlings[J]. Canadian Journal of Botany, 1985, 63(11): 2049-2055. |
| [12] |
Körner C, Diemer M. Evidence that plants from high altitudes retain their greater photosyntheti efficiency under elevated CO2[J]. Functional Ecology, 1994, 8(1): 58-68. |
| [13] |
Dahlman R C. CO2 and plants:Revisited[M]. Dordrecht: Springer, 1993: 339-355.
|
| [14] |
马合法, 段同心, 武全, 等. CO2对温棚蔬菜的增产效应[J]. 河南气象, 1995(1): 23-24. MA He-fa, DUAN Tong-xin, WU Quan, et al. The yield response of vegetables in greenhouse to elevated[CO2][J]. Henan Meteorology, 1995(1): 23-24. |
| [15] |
Critten D. Optimization of CO2 concentration in greenhouses:A modelling analysis for the lettuce crop[J]. Journal of Agricultural Engineering Research, 1991, 48: 261-271. |
| [16] |
刘超, 胡正华, 陈健, 等. 不同CO2浓度升高水平对水稻光合特性的影响[J]. 生态环境学报, 2018, 27(2): 246-254. LIU Chao, HU Zheng-hua, CHEN Jian, et al. Effects of elevated CO2 concentration levels on photosynthetic characteristics of rice[J]. Ecology and Environmental Sciences, 2018, 27(2): 246-254. |
| [17] |
刘晓萌, 于凌飞, 黄耀, 等. CO2浓度升高下粳稻叶片光合作用对光强变化的响应[J]. 生态学杂志, 2018, 37(4): 1051-1057. LIU Xiao-meng, YU Ling-fei, HUANG Yao, et al. Responses of photosynthesis in leaves of Japonica rice to light intensity at elevated CO2 concentration[J]. Chinese Journal of Ecology, 2018, 37(4): 1051-1057. |
| [18] |
Jones P, Collins L, Ingram K. Open top chambers for field studies of crop response to elevated CO2 and temperature[J]. Transactions of the ASAE, 1995, 38(4): 1195-1201. |
| [19] |
Van Oijen M, Schapendonk A, Jansen M, et al. Effects of elevated CO2 on development and morphology of spring wheat grown in cooled and non-cooled open-top chambers[J]. Functional Plant Biology, 1998, 25(5): 617-626. |
| [20] |
Torbert H, Prior S, Rogers H, et al. Review of elevated atmospheric CO2 effects on agro-ecosystems:Residue decomposition processes and soil C storage[J]. Plant and Soil, 2000, 224(1): 59-73. |
| [21] |
Ainsworth E A, Long S P. What have we learned from 15 years of free-air CO2 enrichment(FACE)? A meta-analytic review of the responses of photosynthesis, canopy properties and plant production to rising CO2[J]. New Phytologist, 2005, 165(2): 351-372. |
| [22] |
Okada M, Lieffering M, Nakamura H, et al. Free-air CO2 enrichment (FACE)using pure CO2 injection:System description[J]. New Phytologist, 2001, 150(2): 251-260. |
| [23] |
赖上坤, 庄时腾, 吴艳珍, 等. 大气CO2浓度和温度升高对超级稻生长发育的影响[J]. 生态学杂志, 2015, 34(5): 1253-1262. LAI Shang-kun, ZHUANG Shi-teng, WU Yan-zhen, et al. Impact of elevated atmospheric CO2 concentration and temperature on growth and development of super rice[J]. Chinese Journal of Ecology, 2015, 34(5): 1253-1262. |
| [24] |
Kimball B A, Pinter P J, Garcia R L, et al. Productivity and water use of wheat under free-air CO2 enrichment[J]. Global Change Biology, 1995, 1(6): 429-442. |
| [25] |
Högy P, Wieser H, Köhler P, et al. Effects of elevated CO2 on grain yield and quality of wheat:Results from a 3-year free-air CO2 enrichment experiment[J]. Plant Biology, 2009, 11: 60-69. |
| [26] |
Yang L, Wang Y, Dong G, et al. The impact of free-air CO2 enrichment(FACE)and nitrogen supply on grain quality of rice[J]. Field Crops Research, 2007, 102(2): 128-140. |
| [27] |
Kim H Y, Lieffering M, Kobayashi K, et al. Effects of free-air CO2 enrichment and nitrogen supply on the yield of temperate paddy rice crops[J]. Field Crops Research, 2003, 83(3): 261-270. |
| [28] |
Yang L, Wang Y, Kobayashi K, et al. Seasonal changes in the effects of free-air CO2 enrichment(FACE)on growth, morphology and physiology of rice root at three levels of nitrogen fertilization[J]. Global Change Biology, 2008, 14(8): 1844-1853. |
| [29] |
Morgan P B, Bollero G A, Nelson R L, et al. Smaller than predicted increase in aboveground net primary production and yield of fieldgrown soybean under fully open-air[CO2] elevation[J]. Global Change Biology, 2005, 11(10): 1856-1865. |
| [30] |
Hao X, Li P, Han X, et al. Effects of free-air CO2 enrichment (FACE)on N, P and K uptake of soybean in northern China[J]. Agricultural and Forest Meteorology, 2016, 218: 261-266. |
| [31] |
Pinter Jr P, Kimball B, Wall G, et al. Free-air CO2 enrichment (FACE):Blower effects on wheat canopy microclimate and plant development[J]. Agricultural and Forest Meteorology, 2000, 103(4): 319-333. |
| [32] |
Yang L, Huang J, Yang H, et al. The impact of free-air CO2 enrichment(FACE)and N supply on yield formation of rice crops with large panicle[J]. Field Crops Research, 2006, 98(2/3): 141-150. |
| [33] |
Mollah M, Norton R, Huzzey J. Australian grains free-air carbon dioxide enrichment(AGFACE)facility:Design and performance[J]. Crop and Pasture Science, 2009, 60(8): 697-707. |
| [34] |
Erbs M, Manderscheid R, Jansen G, et al. Effects of free-air CO2 enrichment and nitrogen supply on grain quality parameters and elemental composition of wheat and barley grown in a crop rotation[J]. Agriculture, Ecosystems & Environment, 2010, 136(1/2): 59-68. |
| [35] |
Hasegawa T, Sakai H, Tokida T, et al. Rice cultivar responses to elevated CO2 at two free-air CO2 enrichment(FACE)sites in Japan[J]. Functional Plant Biology, 2013, 40(2): 148-159. |
| [36] |
Katie M, Michael S, Danielle A, et al. CO2 studies remain key to understanding a future world[J]. New Phytologist, 2017, 214(1): 34-40. |
| [37] |
杨连新, 王云霞, 朱建国, 等. 十年水稻FACE研究的产量响应[J]. 生态学报, 2009, 29(3): 1486-1497. YANG Lian-xin, WANG Yun-xia, ZHU Jian-guo, et al. What have we learned from 10 years of free air CO2 enrichment(FACE)experiments on rice grain yield?[J]. Acta Ecologica Sinica, 2009, 29(3): 1486-1497. |
| [38] |
袁嫚嫚, 朱建国, 刘钢, 等. 不同天气水稻光合日变化对大气CO2浓度和温度升高的响应:FACE研究[J]. 生态学报, 2018, 38(6): 1897-1907. YUAN Man-man, ZHU Jian-guo, LIU Gang, et al. Response of diurnal variation in photosynthesis to elevated atmospheric CO2 concentration and temperature of rice between cloudy and sunny days:A free air CO2 enrichment study[J]. Acta Ecologica Sinica, 2018, 38(6): 1897-1907. |
| [39] |
Bishop K A, Betzelberger A M, Long S P, et al. Is there potential to adapt soybean to future[CO2]? An analysis of the yield response of 18 genotypes in free-air CO2 enrichment[J]. Plant, Cell & Environment, 2015, 38(9): 1765-1774. |
| [40] |
秦大河, 罗勇, 陈振林, 等. 气候变化科学的最新进展:IPCC第四次评估综合报告解析[J]. 气候变化研究进展, 2007, 3(6): 311-314. QIN Da-he, LUO Yong, CHEN Zhen-lin, et al. Latest advances in climate change sciences:Interpretation of the synthesis report of the IPCC fourth assessment report[J]. Advances in Climate Change Research, 2007, 3(6): 311-314. |
| [41] |
秦大河. 气候变化科学与人类可持续发展[J]. 地理科学进展, 2014, 33(7): 874-883. QIN Da-he. Climate change science and sustainable development[J]. Progress in Geography, 2014, 33(7): 874-883. |
| [42] |
Di Paola A, Valentini R, Santini M. An overview of available crop growth and yield models for studies and assessments in agriculture[J]. Journal of the Science of Food and Agriculture, 2016, 96(3): 709-714. |
| [43] |
De Wit C, Brouwer R, De Vries F P. A dynamic model of plant and crop growth[M]//Potential crop production: A case study. Netherlands: Heinemann Educational Books. 1971: 117-142.
|
| [44] |
De Vries F P, Van Laar H. Simulation of growth processes and the model BACROS[J]. Simulation of Plant Growth and Crop Production, 1982, 114-135. |
| [45] |
Van Keulen, De Vries F P, Drees E. A summary model for crop growth[J]. Simulation of Plant Growth and Crop Production, 1982, 87-97. |
| [46] |
Van Ittersum M K, Leffelaar P A, Van Keulen H, et al. On approaches and applications of the Wageningen crop models[J]. European Journal of Agronomy, 2003, 18(3/4): 201-234. |
| [47] |
Angus J, Zandstra H. Climatic factors and the modeling of rice growth and yield: Proceedings of a symposium on the agrometeorology of the rice crop[C]. Philippines: IRRI, 1980.
|
| [48] |
Mohandass S, Natarajaratnam N, Kailasam C. A new hybrid model for panicle growth in rice(Oryza sativa L.)[J]. Journal of Agronomy and Crop Science, 1988, 161(3): 207-209. |
| [49] |
Acock B, Thornley J, Wilson J W. Photosynthesis and energy conversion[J]. Potential Crop Production, 1971, 43-75. |
| [50] |
Acock B, Allen Jr L. Crop responses to elevated carbon dioxide concentrations[J]. Direct Effects of Increasing Carbon Dioxide on Vegetation, 1985, 53-97. |
| [51] |
Charles-Edwards D A. The mathematics of photosynthesis and productivity[M]. Academic Press: 1981.
|
| [52] |
Farquhar G D, Von Caemmerer S. Modelling of photosynthetic response to environmental conditions[J]. Physiological Plant Ecology, 1982, 549-587. |
| [53] |
Ball J T, Woodrow I E, Berry J A. A model predicting stomatal conductance and its contribution to the control of photosynthesis under different environmental conditions[M]. Springer: Progress in Photosynthesis Research, 1987: 221-224.
|
| [54] |
Long S P. Modification of the response of photosynthetic productivity to rising temperature by atmospheric CO2 concentrations:has its importance been underestimated?[J]. Plant, Cell & Environment, 1991, 14(8): 729-739. |
| [55] |
The prediction of canopy assimilation[M]//Boote K, Loomis R.Modeling crop photosynthesis: From biochemistry to canopy, 1991: 109-140.
|
| [56] |
Hansen J, Jones J. Scaling-up crop models for climate variability applications[J]. Agricultural Systems, 2000, 65(1): 43-72. |
| [57] |
Semenov M A, Porter J. Climatic variability and the modelling of crop yields[J]. Agricultural and Forest Meteorology, 1995, 73(3/4): 265-283. |
| [58] |
Tubiello F N, Donatelli M, Rosenzweig C, et al. Effects of climate change and elevated CO2 on cropping systems:model predictions at two Italian locations[J]. European Journal of Agronomy, 2000, 13(2/3): 179-189. |
| [59] |
Newbery F, Qi A, Fitt B D. Modelling impacts of climate change on arable crop diseases:Progress, challenges and applications[J]. Current Opinion in Plant Biology, 2016, 32: 101-109. |
| [60] |
Jin X, Kumar L, Li Z, et al. A review of data assimilation of remote sensing and crop models[J]. European Journal of Agronomy, 2018, 92: 141-152. |
| [61] |
Ainsworth E A, Rogers A. The response of photosynthesis and stomatal conductance to rising[CO2]:Mechanisms and environmental interactions[J]. Plant, Cell & Environment, 2007, 30(3): 258-270. |
| [62] |
Ziska L H, Teramura A H. CO2 enhancement of growth and photosynthesis in rice(Oryza sativa):Modification by increased ultraviolet-B radiation[J]. Plant Physiology, 1992, 99(2): 473-481. |
| [63] |
Leakey A, Bernacchi C, Dohleman F, et al. Will photosynthesis of maize(Zea mays)in the US Corn Belt increase in future[CO2] rich atmospheres? An analysis of diurnal courses of CO2 uptake under freeair concentration enrichment (FACE)[J]. Global Change Biology, 2004, 10(6): 951-962. |
| [64] |
Leakey A D, Uribelarrea M, Ainsworth E A, et al. Photosynthesis, productivity, and yield of maize are not affected by open-air elevation of CO2 concentration in the absence of drought[J]. Plant Physiology, 2006, 140(2): 779-790. |
| [65] |
Farquhar G D, Caemmerer S V, Berry J A. A biochemical model of photosynthetic CO2 assimilation in leaves of C3 species[J]. Planta, 1980, 149(1): 78-90. |
| [66] |
Ehleringer J R, Cerling T E. Atmospheric CO2 and the ratio of intercellular to ambient CO2 concentrations in plants[J]. Tree Physiology, 1995, 15(2): 105-111. |
| [67] |
Gerbaud A, André M. Effect of CO2, O2, and light on photosynthesis and photorespiration in wheat[J]. Plant Physiology, 1980, 66(6): 1032-1036. |
| [68] |
Ehlers I, Augusti A, Betson T R, et al. Detecting long-term metabolic shifts using isotopomers:CO2-driven suppression of photorespiration in C3 plants over the 20th century[J]. Proceedings of the National Academy of Sciences, 2015, 112(51): 15585-15590. |
| [69] |
Tuba Z, Lichtenthaler H K. Long-term acclimation of plants to elevated CO2 and its interaction with stresses[J]. Annals of the New York Academy of Sciences, 2007, 1113(1): 135-146. |
| [70] |
Daepp M, Suter D, Almeida J P, et al. Yield response of Lolium perenne swards to free air CO2 enrichment increased over six years in a high N input system on fertile soil[J]. Global Change Biology, 2000, 6(7): 805-816. |
| [71] |
Hymus G J, Baker N R, Long S P. Growth in elevated CO2 can both increase and decrease photochemistry and photoinhibition of photosynthesis in a predictable manner. Dactylis glomerata grown in two levels of nitrogen nutrition[J]. Plant Physiology, 2001, 127(3): 1204-1211. |
| [72] |
Micallef B J, Haskins K A, Vanderveer P J, et al. Altered photosynthesis, flowering, and fruiting in transgenic tomato plants that have an increased capacity for sucrose synthesis[J]. Planta, 1995, 196(2): 327-334. |
| [73] |
Stitt M, Krapp A. The interaction between elevated carbon dioxide and nitrogen nutrition:The physiological and molecular background[J]. Plant, Cell & Environment, 1999, 22(6): 583-621. |
| [74] |
Bloom A J, Smart D R, Nguyen D T, et al. Nitrogen assimilation and growth of wheat under elevated carbon dioxide[J]. Proceedings of the National Academy of Sciences, 2002, 99(3): 1730-1735. |
| [75] |
Bloom A J, Asensio J S R, Randall L, et al. CO2 enrichment inhibits shoot nitrate assimilation in C3 but not C4 plants and slows growth under nitrate in C3 plants[J]. Ecology, 2012, 93(2): 355-367. |
| [76] |
Van Oijen M, Ewert F. The effects of climatic variation in Europe on the yield response of spring wheat cv. Minaret to elevated CO2 and O3:An analysis of open-top chamber experiments by means of two crop growth simulation models[J]. European Journal of Agronomy, 1999, 10(3/4): 249-264. |
| [77] |
Maliba B G, Inbaraj P M, Berner J M. Photosynthetic responses of canola and wheat to elevated levels of CO2, O3 and water deficit in open-top chambers[J]. Plants, 2019, 8(6): 171. |
| [78] |
Kimball B, Kobayashi K, Bindi M. Responses of agricultural crops to free-air CO2 enrichment[M]. Elsevier: Advances in Agronomy, 2002: 293-368.
|
| [79] |
Wand S J, Midgley G F, Jones M H, et al. Responses of wild C4 and C3 grass(Poaceae)species to elevated atmospheric CO2 concentration:A meta-analytic test of current theories and perceptions[J]. Global Change Biology, 1999, 5(6): 723-741. |
| [80] |
Leakey A D. Rising atmospheric carbon dioxide concentration and the future of C4 crops for food and fuel[J]. Proceedings of the Royal Society B:Biological Sciences, 2009, 276(1666): 2333-2343. |
| [81] |
王建林, 温学发. 气孔导度对CO2浓度变化的模拟及其生理机制[J]. 生态学报, 2010, 30(17): 4815-4820. WANG Jian-lin, WEN Xue-fa. Modeling the response of stmotal conductance to variable CO2 concentration and its physiological mechanism[J]. Acta Ecologica Sinica, 2010, 30(17): 4815-4820. |
| [82] |
刘玉洁, 陶福禄. 作物水分利用效率对温度和CO2浓度升高的响应研究进展[J]. 地理科学进展, 2013, 32(3): 416-424. LIU Yu-jie, TAO Fu-lu. Response of crop water use efficiency to elevated temperature and CO2 concentration:A review[J]. Progress in Geography, 2013, 32(3): 416-424. |
| [83] |
Kimball B, Idso S. Increasing atmospheric CO2:Effects on crop yield, water use and climate[J]. Agricultural Water Management, 1983, 7(1/2/3): 55-72. |
| [84] |
Rogers H H, Cure J D, Smith J M. Soybean growth and yield response to elevated carbon dioxide[J]. Agriculture, Ecosystems & Environment, 1986, 16(2): 113-128. |
| [85] |
Jablonski L M, Wang X, Curtis P S. Plant reproduction under elevated CO2 conditions:A meta-analysis of reports on 79 crop and wild species[J]. New Phytologist, 2002, 156(1): 9-26. |
| [86] |
Kimball B A. Crop responses to elevated CO2 and interactions with H2O, N, and temperature[J]. Current Opinion in Plant Biology, 2016, 31: 36-43. |
| [87] |
Fitzgerald G J, Tausz M, O' Leary G, et al. Elevated atmospheric[CO2] can dramatically increase wheat yields in semi-arid environments and buffer against heat waves[J]. Global Change Biology, 2016, 22(6): 2269-2284. |
| [88] |
Allen L H, Kimball B A, Bunce J A, et al. Fluctuations of CO2 in Free-Air CO2 Enrichment(FACE) depress plant photosynthesis, growth, and yield[J]. Agricultural and Forest Meteorology, 2020, 284: 107899. |
| [89] |
Yoshinaga S, Tokida T, Usui Y, et al. Analysis of factors related to varietal differences in the yield of rice(Oryza sativa L.)under free-air CO2 enrichment(FACE) conditions[J]. Plant Production Science, 2020, 23(1): 19-27. |
| [90] |
Liu H, Yang L, Wang Y, et al. Yield formation of CO2-enriched hybrid rice cultivar Shanyou 63 under fully open-air field conditions[J]. Field Crops Research, 2008, 108(1): 93-100. |
| [91] |
Yang L, Liu H, Wang Y, et al. Yield formation of CO2-enriched intersubspecific hybrid rice cultivar Liangyoupeijiu under fully open-air field condition in a warm sub-tropical climate[J]. Agriculture, Ecosystems & Environment, 2009, 129(1/2/3): 193-200. |
| [92] |
赖上坤, 周三妮, 顾伟锋, 等. 二氧化碳、施氮量和移栽密度对汕优63产量形成的影响-FACE研究[J]. 农业环境科学学报, 2014, 33(5): 836-843. LAI Shang-kun, ZHOU San-ni, GU Wei-feng, et al. Effects of CO2 concentration, nitrogen supply and transplanting density on yield formation of hybrid rice Shanyou 63:A FACE study[J]. Journal of AgroEnvironment Science, 2014, 33(5): 836-843. |
| [93] |
Lv C, Huang Y, Sun W, et al. Response of rice yield and yield components to elevated[CO2]:A synthesis of updated data from FACE experiments[J]. European Journal of Agronomy, 2020, 112: 125961. |
| [94] |
Mooney H, Drake B G, Luxmoore R, et al. Predicting ecosystem responses to elevated CO2 concentrations[J]. BioScience, 1991, 41(2): 96-104. |
| [95] |
Kimball B. The effects of free-air[CO2] enrichment of cotton, wheat, and sorghum[M]. Springer: Managed Ecosystems and CO2, 2006: 47-70.
|
| [96] |
Bishop K A, Leakey A D, Ainsworth E A. How seasonal temperature or water inputs affect the relative response of C3 crops to elevated[CO2]:A global analysis of open top chamber and free air CO2 enrichment studies[J]. Food and Energy Security, 2014, 3(1): 33-45. |
| [97] |
Ottman M J, Kimball B, Pinter P, et al. Elevated CO2 increases sorghum biomass under drought conditions[J]. New Phytologist, 2001, 150(2): 261-273. |
| [98] |
Manderscheid R, Erbs M, Weigel H J. Interactive effects of free-air CO2 enrichment and drought stress on maize growth[J]. European Journal of Agronomy, 2014, 52: 11-21. |
| [99] |
Ruiz-Vera U M, Siebers M H, Drag D W, et al. Canopy warming caused photosynthetic acclimation and reduced seed yield in maize grown at ambient and elevated[CO2][J]. Global Change Biology, 2015, 21(11): 4237-4249. |
| [100] |
Cotrufo M F, Ineson P, Scott A. Elevated CO2 reduces the nitrogen concentration of plant tissues[J]. Global Change Biology, 1998, 4(1): 43-54. |
| [101] |
Taub D R, Wang X. Why are nitrogen concentrations in plant tissues lower under elevated CO2? A critical examination of the hypotheses[J]. Journal of Integrative Plant Biology, 2008, 50(11): 1365-1374. |
| [102] |
Feng Z, Rütting T, Pleijel H, et al. Constraints to nitrogen acquisition of terrestrial plants under elevated CO2[J]. Global Change Biology, 2015, 21(8): 3152-3168. |
| [103] |
Tausz M, Norton R, Tausz-Posch S, et al. Can additional N fertiliser ameliorate the elevated CO2-induced depression in grain and tissue N concentrations of wheat on a high soil N background?[J]. Journal of Agronomy and Crop Science, 2017, 203(6): 574-583. |
| [104] |
Idso S B, Idso K E. Effects of atmospheric CO2 enrichment on plant constituents related to animal and human health[J]. Environmental and Experimental Botany, 2001, 45(2): 179-199. |
| [105] |
Loladze I. Hidden shift of the ionome of plants exposed to elevated CO2 depletes minerals at the base of human nutrition[J]. Elife, 2014, 3: e02245. |
| [106] |
Pleijel H, Uddling J. Yield vs. quality trade-offs for wheat in response to carbon dioxide and ozone[J]. Global Change Biology, 2012, 18(2): 596-605. |
| [107] |
Zhu C, Kobayashi K, I. Loladze, et al. Carbon dioxide(CO2)levels this century will alter the protein, micronutrients, and vitamin content of rice grains with potential health consequences for the poorest rice-dependent countries[J]. Science Advances, 2018, 4(5): eaaq1012.
|
| [108] |
Lee T D, Barrott S H, Reich P B. Photosynthetic responses of 13 grassland species across 11 years of free-air CO2 enrichment is modest, consistent and independent of N supply[J]. Global Change Biology, 2011, 17(9): 2893-2904. |
| [109] |
Loladze I. Rising atmospheric CO2 and human nutrition:toward globally imbalanced plant stoichiometry?[J]. Trends in Ecology & Evolution, 2002, 17(10): 457-461. |
| [110] |
Tulchinsky T H. Micronutrient deficiency conditions:Global health issues[J]. Public Health Reviews, 2010, 32(1): 243-255. |
 2020, Vol. 39
2020, Vol. 39



