2. 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所), 南京 210008;
3. 安徽大学矿山生态修复工程实验室, 合肥 230000;
4. 中国科学院土壤与农业可持续发展国家重点实验室, 南京土壤研究所, 南京 210008
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. Mine Ecological Restoration Engineering Laboratory of Anhui University, Hefei 230000, China;
4. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
镉(Cd)在环境中迁移性强[1],可通过食物链积累,对动植物和人均有不同程度的危害[2-5]。因此,Cd污染问题受到人们的广泛关注。生物炭是生物质在厌氧高温条件下的热解产物[6],具有高度芳香性、大的比表面积、丰富的含氧官能团和矿物质离子[7-8],在诸多领域里具有广泛的应用前景[9]。化学稳定法是一种通过化学稳定剂来降低重金属在土壤中的迁移率的有效方法[10]。炭材料可增加土壤阳离子交换量、持水量、微生物活性以及植物生长所需营养元素的有效性[11];此外,生物炭可高效吸附固定土壤中的阳离子型重金属污染物,降低土壤中有效态重金属含量。研究表明生物炭可有效吸附固定土壤中的Cd[12],降低Cd在土壤中的可溶性和迁移率[13-14],从而进一步控制植物中Cd含量[15-16],但关于长期施用生物炭对农田土壤中Cd生物有效性的影响研究较少。
小麦和水稻是我国主要粮食作物[17],在我国诸多地区均存在小麦和大米Cd超标问题,人体摄入的Cd很大一部分来自于谷物[18-19],且Cd很难随着人体代谢排出体外,若其在人体中持续积累会严重损害人体健康[20-21]。秸秆还田是我国应用广泛且传统的处理农业废弃物的有效方法,生物炭还田作为一种新型方法受到广泛关注[22]。将当季作物秸秆作为生物质原料制得的生物炭应用于农田土壤,可在实现作物秸秆减量化和资源化的同时,降低农田土壤中重金属的生物有效性。因此,研究实际农田土壤中长期施用生物炭对小麦和水稻中Cd的生物有效性影响具有重要意义。本研究结合大田试验和实验室微观实验,研究Cd在长期施用生物炭土壤中的吸附-解吸过程,并结合大田稻麦轮作系统,探究长期施用生物炭对小麦和水稻籽粒吸收Cd的影响,其研究结果为生物炭农用风险评估提供理论支撑,也为生物炭修复Cd污染农田土壤提供技术支撑。
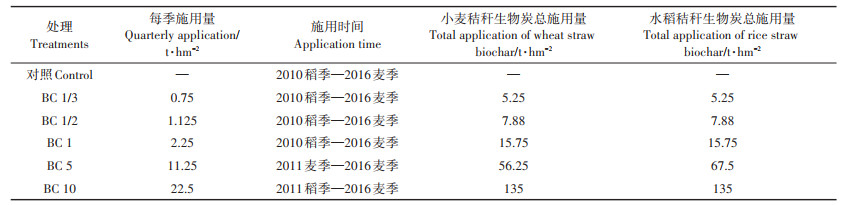
1 材料与方法 1.1 田间试验大田试验地点位于江苏宜兴(31°16′ N,119°54′ E)。对农田土壤进行6个处理,按照生物炭每季施用量将处理分别命名为:对照、BC 1/3、BC 1/2、BC 1、BC5、BC 10,每个处理设3个平行。生物炭是以当季作物秸秆为生物质原料,500 ℃限氧条件下裂解8 h所得[23]。该试验田从2010年起稻季施入小麦秸秆生物炭、麦季施入水稻秸秆生物炭,至2016年麦季止共进行了7 a的稻麦轮作试验。对应处理生物炭的施用量及时间见表 1。
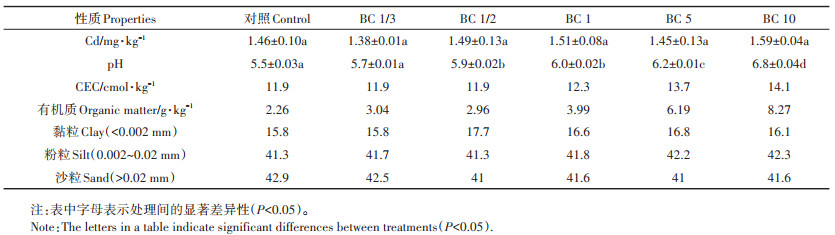
1.2 样品采集与分析试验土壤采集于2016年6月麦季后,在不同处理的实验田区域内随机采集0~20 cm耕地土壤,经自然风干后研磨,过20目筛。土壤样品经HClO4-HFHNO3法消解[25],通过电感耦合等离子体质谱仪(ICPMS)(Thermo Fisher,美国)和原子吸收分光光度计(Hitachi,日本)测定Cd元素含量,测定结果见表 2。土壤pH测定是将土壤和去CO2超纯水以固液比1: 2.5置于康宁管中,振荡1 h后静置测其溶液的pH和电导率[27],结果见表 2。土壤有机质含量测定采取重铬酸钾氧化-容量法[28]。土壤有效态Cd含量是将农田土壤与0.01 mol·L-1 CaCl2以1:10混合,振荡4 h后离心过滤[29],采用ICP-MS测定提取液中Cd2+的浓度。
水稻籽粒和小麦籽粒分别收集于2015年11月稻季和2016年6月麦季,将籽粒自然风干后碾碎,取0.1 g籽粒粉末于微波消解管中,加入10 mL浓HNO3消解完全,赶酸至近干后,用2% HNO3定容,过滤后澄清液通过ICP-MS测定消解液中Cd含量。
1.3 吸附和解吸实验吸附热力学实验:以10 mmol·L-1 NaNO3为支持电解质溶解Cd(NO3)2·4H2O,分别配制20、40、60、100、150、300 mg·L-1 Cd2+溶液[24],称取0.5 g土壤置于50 mL康宁管中,加入25 mL不同浓度Cd2+溶液,在200 r·min-1、25 ℃条件下振荡24 h[30-31]后以10 000 r· min-1离心6 min,取部分上清液通过0.45 μm PES滤膜过滤,采用AAS分析溶液中Cd2+浓度。
土壤解吸实验:将康宁管中剩余液体移出,加入25 mL 10 mmol·L-1 NaNO3后置于恒温振荡箱,在200 r·min-1、25 ℃条件下振荡24 h[24, 32],取出后置于离心机内以10 000 r·min-1离心8 min,取上清液并过滤,通过AAS测定溶液中Cd2+浓度。解吸率是不同处理的土壤解吸量与吸附量的比值。
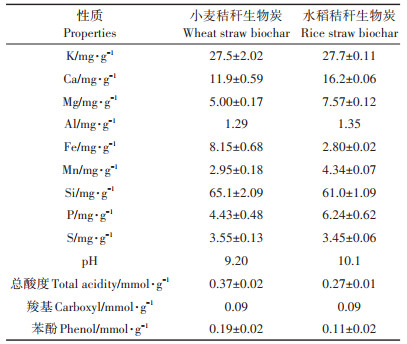
2 结果与讨论 2.1 生物炭改良后的土壤性质XRD图谱显示水稻和小麦秸秆生物炭中富含钾盐、CaCO3等物质,这使得生物炭自身呈碱性[24]。秸秆生物炭的元素含量及酸性官能团含量见表 3,与XRD结果相符,生物炭中含有大量的碱性阳离子(K+、Ca2+、Na+、Mg2+),其施入到农田土壤后,碱性离子扩散到土壤环境中使土壤pH呈升高趋势[33-34](表 2),且随生物炭施用量的增加土壤pH升高越显著,BC 10处理的土壤pH(6.8)较对照组增加了1.3个单位。长期施用生物炭会改善土壤的CEC[35],随着生物炭施用量的增加土壤CEC也呈现上升趋势,这与生物炭自身具有较高的CEC和灰分含量有关,且生物炭施入土壤后向环境中缓慢释放的无机盐[36]可增强土壤CEC。供试所用水稻秸秆生物炭CEC(24.1 cmol·kg-1)是土壤本身CEC(11.9 cmol·kg-1)的2倍,也能很好地说明生物炭具备改善土壤CEC的能力。由于生物炭本身在土壤环境中性质稳定且难以降解,由施用生物炭增加的有机质能够在土壤中稳定存在[37],故长期施用生物炭可显著增加土壤中有机质含量,且施用量越大改善效果越显著。
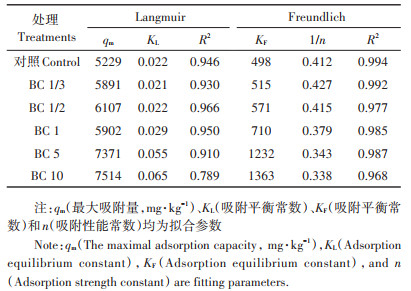
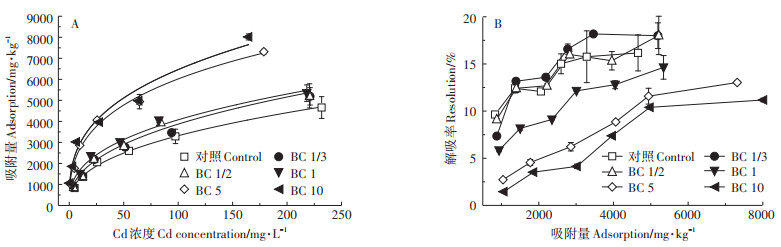
2.2 Cd在土壤表面的吸附等温线基于批平衡吸附实验,初步探究了不同生物炭处理的土壤对Cd的吸附固定作用,并用Langmuir和Freundlich吸附模型拟合了吸附等温线,拟合参数见表 4。结果表明Freundlich吸附模型能很好地描述Cd在土壤中的吸附过程,拟合结果见图 1A。随着生物炭施用量的增加,土壤对Cd的吸附量逐渐增加,Cd在土壤上的最大吸附量也逐渐增加,BC 10处理土壤较对照土壤Cd最大吸附量增加了1.74倍。这主要是由于生物炭的施用量越大对土壤的性质改变越显著,主要体现在土壤pH、CEC和有机质的增加。土壤pH对土壤重金属的形态及迁移存在显著影响[38],水稻秸秆和小麦秸秆生物炭呈强碱性,随着生物炭施用量的增加土壤pH显著增加,从而增大了土壤颗粒表面的电负性,也增加了Cd在土壤表面的吸附固定能力。此外,生物炭中富含带负电荷的含氧官能团如羧基,这些基团有较强的络合重金属的能力[38],生物炭的施入增加了土壤有机质含量,从而能有效增强土壤对Cd的吸附能力。同样,生物炭的施用量增加使土壤的CEC增加,从而增强了土壤对Cd的吸附[39]。
|
|
表 4 Cd在不同处理土壤表面的吸附等温线拟合参数 Table 4 Langmuir and Freundlich sorption isotherm parameters of Cd on different treated soil surfaces |
|
图 1 Cd在土壤上的吸附等温线(A)及解吸率(B) Figure 1 Adsorption isotherms(A)and desorption rate(B)of Cd on soils |
为进一步评价生物炭的施入对土壤吸附固定Cd稳定性的影响,探究了土壤颗粒表面Cd的解吸过程(图 1B),结果表明随着生物炭施用量的增加,土壤表面Cd的解吸率降低。这是由于生物炭的施用量越增加对土壤pH的影响越显著[37, 40],使得对应处理土壤中吸附的Cd可交换态更多地转化为不可交换态[41],降低了土壤中Cd的解吸率。另外,生物炭的施入可增加土壤中有机质含量,从而增强土壤吸附Cd的稳定性,降低土壤对已吸附Cd的解吸率。
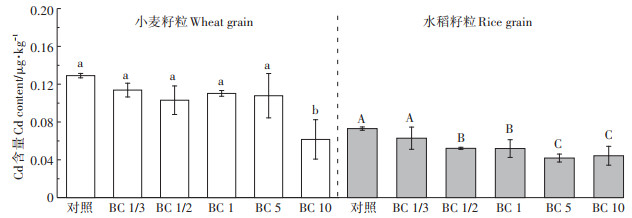
2.4 不同生物炭处理对Cd生物有效性的影响 2.4.1 水稻和小麦籽粒中Cd含量水稻和小麦籽粒中Cd含量见图 2。由图 2可知,生物炭的施入可降低水稻和小麦籽粒中Cd的含量,虽然以当季作物秸秆生物炭施加到土壤中会增加土壤中的Cd含量,但由于生物炭富含有机质、CEC且pH值较高,可显著增强土壤对Cd的吸附固定能力,抑制土壤中的Cd向小麦和水稻籽粒中迁移。当土壤中生物炭的施用量达到270 t·hm-2时能显著降低小麦籽粒中Cd的含量,这是由于施入的生物炭不仅能增强土壤的吸附固定能力,还能有效降低土壤颗粒表面Cd的解吸率,且生物炭的施用量越大,土壤Cd解吸率越低,农田土壤中Cd的生物有效性越小,这与我们前面的吸附-解吸结果一致。
|
A、B、C表示水稻籽粒Cd含量显著差异性;a、b表示小麦籽粒Cd含量显著差异性 A, B, C indicates the significant difference of grain Cd content in rice; a, b indicates the significant difference of grain Cd content in wheat 图 2 小麦和水稻籽粒中Cd的含量 Figure 2 Total Cd concentrations in wheat grains and rice grains |
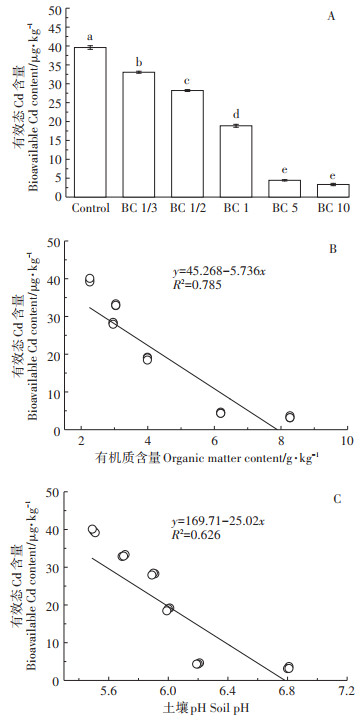
重金属的生物富集过程除了与其总量相关外,还与其形态密切相关,为此,实验采用0.01 mol·L-1 CaCl2试剂浸提分析了土壤中有效态Cd含量(图 3A)。随着生物炭施用量的增加土壤有效态Cd含量显著降低,当生物炭的施用量达123.8 t·hm-2和270 t·hm-2时,可降低土壤中88.8%和91.6%的有效态Cd含量,表明生物炭的施入可有效降低土壤中Cd的有效态。为此进一步探究生物炭的施入对土壤有效态Cd含量的影响机制,分析了土壤pH和有机质的含量与土壤有效态Cd含量之间的相关性(图 3B、图 3C),结果表明,土壤有效态Cd含量与土壤pH(P < 0.01)和有机质含量(P < 0.01)均有显著相关性。进一步证明了生物炭主要是通过增加土壤pH和有机质含量来增强土壤对Cd的有效态的固定,进而降低农田土壤中Cd的生物有效性。这与Jing等[42]研究结果一致:随生物炭施用量增加土壤pH和有机质含量显著增加,从而降低土壤可酸溶性Cd含量,通过控制土壤有效态Cd可减少水稻根系和籽粒中Cd含量。生物炭对于土壤的改良作用受生物炭自身性质约束,同时也受土壤pH等条件的影响,Xiao等[36]以碱性土壤为例,提出生物炭对土壤pH及有机质含量影响显著。但研究结果表明生物炭还田方法对于酸性土壤的pH影响更显著,因此可望广泛应用在酸性Cd污染土壤修复和酸性Cd污染农田土壤农用风险控制领域。
|
a、b、c表示土壤有效态Cd含量显著差异性 a, b, c indicates the significant difference of bioavailable Cd content in soil 图 3 不同处理土壤中有效态Cd含量(A)及其与土壤有机质(B)和pH(C)的相关性 Figure 3 The concentration of the bioavailability of Cd in different treated soils(A). Correlation between the concentration of the bioavailability of Cd with soil organic matter (B)and soil pH(C) |
(1)长期施用生物炭可显著增加土壤pH、CEC和有机质含量,有效增强土壤Cd容量的同时降低土壤颗粒表面Cd的解吸率,降低土壤中Cd的生物有效性。
(2)长期施用生物炭可有效降低小麦籽粒和水稻籽粒中Cd含量。
| [1] |
朱雅兰. 小白菜对镉污染土壤的植物修复[J]. 广东农业科学, 2010(2): 68-72. ZHU Ya-lan. Phytoremediation of cadmium polluted soil by Brassica Chinensis[J]. Guangdong Agricultural Science, 2010(2): 68-72. DOI:10.3969/j.issn.1004-874X.2010.02.024 |
| [2] |
Friol Boim A G, Azevedo Melo L C, Moreno F N, et al. Bioconcentration factors and the risk concentrations of potentially toxic elements in garden soils[J]. Journal of Environmental Management, 2016, 170: 21-27. |
| [3] |
Hu Y, Cheng H, Tao S, et al. The challenges and solutions for cadmium-contaminated rice in China:A critical review[J]. Environment International, 2016, 92/93: 515-532. DOI:10.1016/j.envint.2016.04.042 |
| [4] |
Liu B, Ai S, Zhang W Y, et al. Assessment of the bioavailability and transfer of heavy metals in the soil-grain-human systems near a mining and smelting area in NW China[J]. Science of the Total Environment, 2017a, 609: 822-829. DOI:10.1016/j.scitotenv.2017.07.215 |
| [5] |
吴霄霄, 米长虹, 吴昊, 等. 镉污染稻田修复效果评价指标体系的构建[J]. 农业环境科学学报, 2019, 38(7): 1498-1505. WU Xiao-xiao, MI Chang-hong, WU Hao, et al. Construction of an evaluation index system to evaluate the remediation effect of cadmium pollution in paddy soils[J]. Journal of Agro-Environment Science, 2019, 38(7): 1498-1505. |
| [6] |
Bird M I, Wynn J G, Saiz G, et al. The pyrogenic carbon cycle[J]. Annual Review of Earth and Planetary Sciences, 2015, 43(1): 273-298. DOI:10.1146/annurev-earth-060614-105038 |
| [7] |
Ahmed M B, Zhou J L, Ngo H, et al. Adsorptive removal of antibiotics from water and wastewater:Progress and challenges[J]. Science of the Total Environment, 2015, 532: 112-126. DOI:10.1016/j.scitotenv.2015.05.130 |
| [8] |
Klinar D. Universal model of slow pyrolysis technology producing biochar and heat from standard biomass needed for the techno-economic assessment[J]. Bioresource Technology, 2016, 206: 112-120. DOI:10.1016/j.biortech.2016.01.053 |
| [9] |
Pignatello J J, Mitch W A, Xu W Q. Activity and reactivity of pyrogenic carbonaceous matter toward organic compounds[J]. Environmental Science & Technology, 2017, 51(16): 8893-8908. |
| [10] |
柯国洲, 彭书平, 徐涛, 等. 土壤重金属镉修复技术研究进展[J]. 广州化工, 2017, 45(14): 28-31. KE Guo-zhou, PENG Shu-ping, XU Tao, et al. Research progress on remediation technology on soil heavy metal of cadmium in soil[J]. Guangzhou Chemical Industry, 2017, 45(14): 28-31. DOI:10.3969/j.issn.1001-9677.2017.14.011 |
| [11] |
郭振, 徐艳, 李娟. 我国农业园区土壤重金属镉的研究进展[J]. 绿色科技, 2018(20): 137-139. GUO Zhen, XU Yan, LI Juan. Research progress on heavy metal cadmium in soil of agricultural parks in China[J]. Journal of Green Science and Technology, 2018(20): 137-139. |
| [12] |
David H, Laurent E, Philippe S. Mobility, bioavailability and pH-dependent leaching of cadmium, zinc and lead in a contaminated soil amended with biochar[J]. Chemosphere, 2013, 92(11): 1450-1457. DOI:10.1016/j.chemosphere.2013.03.055 |
| [13] |
Peng L, Deng X Z, Song H J, et al. Manganese enhances the immobilization of trace cadmium from irrigation water in biological soil crust[J]. Ecotoxicology and Environmental Safety, 2019, 168: 369-377. DOI:10.1016/j.ecoenv.2018.10.087 |
| [14] |
Qayyum M F, Abid M, Danish S, et al. Effects of various biochars on seed germination and carbon mineralization in an alkaline soil[J]. Pakistan Journal of Agricultural Sciences, 2015, 51(4): 977-982. |
| [15] |
Sardar K, Cai C, Muhammad W, et al. Sewage sludge biochar influence upon rice(Oryza sativa L) yield, metal bioaccumulation and greenhouse gas emissions from acidic paddy soil[J]. Environmental Science & Technology, 2013, 47(15): 8624-8632. |
| [16] |
Jung K W, Lee S Y, Lee Y J. Hydrothermal synthesis of hierarchically structured birnessite-type MnO2/biochar composites for the adsorptive removal of Cu(Ⅱ)from aqueous media[J]. Bioresource Technology, 2018, 260: 204-212. DOI:10.1016/j.biortech.2018.03.125 |
| [17] |
Curtis T, Halford N G. Food security:The challenge of increasing wheat yield and the importance of not compromising food safety[J]. Annals of Applied Biology, 2014, 164(3): 354-372. DOI:10.1111/aab.12108 |
| [18] |
Rizwan M, Ali S, Abbas T, et al. Cadmium minimization in wheat:A critical review[J]. Ecotoxicology and Environmental Safety, 2016, 130: 43-53. DOI:10.1016/j.ecoenv.2016.04.001 |
| [19] |
Rizwan M, Ali S, Adrees M, et al. A critical review on effects, tolerance mechanisms and management of cadmium in vegetables[J]. Chemosphere, 2017, 182: 90-105. DOI:10.1016/j.chemosphere.2017.05.013 |
| [20] |
Wu X, Jia Y, Zhu H. Bioaccumulation of cadmium bound to ferric hydroxide and particulate organic matter by the bivalve M. meretrix[J]. Environmental Pollution, 2012, 165: 133-139. DOI:10.1016/j.envpol.2012.02.023 |
| [21] |
Tapia Y, Cala V, Eymar E, et al. Chemical characterization and evaluation of composts as organic amendments for immobilizing cadmium[J]. Bioresource Technology, 2010, 101(14): 5437-5443. DOI:10.1016/j.biortech.2010.02.034 |
| [22] |
Singh B, Singh B P, Cowie A L. Characterisation and evaluation of biochars for their application as a soil amendment[J]. Australian Journal of Soil Research, 2010, 48(7): 516-525. DOI:10.1071/SR10058 |
| [23] |
Wang Y, Hu Y T, Zhao X, et al. Comparisons of biochar properties from wood material and crop residues at different temperatures and residence times[J]. Energy & Fuels, 2013, 27(10): 5890-5899. |
| [24] |
吴萍. Zn在生物炭上的吸附固定分子机制及其环境效应[D].南京: 中国科学院南京土壤研究所, 2019. WU Ping. The immobilization molecular mechanism of Zn on biochar and its environmental effects[D]. Nanjing: Institute of Soil Science, Chinese Academy of Sciences, 2019. |
| [25] |
Wu P, Cui P X, Fang G D, et al. Sorption mechanism of zinc on reed, lignin, and reed-and lignin-derived biochars:kinetics, equilibrium, and spectroscopic studies[J]. Journal of Soils and Sediments, 2018, 18(2): 2535-2543. |
| [26] |
Wu P, Cui P X, Fang G D, et al. Biochar decreased the bioavailability of Zn to rice and wheat grains:Insights from microscopic to macroscopic scales[J]. Science of Total Environment, 2018, 621: 160-167. DOI:10.1016/j.scitotenv.2017.11.236 |
| [27] |
王风, 王梦露, 许堃, 等. 生物炭施用对棕壤重金属镉赋存形态及油菜吸收镉的影响[J]. 农业环境科学学报, 2017, 36(5): 907-914. WANG Feng, WANG Meng-lu, XU Kun, et al. Effects of biochar application on cadmium transformation in brown soil and uptake by baby bokchoi[J]. Journal of Agro-Environment Science, 2017, 36(5): 907-914. |
| [28] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Methods of soil agrochemical analysis[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [29] |
颜世红, 吴春发, 胡友彪. 典型土壤中有效态镉CaCl2提取条件优化研究[J]. 中国农学通报, 2013, 29(9): 99-104. YAN Shi-hong, WU Chun-fa, HU You-biao. Optimization of CaCl2 extraction of available cadmium in typical soils[J]. Chinese Agricultural Science Bulletin, 2013, 29(9): 99-104. DOI:10.3969/j.issn.1000-6850.2013.09.018 |
| [30] |
Gao L Y, Deng J H, Huang G F, et al. Relative distribution of Cd2+ adsorption mechanisms on biochars derived from rice straw and sewage sludge[J]. Bioresource Technology, 2019, 272: 114-122. DOI:10.1016/j.biortech.2018.09.138 |
| [31] |
Sun Q, Cui P X, Zhu M Q, et al. Cd(Ⅱ)retention and remobilization on δ-MnO2 and Mn(Ⅲ)-rich δ-MnO2 affected by Mn(Ⅱ)[J]. Environment International, 2019, 130: 104932. DOI:10.1016/j.envint.2019.104932 |
| [32] |
Sun Q, Cui P X, Fan T T, et al. Effects of Fe(Ⅱ)on Cd(Ⅱ)immobilization by Mn(Ⅲ)-rich δ-MnO2[J]. Chemical Engineering Journal, 2018, 353: 167-175. DOI:10.1016/j.cej.2018.07.120 |
| [33] |
Xu P, Sun C X, Ye X Z, et al. The effect of biochar and crop straws on heavy metal bioavailability and plant accumulation in a Cd and Pb polluted soil[J]. Ecotoxicology and Environmental Safety, 2016, 132: 94-100. DOI:10.1016/j.ecoenv.2016.05.031 |
| [34] |
Houben D, Evrard L, Sonnet P. Mobility, bioavailability and pH-dependent leaching of cadmium, zinc and lead in a contaminated soil amended with biochar[J]. Chemosphere, 2013, 92(11): 1450-1457. DOI:10.1016/j.chemosphere.2013.03.055 |
| [35] |
Ji Q, Zhao S X, Li Z H, et al. Effects of biochar-straw on soil aggregation, organic carbon distribution, and wheat growth[J]. Agronomy Journal, 2016, 108(5): 2129-2136. DOI:10.2134/agronj2016.02.0121 |
| [36] |
Xiao R, Wang P, Mi S S, et al. Effects of crop straw and its derived biochar on the mobility and bioavailability in Cd and Zn in two smelter-contaminated alkaline soils[J]. Ecotoxicology and Environmental Safety, 2019, 181: 155-163. DOI:10.1016/j.ecoenv.2019.06.005 |
| [37] |
Ippolito J A, Strawn D G, Scheckel K G, et al. Macroscopic and molecular investigations of copper sorption by a steam-activated biochar[J]. Journal of Environmental Quality, 2012, 41(4): 150-156. |
| [38] |
Abbas T, Rizwan M, Ali S, et al. Effect of biochar on cadmium bioavailability and uptake in wheat(Triticum aestivum L.)grown in a soil with aged contamination[J]. Ecotoxicology and Environmental Safety, 2017, 140: 37-47. DOI:10.1016/j.ecoenv.2017.02.028 |
| [39] |
Chintala R, Schumacher T E, Mcdonald L M, et al. Phosphorus sorption and availability from biochars and soil/biochar mixtures[J]. Clean Soil Air Water, 2014, 42(5): 626-634. DOI:10.1002/clen.201300089 |
| [40] |
Singh D, Mclaren R G, Cameron K C. Effect of pH on zinc sorptiondesorption by soils[J]. Communications in Soil Science and Plant Analysis, 2008, 39(19): 2971-2984. |
| [41] |
Stahl R S, James B R. Zinc sorption by B-horizon soils as a function of pH[J]. Soil Science Society of America Journal, 1991, 55(6): 1592-1597. DOI:10.2136/sssaj1991.03615995005500060015x |
| [42] |
Jing F, Chen C, Chen X M, et al. Effects of wheat straw derived biochar on cadmium availability in a paddy soil and its accumulation in rice[J]. Environmental Pollution, 2020, 257: 113592. DOI:10.1016/j.envpol.2019.113592 |
 2020, Vol. 39
2020, Vol. 39