重金属镉(Cd)由于交通运输、工业排放、大气沉降等活动在土壤中不断积累,对城市环境质量与居民身心健康造成潜在危害[1]。利用植物修复技术进行土壤重金属污染的治理,拥有良好的发展前景。但如何提高植物的重金属修复效率,是近年来相关研究关注的热点问题[2]。研究表明,土壤微生物可以通过分泌铁载体[3]、有机酸[4]、表面活性剂[5]等活性物质改变重金属在土壤中的形态,增加植物对重金属的耐性与吸收,同时促进植物生长,提高植物修复重金属效率[6-7]。因此,微生物-植物联合修复技术成为强化植物重金属修复的重要手段之一。
胶质芽孢杆菌(Bacillus mucilaginosus)作为一种根际促生菌,广泛应用于微生物肥料、矿物分解和生物絮凝等方面[8]。研究表明,胶质芽孢杆菌可以促进印度芥菜(Brassica juncea)的生长并提高其Cd吸收量[9];提高Brassica juncea对土壤中Pb、Zn、Cu的富集吸收能力[10];提高土壤酶活性[11]。蜀葵(Althaea rosea)为锦葵科蜀葵属园林观赏植物,具有生物量大、根系发达和适应能力强等特点[12]。研究表明蜀葵对重金属Cd、Pb具有较强的耐受性[13-14],同时施用外源物质可以促进蜀葵对Cd的富集与转运,使得蜀葵有潜力成为Cd超富集植物[15]。但目前围绕蜀葵进行微生物联合修复重金属污染土壤的研究尚不多见。本研究以蜀葵为试验植物,采用土壤盆栽试验,探讨蜀葵-胶质芽孢杆菌联合修复Cd污染土壤的能力,以期为土壤Cd污染的生态修复提供理论依据。
1 材料与方法 1.1 试验材料试验所用土壤采自四川农业大学成都校区周边0~20 cm的表层田园土,将其置于阴凉通风处风干、辗碎,过4 mm筛混匀备用。土壤理化性质如下:速效氮18.9 mg·kg-1、速效磷64.5 mg·kg-1、速效钾55.2 mg·kg-1,有机质含量21 g·kg-1,Cd含量0.06 mg·kg-1,pH 6.8。
蜀葵种子购于蓝翔园艺种苗有限责任公司,挑选大小一致、饱满的种子经5% NaClO溶液消毒30 min,去离子水洗净。播种于装满蛭石的穴盘内,浇透水后置于光照培养箱培养至4~5片叶,挑选长势一致的幼苗作为供试苗。胶质芽孢杆菌购买自山东绿陇生物公司(芽孢数≥50×108 CFU·g-1)。
1.2 试验设计试验于2017年9月底至2018年1月初在四川农业大学风景园林学院设施大棚内进行。试验设置土壤Cd浓度为25 mg·kg-1,共5个处理(表 1),每个处理3次重复。将Cd以分析纯CdCl2·2.5H2O固体粉末态与供试土壤充分混匀,装入塑料花盆(上缘直径22 cm,底面直径16 cm,高25 cm)中。每盆装土3 kg(以风干土计),静置平衡30 d。
|
|
表 1 试验设计 Table 1 Experimental design |
土壤平衡结束后进行胶质芽孢杆菌接种。接种方式为暗光条件下,分别称取9、18、27 g胶质芽孢杆菌粉剂,按3、6、9 g·kg-1的处理浓度与每盆土壤充分拌匀。装盆时采用根袋法区分根际土壤和非根际土壤。每个根袋内装土300 g放在花盆中间位置,根袋周围用土填满,保持根袋内外装土高度一致且根袋高于土面2 cm。用超纯水浇透后再用黑色塑料袋套住盆面,静置10 d。期间始终保持根袋内外土壤湿度一致,含水量为田间持水量的60%。静置后移栽蜀葵幼苗,每盆种植3株。处理期间采用超纯水进行水分管理,不额外施肥,处理70 d。
1.3 测试指标及方法 1.3.1 生物量的测定处理70 d后将植株从盆中取出,用超纯水冲洗干净,各植株样品分根、茎和叶3部分,用电子天平称量各部分鲜质量。之后分装置于80 ℃烘箱中烘干至恒质量,称量各部分干质量。
1.3.2 植物与土壤样品Cd含量的测定胁迫处理结束后,将根袋小心取出,采用抖落法收集根际土壤。将干燥的植物样品与土壤样品研磨至通过2 mm筛,土壤样品采用HNO3-HCl-HClO4法消化(V:V:V=1:1:2),植物样品采用HNO3-HClO4法消化(V:V=5:1)。待测液用AA-700原子吸收分光光度计(岛津,日本)测定Cd含量,测定波长为228.8 nm。土壤有效态Cd的测定参照Lindsay等[16]采用DTPA(pH 7.3)浸提法。
1.3.3 土壤酶活性的测定土壤相关酶活性测定参照关松荫[17]的方法:土壤脲酶活性采用靛酚蓝比色法测定,以24 h每克土壤产生NH3-N的毫克量为单位;土壤蔗糖酶采用3,5-二硝基水杨酸比色法测定,活性以24 h每克土壤产生葡萄糖的毫克量为单位;土壤脱氢酶活性采用三苯基四氮唑氯化物比色法测定,以24 h每克土壤产生三苯基甲臜的微克量为单位;土壤多酚氧化酶采用邻苯三酚比色法测定,活性以2 h每克土壤生成的紫色没食子酸毫克量为单位。
1.4 数据处理Excel 2010统计软件用于数据统计与绘图,SPSS 24.0软件用于分析数据,采用单因素方差分析(OneWay ANOVA),Duncan法进行多重比较,Pearson法进行相关性分析(双尾检验)。

|
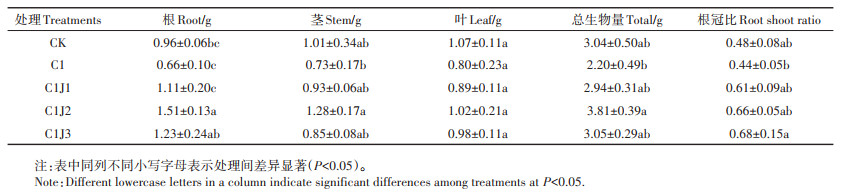
由表 2可知,与CK组相比,Cd处理造成蜀葵根、茎、叶及总生物量降低,但在Cd胁迫下施用不同浓度菌肥可提高蜀葵根冠比。相比于C1处理,C1J2处理下蜀葵根、茎与总生物量显著提高(P < 0.05),C1J3处理下蜀葵根冠比显著提高(P < 0.05)。
|
|
表 2 胶质芽孢杆菌对Cd胁迫下蜀葵干质量的影响 Table 2 Effects of Bacillus mucilaginosus on dry weight of Althaea rosea under cadmium stress |
由图 1可知,Cd胁迫下,C1J2处理显著提高蜀葵根、茎Cd含量(P < 0.05),C1J1和C1J3处理下,蜀葵根、茎Cd含量未发生显著变化;施用菌肥未对蜀葵叶片Cd含量产生影响。图 2显示,Cd胁迫下施用不同浓度菌肥,蜀葵各部位Cd积累量显著提高(P < 0.05),且在C1J2处理下,蜀葵整株Cd积累量相较于C1处理提高189%。
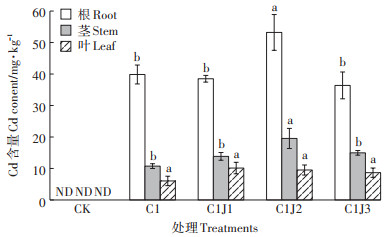
|
同系列不同小写字母表示处理间差异显著(P < 0.05);ND:未检出。下同 The different lowercase letters in a series indicate significant differences among treatments at P < 0.05;ND:Not detected. The same below 图 1 胶质芽孢杆菌对Cd胁迫下蜀葵Cd含量的影响 Figure 1 Effects of Bacillus mucilaginosus on cadmium content of Althaea rosea under cadmium stress |
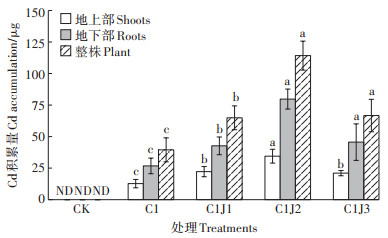
|
图 2 胶质芽孢杆菌对Cd胁迫下蜀葵Cd积累量的影响 Figure 2 Effects of Bacillus mucilaginosus on cadmium accumulation in Althaea rosea under cadmium stress |
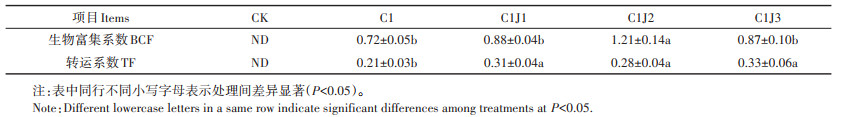
表 3显示,Cd胁迫下施用不同浓度菌肥,均可显著提高蜀葵对重金属Cd的转运系数(P < 0.05)。且与C1处理相比,C1J2处理显著提高了蜀葵Cd生物富集系数(P < 0.05),C1J1和C1J3处理下蜀葵Cd富集系数无显著变化。
|
|
表 3 胶质芽孢杆菌对Cd胁迫下蜀葵Cd富集系数、转运系数的影响 Table 3 Effects of Bacillus mucilaginosus on cadmium enrichment coefficient and transport coefficient of Althaea rosea under cadmium stress |
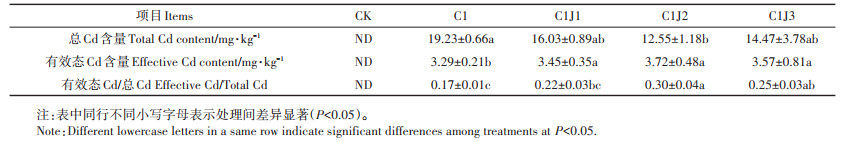
由表 4可知,与C1处理相比,施用菌肥后,蜀葵根际土壤总Cd含量下降,且C1J2处理下总Cd含量显著降低(P < 0.05)。施用菌肥后,根际土壤有效态Cd含量相比C1处理均显著上升(P < 0.05),其中C1J2处理下有效态Cd含量相比C1处理提高了13%,达到峰值。
|
|
表 4 胶质芽孢杆菌对Cd胁迫下蜀葵根际土壤总Cd及有效态Cd含量的影响 Table 4 Effects of Bacillus mucilaginosus on total cadmium and available cadmium in rhizosphere soil of Althaea rosea under cadmium stress |
由图 3可知,与CK组相比,C1处理下蜀葵根际土壤中脲酶、蔗糖酶、脱氢酶活性均显著减弱(P < 0.05),而多酚氧化酶活性显著增强(P < 0.05)。Cd胁迫下,随着菌肥施用浓度的上升,根际土壤中脲酶、蔗糖酶、脱氢酶活性均显著增强(P < 0.05),而多酚氧化酶活性减弱且差异显著(P < 0.05)。
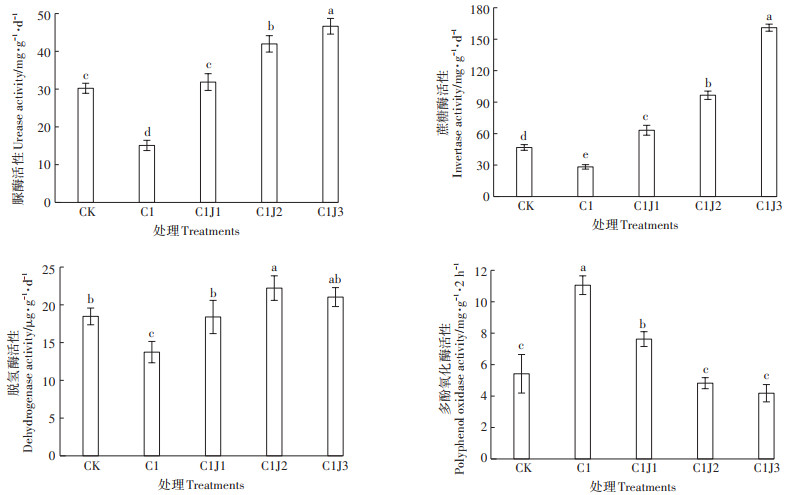
|
图 3 胶质芽孢杆菌对Cd胁迫下蜀葵根际土壤酶活性的影响 Figure 3 Effects of Bacillus mucilaginosus on activities of soil enzymes in rhizosphere of Althaea rosea under cadmium stress |
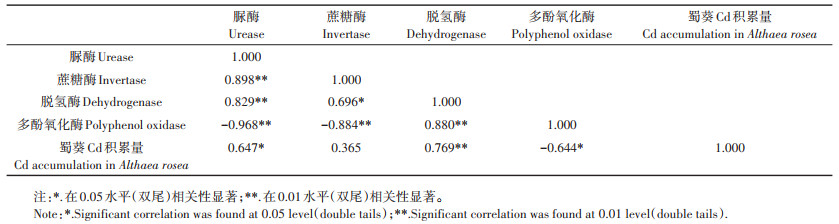
由表 5分析可得,蜀葵Cd积累量与根际土壤中脲酶活性呈显著正相关(P < 0.05),与蔗糖酶活性呈正相关,与脱氢酶活性呈极显著正相关(P < 0.01),但与多酚氧化酶活性呈显著负相关(P < 0.05)。综合表明,蜀葵根际土壤中脲酶、脱氢酶和多酚氧化酶活性对蜀葵的Cd积累量影响能力强,蔗糖酶活性影响力弱。
|
|
表 5 蜀葵根际土壤酶活性与蜀葵Cd积累量间的相关性(n=12) Table 5 Correlation between soil enzymes activity and cadmium accumulation in rhizosphere of Althaea rosea(n=12) |
植物生物量是研究逆境胁迫的常用指标,是植株生长状态的综合体现。研究表明,在重金属胁迫下,接种微生物可促进植物生长[18]。本试验结果表明,Cd胁迫下施用不同浓度胶质芽孢杆菌促进了蜀葵的生长,表现为蜀葵根、茎生物量与根冠比提高。这与Li等[19]、张宇羽等[20]报道的结果一致,原因在于芽孢杆菌分泌的如吲哚乙酸、赤霉素和细胞分裂素等胞外代谢产物[21-22]可以刺激根系扩张及不定根、侧根的发育[23],从而促进植物生长。同时,胶质芽孢杆菌胞外产生的荚膜多糖具有一定的生理活性,可以改善土壤团粒结构[24],提高土壤肥力,促进植物生长。
生物富集系数与转运系数可评估植物对重金属的吸附效率,富集系数可评价植物吸收土壤中重金属能力的高低,转运系数可反映植物对重金属从地下部转移到地上部能力的大小[25]。微生物可通过自身代谢产生的分泌物活化、络合土壤中的Cd,从而改变土壤Cd有效性,影响植物对Cd的富集及转运[26]。本试验中,施用6 g·kg-1胶质芽孢杆菌显著提高了蜀葵根、茎Cd含量与植株Cd积累量。这与Luo等[27]、赵树民等[28]试验结果一致,原因在于根际土壤中有效态Cd含量的显著上升。而当菌肥施用浓度达到9 g·kg-1时,过高浓度的胶质芽孢杆菌与蜀葵开始竞争土壤养分,导致蜀葵生物量下降,进一步影响了整株Cd积累量。同时,与本试验结果不同的是,王小敏等[29]研究发现胶质芽孢杆菌在短期和长期的恒温培养下,对土壤DTPA提取态Cd含量无显著影响或有一定的钝化作用。产生结果相异的原因可能在于即使相同的芽孢杆菌菌株在不同培养条件下代谢产生的有机酸种类与数量也不相同,而且有机酸与重金属的络合作用也受土壤中复杂环境所影响[30]。
土壤酶作为土壤中稳定的具有特殊催化能力的一类蛋白质,在反映土壤生态系统变化[31]等方面起着重要作用。本试验结果表明,Cd处理降低了土壤脲酶与蔗糖酶的活性,说明对土壤脲酶和蔗糖酶有明显的抑制作用,可能是由于Cd与酶的活性位置结合,与底物产生了竞争性抑制[32]。而随着胶质芽孢杆菌施加浓度的上升,土壤脲酶和蔗糖酶的活性也不断增强,表明Cd污染下土壤中的氮、碳的养分循环状况得到有效缓解并好转[33-34]。这一结果与常文智等[11]的研究结果一致,原因可能在于胶质芽孢杆菌在代谢过程中分泌大量的多糖等物质可分解土壤中难溶性矿物,为土壤微生物提供了丰富的营养物质[35]。本试验中,施用胶质芽孢杆菌可显著提高土壤脱氢酶的活性,表明施用菌肥后蜀葵根际土壤微生物新陈代谢的整体活性不断增强[36]。土壤多酚氧化酶参与土壤中芳香族化合物的物质循环,多用于土壤环境修复[37]。本试验中与其他土壤酶不同的是,Cd胁迫后蜀葵根际土壤多酚氧化酶活性显著增强,这与Sharma等[38]、刘耀明等[39]的研究报道一致。可能是因为Cd2+能够促进底物与多酚氧化酶活性中心的亲和作用而产生激活效应,同时Cd2+电子云排布中的空轨道能与酶分子的-OH、-COOH和-NH2等基团形成配位作用,导致酶活力有所增加[40]。研究表明,土壤脲酶活性高时,可能发生氮饱和,从而影响多酚氧化酶的活性[41],这可能是本试验中施用菌肥导致土壤多酚氧化酶活性下降的原因。在土壤这个复杂的环境体系中,土壤酶活性的变化受到多方面的综合影响。因此,对于施用胶质芽孢杆菌后的作用机制和内在机理有待进一步深入研究。
4 结论(1)25 mg·kg-1 Cd处理下,施用6 g·kg-1的胶质芽孢杆菌可促进蜀葵生长发育,提高蜀葵的根际土壤有效态Cd含量、Cd积累量与Cd富集系数,增强了蜀葵对Cd污染土壤的修复效果。今后可通过细胞与分子水平的研究进一步阐明胶质芽孢杆菌促进蜀葵Cd富集的机制。
(2)施用6 g·kg-1胶质芽孢杆菌可提高25 mg· kg-1 Cd污染土壤下蜀葵根际土壤中脲酶、蔗糖酶与脱氢酶的活性,表明蜀葵根际土壤微生物活性得到增强,氮、碳的养分循环有所改善。施用3~9 g·kg-1胶质芽孢杆菌可引起蜀葵根际土壤多酚氧化酶活性的下降。
(3)蜀葵-胶质芽孢杆菌联合体系可以提高蜀葵修复Cd污染土壤的能力。同时,蜀葵因其观赏价值高、生物量大和适应能力强等特点,可在修复Cd污染土壤的同时美化环境。因此,在城市绿地土壤与工矿废弃地等区域,该联合修复体系在Cd污染土壤修复中具有一定的应用潜力和价值。
| [1] |
范刘丹, 王明仕, 宋党育, 等. 部分中国城市公园重金属生态风险及健康风险评价[J]. 环境化学, 2019, 38(4): 1-11. FAN Liu-dan, WANG Ming-shi, SONG Dang-yu, et al. Ecological risk assessment and health risk assessment of heavy metals in some China urban parks[J]. Environmental Chemistry, 2019, 38(4): 1-11. |
| [2] |
秦樊鑫, 魏朝富, 李红梅. 重金属污染土壤修复技术综述与展望[J]. 环境科学与技术, 2015, 38(增刊2): 199-208. QIN Fan-xin, WEI Chao-fu, LI Hong-mei, et al. Current research in remediation of soils contaminated by heavy metals[J]. Environmental Science & Technology, 2015, 38(Suppl2): 199-208. |
| [3] |
He H D, Ye Z H, Yang D J, et al. Characterization of endophytic Rahnella sp. JN6 from Polygonum pubescens and its potential in promoting growth and Cd, Pb, Zn uptake by Brassica napus[J]. Chemosphere, 2013, 90(6): 1960-1965. |
| [4] |
Li W C, Ye Z H, Wong M H. Metal mobilization and production of short-chain organic acids by rhizosphere bacteria associated with a Cd/Zn hyperaccumulating plant, Sedum alfredii[J]. Plant and Soil, 2010, 326(1/2): 453-467. |
| [5] |
黄文. 产表面活性剂根际菌协同龙葵修复镉污染土壤[J]. 环境科学与技术, 2011, 34(10): 48-52. HUANG Wen. Biosurfactant-producing rhizobacteria assisted Solanum nigrum L. phytoremediation of Cd-polluted soils[J]. Environmental Science & Technology, 2011, 34(10): 48-52. |
| [6] |
Rajkumar M, Sandhya S, Prasad M N, et al. Perspectives of plant-associated microbes in heavy metal phytoremediation[J]. Biotechnology Advances, 2012, 30(6): 1562-1574. |
| [7] |
马莹, 骆永明, 滕应, 等. 根际促生菌及其在污染土壤植物修复中的应用[J]. 土壤学报, 2013, 50(5): 1021-1031. MA Ying, LUO Yong-ming, TENG Ying, et al. Plant growth promoting rhizobacteria and their role in phytoremediation of heavy metal contaminated soils[J]. Acta Pedologica Sinica, 2013, 50(5): 1021-1031. |
| [8] |
田稼, 吴小杰, 孙超, 等. 胶质芽孢杆菌(Bacillus mucilaginosus)的研究进展[J]. 中国土壤与肥料, 2017, 51(6): 15-22. TIAN Jia, WU Xiao-jie, SUN Chao, et al. Research progress on Bacillus mucilaginosus[J]. Soil and Fertilizer Sciences in China, 2017, 51(6): 15-22. |
| [9] |
杨榕, 李博文, 刘微, 等. 胶质芽孢杆菌对印度芥菜富集土壤Cd的效果[J]. 水土保持学报, 2012, 26(5): 164-168. YANG Rong, LI Bo-wen, LIU Wei, et al. Effects of Bacillus mucilaginosus on sorption and accumulation for Brassica juncea with Cd in the soil[J]. Journal of Soil and Water Conservation, 2012, 26(5): 164-168. |
| [10] |
Wu S C, Cheung K C, Luo Y M, et al. Effects of inoculation of plant growth-promoting rhizobacteria on metal uptake by Brassica juncea[J]. Environmental Pollution, 2006, 140(1): 124-135. |
| [11] |
常文智, 马鸣超, 李力, 等. 施用胶质类芽孢杆菌对土壤生物活性和花生产量的影响[J]. 中国土壤与肥料, 2014, 48(1): 84-89. CHANG Wen-zhi, MA Ming-chao, LI Li, et al. Effects of Paenibacillus mucilaginosus on soil biological activity and yield of peanut[J]. Soil and Fertilizer Sciences in China, 2014, 48(1): 84-89. |
| [12] |
黄亚萍, 俎丽红, 沈广爽, 等. 铅胁迫对蜀葵重金属积累及抗氧化酶活性的影响[J]. 农业环境科学学报, 2017, 36(9): 1746-1752. HUANG Ya-ping, ZU Li-hong, SHEN Guang-shuang, et al. Effects of lead stress on accumulation ability and antioxidant enzyme activities of Althaea rosea Cavan[J]. Journal of Agro-Environment Science, 2017, 36(9): 1746-1752. |
| [13] |
Liu J N, Zhou Q X, Sun T, et al. Growth responses of three ornamental plants to Cd and Cd-Pb stress and their metal accumulation characteristics[J]. Journal of Hazardous Materials, 2008, 151(1): 261-267. |
| [14] |
Wu M X, Luo Q, Liu S L, et al. Screening ornamental plants to identify potential Cd hyperaccumulators for bioremediation[J]. Ecotoxicology & Environmental Safety, 2018, 162(1): 35-41. |
| [15] |
Cay S, Uyanik A, Engin M S, et al. Effect of EDTA and tannic acid on the removal of Cd, Ni, Pb and Cu from artificially contaminated soil by Althaea rosea Cavan[J]. International Journal of Phytoremediation, 2015, 17(6): 568-574. |
| [16] |
Lindsay W L, Norvell W A. Development of a DTPA soil test for zinc, iron, manganese, and copper[J]. Soil Science Society of America Journal, 1978, 42(3): 421-428. |
| [17] |
关松荫. 土壤酶及其研究方法[M]. 北京: 农业出版社, 1986. GUAN Song-yin. Soil enzyme and its research methods[M]. Beijing: Agricultural Press, 1986. |
| [18] |
Gajdos É, Lévai L, Veres S, et al. Effects of biofertilizers on maize and sunflower seedlings under cadmium stress[J]. Communications in Soil Science & Plant Analysis, 2012, 43(1/2): 272-279. |
| [19] |
Li X, Wu Z Q, Li W D, et al. Growth promoting effect of a transgenic Bacillus mucilaginosus on tobacco planting[J]. Applied Microbiology and Biotechnology, 2007, 74(5): 1120-1125. |
| [20] |
张宇羽, 蔡艳, 王昌全, 等. 苗床添加胶质芽孢杆菌菌肥对2种烟草幼苗生长和养分吸收的影响[J]. 土壤通报, 2015, 46(3): 676-681. ZHANG Yu-yu, CAI Yan, WANG Chang-quan, et al. Effect of Bacillus mucilaginosus fertilizer on growth and nutrients absorption of two tobacco seedlings in seedbed[J]. Chinese Journal of Soil Science, 2015, 46(3): 676-681. |
| [21] |
Joo G J, Kim Y M, Lee I J, et al. Growth promotion of red pepper plug seedlings and the production of gibberellins by Bacillus cereus, Bacillus macroides and Bacillus pumilus[J]. Biotechnology Letters, 2004, 26(6): 487-491. |
| [22] |
蒋先军, 黄昭贤, 谢德体, 等. 硅酸盐细菌代谢产物对植物生长的促进作用[J]. 西南农业大学学报, 2000, 22(2): 116-119. JIANG Xian-jun, HUANG Zhao-xian, XIE De-ti, et al. Promoting effects of the metabolites of silicate for plant growth[J]. Journal of Southwest Agricultural University, 2000, 22(2): 116-119. |
| [23] |
Cavalca L, Zanchi R, Corsini A, et al. Arsenic-resistant bacteria associated with roots of the wild Cirsium arvense(L.)plant from an arsenic polluted soil, and screening of potential plant growth-promoting characteristics[J]. Systematic & Applied Microbiology, 2010, 33(3): 154-164. |
| [24] |
周志峰, 赵小蓉, 李贵桐, 等. 几株产荚膜细菌在土壤水稳性团聚体形成中的作用[J]. 中国生态农业学报, 2006, 14(3): 170-172. ZHOU Zhi-feng, ZHAO Xiao-rong, LI Gui-tong, et al. The function of several slime-forming bacteria on the formation of soil water-stable aggregates[J]. Chinese Journal of Eco-Agriculture, 2006, 14(3): 170-172. |
| [25] |
罗巧, 邬梦晞, 龙月, 等. 圆叶锦葵对Cd处理的光合生理响应及Cd富集特征[J]. 核农学报, 2019, 33(7): 1415-1422. LUO Qiao, WU Meng-xi, LONG Yue, et al. Changes in photosynthesis and Cd accumulation characteristic of Malva pusilla Smith under different concentrations of Cd[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(7): 1415-1422. |
| [26] |
Sessitsch A, Kuffner M, Kidd P, et al. The role of plant-associated bacteria in the mobilization and phytoextraction of trace elements in contaminated soils[J]. Soil Biology and Biochemistry, 2013, 60(100): 182-194. |
| [27] |
Luo S L, Xu T Y, Chen L, et al. Endophyte-assisted promotion of biomass production and metal-uptake of energy crop sweet sorghum by plant-growth-promoting endophyte Bacillus sp. SLS18[J]. Applied Microbiology and Biotechnology, 2012, 93(4): 1745-1753. |
| [28] |
赵树民, 李晓东, 虞方伯, 等. 巨大芽孢杆菌LY02对黑麦草修复重金属污染土壤的影响[J]. 水土保持学报, 2017, 31(5): 340-344. ZHAO Shu-min, LI Xiao-dong, YU Fang-bo, et al. Effect of Bacillus Megaterum LY02 on phytoremediation of heavy metal from contaminated soil by Lolium Perenne L.[J]. Journal of Soil and Water Conservation, 2017, 31(5): 340-344. |
| [29] |
王小敏, 刘文菊, 张丽娟, 等. 添加巨大芽孢杆菌与胶质芽孢杆菌对土壤DTPA提取态Cd的影响[J]. 水土保持学报, 2013, 27(4): 217-221. WANG Xiao-min, LIU Wen-ju, ZHANG Li-juan, et al. Effect of Bacillus megaterium and Bacillus mucilaginosus on soil DTPA extractable Cd[J]. Journal of Soil and Water Conservation, 2013, 27(4): 217-221. |
| [30] |
林琦, 陈英旭, 陈怀满, 等. 有机酸对Pb、Cd的土壤化学行为和植株效应的影响[J]. 应用生态学报, 2001, 12(4): 619-622. LIN Qi, CHEN Ying-xu, CHEN Huai-man, et al. Effect of organic acids on soil chemical behavior of lead and cadmium and their toxicity to plants[J]. Chinese Journal of Applied Ecology, 2001, 12(4): 619-622. |
| [31] |
Badiane N N Y, Chotte J L, Pate E, et al. Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semi-arid tropical regions[J]. Applied Soil Ecology, 2001, 18(3): 229-238. |
| [32] |
潘芳慧, 张晓玮, 王友保. 施磷对吊兰修复镉污染土壤及土壤酶活性的影响[J]. 水土保持学报, 2018, 32(3): 346-351. PAN Fang-hui, ZHANG Xiao-wei, WANG You-bao. Effects of phosphate fertilizer on phytoremediation of Chorophytum comosum and soil enzyme activity in Cd-contaminated soils[J]. Journal of Soil and Water Conservation, 2018, 32(3): 346-351. |
| [33] |
李冰, 李玉双, 陈琳, 等. 沈北新区不同利用类型土壤脲酶活性及其影响因素分析[J]. 生态科学, 2019, 38(3): 1-8. LI Bing, LI Yu-shuang, CHEN Lin, et al. Change characteristics and influencing factors of soil urease activity in different types of land in Shenyang North New Area[J]. Ecological Science, 2019, 38(3): 1-8. |
| [34] |
赵仁竹, 汤洁, 梁爽, 等. 吉林西部盐碱田土壤蔗糖酶活性和有机碳分布特征及其相关关系[J]. 生态环境学报, 2015, 24(2): 244-249. ZHAO Ren-zhu, TANG Jie, LIANG Shuang, et al. Distribution of soil organic carbon and invertase activity and its correlation in saline-alkali paddy field in west Jilin[J]. Ecology and Environmental Sciences, 2015, 24(2): 244-249. |
| [35] |
周雪莹, 李辉, 连宾. 胶质芽孢杆菌胞外多糖在肥料矿物分解转化中的作用[J]. 矿物岩石地球化学通报, 2010, 29(1): 63-66. ZHOU Xue-ying, LI Hui, LIAN Bin. Effect of exo-polysaccharides produced by Bacillus mucilaginosus during the process of fertilizer mineral degradation and transformation[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2010, 29(1): 63-66. |
| [36] |
张晨, 张丽红, 李亚宁, 等. 典型磺胺类抗生素对土壤脱氢酶和过氧化氢酶活性的影响[J]. 安全与环境学报, 2018, 18(6): 2379-2382. ZHANG Chen, ZHANG Li-hong, LI Ya-ning, et al. Impact of the typical sulfonamides on the enzyme activities of the soil[J]. Journal of Safety and Environment, 2018, 18(6): 2379-2382. |
| [37] |
郝建朝, 吴沿友, 连宾, 等. 土壤多酚氧化酶性质研究及意义[J]. 土壤通报, 2006, 37(3): 470-474. HAO Jian-chao, WU Yan-you, LIAN Bin, et al. Properties of polyphenol oxidase in soil and its significance[J]. Chinese Journal of Soil Science, 2006, 37(3): 470-474. |
| [38] |
Sharma N, Hundal G S, Sharma I, et al. 28-homobrassinolide alters protein content and activities of glutathione-s-transferase and polyphenol oxidase in Raphanus sativus L. plants under heavy metal stress[J]. Toxicology International, 2014, 21(1): 44-50. |
| [39] |
刘耀明, 杨慧敏, 张育平, 等. 镉和铬急性染毒对中华稻蝗解毒酶及多酚氧化酶的影响[J]. 农业环境科学学报, 2013, 32(7): 1321-1327. LIU Yao-ming, YANG Hui-min, ZHANG Yu-ping, et al. Acute effects of Cd2+ and Cr6+ on detoxification enzymes and polyphenol oxidase in Oxya chinensis[J]. Journal of Agro-Environment Science, 2013, 32(7): 1321-1327. |
| [40] |
林庆同, 王伟, 杨美花, 等. 金属离子对马铃薯多酚氧化酶活力的影响[J]. 厦门大学学报(自然科学版), 2010, 49(4): 561-563. LIN Qing-tong, WANG Wei, YANG Mei-hua, et al. Effects of some metal ions on the activity of polyphenol oxidase from potato[J]. Journal of Xiamen University (Natural Science), 2010, 49(4): 561-563. |
| [41] |
Toberman H, Evans C D, Freeman C, et al. Summer drought effects upon soil and litter extracellular phenol oxidase activity and soluble carbon release in an upland Calluna heathland[J]. Soil Biology and Biochemistry, 2008, 40(6): 1519-1532. |
 2020, Vol. 39
2020, Vol. 39