2. 南京信息工程大学应用气象学院, 南京 210044
2. School of Applied Meteorology, Nanjing University of Information Science and Technology, Nanjing 210044, China
温室效应导致的全球变暖引起了人们的广泛关注。CO2是最主要的温室气体,大气中CO2浓度升高与陆地生态系统碳循环有关[1]。土壤呼吸是陆地生态系统中重要的碳排放过程[2],在气候变暖条件下,土壤呼吸有可能会产生正反馈效应[3],研究土壤呼吸的影响因素对于模拟土壤呼吸的时空变异具有重要意义。
由于种植作物类型和农业管理措施不同,农田生态系统的植被、养分、水热条件与自然生态系统具有较大差异,农田土壤呼吸作用也与其他生态系统存在不同[4]。农田土壤呼吸的季节变化除了与温度的季节变化有关外,还随种植作物类型的不同而存在差异[5-7]。土壤呼吸中异养组分的季节变化主要与水热因子有关[8-9],而其根呼吸则与光合作用驱动的植物生理生长节律存在密切联系[10-12]。有研究表明,种植大豆条件下的季节平均土壤呼吸速率是种植棉花条件下的2.34倍,同时,植物生长改变了土壤呼吸速率与温度的关系[13]。利用高光谱技术测得的作物植被指数可反映作物的某些生理生长特征(如:绿度、叶绿素含量)[14],作为地下过程的土壤呼吸与地上植被的联系可通过高光谱植被指数来研究[15]。然而,以往关于这方面的研究还相对较少,土壤呼吸与植被指数是否存在相似的季节变异规律?种植不同作物条件下土壤呼吸的差异是否与植被指数的差异有关?这些问题还需要田间观测试验证实,阐明这些问题不仅有助于利用遥感方法研究农田土壤呼吸与作物生长指标的关系,而且对于利用遥感资料估算区域农田土壤呼吸具有参考价值。
本研究选取华东地区种植的3种典型夏熟作物冬小麦、油菜籽、蚕豆,观测土壤呼吸、土壤温度、土壤湿度、植被指数、叶绿素指标,研究土壤呼吸与这些潜在影响因子之间的关系,以期为探讨土壤呼吸的影响因素和利用遥感方法估算农田土壤呼吸提供基础数据和理论支撑。
1 材料与方法 1.1 试验地点在南京信息工程大学农业气象试验站(32.21°N,118.70°E)进行田间试验。试验地多年平均气温和多年平均降水量分别为15.6 ℃和1100 mm,供试土壤为黄棕壤(灰马肝土属),年日照时数1 902.5 h,无霜期237 d。0~20 cm耕层土壤质地为壤质黏土,黏粒含量26.1%,田间持水量25.6%,pH(H2O)为6.3,有机碳和全氮含量分别为8.91 g·kg-1和0.81 g·kg-1,容重1.54 g·cm-3。
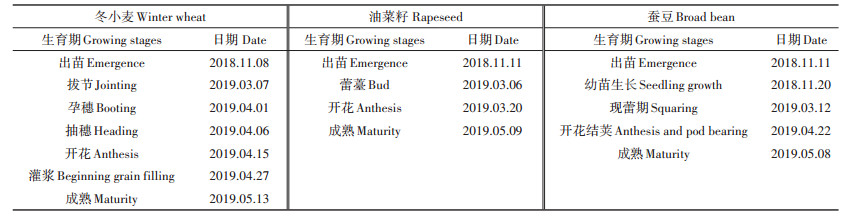
1.2 试验设计于2018年10月至2019年5月进行田间试验,选择当地常规种植的3种越冬夏熟作物冬小麦(Triticum aestivum L.)、油菜籽(Brassica napus L.)、蚕豆(Vicia faba L.)作为供试作物。设置随机区组试验,分为3个区组,每个区组种植冬小麦、油菜籽、蚕豆3种作物,每个小区面积2.5 m×3.0 m。冬小麦、油菜籽、蚕豆品种分别为宁麦13、沣油737、南通青皮。于2018年10月28日施用基肥(复合肥51.3 g·m-2),复合肥N:P2O5:K2O为15%:15%:15%,于2019年1月13日施用越冬肥(尿素51.3 g·m-2),尿素氮含量为46.4%。于2018年10月29日播种3种作物,冬小麦、油菜籽、蚕豆生育期见表 1,3种作物均于2019年5月15日收获。
|
|
表 1 作物生育期 Table 1 The growing stages of crops |
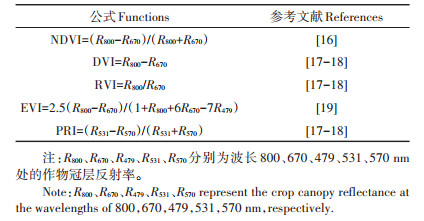
于作物播种前在各个小区中埋入高10 cm、直径20 cm的PVC底座,底座埋入土壤中3 cm,采用便携式土壤碳通量仪(Li-8100A,LI-COR公司,美国)测定土壤呼吸。定期去除底座内生长出的植物,以保证测定的呼吸作用不包含植物呼吸。除越冬期外每周观测1次土壤呼吸、土壤温度、土壤湿度、植被指数(作物出苗后开始观测)、叶绿素SPAD值。选择晴朗天气,采用便携式地物光谱仪(Fieldspec 4 Standardard-Res,ASD公司,美国)采集各种作物冠层反射率,波段范围为350~2500 nm,其中350~1000 nm波段的光谱分辨率为3 nm,光谱采样间隔为1.4 nm;1001~2500 nm波段的光谱分辨率为10 nm,采样间隔为2 nm,探头视场角为25°。选择晴朗无风无云或者少风少云的天气,采用便携式地物光谱仪于11:00—14:00采集各种作物冠层反射率,测量时保持光谱仪探头垂直向下,据作物冠层上方垂直约20~30 cm。每个小区选择2个点测定,每个点测量获得5条光谱曲线,每个小区共测得10条反射率曲线。为保证试验的准确性,每次数据采集前使用40 cm×40 cm高光谱标准白板进行校正(标准白板反射率视为1,所测得的反射率为相对反射率),白板前后校准时间间隔不超过5 min。采用ViewSepcPro光谱处理软件对原始光谱曲线进行预处理。通过测得的作物冠层反射率计算NDVI(归一化植被指数)、DVI(差值植被指数)、RVI(比值植被指数)、EVI(增强植被指数)、PRI(光化学植被指数)5种植被指数,各植被指数的计算公式见表 2。本研究中,绝大部分的土壤呼吸测定日与植被指数观测日相同,若遇不利于观测植被指数的天气,土壤呼吸的测定则与之有观测日的偏差。在测定土壤呼吸时,采用土壤碳通量仪配套的土壤温度探头和湿度探头(TDR)测定5 cm土壤温度和湿度。以便携式叶绿素仪(SPAD-502PLUS,Konica Minolta公司,日本)测定3种作物茎顶叶的叶绿素SPAD值,每个小区随机测定5片叶片。
|
|
表 2 植被指数的计算公式 Table 2 Functions to compute vegetation indexes |
以往的研究表明,每周1次的频率能较好地观测到土壤呼吸、土壤温湿度的最小值和最大值范围[20-21],本研究中每周1次的植被指数观测频率高于以往研究的频率[18, 22-23],并且考虑了苗期到越冬期的植被指数变异,比以往仅观测越冬夏熟作物旺盛生长阶段植被指数的研究更为全面[18],这有利于研究作物全生育期内植被指数的变异及其与土壤呼吸的关系。
1.4 数据分析以配对t检验分析不同3种农田季节土壤温度、湿度的差异,以重复测量的方差分析检验不同农田土壤呼吸的差异。以往的研究表明,土壤呼吸随温度的升高呈指数形式增加[24],该关系由Van′ t Hoff[25]提出的与温度有关的化学反应速率方程衍生而来,本研究中也以指数方程描述土壤呼吸与土壤温度之间的关系,将指数方程模拟的土壤呼吸值与实测土壤呼吸值相减可得到土壤呼吸残差,将土壤呼吸残差与土壤湿度进行二次方程拟合以研究在消除土壤温度的基础上土壤呼吸与湿度的关系,将土壤呼吸残差与各植被指数进行相关分析以研究在消除土壤温度的基础上土壤呼吸与各植被指数的关系。在相关分析的基础上,以多元线性回归初步检验各潜在影响因素对土壤呼吸的影响以及各因素的共线性,以方差膨胀因子(VIF)来判断其共线性,当某因素VIF < 10时,可作为进一步的多元非线性回归的自变量,进而建立基于不具共线性的自变量(土壤温湿度、植被指数或SPAD值)的土壤呼吸模型。
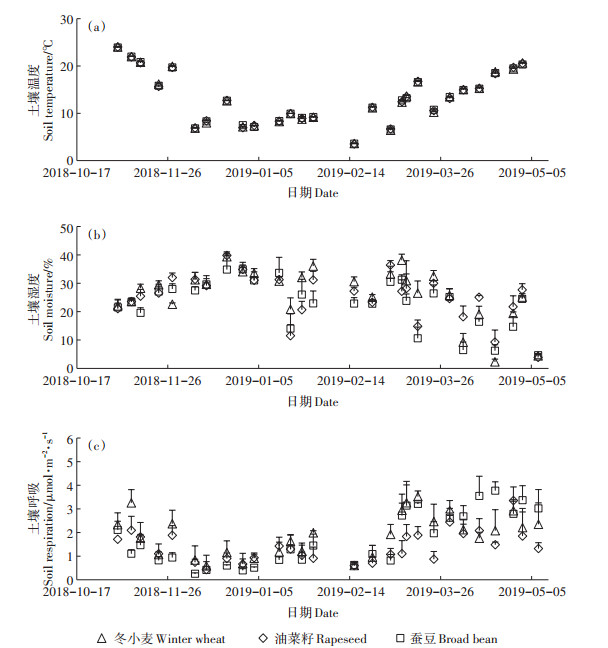
2 结果与分析 2.1 土壤温湿度与土壤呼吸3种农田土壤温度均表现出明显的季节变化规律,冬小麦、油菜籽、蚕豆田土壤温度季节变化范围分别为3.6~31.4、3.5~31.6、3.6~31.9 ℃,3种农田土壤温度无显著差异(P>0.05)(图 1a)。3种农田冬季土壤湿度相对较高,从冬季到收获期土壤湿度呈现出降低趋势,冬小麦、油菜籽、蚕豆田土壤湿度季节变化范围分别为2.3%~39.4%、3.9%~39.8%、4.7%~34.9%(图 1b),冬小麦与油菜籽田土壤湿度无显著差异(P>0.05),但两者土壤湿度均显著(P < 0.05)高于蚕豆田。
|
图 1 土壤温湿度、土壤呼吸的季节变化 Figure 1 Seasonal changes in soil temperature, soil moisture, and soil respiration |
3种农田土壤呼吸与土壤温度的季节变异趋势基本一致,冬季土壤呼吸相对较低,在作物旺盛生长的季节土壤呼吸相对较高。冬小麦、油菜籽、蚕豆田土壤呼吸季节变化范围分别为0.59~3.53、0.43~3.35、0.26~3.77 μmol·m-2·s-1,其季节平均值分别为1.78± 0.15、1.35±0.27、1.61±0.22 μmol·m-2·s-1,在整个生长季尺度上冬小麦田土壤呼吸显著高于油菜籽田(P < 0.05),冬小麦与蚕豆田以及油菜籽与蚕豆田土壤呼吸无显著差异(P>0.05)。在作物旺盛生长的3—5月份3种农田土壤呼吸存在显著差异(P < 0.05)(图 1c)。
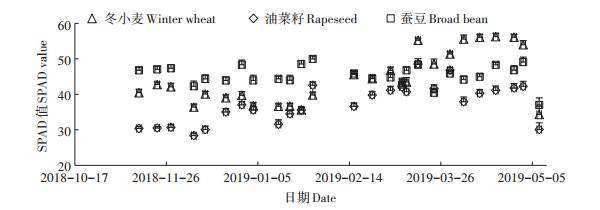
2.2 植被指数从出苗后到作物收获,3种农田的NDVI、DVI、RVI、EVI、PRI均表现出先增加后减少的趋势(图 2a~图 2e)。3—4月份,冬小麦和蚕豆田NDVI和PRI达到整个生长季节中最大的阶段,且变化不大,3—5月份,油菜籽田NDVI和PRI呈现出下降趋势。3种农田的DVI、RVI、EVI均呈现出先增大,后减小的总体趋势。这表明不同的植被指数反映的作物生长状况存在差异,且不同作物的植被指数也存在差异。叶片叶绿素SPAD值也存在季节变异性(图 3)。冬小麦SPAD值呈现出先下降后上升趋势,在生育末期又降至最低;油菜籽SPAD值总体呈逐渐上升趋势,在生育末期又迅速降低;蚕豆SPAD值季节变异性相对较小,在生育末期也降至最低。冬小麦、油菜籽、蚕豆的SPAD季节平均值分别为44.51 ± 0.96、37.42 ± 1.09、45.41±1.08。

|
图 2 NDVI(a)、DVI(b)、RVI(c)、EVI(d)、PRI(e)的季节变化 Figure 2 Seasonal changes in NDVI (a), DVI (b), RVI (c), EVI (d), and PRI (e) |
|
图 3 叶绿素SPAD值的季节变化 Figure 3 Seasonal changes in SPAD value of chlorophyll |
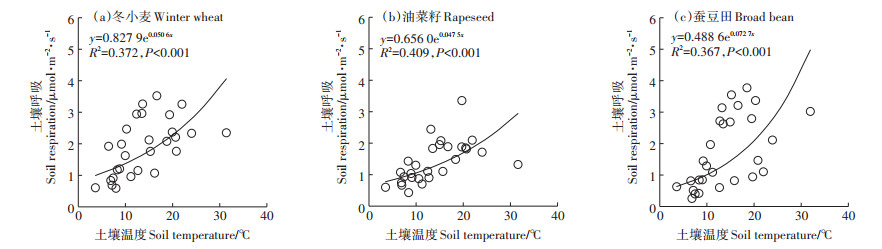
3种农田土壤呼吸与土壤温度均存在指数回归关系,土壤温度可解释冬小麦、油菜籽、蚕豆田土壤呼吸37.2%、40.9%、36.7%的季节变异(图 4)。对于油菜籽田而言,虽然基于土壤温度的幂函数可解释土壤呼吸约50%的变异,但指数方程在机制上具有更普遍的意义。生长季尺度上冬小麦、油菜籽、蚕豆田土壤呼吸的温度敏感系数(Q10)分别为1.66、1.61、2.07。
|
图 4 不同作物农田土壤呼吸与土壤温度的关系 Figure 4 Relationship between soil respiration and soil temperature in different croplands |
冬小麦和蚕豆田土壤呼吸残差与土壤湿度无显著的回归关系(P>0.05)(图 5a、图 5c),这表明冬小麦和蚕豆田土壤湿度对土壤呼吸无显著影响。油菜籽田土壤呼吸残差与土壤湿度的关系可用二次方程拟合(P=0.018)(图 5b),该方程表明,在不考虑土壤温度的基础上土壤湿度可解释油菜籽田土壤呼吸27.3%的季节变异。

|
图 5 不同作物农田土壤呼吸残差与土壤湿度的关系 Figure 5 Relationship between residual soil respiration and soil moisture in different cropland |
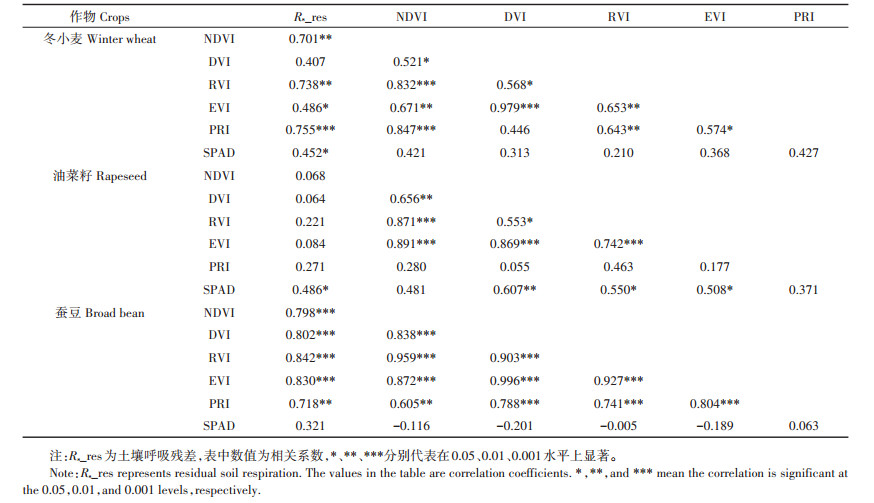
相关分析表明,冬小麦田土壤呼吸残差与NDVI、RVI、EVI、PRI、SPAD值均存在显著(P < 0.05)或极显著(P < 0.01)相关关系(表 3),蚕豆田土壤呼吸残差与NDVI、DVI、RVI、EVI、PRI均存在极显著(P < 0.01)相关关系,而油菜籽田土壤呼吸残差与上述植被指数均不存在显著相关关系,但与SPAD值存在显著(P < 0.05)相关关系。这表明土壤呼吸与植被指数的关系因作物类型的不同而存在差异,油菜籽田土壤呼吸与植被指数无相关性的原因可能与3—4月份花期叶片退化有关,此时利用高光谱测定的反射率反映了油菜花的生理特征,这与其他2种叶片持续生长的作物形成了对比。
|
|
表 3 土壤呼吸残差与植被指数、SPAD值的相关关系 Table 3 Correlation between residual soil respiration and variables of vegetation indexes and SPAD value |
基于土壤温湿度和植被指数建立的土壤呼吸模型比仅包含温度的模型明显提高了模拟效果(图 4、表 4)。基于土壤温度、NDVI、RVI的模型可解释冬小麦田75.4%的土壤呼吸的季节变异,基于土壤温度和RVI的模型可解释蚕豆田91.1%的土壤呼吸的季节变异,基于土壤温湿度和SPAD值的模型也比仅包括土壤温度的指数模型提高了油菜籽田模拟效果。
|
|
表 4 基于土壤温湿度、植被指数、SPAD值的土壤呼吸模型 Table 4 Soil respiration models on the basis of soil temperature, moisture, vegetation indexes, and SPAD value |
江国福等[6]收集的全国不同农田观测地点样本的结果表明,在生长季尺度上各作物类型的土壤呼吸大小顺序为:棉花>玉米>大豆>水稻>小麦。Tufekcioglu等[26]报道,大豆和玉米田的土壤呼吸无显著差异。熊瑛等[27]的研究表明,夏熟作物蚕豆的季节平均土壤呼吸速率与秋熟作物甘薯无显著差异,但显著低于秋熟作物玉米的数值。以往的研究表明,玉米田土壤呼吸显著高于大豆田,其差异主要体现在高温阶段[28]。种植不同作物的农田土壤呼吸的不同既与作物种植季节有关,也与作物本身的特性有关[29],例如,种植固氮作物大豆比种植棉花条件下的土壤呼吸高,这主要是因为共生固氮过程需要消耗能量,而固氮所需能量来自于植物光合产物的分解释放[30]。本研究中,3种农田土壤呼吸的大小顺序为:冬小麦>蚕豆>油菜籽,在作物旺盛生长的3—5月份3种农田土壤呼吸存在显著差异(P < 0.05)(图 1c)。不同作物的光合效率不同,导致输入到根系的含碳物质存在差异,从而影响根呼吸和根际碳沉积[31-32]。试验所用3种作物都是越冬夏熟作物,在返青前个体都比较小,高光谱所测各类植被指数值也比较小,作物土壤呼吸无显著差异;3—5月作物旺盛生长,个体、群体及植被指数差异明显。此外,作物冠层覆被度和冠层高度的不同造成的土壤水热因子和地被物的差异也是造成土壤呼吸差异的潜在影响因素。
3.2 土壤呼吸与温湿度及植被指数的关系土壤呼吸与土壤温度的指数关系已被大量的研究证实,本研究中测得的生长季尺度上冬小麦、油菜籽、大豆田土壤呼吸的温度敏感系数(Q10)分别为1.66、1.61、2.07,这与以往研究基本一致[6, 24]。冬小麦田和蚕豆田土壤呼吸除了与土壤温度具有相关性之外,还与高光谱植被指数有密切联系,冬小麦田土壤呼吸残差与NDVI、RVI、EVI、PRI存在显著(P < 0.05)或极显著(P < 0.01)相关性,蚕豆田土壤呼吸残差与NDVI、DVI、RVI、EVI、PRI均存在显著(P < 0.05)或极显著(P < 0.01)相关性,而油菜籽田则无类似关系。3—4月份为油菜籽的花期,其叶片退化,这可能会对利用高光谱测得的反射率产生影响,这种现象与冬小麦和蚕豆存在明显差异。由此表明,土壤呼吸与上述植被指数的关系不仅与作物类型有关,而且与植被指数的类型有关[22]。
本研究中对苗期到越冬期土壤呼吸残差与植被指数的相关分析表明两者间无显著相关性(P < 0.05),这说明土壤呼吸季节变异与植被指数季节变异的内在联系主要体现在作物旺盛生长的阶段,而非苗期到越冬期。然而,与以往主要关注旺盛生长季节植被指数观测的研究相比[18, 33],本研究中对苗期到越冬期的植被指数观测仍非常必要,有助于更全面地了解作物生长初期的植被指数,例如冬小麦此阶段的NDVI、RVI、EVI、PRI均达到了比较高的数值,油菜籽和蚕豆田的PRI也相对较高(图 2),此阶段的这些基础数据不仅对于本研究所关注的土壤呼吸问题是必要的,而且在地面的高光谱植被指数与卫星遥感观测结果的数据同化分析研究中具有一些借鉴作用。
在作物旺盛生长的3—5月份,冬小麦的NDVI、RVI高于蚕豆,也高于油菜籽(图 2a、图 2b、图 2e),这2个指标的差异与土壤呼吸的差异基本一致(图 1c)。有研究表明,NDVI可反映作物的长势和营养信息,与植物生产力、叶面积指数等具有一定联系[34]。种植不同作物条件下土壤呼吸的差异与植被指数所反映的作物生长状况的差异有关,叶绿素是吸收光能的主要物质,影响作物光合作用效率[35],土壤呼吸、植被指数、叶绿素SPAD值之间的相关性可反映出土壤呼吸与作物生长指标之间的联系,可通过土壤呼吸与植被指数的关系体现。
以往有学者建立了基于植被指数的土壤呼吸模型。武江星[23]基于高光谱观测的植被指数建立的模型可模拟高粱地不同处理下土壤呼吸90%左右的季节变异,Huang等[18]利用EVI和红边叶绿素指数建立的模型可模拟玉米和冬小麦田土壤呼吸60%~85%的季节变异。本研究中,仅基于植被指数的模型对土壤呼吸季节变异的解释性明显低于温度与植被指数的复合模型。基于土壤温度和植被指数的模型可有效模拟冬小麦和蚕豆田土壤呼吸的季节动态,特别是蚕豆田仅土壤温度和RVI即可解释土壤呼吸91.1%的季节变异,比仅包含土壤温度的指数方程(R2=0.367)(图 4c)明显提高了模拟效果。由于油菜籽花期叶片生长的特殊性,土壤呼吸与植被指数无关,然而,此时植株中下部仍存在一定数量的叶片,虽然这些叶片对于植被指数的贡献小于油菜花,但具有可观的光合作用,因而油菜籽田土壤呼吸可通过SPAD值和其他水热因子模拟,这在类似作物的观测中也应予以考虑。基于温度和植被指数的模拟结果,为利用遥感观测的植被指数和地面观测的温度模拟土壤呼吸的时空变化和区域估算提供了理论依据[36],有研究表明基于Landsat遥感观测的EVI、气候因子、地形因子建立的模型模拟了地面土壤呼吸45.0%的季节变异[37]。今后有必要开展更多种作物的观测,这将有助于在大尺度上对农田土壤呼吸进行估算。
4 结论(1)不同作物农田的土壤呼吸存在显著差异,差异最明显的时段为作物旺盛生长的3—5月份。
(2)冬小麦和蚕豆田土壤呼吸与土壤温度和植被指数有关,在这2种农田可分别建立基于土壤温度、植被指数、SPAD值以及土壤温度、植被指数的土壤呼吸模型。
(3)由于花期叶片退化,油菜籽田土壤呼吸与植被指数无关,其季节变化仅与土壤温湿度和SPAD值有关。
| [1] |
Canadell J G, Corinne Le Quéré, Raupach M R, et al. Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks[J]. Proceedings of the National Acadamy of Sciences of the USA, 2007, 104(47): 18866-18870. |
| [2] |
Bond-Lamberty B, Bailey V L, Chen M, et al. Globally rising soil heterotrophic respiration over recent decades[J]. Nature, 2018, 560(7716): 80-83. |
| [3] |
Xu M, Shang H. Contribution of soil respiration to the global carbon equation[J]. Journal of Plant Physiology, 2016, 203(7631): 16-18. |
| [4] |
Dong W, Hu C, Chen S, et al. Tillage and residue management effects on soil carbon and CO2 emission in a wheat-corn double-cropping system[J]. Nutrient Cycling in Agroecosysems, 2009, 83(1): 27-37. |
| [5] |
Lohila A, Aurela M, Regina K, et al. Soil and total ecosystem respiration in agricultural fields:Effect of soil and crop type[J]. Plant and Soil, 2003, 251(2): 303-317. |
| [6] |
江国福, 刘畅, 李金全, 等. 中国农田土壤呼吸速率及驱动因子[J]. 中国科学:生命科学, 2014, 44(7): 725-735. JIANG Guo-fu, LIU Chang, LI Jin-quan, et al. Soil respiration and driving factors of farmland ecosystems in China[J]. Scientia Sinica Vitae:Life Sciences, 2014, 44(7): 725-735. |
| [7] |
周泉, 邢毅, 马淑敏, 等. 西南旱地不同种植模式下土壤呼吸及水热因子对极端低温的响应[J]. 草业学报, 2017, 26(6): 37-44. ZHOU Quan, XING Yi, MA Shu-min, et al. Responses of soil respiration to extreme low temperature and hydro-thermal factors in dryland region with different cropping patterns in southwest China[J]. Acta Prataculturae Sinica, 2017, 26(6): 37-44. |
| [8] |
Akinremi O O, McGinn S M, McLean H D J. Effects of soil temperature and moisture on soil respiration in barley and fallow plots[J]. Canadian Journal of Soil Science, 1999, 79(1): 5-13. |
| [9] |
Hursh A, Ballantyne A, Cooper L, et al. The sensitivity of soil respiration to soil temperature, moisture, and carbon supply at the global scale[J]. Global Change Biology, 2017, 23(5): 2090-2103. |
| [10] |
Badrt D V, Vivanco J M. Regulation and function of root exudates[J]. Plant Cell, and Environment, 2009, 32: 666-681. |
| [11] |
Hanson P J, Edwards N T, Garten C T, et al. Separating root and soil microbial contributions to soil respiration:A review of methods and observations[J]. Biogeochemistry, 2000, 48(1): 115-146. |
| [12] |
Subke J A, Inglima I, Cotrufo M F. Trends and methodological impacts in soil CO2 efflux partitioning:A meta-analytical review[J]. Global Change Biology, 2006, 12(6): 921-943. |
| [13] |
闫静静, 杨兰芳, 庞静. 大豆和棉花生长对土壤呼吸的影响[J]. 作物学报, 2010, 36(9): 1559-1567. YAN Jing-jing, YANG Lan-fang, PANG Jing. Effects of soybean and cotton growth on soil respiration[J]. Acta Agronomica Sinica, 2010, 36(9): 1559-1567. |
| [14] |
Wu C Y, Niu Z, Tang Q, et al. Estimating chlorophyll content from hyperspectral vegetation indices:Modeling and validation[J]. Agricultural and Forest Meteorology, 2008, 148(8/9): 1230-1241. |
| [15] |
Huang N, Gu L H, Niu Z. Estimating soil respiration using spatial data products:A case study in a deciduous broadleaf forest in the Midwest USA[J]. Journal of Geophysical Research:Atmosphere, 2014, 119(11): 6393-6408. |
| [16] |
Gamon J A, Field C B, Goulden M L, et al. Relationship between NDVI, canopy structure and photosynthesis in three Californian vegetation types[J]. Ecological Applications, 1995, 5(1): 28-41. |
| [17] |
Sims D A, Gamon J A. Relationships between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and developmental stages[J]. Remote Sensing of Environment, 2002, 81(2): 337-354. |
| [18] |
Huang N, Niu Z, Zhan Y, et al. Relationships between soil respiration and photosynthesis-related spectral vegetation indices in two cropland ecosystems[J]. Agricultural and Forest Meteorology, 2012, 160: 80-89. |
| [19] |
Huete A, Didan K, Miura T, et al. Overview of the radiometric and biophysical performance of the MODIS vegetation indices[J]. Remote Sensing of Environment, 2002, 83(1/2): 195-213. |
| [20] |
Davidson E A, Belk E, Boone R D. Soil water content and temperature as independent of confounded factors controlling soil respiration in a temperature mixed hardwood forest[J]. Global Change Biology, 1998, 4: 217-227. |
| [21] |
Chen S T, Zhang Y, Chen H S, et al. Effects of elevated O3 on soil respiration in a winter wheat-soybean rotation cropland[J]. Soil Research, 2012, 50(6): 500-506. |
| [22] |
Cicuéndez V, Rodríguez-Rastrero M, Huesca M, et al. Assessment of soil respiration patterns in an irrigated corn field based on spectral information acquired by field spectroscopy[J]. Agriculture, Ecosystems and Environment, 2015, 212: 158-167. |
| [23] |
武江星.生物炭和覆膜对高粱高光谱特征及其土壤呼吸的影响[D].杨凌: 西北农林科技大学, 2016. WU Jiang-xing. The effect of biochar and film mulching on high spectral characteristics of sorghum and its soil respiration[D]. Yangling: Northwest A&F University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10108-1017000313.htm |
| [24] |
Lloyd J, Taylor J A. On the temperature dependence of soil respiration[J]. Functional Ecology, 1994, 8: 315-323. |
| [25] |
Van't Hoff J H. Lectures on theoretical and physical chemistry. Part 1:Chemical dynamics[M]. London: Edward Arnold, 1989: 224-229.
|
| [26] |
Tufekcioglu A, Raich J W, Isenhart T M, et al. Soil respiration within riparian buffers and adjacent crop fields[J]. Plant and Soil, 2001, 229(1): 117-124. |
| [27] |
熊瑛, 王龙昌, 赵琳璐, 等. 保护性耕作下蚕豆/玉米/甘薯三熟制农田土壤呼吸、碳平衡及经济-环境效益特征[J]. 中国生态农业学报, 2018, 26(11): 1653-1662. XIONG Ying, WANG Long-chang, ZHAO Lin-lu, et al. Soil respiration, carbon balance, and economic and environmental benefits of triple intercropping system of fava bean, maize and sweet potato under conservation tillage[J]. Chinese Journal of Eco-Agriculture, 2018, 26(11): 1653-1662. |
| [28] |
陈书涛, 朱大威, 牛传坡, 等. 管理措施对农田生态系统土壤呼吸的影响[J]. 环境科学, 2009, 30(10): 2858-2865. CHEN Shu-tao, ZHU Da-wei, NIU Chuan-po, et al. Effects of management regime on soil respiration from agroecosystems[J]. Environmental Science, 2009, 30(10): 2858-2865. |
| [29] |
杨新明, 韩磊, 庄涛. 北方农牧交错区不同土地利用方式下土壤呼吸动态特征[J]. 农业环境科学学报, 2018, 37(8): 1733-1740. YANG Xin-ming, HAN Lei, ZHUANG Tao. Dynamics of soil respiration under different land uses from an agro-pastoral ecotone of Northern China[J]. Journal of Agro-Environment Science, 2018, 37(8): 1733-1740. |
| [30] |
Warembourg F R, Roumet C. Why and how to estimate the cost of symbiotic N2 fixation? A progressive approach based on the use of 14C and 15N isotopes[J]. Plant and Soil, 1989, 115: 167-177. |
| [31] |
Högberg P, Nordgren A, Buchmann N, et al. Large-scale forest girdling shows that current photosynthesis drives soil respiration[J]. Nature, 2001, 411(6839): 789-792. |
| [32] |
Kuzyakov Y, Cheng W. Photosynthesis controls of rhizosphere respiration and organic matter decomposition[J]. Soil Biology and Biochemistry, 2001, 33(14): 1915-1925. |
| [33] |
Drerup P, Brueck H, Scherer H W. Evapotranspiration of winter wheat estimated with the FAO 56 approach and NDVI measurements in a temperate humid climate of NW Europe[J]. Agricultural Water Management, 2017, 192: 180-188. |
| [34] |
Gitelson A A, Vina A, Verma S B, et al. Relationship between gross primary production and chlorophyll content in crops:Implications for the synoptic monitoring of vegetation productivity[J]. Journal of Geophysical Research-Atmosphere, 2006, 111: D08S11. DOI:10.1029/2005JD006017 |
| [35] |
Li Y B, Song H, Zhou L, et al. Vertical distributions of chlorophyll and nitrogen and their associations with photosynthesis under drought and rewatering regimes in a maize field[J]. Agricultural and Forest Meteorology, 2019, 272/273: 40-54. |
| [36] |
Wu C Y, Gaumont-Guay D, Black T A, et al. Soil respiration mapped by exclusively use of MODIS data for forest landscapes of Saskatchewan, Canada[J]. ISPRS Journal of Photogrammetry and Remote Sensing, 2014, 94: 80-90. |
| [37] |
Berryman E M, Vanderhoof M K, Bradford J B, et al. Estimating soil respiration in a subalpine landscape using point, terrain, climate, and greenness data[J]. Journal of Geophysical Research:Biogeosciences, 2018, 123: 3231-3249. |
 2020, Vol. 39
2020, Vol. 39