2. 北京市环境保护科学研究院, 北京 100037
2. Beijing Municipal Research Institute of Environmental Protection, Beijing 100037, China
浮游动物作为初级消费者和水生食物链的关键环节,通过“上行效应”和“下行效应”制约初级生产者和高营养水平消费者的群落结构,在水生生态系统的物质循环、能量流动及信息传递中起着关键作用[1-3]。又因其对水环境变化响应较为灵敏,且对不同水环境因子适应能力具有种间差异性[1],浮游动物的群落组成、密度及优势种的变化常被认为是水环境变化的直接体现[2, 4]。了解和掌握浮游动物群落结构特征与水环境因子的关系,更有利于制定或调整湖泊生态系统修复和保护方案[5]。
国内外对水生生态系统的浮游动物研究多集中于特定时间段的生态调查,分析其物种组成、群落结构、密度、多样性指数等[6-7],也有学者用来指示水环境的变化并应用于湖泊、水库等的水质状况和健康状态评价[8-9]。王乙震等[10]调查了2012年白洋淀部分季节的浮游动物群落结构,并以此评价其处于富营养状态。生态位理论的提出及发展[11-13]促进了对物种生物多样性、群落种间关系及群落演替等方面的理解[14-15]。Le Coz等[16]结合生态位理论分析了低水位河网中浮游动物群落的结构差异;郑挺等[17]研究了北部湾北部海域浮游动物优势种的生态位及分化指数,发现各优势种对环境的适应能力存在差异。生态位指数扩展了对浮游动物群落结构特征的理解,进一步揭示其与水环境因子的关系,可为湖泊生态系统修复及生态监测管理提供重要科学支撑。
本文对不同时期和不同季节的白洋淀浮游动物进行多次生态调查,分析白洋淀浮游动物群落结构变化、优势种组成及其生态位指数,并结合水环境因子数据,采用冗余分析(RDA)对白洋淀浮游动物群落结构与水环境因子的关系进行研究,探究白洋淀浮游动物群落结构变化的主要影响因子,以期为白洋淀水环境的恢复及科学管理提供理论依据。
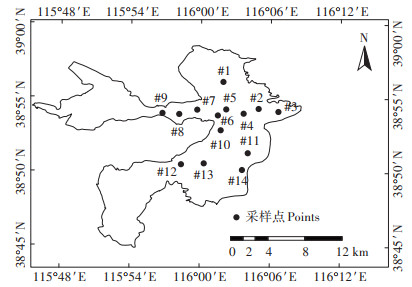
1 材料与方法 1.1 研究区域概况白洋淀是我国华北平原最大的浅水草型湖泊,亦是支撑雄安新区的重要水体(图 1),具有缓洪滞沥、净化水质、提供生物栖息地等多种生态功能[18]。白洋淀淀区面积约366 km2,淀内有大小淀泊143个,地势西高东低。该区属暖温带季风半干旱气候,多年平均气温7.3~12.7 ℃,年平均蒸发量1 369.0 mm,远大于年降水量568.8 mm[19]。近年来,上游9条入淀河流中,仅府河、孝义河和白沟引河常年有水,其余河流基本断流或季节性有水。由于上游来水量不足、气候干旱加剧、淀区人类活动等导致白洋淀水质恶化、生物多样性降低,服务功能退化严重[20-21]。自20世纪80年代以来,水利部、河北省先后开展了近50次生态补水,以期改善淀区生态环境,特别是2017年4月新区建设逐步实施,生态补水力度逐步加大。
|
#1-烧车淀;#2-杨庄子;#3-枣林庄;#4-光淀张庄;#5-王家寨;#6-寨南;#7-鸳鸯岛;#8-南刘庄;#9-府河入淀口;#10-捞王淀;#11-圈头;#12-端村;#13-东田庄;#14-采蒲台 #1-Shaochedian; #2-Yangzhuangzi; #3-Zaolinzhuang; #4-Guangdianzhangzhuang; #5-Wangjiazhai; #6-Zhainan; #7-Yuanyangdao; #8-Nanliuzhuang; #9-The entrance of the Fu River into Baiyangdian Lake; #10-Laowangdian; #11-Quantou; #12-Duancun; #13-Dongtianzhuang; #14-Caiputai 图 1 研究区位置及采样点布设 Figure 1 Locations of study area and sampling sites |
课题组于2009年8、11月、2010年3月及2018年11月、2019年4月和6月(后简写为2009年和2019年)在白洋淀开展了6次浮游动物定点采样,具体点位见图 1。
浮游动物采集参考《水库渔业资源调查规范》(SL 167—1996)[22]方法进行。轮虫类定量样品是用采水器采集混合水样1 L,加入1%鲁戈氏液固定,实验室静置24 h后,浓缩至200 mL,再静置24 h后,虹吸上清液浓缩至50 mL;枝角类和桡足类定量样品用25号浮游生物网(孔径0.064 mm)过滤20 L混合水样,定量至50 mL后,加入1%的鲁戈氏液固定保存。定性样品用25号浮游生物网(孔径0.064 mm)在水体表层(0.5 m处)作“∞”状拖动5 min,将浓缩于网头的水样收集于标本瓶中,加入4%甲醛溶液现场固定。每个样品重复3次。定性和定量样品均带回实验室进行物种种类鉴定和计数[23-24]。
使用多参数水质分析仪(YSI6600)现场测定表层水(0.5 m处)的pH、溶解氧(DO)等;透明度(SD)采用塞氏盘法测定;使用1 L采水器采集表层(0.5 m处)水样1 L,带回实验室低温保存(4 ℃),进行总氮(TN)、总磷(TP)及氨氮(AN)等水质因子测定,其中,TN采用碱性过硫酸钾消解紫外分光光度法(HJ 636—2012),TP采用酸性钼酸铵分光光度法(GB 11893—1989),AN采用纳氏试剂分光光度法(HJ 535—2009)。
1.3 浮游动物优势种及其生态位指数计算 1.3.1 优势种采用Mcnaughton优势度指数[25](Y)确定优势种,计算公式如下:
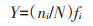
|
(1) |
式中:ni为第i种浮游动物的个体数;N为所有浮游动物总个体数;fi为出现频率。Y≥0.02的种类视为优势种。
1.3.2 种类相似性采用Jaccard′ s种类相似性指数[26]计算两个时期浮游动物的相似程度,计算公式如下:
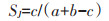
|
(2) |
式中:a、b分别为不同时期浮游动物种类数;c为两个时期都出现的浮游动物种类数;SJ为浮游动物相似性指数,0≤SJ < 0.25为极度不相似,0.25≤SJ < 0.5时为轻度相似,0.5≤SJ < 0.75为中度相似,0.75≤SJ < 1为极其相似,SJ=1为完全相似。
1.3.3 生态位宽度采用以Shannon-Wiener多样性指数为基础的生态位宽度指数[27],计算公式如下:
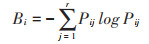
|
(3) |
式中:Pij为种i在第j个样点的个体数占该种所有个体数比例;r为采样点总数;Bi为生态位宽度,Bi值越大,生态位宽度就越大。
1.3.4 生态位重叠指数采用Pianka[28]生态位重叠指数,计算公式如下:
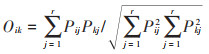
|
(4) |
式中:Oik为生态位重叠指数;Pij和Pkj为种i和种k在样点j的个体数占其所有个体数比例;r为样点总数。根据Wathne等[29]的划分标准:当Oik > 0.6时,该种对间为高度重叠者;当0.3≤Oik≤0.6时,为中度重叠者;当Oik < 0.3时,为低度重叠者。
1.4 数据统计分析采用配对样本t检验判断白洋淀水环境因子、浮游生物指标的年际差异。采用RDA揭示浮游动物群落结构指标与水环境因子间相关关系,先对物种数据进行去趋势对应分析(DCA),根据第一轴的梯度长度选择适宜的排序方法。若梯度长度均 < 3,采用RDA分析;若梯度长度均 > 4,采用CCA分析;若3≤梯度长度≤4,则两种分析均可。
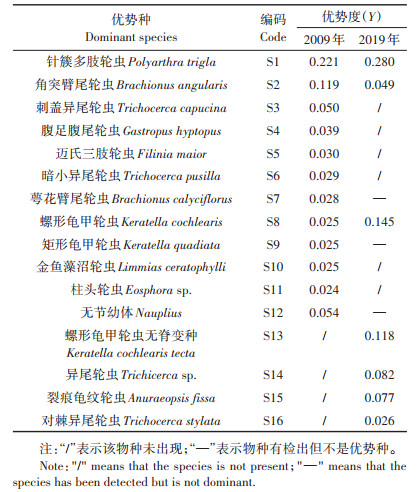
2 结果与分析 2.1 白洋淀浮游动物群落结构时空变化 2.1.1 不同时期对比分析表 1给出了白洋淀6次调查所发现的浮游动物名录。2009年的3季共鉴定出浮游动物56种,包括轮虫类38种、枝角类和桡足类各9种,春、夏、秋季分别调查到29、19种和25种。2019年3季共鉴定出浮游动物43种,轮虫类、枝角类和桡足类分别为24、11种和8种,春、夏、秋季各为37、16种和26种,仍是夏季最少,春季最多。2009年和2019年浮游动物群落中相同物种仅16种,包括轮虫类12种,枝角类和桡足类各2种,其中,角突臂尾轮虫(Brachionus angularis)、针簇多肢轮虫(Polyarthra trigla)、螺形龟甲轮虫(Keratella cochlearis)和无节幼体(Nauplius)在6次调查中均有出现。经计算,2009年和2019年的浮游动物Jaccard′s种类相似性指数(SJ)仅为0.19,种类组成发生显著变化。
|
|
表 1 白洋淀6次调查的浮游动物名录 Table 1 List of zooplankton in Baiyangdian Lake in the six surveys |
白洋淀浮游动物总物种密度从2009年的3.64× 103 ind·L-1显著下降至2019年的1.70×103 ind·L-1(P < 0.05,图 2),其中,轮虫类密度占比最高且有增加,从92.30%上升至96.75%。
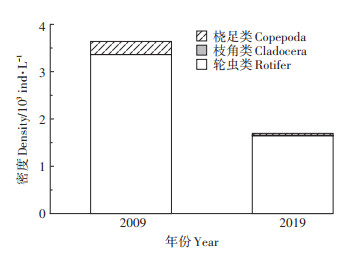
|
图 2 两个时期白洋淀浮游动物物种组成及密度变化 Figure 2 Species composition and density of zooplankton in the two periods in Baiyangdian Lake |
白洋淀浮游动物的物种数及密度分布存在空间异质性(图 3)。2009年,浮游动物物种数在北部地区较高,最高值出现在鸳鸯岛(#7),检测出浮游动物30种,枣林庄(#3)检出物种数最少,仅14种;2019年,白洋淀南部和北部地区的浮游动物物种数较均衡,最高值出现在王家寨(#5),浮游动物为24种,其次是端村(#12),为22种,府河入淀口(#9)的浮游动物物种数最少,仅14种。和2009年相比较,白洋淀北部地区的浮游动物密度大幅降低,密度最低值始终是府河入淀口(#9),减少了60.44%,密度最高值均出现在鸳鸯岛(#7),降低了32.69%。
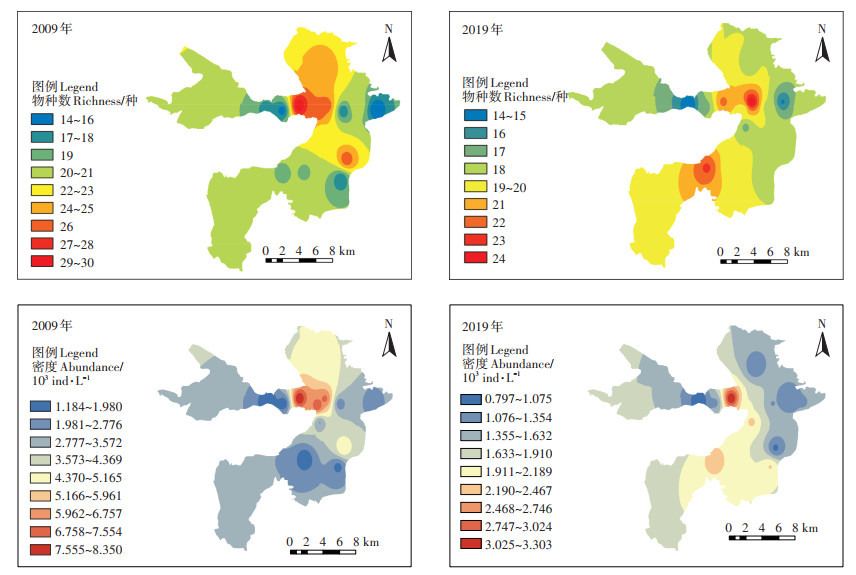
|
图 3 两个时期白洋淀浮游动物物种数及密度的空间分布变化 Figure 3 Spatial distribution of the species richness and density in the two periods in Baiyangdian Lake |
2009年和2019年浮游动物优势种分别为12种(11种轮虫、1种桡足类)和7种(均为轮虫)(表 2)。针簇多肢轮虫(S1)、角突臂尾轮虫(S2)和螺形龟甲轮虫(S8)是两个时期的共同优势种,但其优势度有差异,例如,2019年角突臂尾轮虫(S2)优势度较2009年降低了58.82%,而螺形龟甲轮虫(S8)优势度是2009年的5.8倍。矩形龟甲轮虫(S9)和萼花臂尾轮虫(S7)等富营养型指示种在2019年仍存在,但已不是优势种。
|
|
表 2 2009年和2019年浮游动物优势种及优势度 Table 2 Dominant zooplankton species and the Y values in 2009 and 2019 in Baiyangdian Lake |
不同时期白洋淀浮游动物优势种的生态位宽度值有显著差异(图 4,P < 0.01),其中2009年为1.147~ 2.400,而2019年增加到了2.149~2.530,共同优势种螺形龟甲轮虫(S8)、针簇多肢轮虫(S1)及角突臂尾轮虫(S2)的生态位宽度分别增加了22.11%、7.79%和9.76%。
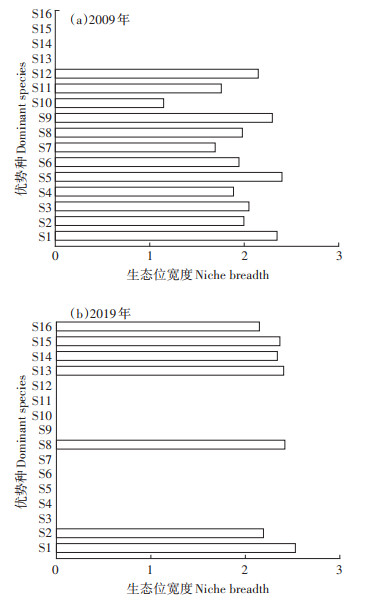
|
图 4 两个时期白洋淀浮游动物优势种生态位宽度值 Figure 4 Niche breadth of zooplankton dominant species in the two periods in Baiyangdian Lake |
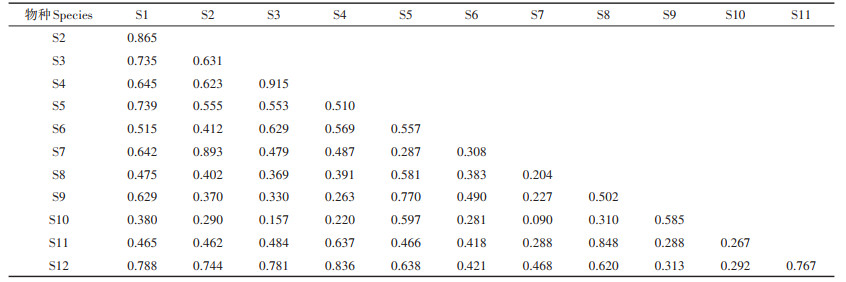
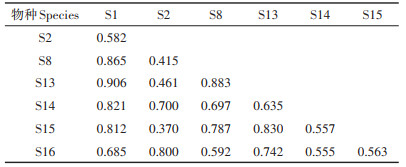
两个时期白洋淀浮游动物优势种生态位重叠指数见表 3和表 4。2009年12个优势种间的生态位重叠值为0.090~0.915,平均值为0.502,且属于高度、中度及低度重叠者的占比分别为31.82%、48.48%和19.70%。广生态位刺盖异尾轮虫(S3)与针簇多肢轮虫(S1)、腹足腹尾轮虫(S4)、无节幼体(S12)的生态位重叠程度较高,分别为0.735、0.915和0.781。针簇多肢轮虫(S1)、迈氏三肢轮虫(S5)和矩形龟甲轮虫(S9)等一些生态位宽度相近的种群之间同样表现出较高的生态位重叠程度,均大于0.6。2019年7个浮游动物优势种间的生态位重叠值为0.370~0.906,平均值为0.679,属于高度重叠者的占比高达61.90%,其余均属中度重叠者。生态位宽度最宽的针簇多肢轮虫(S1)与螺形龟甲轮虫(S8)、螺形龟甲轮虫无脊变种(S13)、异尾轮虫(S14)、裂痕龟纹轮虫(S15)均有较高的重叠度(> 0.8)。
|
|
表 3 2009年白洋淀浮游动物优势种间生态位重叠值 Table 3 Niche overlap between dominant zooplankton species in 2009 in Baiyangdian Lake |
|
|
表 4 2019年白洋淀浮游动物优势种间生态位重叠值 Table 4 Niche overlap between dominant zooplankton species in 2019 in Baiyangdian Lake |
除DO无显著差异之外,2019年白洋淀水质指标较2009年相比,均有显著提升(P < 0.05,图 5)。TP、TN及AN等营养物质变化最为明显,较2009年,TP从(0.40±0.60)mg·L-1减少到(0.05±0.04)mg·L-1;TN从(6.37±8.60)mg·L-1减少到(2.19±1.88)mg·L-1;AN从(3.46±8.19)mg·L-1减少到(0.41±0.30)mg·L-1。
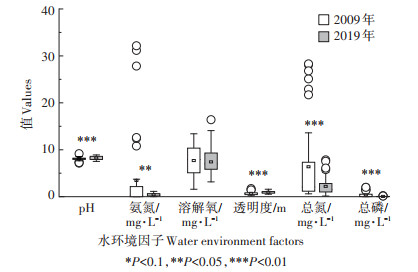
|
图 5 2009年和2019年白洋淀的水质变化 Figure 5 Differences in water quality in 2009 and 2019 in Baiyangdian Lake |
白洋淀水质指标在空间分布上的差异及变化较为显著(图 6),例如,在2009年,白洋淀南部和北部地区的pH为全淀区最低,但在2019年,南部和北部地区的pH在全淀范围内最高。两个时期里,白洋淀西部地区的TN浓度始终高于东部地区,且府河入淀口(#9)和南刘庄(#8)的TN浓度始终是全淀区最高。
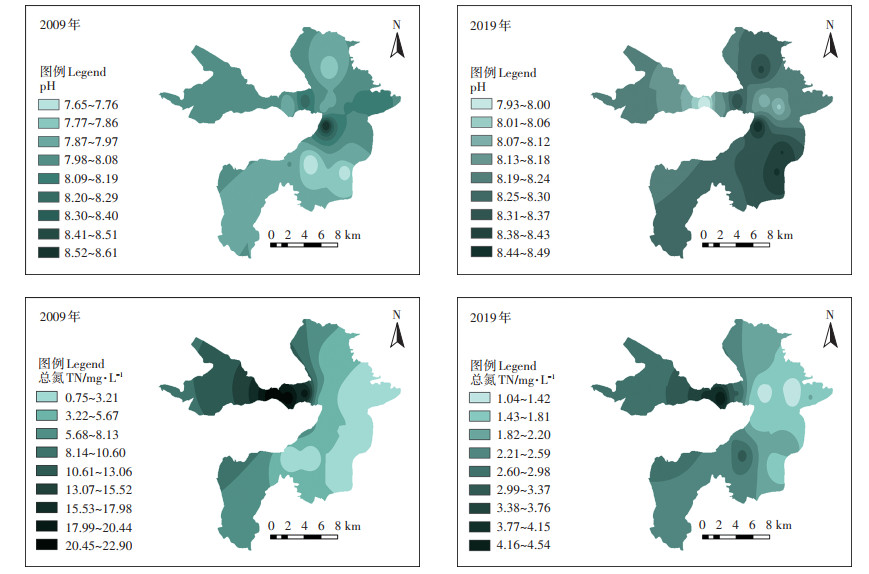
|
图 6 2009年和2019年白洋淀水质指标空间分布 Figure 6 Spatial distribution of water quality in 2009 and 2019 in Baiyangdian Lake |
对白洋淀浮游动物群落结构特征指标与水环境因子之间的关系进行了RDA分析(图 7)。2009年前两个排序轴的特征值分别为0.28和0.20,其解释率为48%,浮游动物群落结构变化整体上由DO和pH所控制,TP、TN、AN也是重要的影响因子。7种优势种(S1、S3、S4、S6、S8、S10、S11)与DO和pH呈正相关,共同优势种S1和S8均与pH、DO和SD呈正相关,与TN、TP和AN呈负相关;共同优势种S2与TN、TP和AN呈正相关,与SD呈负相关。2019年前两个排序轴的特征值分别为0.49和0.08,其解释率为57%,浮游动物群落结构仍存在明显的分化现象,整体上由pH、TN、DO和SD所主导,3个优势种(S8、S13、S15)和pH、SD呈正相关,与TP呈负相关;3个优势种(S1、S2、S14)与TN、DO呈正相关。
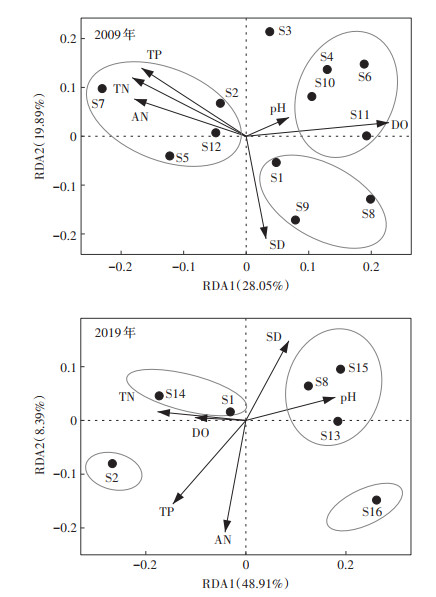
|
图 7 2009年和2019年白洋淀浮游动物优势种生态位宽度与水环境因子的RDA排序图 Figure 7 RDA dimensional ordination biplot of species and environmental factors in 2009 and 2019 in Baiyangdian Lake |
国内外研究表明,许多湖泊的浮游动物群落结构均是以轮虫类为主,个体较大的枝角类和桡足类占比较少[30],例如对鄱阳湖[31]和呼伦湖[32]浮游动物的调查均发现轮虫物种数占比高于50%,本研究显示白洋淀浮游动物中轮虫类为优势类群。这可能归因于轮虫独特的孤雌生殖方式,个体较小,发育时间短,使其能迅速适应水体理化环境从而快速繁殖生长[33-34];同时白洋淀pH波动范围为7.65~8.61,介于7~9之间,比较利于轮虫的生长[35];另外,白洋淀中蓝藻属于浮游植物优势种群[36],其会限制枝角类和桡足类的生长[37]。且在本次调查中,白洋淀轮虫类物种数占比从2009年的67.86%降低为2019年的55.81%,这一现象在我国其他湖泊中也有出现,杨佳等[38]探究了近20年来太湖梅梁湾浮游动物群落结构的演变,发现轮虫类物种数占比从63.11%下降至48.70%。
多项研究表明,湖泊中轮虫密度占较大优势,枝角类和桡足类对密度的贡献很小,且一般不形成优势种[39],在本次调查中,2019年白洋淀浮游动物优势种均为轮虫类。相关研究指出浮游动物优势种在年际间存在明显差异[40],且浮游动物第一优势种的优势地位特别明显[31],例如聂雪等[40]对沙湖2012—2016年浮游动物的调查显示,优势种从7种减少为3种,其共同优势种仅1种;沙湖各月份的浮游动物第一优势种密度均显著高于第二优势种密度[31]。本研究的结果与上述报道一致,白洋淀浮游动物优势种从2009年的12种减少为2019年的7种,其共同优势种仅3种(针簇多肢轮虫、角突臂尾轮虫及螺形龟甲轮虫),且各时期第一优势物种优势度均显著高于第二优势物种。上述优势种也在我国其他淡水湖泊中处于优势地位,例如,螺形龟甲轮虫是广布性种类,具有较强的生态适应性和耐污能力,也是鄱阳湖[40]、呼伦湖[32]浮游动物的优势种;耐污型种针簇多肢轮虫是太湖[41]、巢湖[42]浮游动物的优势种。
3.2 浮游动物生态位分化对淡水生态系统演变的重要指示作用生态位宽度反映物种占有空间资源的多少、分布范围和均匀程度,有研究发现优势种生态位宽度侧重于物种的资源位点数量,与分布站点密切相关[35]。本次调查中,白洋淀浮游动物优势种表现出较强的一致性。2009年生态位宽度较大的迈氏三肢轮虫(S5)和针簇多肢轮虫(S1)等在全淀均有分布,而生态位宽度最小的金鱼藻沼轮虫(S10)仅出现在中部和南部地区。2019年,生态位宽度最大的优势种针簇多肢轮虫(S1)和螺形龟甲轮虫(S8)分布在全淀范围,而生态位宽度值最小的对棘异尾轮虫(S16)在府河入口(#9)和南刘庄(#8)均未出现。生态位宽度较大的优势种分布站点较多,说明其对生境有较强的适应性,窄生态位的优势种群对环境的适应性较差,其分布范围在很大程度上受到环境因素的限制。有研究表明[43],窄生态位物种主要对环境因素作出响应,广生态位物种主要对空间因素作出响应。和2009年相比,白洋淀部分富营养型优势种的生态位宽度均较高,且大幅增加,表现出对环境有更强的适应能力,也存在部分富营养型优势种不再占优势,甚至未在2019年调查中发现的现象。从生态位理论角度,群落的演替就是群落中的物种逐渐替换为生态位宽度较宽、适应能力强的物种的过程[44]。总体来说,白洋淀浮游动物优势种生态位宽度的年际差异较大(P < 0.01),种群之间利用资源的互补性较强,这可能与白洋淀水环境在时空尺度上的多样化及各优势种对环境适应能力的差异有关。
相关研究表明[44-45],生态位宽度较大的物种也会与其他许多优势种表现出较高的生态位重叠程度。本次研究中,和2009年相比较,2019年白洋淀浮游动物优势种的平均生态位重叠指数增加了35.26%,且属于高度重叠者的种对占比增加了30.08%。生态位宽度最宽的针簇多肢轮虫(S1)与螺形龟甲轮虫(S8)、螺形龟甲轮虫无脊变种(S13)、异尾轮虫(S14)、裂痕龟纹轮虫(S15)均有很高的重叠度,生态位重叠值均在0.8以上。这些现象说明了白洋淀浮游动物物种间对资源的竞争增强。另外,白洋淀的浮游动物优势种存在较明显的生态位分化(图 7),如角突臂尾轮虫(S2)和对棘异尾轮虫(S16)之间的生态位重叠度高达0.800,但其存在明显的生态位分化现象。生态位分化通常被认为是有利于生态和功能相似的物种共存的关键过程[13, 18],其通过多种方式减少物种对有限资源或生存空间的竞争[45]。因此,生态位分化有助于促进物种共存和维持整个生物多样性[46-47]。
3.3 浮游动物优势种对水环境变化的响应浮游动物优势种常用来指示水质状态[48],本次调查显示,白洋淀的污染指示种尤其是富营养水体指示种种类减少,非污染指示种数量增加,这在一定程度上体现了白洋淀富营养化程度的降低。浮游动物的自主运动能力较弱,具有随波逐流的特点,因此水环境的变化对浮游动物群落结构分布起着主导作用。在本研究中,两个时期内白洋淀的DO变化不显著,因此其对针簇多肢轮虫(S1)的影响程度仍保持很高,针簇多肢轮虫(S1)始终是白洋淀优势度最高的物种;而营养指标TN、TP和AN均显著降低,使得主要受其影响的角突臂尾轮虫(S2)的优势度降低了58.82%;另外,白洋淀SD显著增加,促使受其影响的螺形龟甲轮虫(S8)的优势度增至5.8倍。本研究冗余分析结果显示,两个时期第一排序轴均反映了pH、DO和TN对白洋淀浮游动物优势种分布的直接影响。总体而言,浮游动物的生态位在一定程度上反映了物种和所处水环境之间的关系,水环境因子的差异使得白洋淀浮游动物的动态分布具有复杂性。在两个时期,白洋淀浮游动物中生态位重叠值最低的种对均在富营养化指标(TN、TP、AN)及理化指标(pH、DO)上分化十分明显,例如,角突臂尾轮虫(S2)是典型的富营养型指示种,其大量分布的采样点,金鱼藻沼轮虫(S10)均未出现,其生态适应性的不同导致了时空分布的差异,从而造成两者间重叠度很低。因此,揭示浮游生物群落结构和水环境因子的关系可为湖泊生态恢复提供科学的理论支撑。
4 结论(1)从2009年到2019年白洋淀浮游动物群落结构发生较大的时空变化。物种数从56种减少为43种,优势种从12种减少到7种,密度从3.64×103 ind· L-1下降到1.70×103 ind·L-1,且淀区北部的浮游动物密度大幅降低,此外两个时期的浮游动物物种组成相似度极低。
(2)从2009年到2019年3个共同优势种的生态位宽度均有所增加,浮游动物优势种间的生态位重叠指数的平均值从0.502增加到0.679,增加较为明显,且高度重叠者占比增加了30.08%,表明白洋淀浮游动物种间竞争加强。
(3)浮游动物群落结构特征与环境因子的RDA结果表明,pH、TN和DO始终是影响白洋淀浮游动物群落结构的主要环境因子,而TP和AN的影响程度在2019年较2009年有所减弱。
| [1] |
Xiong W, Ni P, Chen Y, et al. Zooplankton community structure along a pollution gradient at fine geographical scales in river ecosystems:The importance of species sorting over dispersal[J]. Molecular Ecology, 2017, 26(16): 4351-4360. |
| [2] |
Liu P, Xu S L, Li J H, et al. Urbanization increases biotic homogenization of zooplankton communities in tropical reservoirs[J]. Ecological Indicators, 2019, 110(1): 1-10. |
| [3] |
Ye L, Chang C Y, García-Comas C, et al. Increasing zooplankton size diversity enhances the strength of top-down control on phytoplankton through diet niche partitioning[J]. Journal of Animal Ecology, 2013, 82(5): 1052-1060. |
| [4] |
Vereshchaka A L, Anokhina L L, Lukasheva T A, et al. Long-term studies reveal major environmental factors driving zooplankton dynamics and periodicities in the Black Sea coastal zooplankton[J]. PeerJ, 2019, 7(1): 7588-7612. |
| [5] |
Florencio M, Fernández-Zamudio R, Lozano M, et al. Interannual variation in filling season affects zooplankton diversity in Mediterranean temporary ponds[J]. Hydrobiologia, 2020, 847(1): 1195-1205. |
| [6] |
王丽, 王保栋, 陈求稳, 等. 三峡三期蓄水后长江口海域浮游动物群落特征及影响因子[J]. 生态学报, 2016, 36(9): 2505-2512. WANG Li, WANG Bao-dong, CHEN Qiu-wen, et al. Characteristics of the zooplankton community and impact factors in the Yangtze estuary coastal eara after third stage impoundment of the Three Gorges Dam[J]. Acta Ecologica Sinica, 2016, 36(9): 2505-2512. |
| [7] |
MacLeod J, Keller W, Paterson A M. Crustacean zooplankton in lakes of the far north of Ontario, Canada[J]. Polar Biology, 2018, 41(6): 1257-1267. |
| [8] |
Stamou G, Katsiapi M, Moustaka-Gouni M, et al. Trophic state assessment based on zooplankton communities in Mediterranean lakes[J]. Hydrobiologia, 2019, 844(1): 83-103. |
| [9] |
Yao C, He T R, Xu Y Y, et al. Mercury bioaccumulation in zooplankton and its relationship with eutrophication in the waters in the karst region of Guizhou Province, southwest China[J]. Environmental Science and Pollution Research, 2020, 27(8): 8596-8610. |
| [10] |
王乙震, 罗阳, 周绪申, 等. 白洋淀浮游动物生物多样性及水生态评价[J]. 水资源与水工程学报, 2015, 26(6): 94-100. WANG Yi-zhen, LUO Yang, ZHOU Xu-shen, et al. Zooplankton biodiversity and water ecological evaluation in Baiyangdian Lake[J]. Journal of Water Resources & Water Engineering, 2015, 26(6): 94-100. |
| [11] |
Grinnell J. The niche-relationships of the California thrasher[J]. The Auk, 1917, 34(4): 427-433. |
| [12] |
MacArthur R H. Population ecology of some warblers of northeastern coniferous forests[J]. Ecology, 1958, 39(4): 599-619. |
| [13] |
Angert A L, Huxman T E, Chesson P, et al. Functional tradeoffs determine species coexistence via the storage effect[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(28): 11641-11645. |
| [14] |
刘艳, 郑越月, 敖艳艳. 不同生长基质的苔藓植物优势种生态位与种间联结[J]. 生态学报, 2019, 39(1): 286-293. LIU Yan, ZHENG Yue-yue, AO Yan-yan. Niche and interspecific association of dominant bryophytes on different substrates[J]. Acta Ecologica Sinica, 2019, 39(1): 286-293. |
| [15] |
Dézerald O, Srivastava D S, Cereghino R, et al. Functional traits and environmental conditions predict community isotopic niches and energy pathways across spatial scales[J]. Functional Ecology, 2018, 32(10): 2423-2434. |
| [16] |
Le Coz M, Chambord S, Souissi S, et al. Are zooplankton communities structured by taxa ecological niches or by hydrological features?[J]. Ecohydrology, 2018, 11(5): 1-36. |
| [17] |
郑挺, 林元烧, 曹文清, 等. 北部湾北部生态系统结构与功能:浮游动物空间生态位及其分化[J]. 生态学报, 2014, 34(13): 3635-3649. ZHENG Ting, LIN Yuan-shao, CAO Wen-qing, et al. Ecosystem structure and function in northern Beibu Gulf:Zooplankton spatial niche and its differentiation[J]. Acta Ecologica Sinica, 2014, 34(13): 3635-3649. |
| [18] |
张梦嫚, 吴秀芹. 近20年白洋淀湿地水文连通性及空间形态演变[J]. 生态学报, 2018, 38(12): 4205-4213. ZHANG Meng-man, WU Xiu-qin. Changes in hydrological connectivity and spatial morphology of Baiyangdian wetland over the last 20 years[J]. Acta Ecologica Sinica, 2018, 38(12): 4205-4213. |
| [19] |
刘俊国, 赵丹丹, 叶斌. 雄安新区白洋淀生态属性辨析及生态修复保护研究[J]. 生态学报, 2019, 39(9): 3019-3025. LIU Jun-guo, ZHAO Dan-dan, YE Bin. Ecological attributes, restoration, and protection of the Baiyangdian in Xiong'an New Area[J]. Acta Ecologica Sinica, 2019, 39(9): 3019-3025. |
| [20] |
王青, 严登华, 秦天玲, 等. 人类活动对白洋淀干旱的影响[J]. 湿地科学, 2013, 11(4): 475-481. WANG Qing, YAN Deng-hua, QIN Tian-ling, et al. Impacts of human activities on drought of Baiyangdian Lake[J]. Wetland Science, 2013, 11(4): 475-481. |
| [21] |
Han Q, Tong R Z, Sun W C, et al. Anthropogenic influences on the water quality of the Baiyangdian Lake in north China over the last decade[J]. Science of the Total Environment, 2020, 701(1): 1-9. |
| [22] |
中华人民共和国水利部.水库渔业资源调查规范SL167-1996[S].北京: 中国水利水电出版社, 1996. Minstry of Water Resources of the People's Republic of China. Standard for the investigation of reservoir fishery resources SL167-1996[S]. Beijing: Water & Power Press, 1996. |
| [23] |
王家楫. 中国淡水轮虫志[M]. 北京: 科学出版社, 1961. WANG Jia-ji. Freshwater rotifers of China[M]. Beijing: Science Press, 1961. |
| [24] |
韩茂森. 淡水浮游生物图谱[M]. 北京: 中国农业出版社, 1980. HAN Mao-sen. Maps of freshwater plankton[M]. Beijing: Agriculture Press, 1980. |
| [25] |
Mcnaughton S J. Relationship among functional prosperities of California grassland[J]. Nature, 1967, 216(5111): 168-169. |
| [26] |
Simpson E H. Measurement of diversity[J]. Nature, 1949, 163(4148): 688-688. |
| [27] |
Shannon C E, Weaver E. The mathematical theory of communication[M]. Urbana: University of Illinois Press, 1963.
|
| [28] |
Pianka E R. The structure of lizard communities[J]. Annual Review of Ecology and Systematics, 1973, 4(1): 53-74. |
| [29] |
Wathne J A, Haug T, Lydersen C. Prey preference and niche overlap of ringed seals Phoca hispida and harp seals P. groenlandica in the Barents Sea[J]. Marine Ecology Progress Series, 2000, 194(1): 233-239. |
| [30] |
龚勋, 封圆圆, 赵海涛, 等. 倒天河水库和碧阳湖夏秋轮虫群落结构特征及水质评价[J]. 安徽农业科学, 2019, 47(12): 104-107. GONG Xun, FENG Yuan-yuan, ZHAO Hai-tao, et al. Structural characteristics of rotifer community and water quality evaluation in Daotianhe Reservoir and Biyang Lake in summer and autumn[J]. Journal of Anhui Agricultural Sciences, 2019, 47(12): 104-107. |
| [31] |
吕乾, 胡旭仁, 聂雪, 等. 夏季丰水期水位波动过程中鄱阳湖1个碟形子湖内浮游动物群落的演替特征[J]. 生态学报, 2020, 40(4): 1-10. Qi an, HU Xu-ren, NIE Xue, et al. Succession characteristics of zooplankton community in a shallow dished sub-lake of Poyang Lake during water level fluctuations in summer[J]. Acta Ecologica Sinica, 2020, 40(4): 1-10. |
| [32] |
姜忠峰, 李畅游, 张生. 呼伦湖浮游动物调查与水体富营养化评价[J]. 干旱区资源与环境, 2014, 28(1): 158-162. JIANG Zhong-feng, LI Chang-you, ZHANG Sheng. Zooplankton in Hulun Lake and the eutrophication evaluation[J]. Journal of Arid Land Resources and Environment, 2014, 28(1): 158-162. |
| [33] |
饶利华, 吴芝瑛, 徐骏, 等. 杭州西湖轮虫的群落结构及与水体环境因子的关系[J]. 湖泊科学, 2013, 25(1): 138-146. RAO Li-hua, WU Zhi-ying, XU Jun, et al. Relationship between environmental factors of the water and rotifer community structure in West Lake, Hangzhou[J]. Journal of Lake Science, 2013, 25(1): 138-146. |
| [34] |
郑金秀, 池仕运, 李聃, 等. 富营养化对浅水湖泊轮虫种群结构影响研究[J]. 生态环境学报, 2014, 23(12): 1964-1971. ZHENG Jin-xiu, CHI Shi-yun, LI Dan, et al. Impact of eutrophication on rotifer community structure in shallow lakes[J]. Ecology and Environmental Sciences, 2014, 23(12): 1964-1971. |
| [35] |
Bruno B, Pejler B. Rotifer occurrence in relation to pH[J]. Hydrobiologia, 1987, 147(1): 107-116. |
| [36] |
杨薇, 田艺苑, 张兆衡, 等. 近60年来白洋淀浮游植物群落演变及生物完整性评价[J]. 环境生态学, 2019, 1(8): 1-9. YANG Wei, TIAN Yi-yuan, ZHANG Zhao-heng, et al. Evolution of phytoplankton community and biotic integrity in Baiyangdian Lake in recent 60 years[J]. Environmental Ecology, 2019, 1(8): 1-9. |
| [37] |
Zhang J, Xie P, Tao M, et al. The impact of fish predation and cyanobacteria on zooplankton size structure in 96 subtropical lakes[J]. PLoS One, 2013, 8(10): 1-15. |
| [38] |
杨佳, 周健, 秦伯强, 等. 太湖梅梁湾浮游动物群落结构长期变化特征(1997-2017年)[J]. 环境科学, 2020, 41(3): 1246-1255. YANG Jia, ZHOU Jian, QIN Bo-qiang, et al. Long-term variation characteristics of zooplankton community structure in Meiliang Bay, Lake Taihu[J]. Environmental Science, 2020, 41(3): 1246-1255. |
| [39] |
郭坤, 彭婷, 罗静波, 等. 长湖浮游动物群落结构及其与环境因子的关系[J]. 海洋与湖沼, 2017, 48(1): 40-49. GUO Kun, PENG Ting, LUO Jing-bo, et al. Community structure of zooplankton and the driving physicochemical factors in Changhu Lake[J]. Oceanologia Et limnologia Sinica, 2017, 48(1): 40-49. |
| [40] |
聂雪, 胡旭仁, 刘观华, 等. 鄱阳湖子湖泊浮游动物多样性及水质生物评价[J]. 南昌大学学报(理科版), 2018, 42(2): 161-167. NIE Xue, HU Xu-ren, LIU Guan-hua, et al. Species diversity of zooplankton and water quality biological assessment in a sub-lake of Poyang Lake[J]. Journal of Nanchang University(Natural Science), 2018, 42(2): 161-167. |
| [41] |
代培, 刘凯, 周彦锋, 等. 太湖五里湖湖滨带浮游动物群落结构特征[J]. 水生态学杂志, 2019, 40(1): 55-63. DAI Pei, LIU Kai, ZHOU Yan-feng, et al. Zooplankton community characteristics in the lakeside zone of Wuli Lake, Taihu Lake[J]. Journal of Hydroecology, 2019, 40(1): 55-63. |
| [42] |
李怀国, 杨长明, 王育来. 巢湖水质现状及浮游生物群落结构特征[J]. 安徽农业科学, 2017, 45(22): 13-16. LI Huai-guo, YANG Chang-ming, WANG Yu-lai. Water quality and community structure characteristics of plankton in Chaohu Lake[J]. Journal of Anhui Agricultural Sciences, 2017, 45(22): 13-16. |
| [43] |
Pandit S N, Kolasa J, Cottenie K. Contrasts between habitat generalists and specialists:An empirical extension to the basic metacommunity framework[J]. Ecology, 2009, 90(8): 2253-2262. |
| [44] |
汤雁滨, 廖一波, 寿鹿, 等. 南麂列岛潮间带大型底栖动物群落优势种生态位[J]. 生态学报, 2016, 36(2): 489-498. TANG Yan-bin, LIAO Yi-bo, SHOU Lu, et al. Intertidal zone of the Nanji Islands is a niche for dominant species of the macrobenthic community[J]. Acta Ecologica Sinica, 2016, 36(2): 489-498. |
| [45] |
Hardin G. The competitive exclusion principle[J]. Science, 1960, 131(3409): 1292-1297. |
| [46] |
Chesson P. Mechanisms of maintenance of species diversity[J]. Annual Review of Ecology & Systematics, 2000, 31(1): 343-366. |
| [47] |
Penk M R, Ian D, Kenneth I. Temporally variable niche overlap and competitive potential of an introduced and a native mysid shrimp[J]. Hydrobiologia, 2018, 823(1): 109-119. |
| [48] |
Sládeček V. Rotifers as indicators of water quality[J]. Hydrobiologia, 1983, 100(1): 169-201. |
 2020, Vol. 39
2020, Vol. 39