畜禽养殖废水富含大量的过剩营养元素(碳氮磷等) [1],若未经合理的处理就排入自然水环境,会导致水体的富营养化现象,破坏水生生态系统,并给当地居民带来潜在的健康风险[2]。因此,在排放前需要选择合适的工艺有效去除废水中的营养物质。传统活性污泥法虽然可以有效降解污水中的有机碳,但其脱氮除磷效果不佳。目前通常的脱氮工艺是通过硝化和反硝化来实现的,分别出现在好氧和缺氧的反应阶段,而磷的去除是在厌氧-好氧条件下利用聚磷酸盐积累生物(PAOs)来完成的[3]。在依靠硝化与反硝化作用脱氮以及吸磷与释磷的过程中需要提供好氧与缺氧或厌氧条件,这就导致处理过程无法在同一个空间或时间中进行[4]。此外,反硝化排放的氮气以及剩余活性污泥中的磷也是一种资源浪费。微藻作为一种光合自养生物,具有生长速率快、环境适应性强、油脂含量高等特点,是作为生物质能源开发的优质原料[5],在耦合利用废水培养微藻的过程中,可以同化吸收废水中的氮磷以及小分子有机物,降低培养成本,生产高附加值生物质产品[6]。
近年来有研究表明,利用微藻与活性污泥中细菌建立藻菌共生体系可以有效地提高废水处理效果,良好共生体系的建立还可以提高生物量产率[7],原因是活性污泥中好氧菌消耗氧气并为微藻提供二氧化碳以及一些促进微藻生长的分子,例如维生素B12[8],而微藻可以通过光合作用产生好氧菌需要的氧气,降低一部分机械曝气能耗,降低一定的经济成本。进一步通过采收微藻生物质来回收资源[2, 9-10],还可以改善活性污泥法资源浪费的状况。藻菌共生体系的建立与许多因素有关,因此,对藻菌共生体系参数的优化十分必要,影响藻菌共生体系的主要因素有曝气量、氨氮浓度、接种比例;Tang等[11]通过单因素试验研究表明,0.2 L·min-1(空气)是藻菌体系所需的最佳曝气量;杨翔梅[12]研究表明,当氨氮初始浓度为550 mg·L-1时,废水中氨氮的去除量最大,达到252.56 mg·L-1,当初始氨氮为850 mg·L-1时,废水中氨氮消减量最小,仅为150.70 mg·L-1;Su等[13]研究指出,当微藻与活性污泥接种比例为5:1(m/m)时,藻菌共培养对市政废水中的氮磷去除率达到最大值,去除率分别为93.5%±205%、91.0%±7.0%。目前,大部分研究通过单因素试验优化藻菌共生体系的操作参数,具有较大的局限性,而响应面分析是将体系响应值作为一个或多个因素的函数,运用图形技术将这种函数关系显示出来,以供研究者通过观察和计算选择试验设计中的最优化条件,这是建立在单因素试验基础上进行的试验探究,可以研究不同参数组合中因素的相互关联性并获得最优参数组合,本研究中选取的因素之间存在相互影响,因此利用响应面法进行试验探究更具实际意义。
本文选用实验室前期从废水中筛选的小球藻(Chlorella vulgaris),以养猪场厌氧消化废水为处理对象,采用响应面法对藻菌共生体系猪场厌氧消化废水处理工艺进行参数优化,探究不同的曝气量、初始氨氮浓度、接种比例对共生体系消化废水处理的影响,优化藻菌共生体系对废水处理的工艺参数,为建立稳定的藻菌共生体系以提高水处理效果与生物量产量提供一定的理论依据与技术支持。
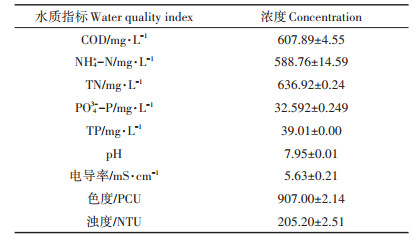
1 材料与方法 1.1 畜禽养殖废水水质特征试验目标废水为厌氧消化处理后的猪场养殖废水,取自南昌市周边某养猪场。采集后的畜禽养殖废水贮存在深色塑料桶中(避光),4 ℃条件下保存。试验前对污水水样进行预处理,去除污水中的颗粒物和杂质,避免对试验过程和结果的干扰,具体步骤是:4 000 g离心10 min去除大部分的悬浮性颗粒物,再取上清液进行0.45 μm滤膜(玻璃纤维膜,津腾)过滤以彻底去除污水中的不溶性悬浮固体。预处理后水样进行水质指标测定,包括COD、NH4+ -N、TN、PO43- -P、TP、pH等,具体测定结果详见表 1。从表 1中数据可知,畜禽养殖废水中的氮主要以氨氮的形式存在,其浓度为(588.76±14.59) mg·L-1,而磷的主要存在形式为正磷酸盐,其浓度为(332.592±0.249) mg·L-1,污水中COD为(607.89±4.55) mg·L-1,pH值为7.95±0.01。
|
|
表 1 猪粪消化废水水质特征 Table 1 The characteristics of digested swine manure wastewater |
微藻:试验所用微藻藻种为前期试验从垃圾渗滤液中分离纯化所得到的一株小球藻(Chlorella vulgaris,编号为NCU-C1),其对污水中的高盐、高氨氮体系具有良好的适应性,适用于本试验研究的目标水质状况。微藻培养基为TAP培养基和BG-11培养基,主要分为两个培养阶段:初始活化阶段,选用TAP培养基,在恒温培养箱(30 ℃)中培养,光照强度3 000~ 3 500 lx,培养至OD680值约为1;扩大培养阶段,选用BG-11培养基,在管式光生物反应器(Photobioreactor,PBR) [14]中培养(图 1),培养温度为30 ℃(夏季室温),光源为5支14 W的LED灯管,光强度4 500~ 9 000 lx (约56~112 μmol·m-2·s-1),曝气量0.1 m3·m-3· min-1,所供应气体中CO2含量0.058%(m/m),气体先经0.45 μm滤膜过滤再进入反应器中,将微藻生物量培养至OD680值0.6~1.2后,可将其用于后续污水处理试验。
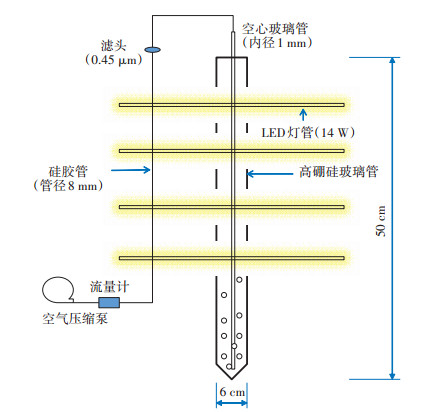
|
图 1 试验装置示意图 Figure 1 Diagram of experimental apparatus |
活性污泥:试验使用的活性污泥为实验室曝气驯化所得,对畜禽养殖废水具有良好的适应性。活性污泥驯化采用空气曝气驯化,将厌氧污泥驯化为好氧活性污泥,用于本研究污水处理试验,培养条件为:曝气量2 L·min-1(空气),培养至干质量约2~4 g·L-1,污泥沉降比(SV30)为10%~20%。
1.3 试验装置本研究基于实验室搭建的管式光生物反应器(PBR)开展为期7 d的污水处理试验,装置示意图如图 1所示,每支反应管有效工作体积为1 L(高500 mm,内径60 mm,管壁厚2 mm),制作材质为透光性良好的高硼硅玻璃,具有较高的透光率。试验所需的光源由反应管后排支架上的LED灯管(14 W)提供,其组合最大光强可达9 000 lx,试验采用的光周期为12 h/12 h。曝气装置采用无油空气压缩机(OTS- 600,台州),通过多孔气排将空气分布至各反应管中,通过流量计控制每支管中的曝气量,用于曝气的细玻璃管内径1 mm,可使通入的气体呈小气泡的形式从反应管底部上升到顶部,提高空气中氧气与二氧化碳在混合液中的传质效率,进而提高体系中微生物对氧气和二氧化碳的利用效率。
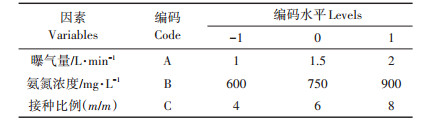
1.4 响应面试验设计基于前期均匀试验U63(代表单因素试验),本试验采用响应面法中Box-Behnken中心组合设计响应面试验,本次试验主要探究处理目标水体内部环境对藻菌体系的影响,因此选择了3个对水体内部环境较为重要的参数:曝气量(Aeration rate,AR)、初始氨氮浓度(NH4+ -N)、接种比例(Inoculation proportion,IP)。响应值为碳、氮、磷去除率,以此建立3因素3水平的中心组合试验,见表 2。
|
|
表 2 Box-Behnken试验因子编码及水平 Table 2 Codes and levels for testing variables of Box-Behnken experiments |
为减轻初始碳氮比偏低对藻菌共生的不利影响,试验开始阶段,通过添加葡萄糖,提高有机碳含量至1000 mg·L-1。因素编码水平设置方法如下:通过流量计调节曝气量;通过投加硫酸铵调整氨氮浓度;固定总接种量1 g·L-1不变,通过改变活性污泥与微藻含量调整接种比例,比如,1 L反应体系中接种0.8 g(干质量)活性污泥与0.2 g(干质量)微藻,此时接种比例记为4.0。其他非变量因素均保持恒定:温度30 ℃(夏季室温),光照强度4 500 lx,光暗比12 h/12 h,pH为7.95~8.21。
1.5 分析方法水质检测:取适量水样,经过0.45 μm滤膜过滤,氮磷检测方法参照《水和废水监测分析方法》 [15]:采用纳氏试剂分光光度法测氨氮(NH4+-N),采用碱性过硫酸钾消解紫外分光光度法测总氮(TN),采用钼酸盐分光光度法测正磷酸盐(PO43--P),采用过硫酸钾消解钼酸盐分光光度法测总磷(TP),吸光度采用分光光度计(DR6000,HACH,US)检测。化学需氧量(Chemical oxygen demand,COD)采用快速消解法(HJ/T 399- 2007)测定[16],基本步骤为:首先配制预装混合试剂,即于消解管(HACH,US)中加入1.0 mL重铬酸钾溶液+硫酸汞溶液(2+1)以及4.0 mL硫酸银-硫酸溶液,然后加入2.0 mL待测试样并拧紧管盖,置于(165± 2) ℃加热器中消解,计时加热15 min,消解完后,静置,冷却至室温,(600±20) nm波长下测吸光度,计算公式(1)如下:
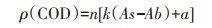
|
(1) |
式中:ρ (COD)为水样COD值,mg·L-1;n为水样稀释倍数;k为校准曲线灵敏度,mg·L-1·1-1;As为试样测定的吸光度值;Ab为空白试样测定的吸光度值;a为校准曲线截距,mg·L-1。
微藻生物量检测:叶绿素a提取改进方法如下[17],取5.0 mL混合液置于10 mL离心管中,然后4000 g离心10 min(TDL5A,英泰仪器),弃去上清液后加入5.0 mL无水甲醇,在避光条件下利用旋涡混匀器振荡提取5 min,提取完毕后4 000 g离心10 min取上清液,以甲醇为参比,在653 nm和666 nm波长下测吸光度,根据公式(2)计算叶绿素a含量,进一步通过获得的微藻干质量与叶绿素a曲线计算微藻干质量,见公式(3)。
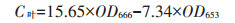
|
(2) |
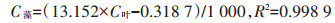
|
(3) |
式中:C叶为叶绿素a浓度,mg·L-1;ODλ为λ波长(nm)的吸光度;C藻为微藻干质量,g·L-1。
响应面数据分析:利用Design expert 8.0.6软件分析。首先设计Box-Behnken中心组合试验设计表,将每组试验的响应值输入,然后依次进行Transform分析、Tit Sumary分析、Model分析、ANOVA(方差分析)、Diagnostics分析、Model Graphs分析,通过ANOVA分析可得到二次回归拟合方程与显著性,通过Model Graphs分析可得到3D与平面响应面。
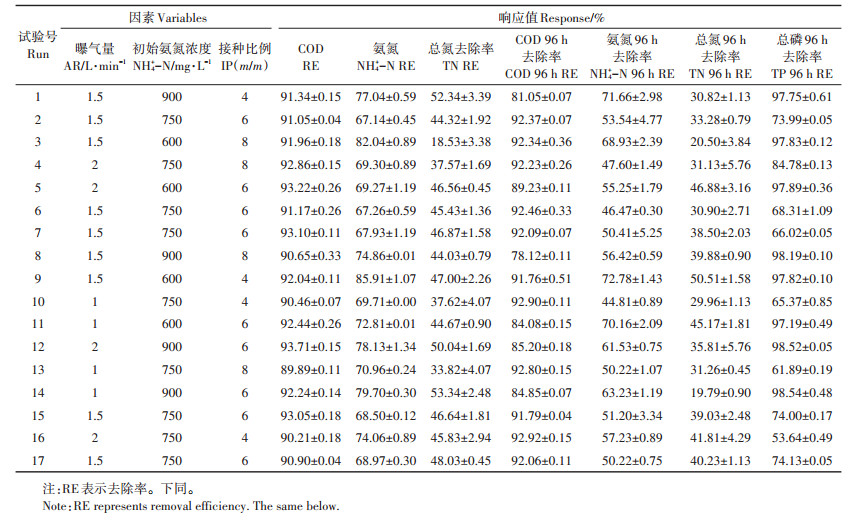
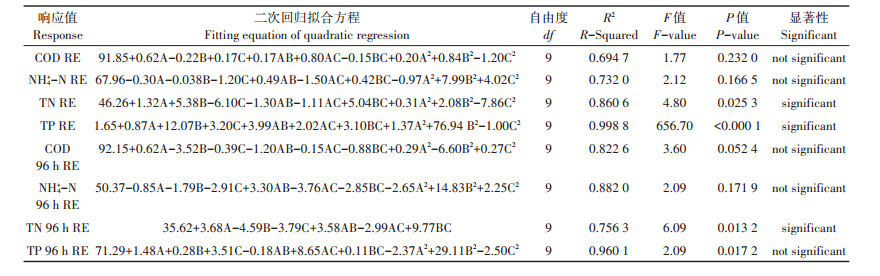
2 结果与讨论 2.1 响应面设计表与响应值本研究采用Box-Behnken中心组合设计方法对参数进行优化[18],试验共进行17组,3个变量在3个水平(-1、0、1)的COD、氨氮(NH4+-N)、TN和TP的响应值如表 3所示,并用Design expert 8.0.6软件对数据进行二次回归分析与方差分析(ANOVA) [19-21],其中软件给出的回归方程如表 4所示。
|
|
表 3 Box-Behnken中心组合试验设计与响应面试验结果 Table 3 Box-Behnken design (BBD)and experiments results of the RSM analysis |
|
|
表 4 响应面方差分析 Table 4 ANOVA results for the RSM |
对模型进行方差分析,并对模型系数进行显著性检验(表 4),方差分析结果显示,TN去除率、TP去除率、TN前96 h去除率的模型P值均小于0.05,因而模型显著,同时这些模型的R2值均接近1,表明试验数据与数学模型拟合性较好,能够用上述模型准确分析因素的交互作用。其他非显著性模型可通过剔除影响其显著性的因素或结合实际情况进行分析,具体分析见2.2。
2.2 响应面分析结果根据各模型分析各因素交互作用对响应值的显著性,分别对回归方程绘制对应的响应面进行分析,探究各因素接种比例、曝气量以及初始氨氮浓度的交互影响。
2.2.1 变量对COD去除率影响的响应面分析图 2为基于中心组合设计(BBC)的COD去除率响应面,响应面背景上(a2、b2、c2、d2)的曲线表示等高线,等高线越密集,对应曲面越陡峭,说明该因素对响应值的影响越大,同一等高线上的每个点表示的数值相同[21]。结合方差分析(表 4)可知,COD去除率响应面模型虽然没有拟合方程显示的显著关系(P=0.232 0> 0.05),但有文献证明,COD的去除与曝气量(AR)、接种比例(IP)有关[11, 13]。进一步分析,由a1为接种比例6.0时初始氨氮(NH4+-N)浓度与曝气量(AR)对COD去除率的响应面可知,随着曝气量上升(1~2 L · min-1),体系COD最终去除率逐渐增大,故曝气量2.0 L·min-1为最佳参数;当体系中初始氨氮含量较低时,氨氮浓度与COD去除率成反比,当初始氨氮含量较高时,初始氨氮浓度与体系中COD去除率成正比关系,当污泥与微藻接种比例6.0(m/m)、曝气量2.0 L· min-1时,体系中COD的去除率达到最大,可达93.7%。由图 2中b1、b2可知,当初始氨氮浓度750 mg·L-1时,COD去除率在接种比例较低时成正比,在接种比例较高时成反比,当活性污泥占比较少时,随着活性污泥的增加,COD的降解效率提高,但是当活性污泥占比过大而微藻含量较少时,活性污泥的增加反而降低COD的去除效果,这说明微藻对活性污泥降解COD有促进作用,当活性污泥占比过大时,微藻对活性污泥活性的促进作用达到饱和状态,此时,当接种比例6.5 (m/m)与曝气量2.0 L·min-1时,体系中COD去除率最大,可达92.5%。
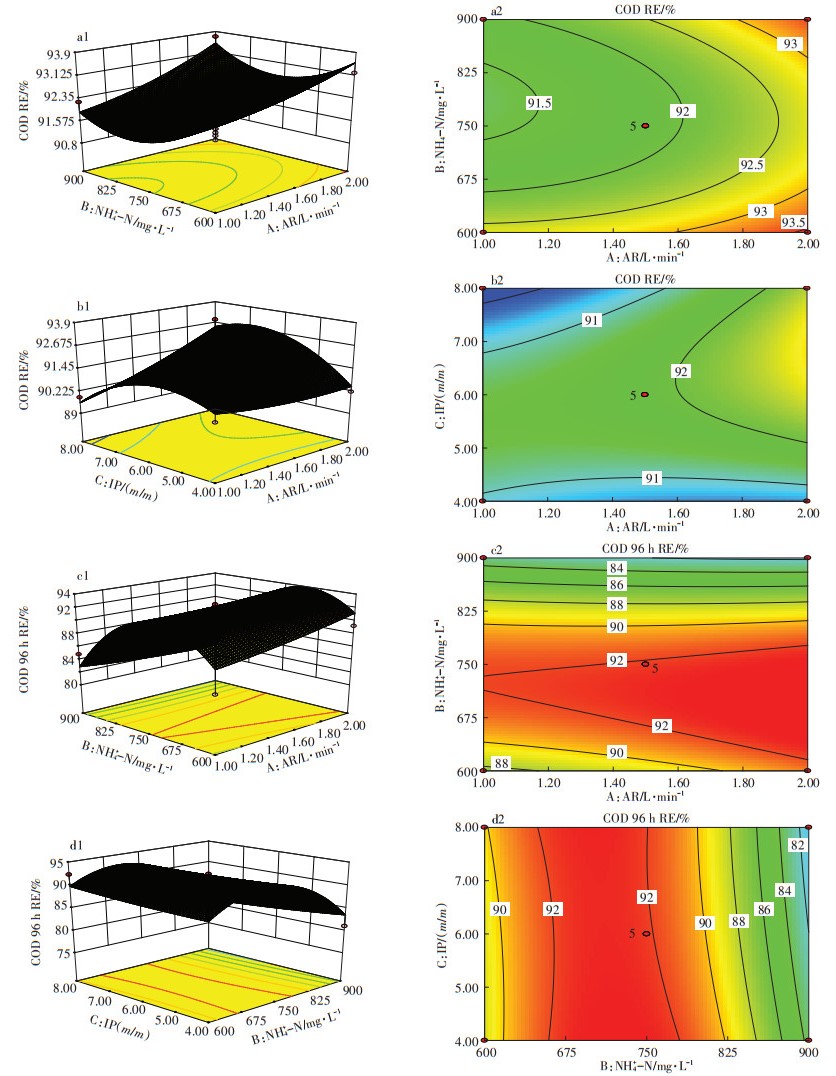
|
图 2 响应值为COD去除率的响应面图 Figure 2 Response surface graph with COD removal efficiency as response value |
由图 2中c1~d2可知,在试验初期(前96 h),曝气量和接种比例对COD去除率影响较小,初始氨氮浓度为主要影响因素,当初始氨氮浓度为750 mg·L-1时,试验前期COD去除率达到最大值92.91%。
综上分析,试验初期(前96 h)影响COD降解的因素主要是初始氨氮浓度,最佳初始氨氮浓度为750 mg·L-1,96 h之后氨氮浓度不再是主要的影响因素,此时活性污泥:微藻接种比例为6.0(m/m)、曝气量2.0 L·min-1可达到最大COD去除率,>92%。
2.2.2 变量对氮去除率影响的响应面分析由表 4可知,在试验选定的3个因素条件下,氨氮去除率的响应面拟合方程未见显著相关性(P=0.166 5>0.05),但是由图 3中e1、e2(初始氨氮750 mg·L-1)可知,当接种比例4.0、曝气量2.0 L·min-1时,体系中氨氮达到最大去除率,约73%。由图 3中f1、f2分析可知,当氨氮初始浓度较高或者较低时,藻菌共生体系对氨氮的去除效果均较好,可能的原因是,虽然初始氨氮浓度较高,但是曝气会起到氨氮吹脱的作用,一部分氨氮会通过吹脱转移到空气中,并没有被生物吸收利用[22],但本试验并没有得到曝气量与氨氮去除的显著关系,可能原因是本试验中曝气的目的是为体系提供无机碳与搅拌混匀作用,没有刻意研究吹脱氨氮效应。
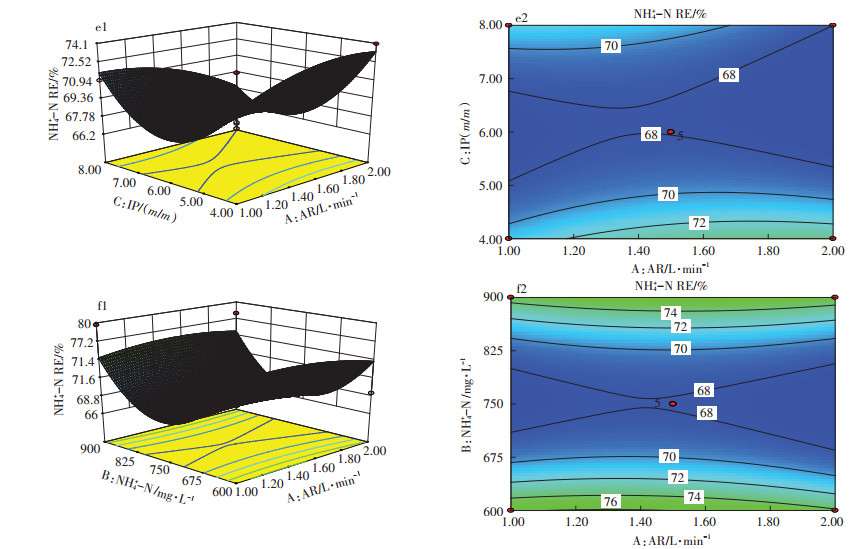
|
图 3 响应值为氨氮去除率的响应面图 Figure 3 Response surface graph with NH+ 4-N removal efficiency as response value |
进一步结合不同试验组氨氮浓度随时间的变化(图 4)分析可知,反应器14(1.0-900-6)的氨氮最终去除量为776.17 mg·L-1,反应器9 (1.5-600-4)的氨氮最终去除量为544.1 mg·L-1,虽然初始氨氮浓度较高或者较低时去除率相近,但是当初始氨氮浓度较高时的去除量比初始值较低的情况提高29.9%,说明在曝气存在的情况下,藻菌共生体系可以适应较高初始氨氮浓度环境,而进一步考虑氨氮对微藻的毒害作用与COD去除情况,初始氨氮浓度750 mg·L-1依然为最佳选择。
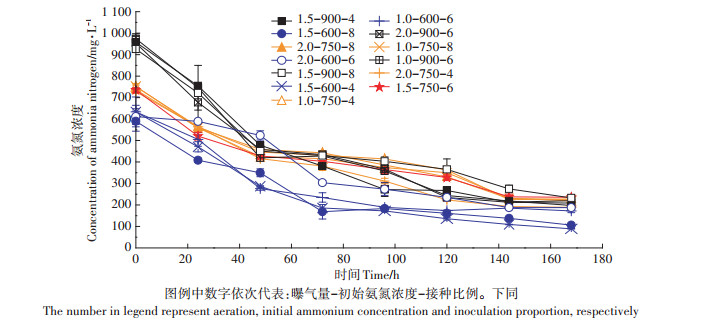
|
图 4 不同试验组氨氮浓度随时间的变化 Figure 4 Changes of NH4+-N concentration with time in different experimental groups |
ANOVA结果显示(表 4),TN去除率响应面模型拟合方程存在显著关系(P=0.025 3 < 0.05)。其中,TN去除率与接种比例存在最为明显的显著关系(P= 0.007 4 < 0.05),说明影响TN去除率的主要因素为接种比例。进一步分析,由图 5中g1为接种比例与曝气量对TN去除率的(初始氨氮浓度为750 mg·L-1)响应面可知,当接种比例小于5.0 (m/m)时,TN去除率与接种比例成正比,原因是随着污泥占比增大,对水中氨氮的硝化能力增强,由于氨氮对微藻有毒害作用,所以促进了微藻对氮源(硝氮)的同化吸收[23];当接种比例大于5.0(m/m)时,虽然体系的硝化能力增强,但接种微生物中微藻占比过少,导致硝氮的同化吸收较少,因此最佳接种比例为5.0(m/m)。对于曝气量而言,曝气对体系中氨氮有一定的吹脱能力,在较大曝气量(2.0 L·min-1)条件下,氨氮吹脱效果自然较好,由试验结果可知,当接种比例5.0、曝气量2.0 L·min-1时,TN去除率最高达到53%。而图 5中h1、h2(曝气量为1.5 L·min-1)表明,当接种比例5.0 (m/m)、初始氨氮浓度900 mg·L-1时TN去除率最高达54%,此参数条件与上述氨氮去除率响应面分析结论基本一致。
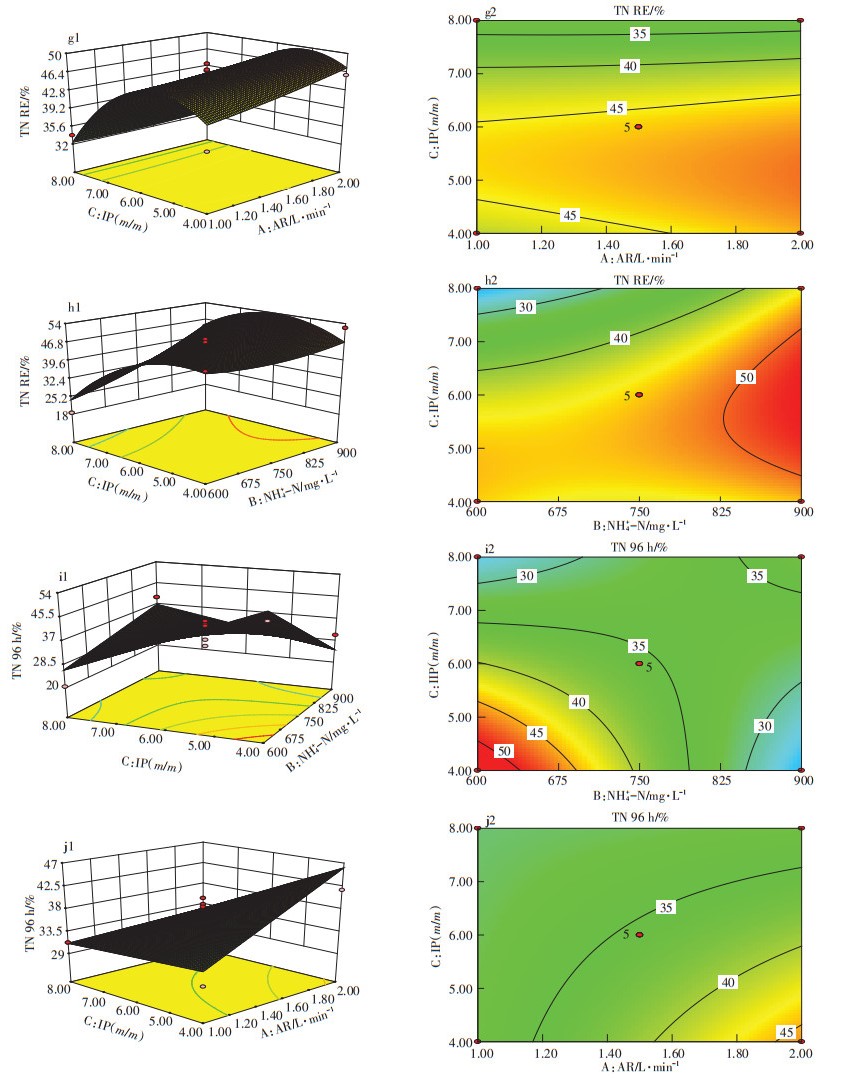
|
图 5 响应值为TN去除率的响应面 Figure 5 Response surface graph with TN removal efficiency as response value |
通过对试验前期(96 h) TN去除率响应面(图 5中i1~j2)的分析可知,试验前期接种比例与曝气量对TN去除率的影响与试验结束时的影响一致,但不同的是,当接种比例与初始氨氮浓度值均较低时[接种比例1.4 (m/m)、初始氨氮浓度600 mg·L-1],TN去除率达到最大值,说明初始氨氮浓度对TN去除率有一定的影响,特别是在试验前期藻菌共生体系正在建立的过程中。
综上所述,当污泥:微藻接种比例5.0(m/m)、曝气量1.5 L·min-1时,体系对TN的去除率可达最大值(53%),而氨氮初始浓度由于曝气吹脱的原因,与TN去除率不存在明显的显著线性关系,考虑到氨氮对微藻毒害作用,初始氨氮值不应该过高,750 mg·L-1的初始氨氮浓度较为合适。
2.2.3 变量对TP去除率影响的响应面分析由于活性污泥释磷以及吸附解析现象的存在,藻菌共生体系对水中磷的去除在试验前期就可完成,而试验后期体系中磷会升高,因此,本研究只对试验前期(96 h)的磷去除率响应面进行分析。由初始水质检测结果可知,养猪消化废水中磷的存在形式几乎全是正磷酸盐(PO43--P),因此本次试验只研究变量对TP的去除率影响的响应面。TP的生物降解主要依靠微藻的生物同化吸收,有研究表明,在光照条件下,微藻在6 h内可以吸收12 mg·L-1 P[10],但是由图 6中k1、k2响应面(初始氨氮750 mg·L-1)可知,活性污泥:微藻接种量为8.0(m/m)时,试验前期TP的去除效率最高,可能的原因是活性污泥占比较大,对磷的吸附量较大,但并非生物同化吸收,在试验后期,体系中磷浓度的回升可以证明这一点,因此,最佳接种比例调整为6.0(m/m)。由图 6中l1~m2响应面可知,初始氨氮浓度对TP去除率的影响类似于氨氮,即在高浓度与低浓度成不同的正、反比例关系,在低浓度600~750mg·L-1成反比例关系,在高浓度750~900 mg·L-1成正比例关系,因此初始氨氮值为600 mg·L-1或900 mg· L-1时,体系中TP去除率达到最大值(约100%),但考虑初始氨氮不宜过高的情况,为保证体系中其他指标的去除效果,应采用较低的初始氨氮浓度值(600 mg· L-1)。由TP去除率响应面与方差分析表(表 4)可知,TP去除率响应面模型没有显著相关性,因此本文在曝气量对TP去除率影响方面未做深入分析,根据图 6中l1与m1响应面,设定曝气量1.5 L·min-1为最佳参数。
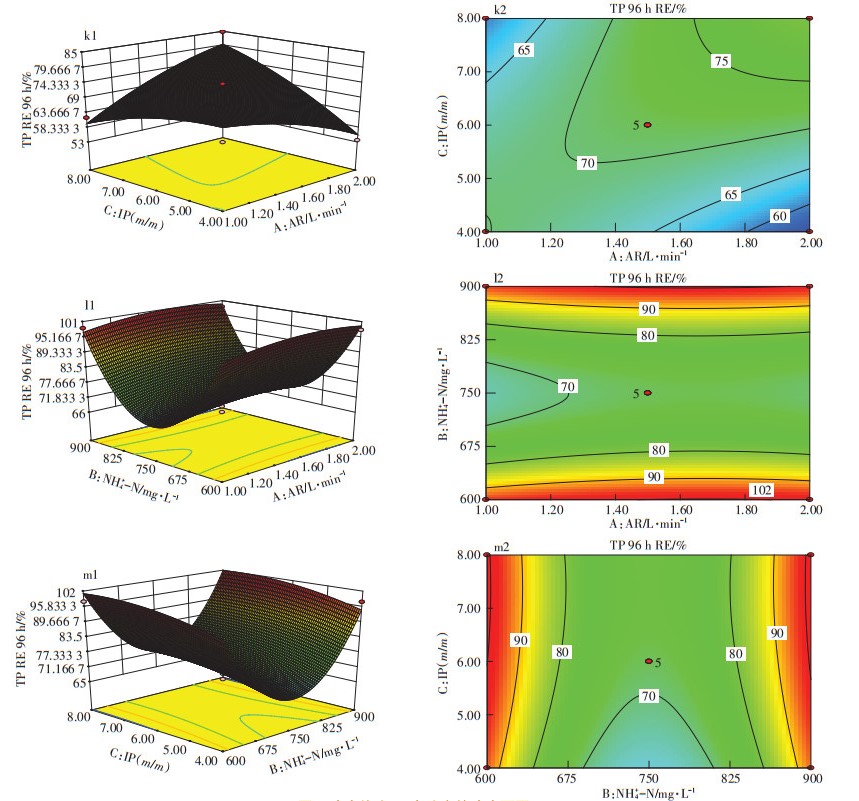
|
图 6 响应值为TP去除率的响应面图 Figure 6 Response surface graph with TP removal efficiency as response value |
综上分析,接种比例6.0(m/m)、曝气量1.5 L· min-1、初始氨氮浓度600 mg·L-1为去除TP的最佳参数,在此参数条件下,试验前期96 h内便可达到接近100%的TP去除率。
2.3 生物量产量由于活性污泥生物量在体系中变化较为稳定,因此微藻生物量可以反映共生体系的生物量产量以及微生物活性,因此本试验检测了不同体系中微藻生物量的变化(图 7)。由图可知,反应器1(1.5-900-4)和10(1.0-750-4)微藻生物量产量最高,达到1.63~1.64g·L-1,由已有相关文献可知[24-26],微藻在废水处理过程中的生物量产量为0.95~2.84 g·L-1,本试验所得微藻产量达到平均水平。反应器1设定的初始条件为曝气量1.5 L·min-1、初始氨氮浓度900 mg·L-1、接种比例4.0(m/m),反应器10设定的初始条件为曝气量1.0 L·min-1、初始氨氮浓度750 mg·L-1、接种比例4.0(m/ m),生物量产量达到最大值,说明此时的条件有利于藻菌共生,初步断定为最佳参数。进一步分析反应器8、12以及14的微藻生物量产量,发现较初始值未见明显增长,其中一个原因是这些反应器设定的初始氨氮浓度较高(900 mg·L-1),与相关研究中氨氮对微藻的毒害作用结论相符[22];另一个原因是这些反应器中活性污泥:微藻的接种比例较大(6~8),藻菌形成竞争关系,抑制了微藻的生长。综上,反应器10(1.0- 750-4)体系中初始氨氮值在900 mg·L-1以下,且生物量产量相比其他试验组达到最大值,因此确定为最佳体系,其参数为最佳操作参数。
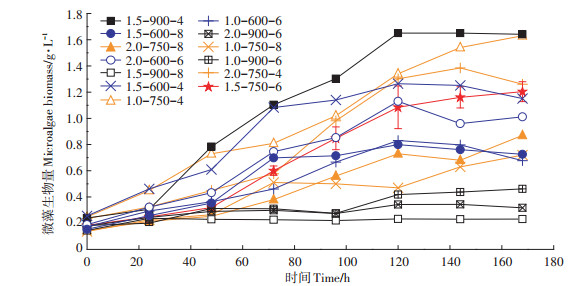
|
图 7 不同试验组微藻生物量随时间的变化 Figure 7 Changes of microalgae biomass with time in different experimental groups |
为了检验模型预测的准确性,以确定的最优工艺参数进行3次重复试验,根据实际情况进行相应调整,具体选择的参数如下:初始氨氮浓度为750 mg· L-1,接种比例6.0(m/m),曝气量1.5 L·min-1。结果取3次平行试验平均值,得到COD、TN、TP 96 h去除率分别为91.96%、46.56%、97.89%,微藻生物量产量达到1.33 g·L-1。与模型预测值非常接近,证明响应面法参数优化结果具有有效性。
3 结论通过响应面法优化藻菌共生体系对畜禽养殖废水的处理,发现针对不同的污染物,具有不同的最优参数组合,通过协调各因素的影响,可以优化废水处理工艺参数,具有实际指导意义,具体研究结果总结如下:
(1) 对于COD的去除研究发现,初始氨氮浓度为750 mg·L-1、活性污泥:微藻接种比例为(6±0.5)、曝气量2.0 L · min-1时可达到最大COD去除率,为92%以上。
(2) 对于氮的去除研究发现,750 mg·L-1的初始氨氮浓度较为合适,且当活性污泥:微藻接种比例(5.0±0.5)、曝气量1.5 L·min-1时,体系中TN的去除率可达最大值(53%)。
(3) 当初始氨氮浓度600 mg·L-1、接种比例6.0、曝气量1.5 L·min-1时,试验前期96 h内便可达到100%的TP去除率。
(4) 初始条件分别为曝气量1.5 L·min-1-初始氨氮浓度900 mg·L-1接种比例4.0、曝气量1.0 L·min-1-初始氨氮浓度750 mg·L-1-接种比例4.0时,微藻生物量产量最高,达到1.63~1.64 g·L-1。
通过本试验研究可知,在中试规模中,以实际废水为处理目标,藻菌共培养在COD和磷方面的去除率可达到90%以上,对于氨氮的去除量可达544~766 mg·L-1,且无需经过硝化反硝化过程,简化了处理流程。采收的生物质具有一定的可利用性,相对于传统的活性污泥,由于含有微藻而降低了危害性。合适的反应器更有利于藻菌共生系统的形成与稳定,因此对于反应器的设计与优化将会是下一步研究的重点。
| [1] |
邵一奇, 王电站, 颜成, 等. 厌氧消化对猪场废水中溶解性和颗粒态有机物的组成与性质的影响[J]. 南京农业大学学报, 2019, 42(4): 713-720. SHAO Yi-qi, WANG Dian-zhan, YAN Cheng, et al. Effect of anaerobic digestion on the composition and properties of particular and soluble organic substance in swine slurry[J]. Journal of Nanjing Agricultural University, 2019, 42(4): 713-720. |
| [2] |
Gonçalves A L, Pires J C M, Simões M. A review on the use of microalgal consortia for wastewater treatment[J]. Algal Research, 2017, 24: 403-415. DOI:10.1016/j.algal.2016.11.008 |
| [3] |
Zhu S, Qin L, Feng P, et al. Treatment of low C/N ratio wastewater and biomass production using co-culture of Chlorella vulgaris and activated sludge in a batch photobioreactor[J]. Bioresource Technology, 2019, 274: 313-320. DOI:10.1016/j.biortech.2018.10.034 |
| [4] |
王霜. PN-Anammox同步脱氮工艺处理猪场废水厌氧消化液调控策略研究[D].北京: 中国农业科学院, 2018: 1-4. WANG Shuang. Control strategies of PN-Anammox process for treating digested effluent of swine wastewater[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018: 1-4. |
| [5] |
Pragya N, Pandey K K, Sahoo P K. A review on harvesting, oil extraction and biofuels production technologies from microalgae[J]. Renewable and Sustainable Energy Reviews, 2013, 24(10): 159-171. |
| [6] |
Mathimani T, Mallick N. A comprehensive review on harvesting of microalgae for biodiesel:Key challenges and future directions[J]. Renewable and Sustainable Energy Reviews, 2018, 91: 1103-1120. DOI:10.1016/j.rser.2018.04.083 |
| [7] |
赵立欣, 宋成军, 董保成, 等. 基于微藻养殖的沼液资源化利用与高价值生物质生产耦合技术研究[J]. 安全与环境学报, 2012, 12(3): 63-67. ZHAO Li-xin, SONG Cheng-jun, DONG Bao-cheng, et al. On the microalgae-cultivation based coupling of biogas fermentative liquid-resource utilization and high-quality biomass production[J]. Journal of Safety and Environment, 2012, 12(3): 63-67. |
| [8] |
Ramanan R, Kim B H, Cho D H, et al. Algae-bacteria interactions:Evolution, ecology and emerging applications[J]. Biotechnology Advance, 2016, 34(1): 14-29. |
| [9] |
Li K, Liu Q, Fang F, et al. Microalgae-based wastewater treatment for nutrients recovery:A review[J]. Bioresource Technology, 2019, 291: 121934. DOI:10.1016/j.biortech.2019.121934 |
| [10] |
Wang L, Liu J, Zhao Q, et al. Comparative study of wastewater treatment and nutrient recycle via activated sludge, microalgae and combination systems[J]. Bioresource Technology, 2016, 211: 1-5. DOI:10.1016/j.biortech.2016.03.048 |
| [11] |
Tang C, Zuo W, Tian Y, et al. Effect of aeration rate on performance and stability of algal-bacterial symbiosis system to treat domestic wastewater in sequencing batch reactors[J]. Bioresource Technology, 2016, 222: 156-164. DOI:10.1016/j.biortech.2016.09.123 |
| [12] |
杨翔梅.细菌强化微藻生物系统对养猪废水厌氧消化液的处理研究[D].杭州: 浙江大学, 2018: 30-38. YANG Xiang-mei. Research on the treatment of digester piggery wastewater by bacteria strengthening microalgae biological system[D]. Hangzhou: Zhejiang University, 2018: 30-38. |
| [13] |
Su Y, Mennerich A, Urban B. Synergistic cooperation between wastewater-born algae and activated sludge for wastewater treatment:Influence of algae and sludge inoculation ratios[J]. Bioresource Technology, 2012, 105: 67-73. DOI:10.1016/j.biortech.2011.11.113 |
| [14] |
Cheirsilp B, Thawechai T, Prasertsan P. Immobilized oleaginous microalgae for production of lipid and phytoremediation of secondary effluent from palm oil mill in fluidized bed photobioreactor[J]. Bioresource Technology, 2017, 241: 787. DOI:10.1016/j.biortech.2017.06.016 |
| [15] |
国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京: 中国环境科学出版社, 2003: 701-731. State Environmental Protection Administration. Methods for monitoring and analysis of water and wastewater[M]. 4th Edition. Beijing: China Environmental Science Press, 2003: 701-731. |
| [16] |
国家环境保护总局.水质化学需氧量的测定快速消解分光光度法(HJ/T 399-2007)[S].北京: 中国环境出版社, 2007. State Environmental Protection Administration. Water quality-Determination of chemical oxygen demand-Fast digestion-Spectrophotometric method (HJ/T 399-2007)[S]. Beijing: China Environment Press, 2007. |
| [17] |
Levasseur W, Taidi B, Lacombe R, et al. Impact of seconds to minutes photoperiods on Chlorella vulgaris growth rate and chlorophyll a and b content[J]. Algal Research, 2018, 36: 10-16. DOI:10.1016/j.algal.2018.10.007 |
| [18] |
Ding Y, Zheng J, Xia X, et al. Box-Behnken design for the optimization of nanoscale retrograded starch formation by high-power ultrasonication[J]. LWT-Food Science and Technology, 2016, 67: 206-213. DOI:10.1016/j.lwt.2015.11.022 |
| [19] |
Chen J, Leng L, Ye C, et al. A comparative study between fungal pellet-and spore-assisted microalgae harvesting methods for algae bioflocculation[J]. Bioresource Technology, 2018, 259: 181-190. DOI:10.1016/j.biortech.2018.03.040 |
| [20] |
Li L, Zhang J, Tian Y, et al. Optimization of nutrient removal of novel electrochemically active carriers by response surface methodology[J]. Bioresource Technology, 2019, 292: 122000. DOI:10.1016/j.biortech.2019.122000 |
| [21] |
Jiang Y, Wang H, Zhao C, et al. Establishment of stable microalgalbacterial consortium in liquid digestate for nutrient removal and biomass accumulation[J]. Bioresource Technology, 2018, 268: 300-307. DOI:10.1016/j.biortech.2018.07.142 |
| [22] |
Beuckels A, Smolders E, Muylaert K. Nitrogen availability influences phosphorus removal in microalgae-based wastewater treatment[J]. Water Research, 2015, 77: 98-106. DOI:10.1016/j.watres.2015.03.018 |
| [23] |
Ayre J M, Moheimani N R, Borowitzka M A. Growth of microalgae on undiluted anaerobic digestate of piggery effluent with high ammonium concentrations[J]. Algal Research, 2017, 24(A): 218-226. |
| [24] |
Chang H, Quan X, Zhong N, et al. High-efficiency nutrients reclamation from landfill leachate by microalgae Chlorella vulgaris in membrane photobioreactor for bio-lipid production[J]. Bioresource Technology, 2018, 266: 374-381. DOI:10.1016/j.biortech.2018.06.077 |
| [25] |
Luo L, Lin X, Zeng F, et al. Performance of a novel photobioreactor for nutrient removal from piggery biogas slurry:Operation parameters, microbial diversity and nutrient recovery potential[J]. Bioresource Technology, 2019, 272: 421-432. DOI:10.1016/j.biortech.2018.10.057 |
| [26] |
Bidhu B B, Debasish D, Gargi G. Production of microbial biomass feedstock via co-cultivation of microalgae-bacteria consortium coupled with effective wastewater treatment:A sustainable approach[J]. Algal Research, 2019, 37: 228-239. DOI:10.1016/j.algal.2018.11.020 |
 2020, Vol. 39
2020, Vol. 39