2. 江苏大学环境生态研究所, 江苏 镇江 212013;
3. 江苏大学农业工程研究院, 江苏 镇江 212013
2. Institute of Environment and Ecology, Jiangsu University, Zhenjiang 212013, China;
3. Institute of Agricultural Engineering, Jiangsu University, Zhenjiang 212013, China
四溴双酚A (Tetrabromobisphenol A,TBBPA)由于极好的阻燃性能成为大量使用的溴代阻燃剂(Brominated flame retardants,BFRs),常见于电子产品、纺织品等生活用品中[1]。2001年全球市场总需求达12万t,2004年约17万t[2]。正是由于TBBPA类阻燃剂的大量应用,导致其在环境样品中广泛检出,在大气[3-4]、水体、鱼类[5-6]、土壤[7]、底泥[8-9]、植物[10]、鸟蛋[11]以及哺乳动物[12-13]中均有报道。研究发现TBBPA类化合物是潜在的环境内分泌干扰物,类似于持久性有机污染物,会在环境和生物体内积聚并且具有细胞毒性[14]、神经毒性[15]、内分泌干扰性[16]、免疫毒性[17]以及干扰甲状腺激素[18]等作用。
四溴双酚A双(2-羟乙基)醚[TBBPA bis(2-hydroxyethyl)ether,TBBPA-DHEE]是主要的TBBPA衍生物之一,在工程聚合物、环氧树脂、热塑性聚酯、聚氨酯等中广泛应用。由于其具有较高的logKow值,有研究人员认为TBBPA-DHEE具有一定持久性和生物蓄积性,并且具有较高的神经毒性。四溴双酚A单(2 -羟乙基)醚[TBBPA mono(2-hydroxyetyl)ether,TBBPA-MHEE]是TBBPAs类化合物及其衍生物在生产过程中的副产物[19]。由于结构与TBBPA-DHEE类似,TBBPA-MHEE可能与TBBPA-DHEE具有类似的毒性作用。然而,TBBPA-DHEE/TBBPA-MHEE在环境中累积、转运以及分布的研究较为少见。因此,亟需建立TBBPA-DHEE/TBBPA-MHEE的检测方法,为评估其环境行为提供技术手段。Liu等[19]建立了基于ESI-MS用于测定TBBPA-MHEE和TBBPA-DHEE及其他副产物或降解产物。但是TBBPA-DHEE的质子亲和力低,基于ESI或APCI的离子源无法生成足够的特定离子簇用于定量测定,必须通过AgNO3的衍生化,然而高浓度AgNO3的引入可能会增加仪器污染[20-21]。Liu等[22]应用超高效液相色谱仪-Orbitrap Fusion三重质谱检测TBBPA-MHEE。但是若采用仪器方法,则需要优先获得仪器资源并且需要在测样品前对样本按要求进行处理,且该方法也不能实现一次检测多种样品。以抗原-抗体特异性结合为基础的免疫分析方法,由于其检测手段简单等优势在环境分析领域被大量使用[21-24]。然而,应用免疫分析方法检测TBBPA-DHEE/TBBPA-MHEE却鲜有报道。
本研究以阻燃剂TBBPA-DHEE/TBBPA-MHEE为目标物,先通过设计半抗原结构,定期免疫小鼠;之后利用杂交瘤技术筛选出高灵敏度的单克隆抗体,并且对抗体的灵敏度等性质进行了鉴定;建立间接竞争性ELISA方法用于TBBPA-DHEE/TBBPA-MHEE的检测;采集典型区域的环境样本,分析其中TBBPADHEE/TBBPA-MHEE的分布情况。
1 材料与方法 1.1 材料5~6周龄的雌性Balb/C小鼠购自扬州大学兽医学院比较医学中心,SP2/0骨髓瘤细胞购自武汉博士德生物工程有限公司,四溴双酚A单(2-羟基二乙)醚标准品、四溴双酚A双(2-羟基二乙)醚标准品来自中科院生态环境中心,BSA、OVA、EDC·HCl、FCA、FIA、HAT(50×)、HT(50×)、50% PEG、3′-3′-5′-5′-四甲基联苯胺(TMB)购自美国Sigma公司,HRP-IgG购自美国Jacket公司,胎牛血清(Fetal bovine serum,FBS)购自美国Gibico公司。其他常规试剂均购自国药集团化学试剂有限公司。酶标板购于厦门怡佳美公司。多功能酶标仪(TECAN Infinite M1000 PRO)为奥地利TECAN公司生产。
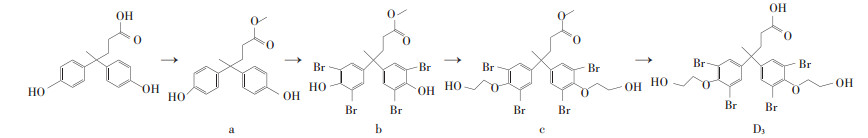
1.2 TBBPA-DHEE半抗原的合成与鉴定称取2.86 g双酚酸装入圆底烧瓶内,加入甲醇20 mL,回流2 h得到2.9 g双酚酸甲酯(a);将双酚酸甲酯溶于40 mL冰醋酸中,然后慢慢加入10 mL含25.7 g液溴的冰醋酸,连续转动5 h;将其倒入亚硫酸氢钠的饱和水溶液,将上述步骤得到的物质通过快速硅胶柱色谱法获得4,4-双(3,5-二溴-4-羟苯基)戊酸甲酯(b);随后利用(b)与2-溴乙醇进行相互作用,得到了化合物4,4-双[3,5-二溴-4-(2-羟基乙氧基)苯基]戊酸甲酯(c);最后再通过化合物(c)与氢氧化钠的相互作用后,即可得到半抗原4,4-双[3,5-二溴-4-(2-羟基乙氧基)苯基]戊酸D3。合成路线如图 1所示。对合成TBBPA-DHEE的半抗原D3用质谱与核磁共振进行结构鉴定。
|
图 1 D3合成路线 Figure 1 The synthetic route of the D3 |
为了制备完全抗原,本研究采取了碳化二亚胺法将之前合成好的半抗原D3与载体蛋白(BSA、OVA)进行偶联。400 mg EDC·HCl和20 mg载体蛋白溶于2 mL PBS(0.01 mol·L-1,pH 7.4)中,在室温下摇匀30 min。取60 mg半抗原D3溶于2 mL PBS中,和上述溶液混合均匀,反应4 h,然后在4 ℃冰箱条件下反应16 h。随后将其吸出,在PBS溶液(0.01 mol·L-1,pH 7.4)中透析2 d。2 d后剩余在透析袋中的溶液,就是试验需要的完全抗原,其中把BSA-D3用作免疫原,把OVA-D3用作包被原。将其进行分装后,置于-20 ℃冰箱存放。
人工抗原BSA-D3、OVA-D3、BSA、OVA和TBBPA-DHEE,配制浓度均为1 mg·mL-1,并用紫外分光光度计进行全波长扫描。
1.4 间接竞争ELISA方法的流程将OVA-D3通过包被液(0.05 mol·L-1碳酸盐缓冲液,pH 9.6)稀释,以每孔100 μL逐孔入酶标板中,4 ℃条件反应9 h。甩去包被液,利用洗涤液进行清洗。之后每孔加入200 μL封闭液(含1%明胶的0.01 mol·L-1 PBS,pH 7.4),37 ℃培养箱反应2 h。反应后,去除封闭液,拍干。用抗体稀释液(含0.1%明胶的0.01 mol·L-1 PBS,pH 7.4)将血清降低浓度,标准品用PBS降低浓度,将反应浓度的血清和标准品每孔对半各加入,每个浓度做3个平行并设空白对照和阳性对照,37 ℃反应2 h。竞争反应后,用洗涤液清洗,用吸水纸将板拍干后,逐孔加入适量浓度的羊抗鼠酶标二抗,37 ℃孵育60 min,随后步骤和之前反应结束后步骤一致。拍干后每孔滴入100 μL的TMB显色液,在培养箱内放置20 min左右。从培养箱中取出酶标板后滴入2 mol·L-1的H2SO4,使反应结束进程。最后通过仪器酶标仪来测定其在450 nm处的吸光度。
1.5 单克隆抗体的制备与筛选通过颈背部皮下多处注射的方法将BSA-D3与FCA进行乳化后的乳化物免疫6~8周龄Balb/C雌性小鼠;4周后换取BSA-D3与FIA乳化后的乳化物进行小鼠免疫。第5次免疫后,采用1.4的方法对抗血清进行筛查,选择抗体效价与灵敏度满足要求的小鼠,取出脾脏细胞,与骨髓瘤细胞SP2/0进行融合,并进一步克隆并筛选出单克隆细胞。
1.6 单克隆抗体的鉴定 1.6.1 类与亚型的鉴定采用Thermo单克隆抗体亚型鉴定试剂盒对细胞培养液上清进行亚类鉴定。
1.6.2 抗体灵敏度的测定通过建立的ELISA方法模拟出标准曲线,计算抗体的半数抑制率(50% Inhibition of concentration,IC50)。其中以不添加标准品OD值为B0,添加不同比例标准品的OD值为B,将B和B0的比值设为纵坐标,标准品浓度的对数值设为横坐标。
1.6.3 抗体交叉反应率测定选取结构类似物进行交叉反应测定,测定其特异性。公式为:交叉反应率(CR%) = IC50 (待检测标准片浓度) /IC50 (其他衍生物浓度) ×100%。
1.7 ELISA方法建立 1.7.1 抗体和包被原用于反应的最佳浓度采用棋盘法确定抗原-抗体结合浓度。包被不同浓度的OVA-D3(1:1 000倍比稀释到1:32 000),不同浓度的抗体(1:20倍比稀释到1:2 560),其他流程同1.4。采用酶标仪确定其在450 nm的OD值,并选取OD值在1.0左右的包被原和抗体稀释浓度作为优化后的反应浓度。
1.7.2 确定最优pH值按1.7.1确定的结果进行前面的步骤,之后利用不同pH值的缓冲溶液稀释标准品,pH分别为4.0、5.0、7.4、8.0和10.0,之后步骤不变,测定450 nm处的吸光度,确定pH值。
1.7.3 确定最优蛋白浓度标准品用不同蛋白质浓度(0、0.10%、0.50%、1%、5%、10%)的缓冲液降低浓度,完成ELISA反应,确定蛋白质浓度。
1.7.4 确定最优离子强度值利用不同离子强度(0、0.01、0.05、0.1、0.2 mol· L-1)缓冲液降低标准品浓度,ELISA反应后,确定离子强度。
1.7.5 确定有机溶液浓度用不同浓度的甲醇(分别为0、5%、10%、20%、30%、50%)缓冲液降低标准品浓度,ELISA反应后,通过450 nm处的吸光度,选择甲醇浓度。
1.7.6 标准曲线的建立基于上述优化条件,按照1.4中的操作流程,建立标准曲线,每个平行设置2组重复。用四参数方程拟合标准曲线,按照下式计算检测限(Limit of detection,LOD)、半数抑制率(IC50)及检测范围(IC20~IC80)。
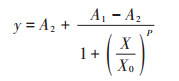
|
式中:y为吸光度的比值A/A0;X为已知的标准品浓度,ng·mL-1;A1为拟合成功曲线的上渐近线斜率;A2为拟合成功曲线的下渐近线斜率;X0即为IC50的值,ng·mL-1;P是IC50处点的斜率。
1.8 典型环境样本的采集、前处理及检测山东省寿光市是我国主要的BFRs生产地,当地有多家TBBPA及其衍生物生产工厂。于2016年10月对山东省寿光市溴代阻燃剂加工基地附近水样和土样进行收集,分装并保存在-20 ℃条件下。
水样的前处理方法:用10 mL注射器吸取水样,并使用0.22 μm硝酸纤维素膜进行过滤,滤液直接用于检测。
土壤样本的前处理方法:将样本冻存干燥后,使用研钵打碎研磨至粉状;在加速溶剂萃取(Accelerated solvent extraction,ASE)反应釜中加入一半量的硅藻土,称取1 g土壤样本加入反应釜中用玻璃棒轻轻搅匀,使得土样样本与硅藻土充分混匀后,用硅藻土将反应釜填满,上机待测;加入萃取剂,萃取样本中待检测物;收集萃取液,旋转蒸发,保留5 mL左右;将剩余的萃取剂用氮气吹干,然后用含有一定浓度的甲醇进行复溶,用于检测。
参考Tian等[25]的方法采用ESI-MS方法对样本中的TBBPA-DHEE/TBBPA-MHEE进行检测。其中针对TBBPA-DHEE的最低检测限LOD为0.49 ng·mL-1,TBBPA-MHEE的LOD为0.33 ng·mL-1。
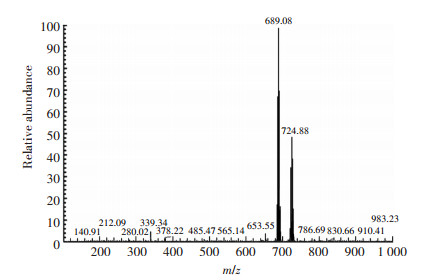
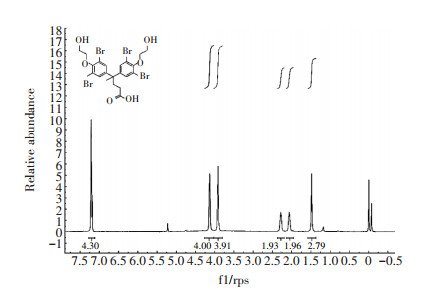
2 结果与分析 2.1 TBBPA-DHEE半抗原的鉴定由于TBBPA-DHEE属于小分子物质,不具备免疫原性,需要与大分子载体蛋白偶联获得完全抗原。然而,TBBPA-DHEE结构中没有活性基团,无法直接偶联,需要衍生化;同时需要考虑暴露适当结构,作为抗原识别表位[26-28]。根据目标物质的分子结构,采用两种策略:(1)从苯环侧链的羟基衍生,以两个苯环及其侧链作为表位;(2)从两个苯环中间的支链进行衍生,以一侧的苯环及其侧链作为表位。前期本课题组采用前一种策略合成了半抗原M3,免疫家兔制备了TBBPA-DHEE多克隆抗体,并建立了竞争性ELISA方法,其IC50为9.868 ng·mL-1 [26]。在本研究中,通过苯环中间的支链衍生出羧基,获得半抗原D3。对TBBPA-DHEE的半抗原D3用核磁共振氢谱和质谱分析法进行鉴定。质谱结果如图 2所示,核磁共振氢谱结果如图 3所示,根据对特征峰形的研究、化合物官能团中氢原子数量种类的分析以及对化学位移的分析,结果表明反应产物为目标化合物,即TBBPA-DHEE半抗原D3。
|
图 2 半抗原D3的电喷雾质谱图 Figure 2 ESI-MS spectrogram for hapten D3 |
|
图 3 半抗原D3的核磁共振氢谱图 Figure 3 1H-NMR spectrogram for hapten D3 |
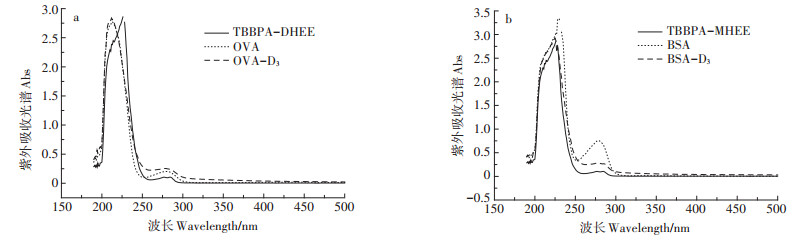
通过紫外扫描全光谱的方法按照吸收峰位置的变化,可以判断出半抗原与载体蛋白的偶联情况。如图 4为BSA-D3、OVA-D3等物质的紫外吸收光谱图。半抗原、载体蛋白和结合物的紫外吸收光谱发生了显著变化,结合物的峰位发生了位移,说明免疫原偶联是成功的。
|
图 4 OVA、BSA及偶联物的紫外吸收光谱 Figure 4 UV absorption spectrogram of the D3 and conjugate |
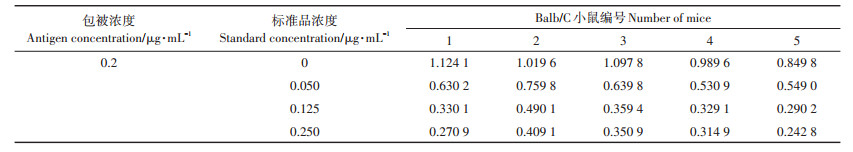
用ELISA方法对免疫后的抗血清进行效筛选,结果见表 1,其中抗血清以1:2 000用抗体稀释液稀释。可以看出1、2、3号小鼠血清的效价较高,同时比较其在0.250 mg·mL-1时抑制率,发现1号小鼠的抑制率最高(75.9%)。因此,最终选择1号Balb/C小鼠进行后面细胞融合试验。
|
|
表 1 抗血清的筛选 Table 1 Screening of antiserum |
经过多次克隆培养后,获得5株能够稳定分泌TBBPA-DHEE单克隆抗体的杂交流细胞株,标记为E2D2、D2D4、C2D6、D4G6、F7D5。经亚型鉴定试剂盒测定,5株单克隆抗体均为IgG1型、Kappa链。
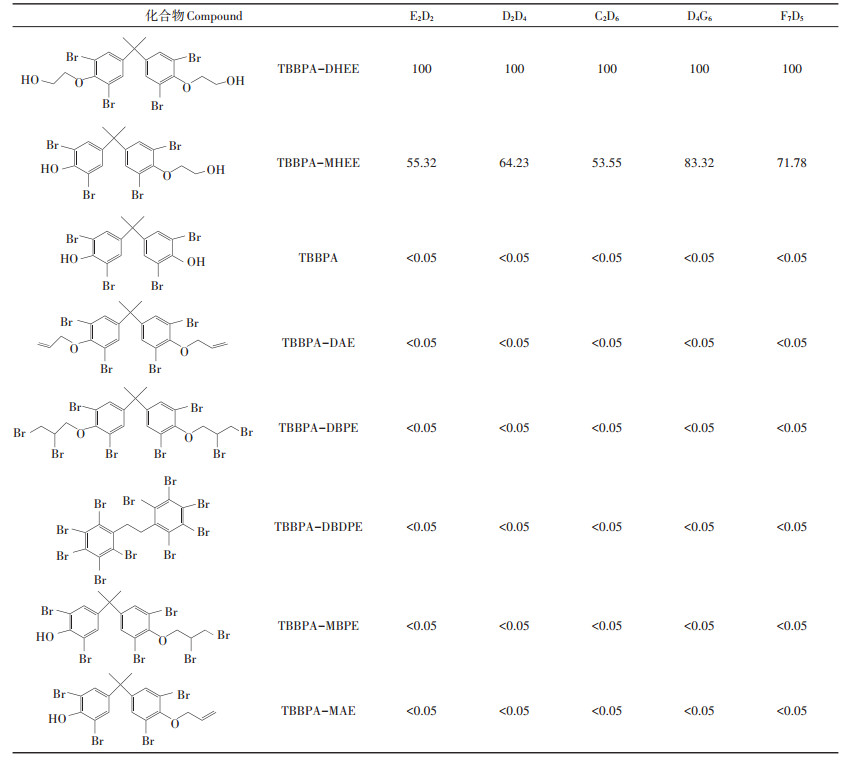
同时对5株单克隆抗体的特异性进行了鉴定(表 2)。结果显示,这5株单克隆抗体与TBBPA、TBBPADAE、TBBPA-DBPE、TBBPA-MHPE、TBBPA-MBPE、TBBPA-MAE没有交叉反应,而与TBBPA-MHEE均有不同程度的交叉反应(55.32%~83.32%)。根据TBBPA-DHEE和TBBPA-MHEE的结构,可以看出,二者结构具有较高的相似性,仅在侧链有所不同。因此所得抗体能够同时识别这两种物质。鉴于D4G6株抗体与TBBPA-MHEE有较高的交叉反应,因此后续试验中用其构建同时检测TBBPA-DHEE与TBBPAMHEE的免疫分析方法。
|
|
表 2 单克隆抗体的交叉反应率(%) Table 2 Cross - reactivity of monoclonal antibodies(%) |
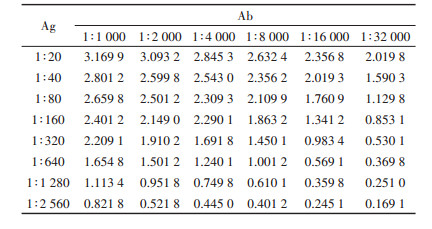
首先采用棋盘法确定抗原-抗体最佳反应浓度,结果见表 3。选择吸光度在1.2前后且相邻浓度结果下吸光度区分较为明显的位点,由此确定的浓度为包被原1:640,抗体1:4 000。
|
|
表 3 棋盘法选择包被原及抗体反应稀释比例 Table 3 Dilution rate of coating antigen and antibody by checkerboard method |
在ELISA反应体系中,抗原抗体的结合通过非共价键的结合作用,体系处于动态平衡中,故反应缓冲液对整个体系起着至关重要的作用。在反应过程中,溶液的成分、pH以及有机溶剂均能够影响检测方法的灵敏度。本研究选择IC50和ODmax两个指标来判断最佳条件,通常认为最优条件下IC50越低而ODmax越高。试验结果整合于图 5。从试验结果来看,随着pH的增加,IC50和ODmax均呈现先升高后降低的态势,其中当pH为10时,IC50最小,而pH为7.4时,ODmax最大。综合两个指标的结果,选用pH 7.4作为优化参数。从图中可以看出,溶液中含有适量的蛋白(0.5% BSA)有助于提升方法的灵敏度。缓冲液中Na+离子强度升高会导致ODmax的降低,同时使得IC50先降低后升高。最终选择0.01 mol·L-1 Na+作为最佳浓度。由于TBBPA-DHEE和TBBPA-MHEE脂溶性较强,因此需要有机溶剂进行助溶[29],本研究选择常用的甲醇作为助溶剂进行评估。伴着缓冲液中甲醇含量的增加,ODmax呈先减小后增加再减小的趋势。故选择甲醇含量为30%作为优化条件。
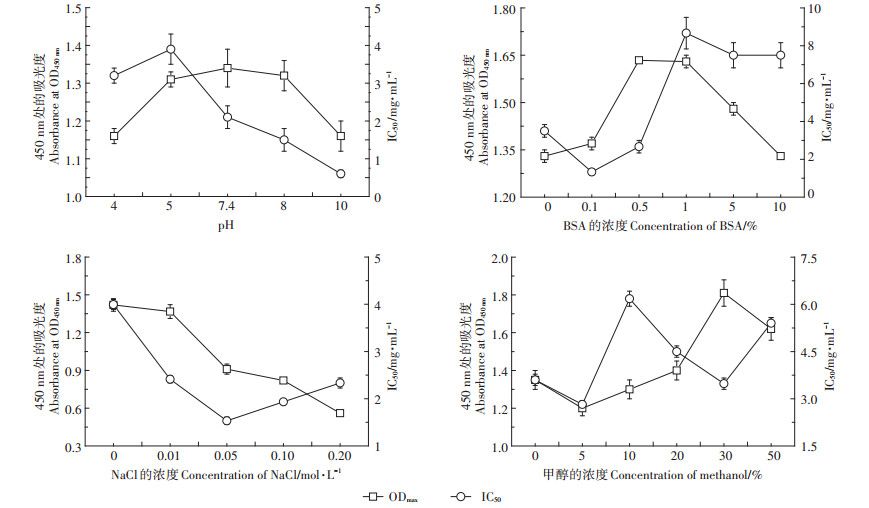
|
图 5 不同缓冲液条件下的ODmax和IC50值 Figure 5 ODmax and IC50 value of ELISA in various buffer conditions |
在上述ELISA的优化条件下,基于D4G6株单克隆抗体,按照梯度分别稀释TBBPA-MHEE的标准品浓度(CK、0、0.1、1、3、10、30、100、1 000 ng·mL-1)和TBBPA-DHEE的标准品浓度(CK、0、0.312 5、0.625、1.25、2.5、5、10、20 ng·mL-1)做标准曲线,每组4个平行。建立TBBPA-MHEE与TBBPA-DHEE的竞争ELISA标准曲线(图 6)。该方法检测出TBBPA-MHEE的IC50为3.51 ng· mL-1,线性范围是0.86~13.7 ng·mL-1,LOD为0.78 ng·mL-1,R2≥0.99。检测TBBPA-DHEE的IC50为2.76 ng·mL-1,线性范围在0.96~8.098 ng·mL-1,LOD为0.56 ng·mL-1,R2≥0.99。
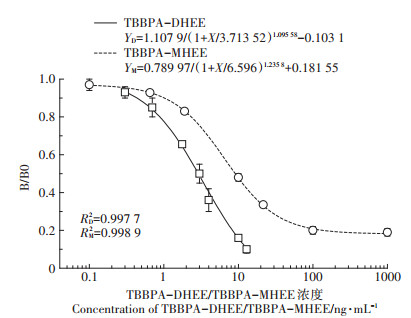
|
图 6 同时检测TBBPA-DHEE和TBBPA-MHEE的ELISA标准曲线 Figure 6 Calibration curve for TBBPA-DHEE and TBBPA-MHEE by ELISA |
由于TBBPAs的广泛应用,在多种环境样本中均有检出报道,然而对于TBBPA-DHEE/TBBPA-MHEE在环境中分布情况报道较少。仅有Liu等[30]在山东省一家BFR厂家周围的土壤样本中检测到TBBPAMHEE,浓度在ND~13.7 ng·g-1 DW;Zhang等[26]在镇江市区域内采集了池塘水、自来水、湖水、河水和稻田水,并应用ELISA方法对环境水样进行了检测,发现TBBPA-DHEE/TBBPA-MHEE的含量在1.5~7.7 ng· mL-1。
山东省寿光市是我国主要的BFRs生产地,当地有多家TBBPA及其衍生物生产工厂。于2016年8月对山东省寿光市某生产BFRs工业区域周边环境采样,对样本采用1.8中提到的处理流程及方法,并应用建立的ELISA方法检测样本中TBBPA - DHEE和TBBPA-MHEE。在表 4中发现TBBPA-DHEE/TBBPA - MHEE在水样中检出率为80%,检出浓度在1.759~15.45 ng·mL-1,土壤样本中检出率为100%,检出浓度在1.12~6.75 ng·g-1。同时,采用ESI-MS对采集的样本进行了检测,结果与ELISA具有较好的一致性。但是,由于所获得的抗体对TBBPA - DHEE和TBBPA-MHEE均有较好的识别能力,因此建立的ELISA方法检测的是TBBPA-DHEE和TBBPA-MHEE的总量。在后续试验中,筛选特异性识别这两种靶物质的抗体,建立特异性的检测方法,则是笔者的研究重点。
|
|
表 4 环境样本中TBBPA-DHEE和TBBPA-MHEE浓度 Table 4 Occurrence of TBBPA-DHEE and TBBPA-MHEE in samples |
(1) 设计并合成制备TBBPA-DHEE半抗原D3,并将D3与载体蛋白BSA、OVA偶联结合;免疫小鼠并筛选血清后,采用杂交瘤技术制备抗TBBPA-DHEE单克隆抗体5株,经鉴定这5株抗体均能同时识别TBBPA-MHEE和TBBPA-DHEE,并与其他TBBPA类似物没有交叉反应;基于单克隆抗体D4G6,建立了ELISA方法,优化条件后,其针对TBBPA-DHEE的IC50和LOD分别为2.76 ng·mL-1和0.56 ng·mL-1,针对TBBPA-MHEE的IC50和LOD分别为3.51 ng·mL-1和0.78 ng·mL-1。
(2) 以建立的ELISA方法检测了山东省寿光市一家BFR工厂周边的水样和土壤样本,发现TBBPADHEE /TBBPA-MHEE在水样中检出浓度在1.759~ 15.45 ng·mL-1,土壤样本中检出浓度在1.12~6.75 ng· g-1。酶联免疫分析方法的建立为环境中污染物的分布调查,继而进行风险评估提供了有效的技术手段。
| [1] |
王旭. 新兴污染物质溴代阻燃剂的环境问题[J]. 中国科技信息, 2011(12): 38. WANG Xu. Environmental problems of brominated flame retardants[J]. China Science and Technology Information, 2011(12): 38. |
| [2] |
Mäkinen M S E, Mäkinen M R A, Koistinen J T B, et al. Respiratory and dermal exposure to organophosphorus flame retardants and tetrabromobisphenol A at five work environments[J]. Environmental Science & Technology, 2009, 43(3): 941-947. |
| [3] |
Takigami H, Suzuki G, Hirai Y, et al. Brominated flame retardants and other polyhalogenated compounds in indoor air and dust from two houses in Japan[J]. Chemosphere, 2009, 76: 270-277. DOI:10.1016/j.chemosphere.2009.03.006 |
| [4] |
Ni H G, Zeng H. HBCD and TBBPA in particulate phase of indoor air in Shenzhen, China[J]. Science of the Total Environment, 2013, 458-460: 15-19. DOI:10.1016/j.scitotenv.2013.04.003 |
| [5] |
赵明东, 杨苏文, 李和平, 等. 洱海表层沉积物与鱼体中四溴双酚A的环境暴露水平[J]. 环境科学研究, 2013, 26(2): 160-165. ZHAO Ming-dong, YANG Su-wen, LI He-ping, et al. Determination of tetrabromobisphenol A exposed in surface sediment and fishes from Erhai Lake[J]. Research of Environmental Sciences, 2013, 26(2): 160-165. |
| [6] |
Harrad S, Abdallah M A E, Rose N L, et al. Current-use brominated flame retardants in water, sediment, and fish from English lakes[J]. Environmental Science and Technology, 2009, 43(24): 9077-9083. |
| [7] |
Wang J X, Liu L L, Wang J F, et al. Distribution of metals and brominated flame retardants(BFRs)in sediments, soils and plants from an informal E-waste dismantling site, South China[J]. Environmental Science Pollution Research, 2015(22): 1020-1033. |
| [8] |
Zhang X L, Luo X J, Chen S J, et al. Analysis of free and bound residues of polybrominated diphenyl ethers and tetrabromobisphenol A in sediment[J]. Chinese Journal of analytical Chemistry, 2009, 37(11): 1577-1582. |
| [9] |
Feng A H, Chen S J, Chen M Y, et al. Hexabromocyclododecane (HBCD)and tetrabromobisphenol A(TBBPA)in riverine and estuarine sediments of the Pearl River Delta in southern China, with emphasis on spatial variability in diastereoisomer- and enantiomer-specific distribution of HBCD[J]. Marine Pollution Bulletin, 2012(64): 919-925. |
| [10] |
Li Y N, Zhou Q X, Wang Y Y, et al. Fate of tetrabromobisphenol A and hexabromocyclododecane brominated flame retardants in soil and uptake by plants[J]. Chemosphere, 2011, 82: 204-209. DOI:10.1016/j.chemosphere.2010.10.021 |
| [11] |
Vorkamp K, Thomsen M, Falk K, et al. Temporal development of brominated flame retardants in peregrine falcon(Falco peregrinus)eggs from South Greenland(1986-2003)[J]. Environmental Science and Technology, 2005, 39(21): 8199-8206. |
| [12] |
Jakobsson K, Thuresson K, Rylander L, et al. Exposure to polybrominated diphenyl ethers and tetrabromobisphenol A among computer technicians[J]. Chemosphere, 2002, 46: 709-716. |
| [13] |
Cariou R, Antignac J P, Zalko D, et al. Exposure assessment of French women and their newborns to tetrabromobisphenol-A:Occurrence measurements in maternal adipose tissue, serum, breast milk and cord serum[J]. Chemosphere, 2008, 73: 1036-1041. |
| [14] |
Zieminska E, Lenart J, Jerzy W, et al. Select putative neurodevelopmental toxins modify SNAP-25 expression in primary cultures of rat cerebellar granule cells[J]. Toxicology, 2016, 370: 86-93. |
| [15] |
Pullen S, Boecker R, Tiegs G, et al. The flame retardants terabromobisphenol A and terabromobisphenol A-bisallulether suppress the induction of interleukin-2 receptor alpha chain(CD25)in murine splenocytes[J]. Toxicology, 2003, 184(1): 11-22. |
| [16] |
高丹丹, 于云江, 王琼, 等. 不同暴露方式四溴双酚A的代谢及毒性特征[J]. 环境与健康, 2015, 32(2): 165-168. GAO Dan-dan, YU Yun-jiang, WANG Qiong, et al. Researches on toxicology and metabolic characteristics of tetrabromobisphenol A under different exposure ways[J]. Journal of Environmental Health, 2015, 32(2): 165-168. |
| [17] |
杨苏文, 王圣瑞, 闫振广, 等. 四溴双酚A在5种巢湖鱼类体内的组织分布与生物浓缩因子研究[J]. 环境科学, 2012, 33(6): 1853-1857. YANG Su-wen, WANG Shen-rui, YAN Zhen-guang, et al. Tissue distribution and bioconcentration factors of tetrabromobisphenol A in five fishes in lake Chaohu[J]. Environmental Science, 2012, 33(6): 1853-1857. |
| [18] |
Fini J B, Riu A, Debrauwer L, et al. Parallel biotransformation of tetrabromobisphenol A in xenopus laevis and mammals:Xenopus as a model for endocrine perturbation studies[J]. Toxicological Sciences, 2012, 125(2): 359-367. |
| [19] |
Liu Q, Ren X M, Long Y M, et al. The potential neurotoxicity of emerging tetrabromobisphenol A derivatives based on rat pheochromocytoma cells[J]. Chemosphere, 2016, 154: 194-203. DOI:10.1016/j.chemosphere.2016.03.117 |
| [20] |
Tian Y, Chen J, Ouyang Y Z, et al. Reactive extractive electrospray ionization tandem mass spectrometry for sensitive detection of tetrabromobisphenol A derivatives[J]. Analytica Chimica Acta, 2014, 814: 49-54. DOI:10.1016/j.aca.2014.01.035 |
| [21] |
Tian Y, Liu A F, Qu G B, et al. Silver ion post-column derivatization electrospray ionization mass spectrometry for determination of tetrabromobisphenol A derivatives in water samples[J]. The Royal Society of Chemistry, 2015, 5: 17474-17481. |
| [22] |
Liu A F, Qu G B, Zhang C L, et al. Identification of two novel brominated contaminants in water samples by ultra-high performance liquid chromatography-Orbitrap Fusion Tribrid mass spectrometer[J]. Journal of Chromatography A, 2015, 1377: 92-99. DOI:10.1016/j.chroma.2014.12.038 |
| [23] |
Li Y S, Meng X Y, Zhou Y, et al. Magnetic bead and gold nanoparticle probes based immunoassay for β-casein detection in bovine milk samples[J]. Biosensors and Bioelectronics, 2015, 66: 559-564. DOI:10.1016/j.bios.2014.12.025 |
| [24] |
Liu L H, Liu A F, Zhang Q H, et al. Determination of tetrabromobisphenol-A/S and their main derivatives in water samples by high performance liquid chromatography coupled with inductively coupled plasma tandem mass spectrometry[J]. Journal of Chromatography A, 2017, 1497: 81-86. DOI:10.1016/j.chroma.2017.03.040 |
| [25] |
Tian Y, Liu A F, Qu G B, et al. Silver ion post-column derivatization electrospray ionization mass spectrometry for determination of tetrabromobisphenol A derivatives in water samples[J]. The Royal Society of Chemistry, 2015, 5(23): 17474-17481. |
| [26] |
Zhang Z, Zhu N F, Huang M L, et al. Sensitive immunoassay for simultaneous determination of tetrabromobisphenol A bis(2-hydroxyethyl)ether and tetrabromobisphenol A mono(hydroxyethyl)ether:An effective and reliable strategy to estimate the typical tetrabromobisphenol A derivative and byproduct in aquatic environments[J]. Environmental Pollution, 2017, 229: 431-438. DOI:10.1016/j.envpol.2017.05.076 |
| [27] |
Wang J, Candace R S B, Majkova Z, et al. Heterologous antigen selection of camelid heavy chain single domain antibodies against tetrabromobisphenol A[J]. Analytical Chemistry, 2014, 86: 8296-8302. DOI:10.1021/ac5017437 |
| [28] |
Xu T, Wang J, Liu S Z, et al. A highly sensitive and selective immunoassay for the detection of tetrabromobisphenol A in soil and sediment[J]. Analytica Chimica Acta, 2012, 751: 119-127. DOI:10.1016/j.aca.2012.06.030 |
| [29] |
Vasylieva N, Ahn K C, Barnych B, et al. Development of an immunoassay for the detection of the Phenylpyrazole insecticide fipronil[J]. Environmental Science and Technology, 2015, 49: 10038-10047. DOI:10.1021/acs.est.5b01005 |
| [30] |
Liu A F, Shi J B, Qu G B, et al. Identification of emerging brominated chemicals as the transformation products of tetrabromobisphenol A (TBBPA)derivatives in soil[J]. Environmental Science and Technology, 2017, 51: 5434-5444. |
 2020, Vol. 39
2020, Vol. 39