2. 土肥资源高效利用国家工程实验室, 山东农业大学资源与环境学院, 山东 泰安 271018
2. National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer Resources, College of Resources and Environment, Shandong Agricultural University, Tai'an 271018, China
随着阻燃剂四溴双酚A(TBBPA)和得克隆(DP)的大范围应用和长期以来原始的粗放型电子拆解活动,我国典型电子垃圾拆解场土壤环境中重金属镉、DP和TBBPA污染严重,其在土壤中的残留对农作物和土壤生态环境的影响已引起人们的高度重视。得克隆(Dechlorane Plus,DP),化学名为双(六氯环戊二烯)环辛烷,是一种添加型阻燃剂。目前科研工作者已在土壤[1-2]、沉积物[3-4]、水[5]、大气[6]、生物[7-9]等多种环境介质中检出了DP。DP具有很强的疏水性和亲脂性,会在生物体内不断蓄积,并沿着食物链在各营养级生物中逐渐放大。同时,DP热稳定性好(分解温度285 ℃),难于被水解和生物降解,可在环境中稳定长期存在。近年来,研究表明DP对鹌鹑、大鼠和中华鲟幼鱼均具有肝脏毒性,对斑马鱼具有潜在的神经毒性。四溴双酚A(Tetrabromobisphenol A,TBBPA)是一种反应型和添加型阻燃剂,目前已在水、土壤、粉尘和生物体等多种环境介质中检出[10-13],TBBPA广泛存在于各种生物体中,如海洋哺乳动物、鸟类、鱼类、无脊椎动物等。此外,在人体的血清、母乳和脂肪中均有不同程度TBBPA的检出[14-15]。研究发现巢湖水体中TBBPA含量最大达到4.87 μg·L-1[16]。TBBPA具有较强的免疫毒性、细胞毒性和神经毒性,因其结构与甲状腺素相似,被认为是一种潜在的内分泌干扰物质,对某些水生生物具有很强的急性毒性[17],并极容易在环境和生物体内积累,对环境和生物产生严重影响。镉(Cd)是生物毒性最强的重金属元素,具有较强的致癌、致畸和致突变作用,由于在环境中的化学活力强,移动性大,毒性持久,容易通过食物链的富集作用危及人类健康。
陆生植物作为敏感物种,利用陆生高等植物对污染土壤进行生态毒性评估是典型的生态毒理学方法,采用的试验方法为种子发芽、根伸长抑制和植物幼苗早期生长试验[18]。在污染胁迫下植物生长状况可综合反映生态系统的环境健康水平,也是土壤诊断的重要方法之一。本研究以高等植物水稻作为供试生物,通过种子萌发试验,研究了DP、TBBPA与重金属镉污染土壤对水稻种子萌发状况、芽伸长和根伸长及其生理生化指标的影响,通过种子萌发、根伸长受抑制的程度及其种子萌发时生理生化指标的变化,确定卤代阻燃剂和重金属镉对水稻种子萌发的影响,探讨污染物对水稻的生态毒性和污染生态指标,为评估复合污染区域环境风险提供科学依据。
1 材料与方法 1.1 仪器与试剂供试植物为原旱稻3号(国审稻2012041);得克隆(纯度99.00%,AccuStandard,Inc. USA)丙酮配制,syn-DP和anti-DP标样(浓度为50 mg·L-1,溶剂为苯,AccuStandard,Inc. USA);氯化镉(优级纯,99.85%);四溴双酚A(纯度99.00%,德国Dr)色谱纯甲醇配制;正己烷(色谱纯);二氯甲烷(色谱纯);无水硫酸钠(分析纯)。
TSQ8000三重四极杆气质联用仪(Thermo Fisher Scientific);三重四极杆液质联用仪(TSQ Quantum Ac⁃ cess Max,Thermo Fisher Scientific);ICP /MS(Thermo Fisher Scientific)。
1.2 DP、TBBPA和镉土壤染毒试验供试土壤为棕壤,采于山东农业大学试验农场,采集表层土壤(2~20 cm),混匀过20目筛,土壤理化性质如下:有机氮、速效磷、速效钾和有机质分别为133.3、18.6、123.7 mg·kg-1和17.8 g·kg-1,土壤中TBBPA染毒浓度分别设置为:1、5、10、50、100 mg·kg-1和250 mg·kg-1;DP染毒浓度分别设置为:1、5、10、50 mg·kg-1和100 mg·kg-1;镉浓度分别设置为:1、5、10、50 mg· kg-1和100 mg·kg-1;三者复合污染浓度均为10 mg· kg-1,同时设置空白对照,土壤染毒后平衡24 h待用。
1.3 水稻种子萌发试验采用土壤染毒法进行水稻种子萌发试验,挑选籽粒饱满、大小一致的水稻种子进行催芽处理,待种子露白后,用医用小镊子将15粒露白的种子播种于染毒的土壤中,置于生化培养箱中培养[温度(25±1)℃,湿度(75±1)%,光照时间12 h]。观察到种子发芽后揭开培养皿盖继续培养,每日浇一次水,保持土壤湿润。5 d记录发芽粒数,计算发芽势,10 d记录发芽粒数,计算发芽率,并收获植株,将根部和地上部分分开,用刻度尺(最小分度单位为mm)测定芽长和根长。用刻度尺测量根颈部至幼苗顶端叶尖,即为芽长;测量根尖到幼苗茎基部的长度,即为根长[19]。每个处理设置5个平行。种子活力指标采用发芽指数和活力指数表示,活力指数是种子萌发速率和生长量的综合反映。
1.4 阻燃剂和镉污染土壤对水稻种子萌发的生理生化指标的影响选取DP(5 mg·kg-1)、四溴双酚A(10 mg·kg-1)、镉(25 mg·kg-1)和DP+TBBPA+镉复合污染及空白对照5个处理的水稻萌发幼苗,测定阻燃剂和镉污染土壤对水稻种子萌发的生理生化指标的影响,测定指标分别为:反映物质代谢能力的可溶性总糖(蒽酮比色法)和可溶性蛋白质(考马斯亮蓝法)、反映逆境对水稻影响的脯氨酸(酸性茚三酮法)和水稻的根系活力(TTC法)[20],水稻的根系活力采用四氮唑还原强度表示。
1.5 水稻幼苗中DP、TBBPA和镉的残留测定取培养10 d的整株幼苗剪碎研磨,准确称取样品2.00 g,加入3 g硅藻土为分散剂,混合均匀,装入快速溶剂萃取仪(ASE)150样品池中,样品池的顶部和底部各垫一层玻璃纤维滤膜(美国Dionex公司),防止土壤和硅藻土阻塞管路。平衡过夜后,加5 mL正己烷/二氯甲烷(1:1,V/V),在100 ℃和压力10.34 MPa下萃取10 min,萃取液直接过SampliQ SPE-C18固相萃取小柱净化,氮吹仪吹干后加入1 mL正己烷,用三重四极杆气质联用仪进行测定DP。
准确称取样品2.00 g,加入3 g硅藻土作为分散剂,混合均匀,装入ASE 150样品池中,样品池的顶部和底部各垫一层玻璃纤维滤膜(美国Dionex公司),防止土壤和硅藻土阻塞管路。平衡过夜后,加5 mL乙腈(1:1,V/V),在100 ℃和压力10.34 MPa下萃取10 min,氮吹仪吹干后加入1 mL乙腈,过0.22 μm有机相滤膜过滤,用液质联用仪进行测定TBBPA。
称取样品试样1.000 g于三角瓶中,取3份平行,放数粒玻璃珠,加硝酸/高氯酸混合酸(4:1)5 mL,盖上小漏斗,浸泡过夜,将三角瓶放置电热板上于280 ℃消化,直至消化液呈无色透明,冷却后将消化液过滤入5 mL比色管中,用1%硝酸多次冲洗三角瓶,定容,用ICP/MS测定。
幼苗中DP、TBBPA和镉的残留测定方法均已经做了添加回收率的试验验证,回收率分别为86.78%~ 90.23%、88.25%~93.43%和93.46%~96.87%,满足污染物测定分析方法的要求。
1.6 数据处理和分析种子萌发的发芽势、发芽率、发芽指数、活力指数、芽长的抑制率和根伸长的抑制率采用以下公式计算,由SPSS 22.0和Sigmaplot 12.5对数据进行方差分析和回归拟合方程分析,对剂量-效应曲线进行拟合并作图,计算出土壤中TBBPA、DP和镉单一及复合污染对根和芽伸长50%抑制浓度(EC50)[21]。脯氨酸含量、水稻根系活力、可溶性总糖和可溶性蛋白质采用相应公式计算[20],采用平均值±标准差(Mean±SD)表示,差异显著性水平为P < 0.05。

|
阻燃剂和镉对水稻种子萌发的影响采用发芽率、发芽势、发芽指数和活力指数表示(表 1),而活力指数指标最灵敏,可作为评价水稻萌发的一个敏感指标。由表 1可知,DP、TBBPA和镉对水稻种子萌发的影响趋势基本一致,随着土壤中DP、TBBPA和镉浓度的增加,发芽率、发芽势、发芽指数和活力指数均呈下降趋势,与土壤中的浓度呈负相关性,对于水稻种子的萌发具有显著的抑制作用。土壤中浓度均为10 mg·kg-1的DP、TBBPA和镉复合污染与单一污染相比,水稻发芽率、发芽势、发芽指数均无显著性差异,活力指数仅和DP单一污染具有显著性差异,和TBBPA与镉的单一污染无显著性差异,这与DP的性质有关,DP分子量大(相对分子质量为653.7),水溶性极小,生物有效性较弱,对水稻种子萌发影响较小,而镉和TBBPA的生物有效性较强,对水稻种子萌发影响较大,所以复合污染对水稻种子萌发的影响主要是由TBBPA和镉造成的。
|
|
表 1 阻燃剂和镉对原旱稻3号稻种子萌发的影响 Table 1 The effect of flame retardant and Cd on germination of rice |
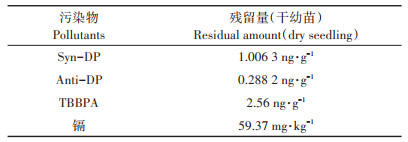
DP、TBBPA和镉对水稻根和芽伸长的影响如图 1所示。
|
不同小写字母代表处理间差异显著。下同 Different lowercase letters indicate significant differences among treatments. The same below 图 1 土壤中阻燃剂和镉对水稻根芽伸长毒性的剂量-效应关系 Figure 1 Dose-response curves of flame retardants and Cd on root and shoot elongation of rice seedlings |
由图 1可知,随着土壤中DP、TBBPA和镉浓度的增加,水稻芽和根长均受到不同程度的抑制作用。DP污染土壤虽然对水稻芽长没有显著性抑制作用(P> 0.05),但对根具有显著的影响,施药处理组均与对照具有显著性差异(P < 0.05),浓度50 mg · kg-1和100 mg·kg-1对水稻根长抑制率分别为34.65%和49.15%,说明水稻根比芽对DP更敏感;TBBPA处理,除了浓度为1 mg·kg-1与对照的水稻芽长无显著性差异(P> 0.05),其他处理和对照相比均具有显著性差异(P < 0.05),而对水稻根长均具有显著性差异(P < 0.05),说明不同浓度的TBBPA对水稻根长具有显著的影响作用。土壤中TBBPA浓度为10 mg·kg-1时,根和芽伸长抑制率分别为31.43%和31.15%,土壤中TBBPA浓度高达100 mg·kg-1时,根和芽伸长抑制率则分别为49.47%和47.90%,说明高浓度TBBPA对水稻芽和根均具有严重的影响。10 mg·kg-1是本试验水稻对镉的敏感浓度分界线,当浓度为10 mg·kg-1,处理和对照之间的芽长具有显著性差异,而根长无显著性差异;当土壤中镉浓度为5 mg·kg-1时,水稻根和芽伸长抑制率分别为4.55%和15.85%,土壤中镉浓度为10 mg· kg-1时,根和芽伸长抑制率则分别达到4.83%和29.87%,土壤中镉浓度为50 mg·kg-1时,根和芽伸长抑制率高达46.94%和49.60%。虽然随着土壤中镉浓度的增大,芽和根长逐渐减小,但不同浓度递减幅度差别非常大,低浓度对水稻影响较小,超过水稻敏感浓度后则对水稻幼苗生长具有显著的抑制作用,同时也说明了水稻对低浓度镉具有一定的耐受性,对高浓度镉的生物有效性减弱。
采用SPSS统计分析,浓度均为10 mg·kg-1的DP、TBBPA和镉复合污染与对照相比,水稻芽和根的伸长均受到明显的抑制作用;复合污染与DP处理的芽长具有显著性差异,对芽长的抑制作用大于单一污染,但与TBBPA和镉处理的芽长无显著性差异,对水稻幼苗生长的影响主要是由TBBPA和镉造成的;复合污染与DP和镉处理的根长具有显著性差异,与TBBPA处理的根长无显著性差异。
2.3 TBBPA与DP和镉对水稻幼苗根和芽长抑制的拟合方程和EC50污染物对植物的急性毒性采用毒理学指标半数效应浓度EC50来评价,卤代阻燃剂和镉对水稻幼苗根和芽长抑制的拟合方程和EC50如表 2所示。
|
|
表 2 TBBPA、DP和镉对水稻幼苗根和芽长抑制的拟合方程和EC50 Table 2 Fitting equations for the inhibition of root and shoot length of rice seedlings and EC50 by TBBPA, DP and Cd pollution |
由表 2可知,土壤中污染物的浓度与水稻芽伸长和根伸长抑制率之间存在显著的正相关关系(P < 0.05),水稻的根(或芽)伸长抑制率与土壤中DP、TBBPA和镉的浓度存在显著的剂量-效应关系。通过拟合方程的相关系数可知,污染物对芽和根伸长抑制的影响采用对数回归拟合方程描述更确切。镉对水稻根伸长和芽伸长的EC50分别为133.41 mg·kg-1和81.80 mg· kg-1,TBBPA对水稻根伸长和芽伸长的EC50分别为124.75 mg·kg-1和244.52 mg·kg-1,DP对水稻根伸长和芽伸长的EC50分别为250.40 mg · kg-1和645 265.53 mg·kg-1。研究结果表明本试验水稻对镉污染具有较强的敏感性,其中芽比根更为敏感;TBBPA对水稻抑制作用较强,根更敏感;土壤中较高浓度的DP对水稻种子萌发和幼苗生长产生抑制作用,水稻根比芽对TBBPA和DP污染更敏感。卤代阻燃剂在水中的溶解度影响其由根部向茎叶转运的能力,影响着被植物吸收的能力。
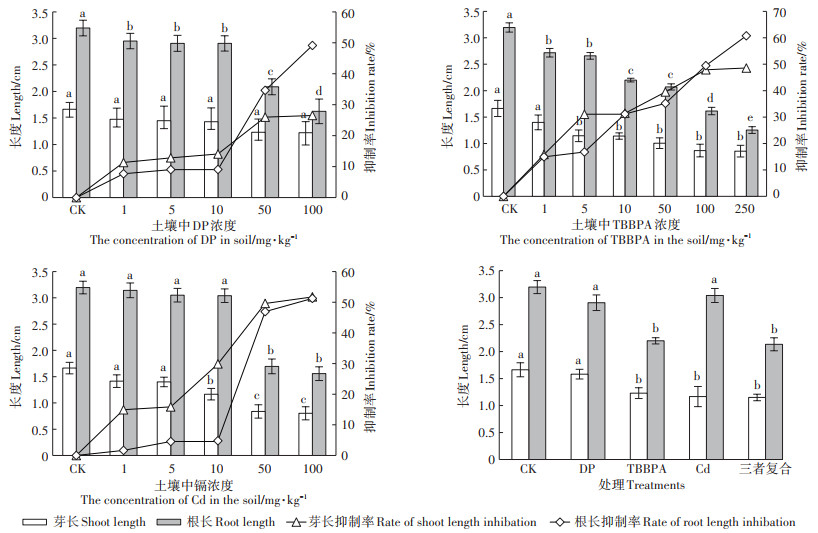
2.4 阻燃剂和镉对水稻幼苗生理生化指标的影响阻燃剂和镉对水稻幼苗根系活力、脯氨酸、蛋白质和可溶性糖含量的影响如图 2。
|
图 2 阻燃剂和镉对水稻幼苗生理生化指标的影响 Figure 2 Effects of flame retardant and Cd on physiological indexes of rice seedlings |
种子根系活力是决定种子在发芽和出苗期间的活性强度和种子特性的综合表现,根系活力反映根系吸收营养元素和水分的能力[22-23]。由图 2A可知,10 mg·kg-1 TBBPA、5 mg·kg-1 DP、25 mg·kg-1镉和复合污染处理的水稻根系活力均比对照分别增加了7.01%、22.04%、25.09%和32.58%,除了四溴双酚A和对照无显著性差异外,其他处理与对照均具有显著性差异。染毒处理增强了水稻种子根系的活力,复合污染和25 mg·kg-1镉处理的水稻根系活力均较强,可能污染物刺激了根系中物质的合成,增强根系的代谢能力,可能是水稻幼苗对低浓度阻燃剂和重金属镉胁迫的一种适应性机制[23]。
脯氨酸是植物细胞膜以及酶的保护物质,具有清除植物活性氧、调节细胞质渗透势、稳定蛋白结构的功能,在受到污染等胁迫条件下,导致植物体内脯氨酸迅速积累,进而提高植物的抗逆性。由图 2B可知,TBBPA、DP、镉和复合污染处理中脯氨酸均比对照分别增加了51.03%、4.91%、42.52%和86.35%,脯氨酸的累积反映出水稻幼苗受污染物的胁迫提高自身的抗逆性。除了得克隆与对照无显著差异外,其他处理均与对照具有显著性差异,且复合污染与其他处理间差异显著,说明复合污染对水稻幼苗的影响较大,脯氨酸积累对植物抵抗污染胁迫具有重要意义。
植物体内可溶性蛋白质可以通过诱导抗氧化酶、解毒酶、代谢酶和几种消除植物自由基的功能因子来提高植物对环境胁迫的耐受性[24]。由图 2C可知,阻燃剂TBBPA和DP具有促进植物可溶性蛋白质生成的作用,比对照分别增加了36.55%和5.86%,但是镉和复合污染均抑制了水稻幼苗可溶性蛋白质的生成,抑制率分别为28.86%和15.09%,重金属镉显著影响了水稻幼苗体内可溶性蛋白质的生成,可溶性蛋白质含量的变化可以污染胁迫下的总代谢水平和植物损伤程度。
可溶性糖含量是植物抗逆性的指标,由图 2D可知,镉具有抑制水稻体内可溶性糖生成的作用,抑制率为8.41%,阻燃剂和复合污染具有促进水稻体内可溶性糖生成的作用,TBBPA、DP和复合污染比对照分别增加了32.12%、33.63%和11.15%。在污染胁迫下,植物积累可溶性糖以调节渗透势并维持保证正常生长所需的水分[25]。Chaum等[26]报道籼稻积累可溶性糖以应对盐胁迫,植物的代谢活动随着植物的发育过程而不断发生着变化,碳水化合物的代谢也不例外,其含量也随之发生变化,水稻种子萌发过程中,受到外界污染环境的胁迫等情况,植物可溶性糖含量都会发生变化。
DP处理种子根系活力较高,脯氨酸含量较低,蛋白质含量较高,可溶性糖含量最高,由此表明土壤中浓度为5 mg·kg-1的DP对水稻幼苗的毒害较小,幼苗产生一些参与代谢和调节细胞环境的物质提高对DP的抗逆性,从而表现出较高的生长活力。TBBPA处理种子根系活力较低,脯氨酸含量较高,蛋白质含量最高,可溶性糖含量较高,水稻幼苗受土壤中TBBPA胁迫较为严重时,通过增加脯氨酸、可溶性蛋白质和可溶性糖的含量来增强自身抗逆性。镉处理种子根系活力较高,脯氨酸含量较低,蛋白质含量和可溶性糖含量最低,其对25 mg·kg-1的镉有一定的耐受性。复合污染对水稻幼苗影响最大,脯氨酸含量最高,蛋白质含量和可溶性糖含量较低,水稻幼苗受土壤环境中污染物的胁迫时,脯氨酸大量增加以调节细胞渗透势,维持细胞正常的生理状态。
2.5 水稻幼苗中污染物残留量按照1.5方法处理幼苗后测定3种污染物的残留量如表 3。
|
|
表 3 原旱稻3号幼苗中DP、TBBPA和镉的残留量 Table 3 DP, TBBPA and Cd residues in rice seedlings |
研究结果表明DP和TBBPA在幼苗中的浓度均较小,尽管土壤浓度均达到mg·kg-1水平,但幼苗中残留浓度均为ng·g-1水平,这是由于两种阻燃剂分子量较大且疏水性强,很难被植物吸收,而且DP两种顺反异构体在幼苗中的残留水平差异较大;重金属镉在幼苗中浓度达到59.37 mg·kg-1(干样),镉的富集系数为2.37,说明本品种对镉具有一定的生物积累作用。
3 讨论 3.1 DP对生物的毒性虽然在环境中广泛检出,但目前对DP的毒理学机制研究仍十分有限。受试生物多为动物[27-32]。研究结果显示,虽然DP的生物毒性较低,但高浓度长期作用仍会对机体造成一定损伤;与十溴联苯醚(溴代阻燃剂)相比,DP所导致的繁殖毒性及生物富集则更为严重。卤化有机污染物从土壤向作物的迁移被认为是人类暴露于此类化学品的重要途径[33]。Sun等[34]研究表明温室增加了蔬菜对土壤浓度高的DP的吸收,DP可以从根部运输到果实,温室土壤中DP的消散速度略慢于常规土壤。但从目前研究进展来看,有关DP生态毒理学机制的研究还不够全面,主要集中在生理水平、基因和蛋白质表达层面,缺乏对个体、种群和群落水平的研究;受试对象也很局限,主要集中在动物,而在植物中还缺乏广泛的研究。
本试验研究了DP对水稻种子萌发的影响,随着DP浓度增加,种子活力指数逐渐减小,DP对种子萌发的抑制作用逐步加强。DP各浓度处理组对于水稻芽伸长没有显著性抑制,DP≥5 mg·kg-1的处理组对于根伸长有显著性抑制作用(P < 0.05),且随着DP浓度增加抑制作用也随之加强,存在着明显的剂量-效应关系,DP对水稻根伸长的EC50为250.40 mg·kg-1,可能的原因是DP诱导了水稻细胞的氧化应激,抑制了细胞伸长和细胞分裂。5 mg·kg-1的DP处理下水稻种子根系活力高,代谢较为活跃,推测可能是低浓度的DP对水稻的整个萌发过程毒害较轻,而根部对于DP更为敏感。水稻根系是直接与土壤接触的部位,土壤中的营养物质通过根系进入到水稻植株各个器官。当然,DP胁迫逆境环境中,水稻根系也是最先感受到DP胁迫的器官。因此,水稻根系感受到低浓度DP的胁迫,而高浓度DP势必会影响水稻植株根系生长及其生理生化的变化。
3.2 TBBPA对植物的影响本试验研究了TBBPA对水稻种子萌发和幼苗生长的影响,研究结果表明TBBPA对水稻种子的萌发有不利影响,TBBPA处理组与对照相比发芽率、发芽势、发芽指数和活力指数都有下降。TBBPA对水稻芽与根伸长均有显著的抑制效应,其中根对TBBPA敏感性较强,这与Wang等[35]研究的TBBPA对于玉米种子发芽的影响结果一致。试验结果表明TBBPA对水稻根伸长和芽伸长的EC50分别为124.75 mg·kg-1和244.52 mg · kg-1,水稻的根比芽对TBBPA更敏感。Dogan等[36]研究表明发芽期鹰嘴豆在低浓度的TBBPA处理下,根质膜的完整性得到了相对保护,高浓度下没有保持完整性。Sverdrup等[37]报道,TBBPA对红三叶草(Trifolium pratense)的影响较小,对红三叶草的茎和根伸长没有显著影响。也可能是由于水稻对TBBPA比较敏感。TBBPA对不同作物的种子发芽和生长的影响还需进一步研究。Ge等[38]有关TBBPA对大豆种子发芽影响的研究表明,5~100 mg·kg-1 TBBPA处理降低了芽长和植株质量,低浓度的TBBPA处理增加了可溶性糖和可溶性蛋白质含量,高浓度的TBB⁃ PA处理降低了可溶性糖和可溶性蛋白质含量,这与试验结果10 mg·kg-1的TBBPA处理增加了脯氨酸、可溶性糖和可溶性蛋白质含量一致。这3个指标的增高说明水稻幼苗生长受到TBBPA胁迫,并调节物质代谢增强自身抗逆性。研究发现,TBBPA诱导氧化应激,增强了H2O2水平和脂质过氧化,抑制了细胞伸长和细胞分裂,氧化应激会促进细胞死亡,被认为是一个重要的病理生理条件。水稻在TBBPA低浓度具有耐受氧化应激的能力,高浓度此能力部分丧失,因此水稻种子萌发和幼苗生长均受到高浓度TBBPA的毒害。
3.3 镉对植物的影响镉胁迫对水稻种子萌发与幼苗生长具有不同程度的影响。本研究以原旱稻3号水稻为试验生物,浓度>10 mg·kg-1时,处理组和对照之间的根和芽长均存在显著性差异(P < 0.05)。在种子萌发指标中活力指数最敏感,其次是发芽指数,受抑制最轻的是发芽率,这与前人研究镉对水稻[39]、乌麦[40]等植物上的试验结果基本一致。研究表明,低浓度Cd2+(≤1 mg·L-1)促进水稻种子萌发,随着Cd2+(≥10 mg·L-1)溶液浓度的增加,水稻种子萌发逐渐受到抑制。Cd2+对水稻幼根生长的影响,在低浓度下即表现为抑制作用,根长随Cd2+浓度的增加而递减。镉对水稻根伸长和芽伸长的EC50分别为133.41 mg·kg-1和81.80 mg·kg-1,由于水稻种子萌发时根部最先吸收、积累并固定重金属镉,破坏根细胞内核仁及染色体,同时诱导产生对根细胞具有较强伤害作用的乙烯,从而严重抑制根的生长;随着根中镉和乙烯的增加及向芽部输导,芽的生长也受到伤害,芽长及芽鲜质量受到一定影响。前人研究显示,镉胁迫下各营养器官镉含量表现一致,均随镉浓度增加而升高。一般表现为水稻根系的镉含量最高,茎的镉含量次之,叶鞘中镉含量较低[39]。25 mg·kg-1镉处理水稻根系活力较高,水稻幼苗生长对土壤中镉胁迫有一定的耐性,水稻幼苗生长较种子萌发能耐受更高浓度的镉胁迫。
3.4 阻燃剂和镉复合污染对生物的影响陆雅婕等[41]研究了镉和TBBPA复合污染对小白菜的生物效应,结果表明野外长期污染土壤中的TBBPA对小白菜没有明显的毒性效应,但与镉复合后,抑制了镉在小白菜茎叶中的累积,诱导了SOD、CAT和类胡萝卜素等抗氧化剂生成,减弱了脂质过氧化,增加了叶绿素的含量,缓解了重金属对小白菜的生长抑制作用,产生了拮抗效应。本研究结果表明,DP、TBBPA、镉浓度为10 mg·kg-1,其单一及复合污染都对水稻种子的萌发和幼苗的生长起抑制作用,DP生物有效性较弱,对水稻种子萌发及幼苗生长影响较小,而镉和TBBPA的生物有效性较强,对水稻种子萌发及幼苗生长影响较大,复合污染对水稻种子萌发的影响主要由TBBPA和镉造成。在5 mg·kg-1的DP、10 mg·kg-1的TBBPA和25 mg·kg-1的镉污染时,水稻受DP胁迫较轻,受TBBPA胁迫较为严重,对镉有一定的耐受性;由复合污染对旱稻种子萌发生长的影响结果得知,TBBPA和镉共同作用对水稻产生了明显的毒性效应,DP在复合污染中所起作用较小。
4 结论(1)DP、TBBPA和镉对原旱稻3号种子萌发和幼苗生长具有抑制作用,且存在明显的剂量-效应关系。
(2)DP的生物有效性较弱,对原旱稻3号影响较小,TBBPA对原旱稻3号毒性较强,原旱稻3号幼苗对镉具有一定的积累作用,对高浓度镉的生物有效性减弱。
(3)卤代阻燃剂和镉对原旱稻3号幼苗生理生化指标具有一定的影响,幼苗通过调节细胞中脯氨酸、可溶性糖和可溶性蛋白质等物质的含量来提高对卤代阻燃剂和镉胁迫的耐受性。
| [1] |
Ma W L, Liu L Y, Qi H, et al. Dechlorane plus in multimedia in northeastern Chinese urban region[J]. Environment International, 2011, 37(1): 66-70. |
| [2] |
Yu Z Q, Lu S Y, Gao S T, et al. Levels and isomer profiles of dechlorane plus in the surface soils from e-waste recycling areas and industrial areas in South China[J]. Environmental Pollution, 2010, 158(9): 2920-2925. |
| [3] |
Sverko E, Tomy G T, Marvin C H, et al. Dechlorane plus levels in sediment of the lower Great Lakes[J]. Environmental Science & Technology, 2008, 42(2): 361-366. |
| [4] |
Qi H, Liu L Y, Jia H L, et al. Dechlorane plus in surficial water and sediment in a northeastern Chinese river[J]. Environmental Science & Technology, 2010, 44(7): 2305-2308. |
| [5] |
Möller A, Xie Z, Sturm R, et al. Large-scale distribution of dechlorane plus in air and seawater from the Arctic to Antarctica[J]. Environmental Science & Technology, 2010, 44(23): 8977-8982. |
| [6] |
Salamova A, HitesR A. Dechlorane plus in the atmosphere and precipitation near the Great Lakes[J]. Environmental Science & Technology, 2011, 45(23): 9924-9930. |
| [7] |
Kang J H, Kim J C, Jin G Z, et al. Detection of dechlorane plus in fish from urban-industrial rivers[J]. Chemosphere, 2010, 79(8): 850-854. |
| [8] |
Gauthier L T, Letcher R J. Isomers of dechlorane plus flame retardant in the eggs of herringgulls(Larus argentatus) from the Laurentian Great Lakes of North America:Temporal changes and spatial distribution[J]. Chemosphere, 2009, 75(1): 115-120. |
| [9] |
Ben Y J, Li X H, Yang Y L, et al. Dechloran plus and its dechlorinated analogs from an e-waste recycling center in maternal serum and breast milk of women in Wenling, China[J]. Environmental Pollution, 2013, 173: 176-181. |
| [10] |
He M J, Luo X J, Yu L H, et al. Diasteroisomer and enantiomer-specific profiles of hexabromocyclododecane and tetrabromobisphenol A in an aquatic environment in a highly industrialized area, South China:Vertical profile, phase partition, and bioaccumulation[J]. Environmental Pollution, 2013(179): 105-110. |
| [11] |
He M J, Luo J, Yu L H, et al. Tetrabromobisphenol-A and hexabromocyclododecane in birds from an e-waste region in South China:Influence of diet on diastereoisomer and enantiomer specific distribution and trophodynamics[J]. Environmental Science & Technology, 2010, 44(15): 5748-5754. |
| [12] |
Gina D N, Janel E O. Quantization of tetrabromobisphenol-A from dust sampled on electronics by dispersed liquid-liquid microextraction[J]. Environmental Pollution, 2013, 180: 274-280. DOI:10.1016/j.envpol.2013.05.038 |
| [13] |
Huang D Y, Zhao H Q, Liu C P, et al. Characteristics, sources and transport of tetrabromobisphenol A and bisphenol A in soils from a typical e-waste recycling area in South China[J]. Environmental Science and Pollution Research, 2014, 21(9): 5818-5826. |
| [14] |
Ni H G, Zeng H. HBCD and TBBPA in particulate phase of indoor air in Shenzhen, China[J]. Science of the Total Environment, 2013, 458-460: 15-19. |
| [15] |
Shi Z X. Levels of tetrabromobisphenol A, hexabromocyclododecanes and polybrominated diphenyl ethers in human milk from the general population in Beijing, China[J]. Science of the Total Environment, 2013, 452/453(452/453C): 10-18. |
| [16] |
Yang S W, Wang S R, Wu F C, et al. Tetrabromobisphenol A:Tissue distribution in fish and seasonal variation in water and sediment of Lake Chaohu, China[J]. Environmental Science and Pollution Research, 2012, 19(9): 4090-4096. |
| [17] |
Song M Y, Liang D, Liang Y, et al. Assessing developmental toxicity and estrogenic activity of halogenated bisphenol A on zebrafish(Danio rerio)[J]. Chemosphere, 2014, 112: 275-281. |
| [18] |
Banks M K, Schultz K E. Comparison of plants for germination toxicity tests petroleum contaminated soils[J]. Water, Air, and Soil Pollution, 2005, 167(1): 211-219. |
| [19] |
李天哲, 陈爱婷, 李彩, 等. 镉胁迫下硅对水稻幼苗生长与生理响应的影响[J]. 农业环境科学学报, 2018, 37(6): 1072-1078. LI Tian-zhe, CHEN Ai-ting, LI Cai, et al. Effects of silicon on the growth and physiological responses of rice seedlings under cadmium stress[J]. Journal of Agro-Environment Science, 2018, 37(6): 1072-1078. |
| [20] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. GAO Jun-feng. Guide for plant physiology experiments[M]. Beijing: Higher Education Press, 2006. |
| [21] |
宋文恩, 陈世宝. 基于水稻根伸长的不同土壤中镉(Cd)毒性阈值(ECx)及预测模型[J]. 中国农业科学, 2014, 47(17): 3434-3443. SONG Wen-en, CHEN Shi-bao. The toxicity thresholds(ECx)of cadmium(Cd)to rice cultivars as determined by root elongation tests in soils and its predicted models[J]. Scientia Agricultura Sinica, 2014, 47(17): 3434-3443. |
| [22] |
段九菊, 郭世荣, 康云艳, 等. 盐胁迫对黄瓜幼苗根系生长和多胺代谢的影响[J]. 应用生态学报, 2008, 19(1): 57-64. DUAN Jiu-ju, GUO Shi-rong, KANG Yun-yan, et al. Effects of salt stress on cucumber seedlings root growth and polyamine metabolism[J]. Chinese Journal of Applied Ecology, 2008, 19(1): 57-64. |
| [23] |
刘洪月, 申泽辉, 梁婵娟. 微囊藻毒素对水稻幼苗营养吸收的影响[J]. 农业环境科学学报, 2019, 38(11): 2449-2455. LIU Hong-yue, SHEN Ze-hui, LIANG Chan-juan. Effect of microcystins on nutrient absorption of rice seedling[J]. Journal of Agro-Environment Science, 2019, 38(11): 2449-2455. |
| [24] |
Naeem M S, Rasheed M, Liu D, et al. 5-Aminolevulinic acid ameliorates salinity-induced metabolic, water-related and biochemical changes in Brassica napus L.[J]. Acta Physiologiae Plantarum, 2011, 33(2): 517-528. |
| [25] |
Gill P K, Sharma A D, Singh P, et al. Changes in germination, growth and soluble sugar contents of Sorghum bicolor(L.)Moench seeds under various abiotic stresses[J]. Plant Growth Regulation, 2003, 40(2): 157-162. |
| [26] |
Chaum S, Charoenpanich A, Roytrakul S, et al. Sugar accumulation, photosynthesis and growth of two indica rice varieties in response to salt stress[J]. Acta Physiologiae Plantarum, 2009, 31(3): 477-486. |
| [27] |
Yang Y, Ji F, Cui Y, et al. Ecotoxicological effects of earthworm following long-term dechlorane plus exposure[J]. Chemosphere, 2016, 144: 2476-2481. |
| [28] |
Zhang L, Ji F, Li M, et al. Short-term effects of dechlorane plus on the earthworm Eisenia fetida determined by a systems biology approach[J]. Journal of Hazardous Materials, 2014, 273C(6): 239-246. |
| [29] |
Kang H, Moon H B, Choi K. Toxicological responses following shortterm exposure through gavage feeding or water-borne exposure to dechlorane plus in zebrafish(Danio rerio)[J]. Chemosphere, 2015, 146: 226-232. |
| [30] |
Liang X, Li W, Martyniuk C J, et al. Effects of dechlorane plus on the hepatic proteome of juvenile Chinese sturgeon(Acipenser sinensis)[J]. Aquatic Toxicology, 2014, 148(3): 83-91. |
| [31] |
Barón E, Dissanayake A, Vilà-Cano J, et al. Evaluation of the genotoxic and physiological effects of decabromo-diphenyl ether(BDE-209)and dechlorane plus(DP)flame retardants in marine mussels (Mytilus gallopro-vincialis)[J]. Environmental Science & Technology, 2016, 50(5): 2700-2708. DOI:10.1021/acs.est.5b05814 |
| [32] |
Wu J P, Chen X Y, Wu S K, et al. Dechlorane plus flame retardant in a contaminated frog species:Biomagnification and isomer-specific transfer from females to their eggs[J]. Chemosphere, 2018, 211: 218-225. |
| [33] |
Navarro I, De la Torre, Sanz P, et al. Uptake of perfluoroalkyl substances and halogenated flame retardants by crop plants grown in biosolids-amended soils[J]. Environmental Research, 2017, 152: 199-206. |
| [34] |
Sun J Q, Wu Y H, Tao N G, et al. Dechlorane plus in greenhouse and conventional vegetables:Uptake, translocation, dissipation and human dietary exposure[J]. Environmental Pollution, 2019, 244: 667-674. |
| [35] |
Wang Y, Zhang M, Zhao L F, et al. Effects of tetrabromobisphenol A on maize(Zea mays L.)physiological indexes, soil enzyme activity, and soil microbial biomass[J]. Ecotoxicology, 2019, 28: 1-12. |
| [36] |
Dogan M, Yumrutas O, Saygideger S D, et al. Effects of bisphenol A and tetrabromobisphenol A on chickpea roots in germination stage[J]. American-Eurasian Journal, Agricultural & Environmental Science, 2010, 9: 186-192. |
| [37] |
Sverdrup L E, Hartnik T, Mariussen E, et al. Toxicity of three halogenated flame retardants to nitrifying bacteria, red clover(Trifolium pratense), and a soil invertebrate(Enchytraeus crypticus)[J]. Chemosphere, 2006, 64(1): 96-103. |
| [38] |
Ge H L, Zhang F L. Effects of tetrabromobisphenol A stress on growth and physiological characteristics of soybean seedling[J]. Bulletin of Environmental Contamination & Toxicology, 2016, 98(1): 1-6. |
| [39] |
刘玉玲, 彭鸥, 铁柏清, 等. Delftia sp. B9对镉胁迫下水稻种子萌发及幼苗镉积累的影响[J]. 农业环境科学学报, 2019, 38(8): 1855-1863. LIU Yu-ling, PENG Ou, TIE Bai-qing, et al. Effects of Delftia sp. B9 on rice seed germination and cadmium accumulation in rice seedlings under Cd stress[J]. Journal of Agro-Environment Science, 2019, 38(8): 1855-1863. |
| [40] |
马文丽, 金小弟, 王转花. 镉处理对乌麦种子萌发幼苗生长及抗氧化酶的影响[J]. 农业环境科学学报, 2004, 23(1): 55-59. MA Wen-li, JIN Xiao-di, WANG Zhuan-hua. Effects of cadmium on seed germination, growth of seedling and antioxidant enzyme of rye and wheat[J]. Journal of Agro-Environment Science, 2004, 23(1): 55-59. |
| [41] |
陆雅婕, 吴笛, 尹颖, 等. 重金属和溴代阻燃剂复合污染对小白菜的生物效应[J]. 南京大学学报(自然科学), 2018, 54(1): 196-203. LU Ya-jie, WU Di, YIN Ying, et al. Combined effect of heavy metals and bromine flame retardants for pakchoi[J]. Journal of Nanjing University (Natural Science), 2018, 54(1): 196-203. |
 2020, Vol. 39
2020, Vol. 39