我国农业用地重金属污染严重。据报道,我国11个省市25个地区存在土壤Cd污染问题,总面积达1.3万km2[1],且在2005年到2017年间,Cd含量较背景值有所升高[2]。一般认为,水稻是对Cd吸收能力最强的大宗谷类作物[3]。在研究作物对Cd迁移转化过程中,亚细胞分级技术已经成为评价植物对Cd积累过程的重要方法,研究表明,作物籽粒的Cd含量受细胞壁吸附和液泡截留的影响显著[4-5]。同时相关研究[6]指出植物通过细胞壁固定和液泡区室化可以避免Cd进入细胞器,从而减轻Cd对细胞器及膜结构的破坏[7],避免了Cd对细胞正常代谢的毒害。因此,通过不同部位水稻Cd的亚细胞分析,有助于系统评价土壤-水稻系统中Cd的有效性。国内评价土壤重金属的有效性,常用中性盐和有机络合物作为一次提取剂[8-9],但近期研究表明,梯度扩散薄膜技术(Diffusive gradients in thin-films,DGT)[10]相较于常规的一次提取剂,通过模拟金属离子在土壤体系的扩散与固-液交换过程,更真实地反映Cd的有效性及Cd的转运情况。因此,DGT被认为是一种预测植物吸收Cd的较好方法[11-12]。
我国是秸秆大国,秸秆作为重要的有机物资源被广泛应用于土壤改良,直接还田的比例达到35%以上[13]。前期研究表明,秸秆还田缓解了Cd对水稻的毒害[14],这种解毒效应可能与秸秆还田引起的可溶性有机物与Cd结合,从而降低土壤有效Cd含量有关[15-17],但以往的研究多以秸秆粉末还田,与生产实际情况不符,且秸秆还田对Cd的解毒机理仍不明确。因此,研究小麦秸秆还田量对Cd在水稻体内的亚细胞分布特征影响,有助于理解秸秆还田下水稻对Cd的耐受机制。
本研究以安徽典型矿区Cd污染土壤为对象,以实际生产中秸秆产量为还田依据,按照大田秸秆处理方式将秸秆处理成段还田,更真实地反映了田间实际情况。通过研究小麦秸秆还田量对水稻Cd亚细胞分布的影响,从器官和亚细胞水平上探讨秸秆还田下水稻对Cd的耐受解毒机制,同时运用3种典型的土壤重金属有效态评价手段,对土壤-水稻系统中Cd运移情况进行评估对比,以期为Cd污染农田的秸秆还田提供科学依据。
1 材料和方法 1.1 供试材料 1.1.1 供试土壤供试土壤采集于安徽某矿区(30°56′ 39″ N,117° 59′16″E),土壤类型为水稻土,土壤全Cd含量超过现行《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)中农用地土壤污染风险管控值2倍以上,达重度污染,其基本理化性质见表 1。
|
|
表 1 供试土壤基本理化性质 Table 1 The physico-chemical properties of the tested soil |
供试秸秆为小麦秸秆,品种为烟农19号。小麦秸秆经风干后剪至3~5 cm备用。
1.1.3 供试作物供试作物为水稻,品种为丰两优香1,由安徽农业大学农学院水稻课题组提供。
1.1.4 其他材料梯度扩散薄膜装置购自南京智感环境科技有限公司。
1.2 试验设计秸秆还田土壤处理采用盆栽试验,该水稻盆栽试验在安徽农业大学农萃园开展。试验设常规施肥无秸秆对照(CK)、半量小麦秸秆还田(Half dose wheat straw,HDWS)、全量小麦秸秆还田(Full dose wheat straw,FDWS)3个处理,每处理重复12次。以安徽平均小麦秸秆产量计算得每盆钵中小麦全量、半量秸秆量分别为10.6 g和5.3 g[18]。将过2 mm筛的重度Cd污染土样装入上口径28 cm、下口径20 cm,高30 cm的塑料盆钵中,按照3个小麦秸秆还田水平混匀,用(NH4)2SO4、KH2PO4、K2SO4溶液施基肥,加入量分别为N:0.10 g·kg-1,K2O:0.10 g·kg-1,P2O5:0.07 g·kg-1。淹水培养15 d后于2019年5月15日移栽30 d秧龄幼苗,每钵定苗4株,其他措施按照当地优质栽培管理措施进行。水稻于2019年9月30日收获,全生育期169 d。分别在水稻苗期、分蘖期、灌浆期和成熟期各取3盆采集全株植株,用于植株不同部位及各亚细胞组分Cd含量的测试。同期,取盆栽土样,除去植物根系,风干后分别过2 mm筛,用于土壤有效态Cd含量测定。
1.3 测定指标与方法 1.3.1 土壤Cd有效态测定土壤有效态Cd分别采用CaCl2(0.01 mol·L-1)、EDTA(0.005 mol·L-1)和DGT 3种具有代表性的提取剂浸提。DGT测定方法如下[19]:
采用梯度扩散薄膜技术测定土壤Cd有效态。将研磨过筛后的土样调节最大田间持水量80%,土壤平衡48 h后放置于DGT并暴露24 h。回收固定膜,使用1 mol·L-1硝酸提取待测。
DGT浓度(CDGT)计算方法如下:
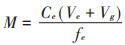
|
(1) |
式中:M为固定膜中Cd的积累量,μg;Ce为提取液Cd浓度,μg·L-1;Ve为提取液体积,L;Vg为固定相体积,L;fe为Cd提取率。
利用公式(2)计算DGT浓度:
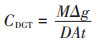
|
(2) |
式中:Δg为扩散层厚度,cm;D为磷酸根离子在DGT扩散层中的扩散系数,cm2·s-1;A为每一个圆片膜的面积,3.14 cm2;t为DGT装置的放置时间,s。
1.3.2 植物及其亚细胞组分Cd含量测定亚细胞分组方法[20]如下:采集新鲜水稻样,经清洗剪切处理后,在低温环境下使用液氮研磨至粉末状。以与样品1:5的比例加入提取剂,提取剂成分为250 mmol·L-1蔗糖、50 mmol·L-1 tris-HCl、1.0 mmol·L-1二硫赤藓糖醇、5.0 mmol·L-1抗坏血酸、1.0%Polyclar AT PVPP(pH=7.5)。
采用分级离心法分离细胞不同组分:将上述混合样品7 000 r·min-1离心20 min,沉淀为细胞壁组分(F1);再将上一步骤中得到的上清液12 000 r·min-1离心40 min,得到的上清液即为细胞可溶性组分(F3),沉淀为细胞器组分(F2),采用硝酸-高氯酸消解(GB 5009.15—2014)待测。
利用ZEEnit-700P原子吸收分光光度计和ICAP6000Series电感耦合等离子发射光谱仪测定Cd浓度,测定过程中使用国家标准物质(GBW07405、GBW07460)进行质量控制。
1.4 数据处理采用Excel 2016、Origin 2017对试验数据处理分析和常规作图,采用SPSS 25.0进行相关性分析和差异显著性分析。
2 结果与分析 2.1 小麦秸秆还田量对水稻Cd亚细胞分布的影响 2.1.1 小麦秸秆还田量对水稻根Cd亚细胞分布的影响图 1为小麦秸秆还田量对各生育期水稻根Cd亚细胞分布及含量分配的影响。整体上,小麦秸秆还田降低了水稻苗期与分蘖期根部F1、F2和F3中的Cd含量,但提高了灌浆期和成熟期根部F1、F2和F3中的Cd含量;在根部各亚细胞组分的Cd含量分配上,不同生育阶段不同处理均呈现F1>F3>F2,至生育后期各处理F2和F3组分中的Cd含量百分比上升,但仍以F1组分中的Cd含量占比最大,并未表现出秸秆还田量间的一致规律(图 1d)。在苗期,F1、F3中的Cd含量均表现为CK高于秸秆还田组(P<0.05),降幅达35.8%~76.0%和58.8%~69.1%,到了分蘖期CK与秸秆还田组之间的Cd含量差距缩小,这可能是秸秆还田在短时间内促进了土壤对Cd的吸附,降低了植物对Cd的吸收所致。而在灌浆期,F1组分FDWS的Cd含量显著大于HDWS和CK,在成熟期F3组分HDWS的Cd含量显著大于CK,这种现象可能与秸秆腐解程度有关。而在F2中,所有生育阶段中处理间均无显著性差异。
|
不同字母代表处理间差异显著(P<0.05)。下同 Different letters indicate significant differences among treatments(P < 0.05). The same below 图 1 小麦秸秆还田对各生育期水稻根Cd亚细胞分布及含量分配的影响 Figure 1 Effects of wheat straw residue amount on Cd subcellular distribution and content in rice roots at different growth stages |
小麦秸秆还田量对各生育期水稻茎Cd亚细胞分布的影响如图 2所示,小麦秸秆还田显著降低了灌浆期和成熟期水稻茎部F1、F2中的Cd含量,亦显著降低了分蘖期和灌浆期F3中的Cd含量,在茎部各亚细胞组分的Cd含量分配上,不同生育阶段不同处理均呈现F1>F3>F2。在灌浆期,茎部F1、F3中CK的Cd含量显著高于秸秆还田组(P<0.05)。在成熟期F2中CK的Cd含量显著高于秸秆还田组,其中,FDWS和HDWS的F2组分Cd含量较CK分别下降了45.3%和31.3%,说明小麦秸秆还田一定程度上降低了Cd对细胞器的毒害。
|
图 2 小麦秸秆还田量对各生育期水稻茎Cd亚细胞分布的影响 Figure 2 Effects of wheat straw residue amount on Cd subcellular distribution and content in rice stems at different growth stages |
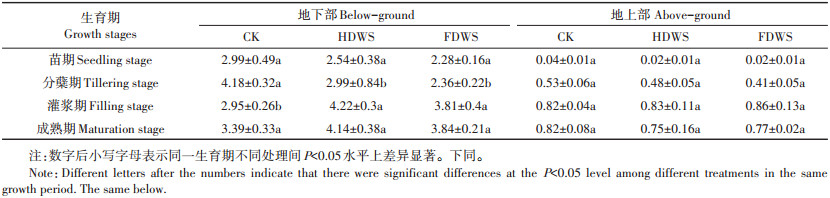
小麦秸秆还田对不同生育期水稻各部位Cd含量的影响如表 2所示。与CK相比,HDWS和FDWS在水稻分蘖期均显著降低了水稻地下部分Cd的浓度(P<0.05),降幅达28.5%和43.5%,但是在灌浆期HDWS和FDWS水稻地下部分Cd的浓度显著升高,增幅达43.1%和29.2%。
|
|
表 2 小麦秸秆还田对不同生育期水稻各部位Cd含量的影响(mg·kg-1) Table 2 Effect of wheat stalk returning on the Cd contents of each organ in different rice varieties(mg·kg-1) |
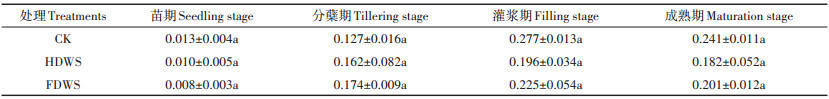
小麦秸秆还田对Cd在水稻中转运系数的影响见表 3。在苗期、灌浆期和成熟期,小麦秸秆还田一定程度上降低了Cd从水稻地下部向地上部的转运能力,但效果不显著(P<0.05)。而在分蘖期,HDWS和FDWS处理的转运系数较CK有所上升,但均未达显著水平,说明在水稻的营养生长期间,小麦秸秆还田可能促进了土壤有效Cd的溶出。
|
|
表 3 小麦秸秆还田对Cd在水稻中转运系数的影响 Table 3 Effect of wheat stalk returning on the Cd transfer coefficient in rice |
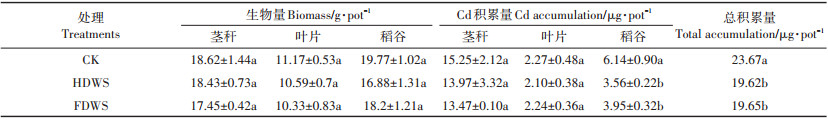
小麦秸秆还田对水稻生物量的影响见表 4。总体上,小麦秸秆还田处理未对水稻生物量产生显著性影响,CK的植株地上部分生物总量要略高于HDWS和FDWS,但差异未达显著水平。
|
|
表 4 小麦秸秆还田对成熟期水稻植株Cd积累量的影响 Table 4 Effects of wheat straw residue amount on Cd accumulation in rice plants |
小麦秸秆还田对水稻地上各部位Cd积累量的影响如表 4所示。与CK相比,HDWS和FDWS显著降低了水稻稻谷中Cd积累量(P<0.05),亦显著降低了地上部对Cd总积累量(P<0.05),两种处理对地上部Cd积累量降低幅度均为0.17%,处理间未达显著水平。
2.3 小麦秸秆还田量对土壤有效态Cd的影响小麦秸秆还田量对水稻不同生育期土壤有效态Cd含量的影响如图 3所示。总体上,EDTA提取剂提取的Cd含量高于CaCl2和DGT提取的Cd含量,随着生育期的延长,3种提取剂提取的Cd含量均呈现增长趋势。小麦秸秆还田量对土壤有效态Cd含量的影响效应在CaCl2和EDTA提取剂中表现不明显,仅苗期CaCl2提取的Cd含量和EDTA提取的Cd含量、分蘖期EDTA提取的Cd含量表现出了与CK间的显著差异或HDWS和FDWS间的显著差异。其中,苗期HDWS和FDWS较CK均显著降低了土壤CaCl2提取态Cd含量(P<0.05),下降幅度为31.1%和30.4%,且HDWS处理的EDTA提取态Cd含量显著低于CK和FDWS(P<0.05);在分蘖期FDWS较CK显著提高了土壤EDTA提取态Cd的含量,提高幅度为15.1%。而小麦秸秆还田量对土壤有效态Cd含量的影响效应在DGT提取剂中表现明显,具体表现为:在苗期,FDWS和HDWS较CK均显著降低了DGT提取态Cd的含量,下降幅度为14.1%和43.9%。在苗期至分蘖期内,CK增长平缓,FDWS和HDWS处理DGT提取态Cd大幅度增长,而在分蘖期后,与CK大幅增长相反,FDWS和HDWS增长趋于平缓,直到灌浆期,CK中DGT提取态Cd的含量超过FDWS和HDWS。

|
图 3 小麦秸秆还田对土壤有效Cd的影响 Figure 3 Effect of wheat stalk returning on soil available Cd, as measured using different chemical extractants |
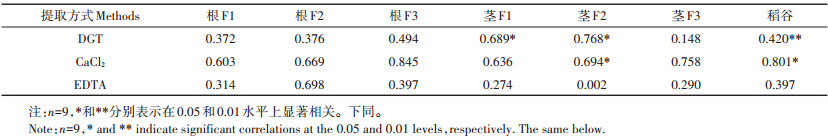
成熟期土壤有效态Cd与水稻亚细胞组分Cd含量相关性见表 5。总的来说,化学提取的有效态Cd与各亚细胞组分Cd含量相关性较差,相对而言,DGT提取的有效态Cd与各亚细胞组分Cd含量相关性较好。具体表现为:DGT提取的Cd与茎细胞F1、F2组分Cd含量呈显著正相关(P<0.05),与稻谷Cd含量极显著正相关(P<0.01),与地下各部分CaCl2均无显著相关性;土壤CaCl2提取的Cd与茎F2和稻谷Cd含量显著正相关(P<0.05),其余部分均无明显相关性。
|
|
表 5 成熟期土壤有效Cd与水稻亚细胞组分Cd含量相关性分析 Table 5 Correlation analysis between soil available Cd and Cd contents in subcellular components of rice at the mature stage |
水稻各亚细胞组分和稻谷之间的Cd含量相关性分析见表 6。总体上看,大部分亚细胞组分和稻谷中Cd含量没有相关性,只有根F3、茎F1与茎F2和根F3、茎F1与稻谷间存在较好的相关性。其中,根F3组分与茎F2显著负相关(P<0.05),与稻谷呈极显著负相关(P<0.01),这可能是由于根细胞可溶性组分对Cd向稻谷转运有较强的截留作用导致。此外,茎F1与茎F2显著正相关,茎F2与稻谷显著正相关。
|
|
表 6 水稻各亚细胞组分、稻谷Cd含量相关性分析 Table 6 Correlation analysis between Cd contents of rice subcellular components and Cd content in rice grains |
小麦秸秆还田对水稻Cd亚细胞分布影响差异显著。在水稻苗期与分蘖期,根系细胞壁和可溶性组分Cd含量均表现为CK>HDWS>FDWS,这可能是因为Cd在进入植物细胞之前,先于土壤中秸秆相互作用所致。秸秆还田可以通过改变土壤有机质、低分子量有机酸和pH,从而达到促进秸秆对Cd的吸附作用[21-22]。到了灌浆期与成熟期,HDWS和FDWS在根系细胞壁、细胞器和可溶性组分Cd含量高于CK,该变化可能与秸秆的腐解程度有关。相关报道[23]指出,进入农田的秸秆通常具有较快矿化速率,能固定到土壤碳库的比例较低,在历经1.5~6个月的半衰期后,Cd会再次释放到土壤中,从而被根系固定吸收。同时,本文结果表明,在灌浆期和成熟期,小麦秸秆还田显著降低了水稻茎细胞器组分Cd含量,大部分的Cd被固定在了根F1和F3、茎F1上,从而抑制了Cd向上转运的能力。相关研究已证明,Cd能够对细胞器产生明显伤害,例如破坏叶绿体膜、破坏线粒体膜、损伤细胞核仁、抑制核糖核酸酶活性、改变RNA合成[24]等。同时,孕穗期、灌浆期和成熟期是水稻籽粒Cd累积关键时期[25]。一方面,由于细胞壁富含果胶、纤维素等多糖分子,含有羟基、羧基、醛基和磷酸基等亲金属离子的配位基团[26],易与金属离子结合,有学者提出,水稻根部的耐Cd机制之一是将大部分Cd累积在细胞壁上,减少Cd向地上部的转运[27],这种特性与细胞壁中果胶和HC1成分含量有关[28-29];另一方面这可能是由于秸秆中富Si和S的特性,研究表明,Si能促进细胞壁对Cd的固持[30],S通过促进铁斑的形成、Cd的螯合和空泡的隔离减少了水稻对Cd的吸收和转运[31],并能促进液泡对Cd的区隔化[32],由于秸秆中Si和S的作用将大部分Cd固定在了细胞壁和可溶性组分上,因此减少了Cd向细胞器和籽粒的运输。
小麦秸秆还田对土壤有效态Cd影响差异显著,随着水稻根系的生长,利用DGT技术提取的土壤有效态Cd逐渐增大。报道指出,Cd胁迫会刺激根系分泌有机酸,且Cd胁迫对根系分泌氨基酸的种类影响不大,但对分泌量变化影响显著[33]。同时,根系分泌物中的柠檬酸、酒石酸等有机酸或氨基酸类物质对重金属有明显的活化作用[34]。因此,根系分泌物与土壤Cd相互作用可能是有效态Cd升高的主要原因。秸秆还田明显抑制了土壤有效态Cd的上升趋势,这可能是厌氧条件促进了秸秆腐解过程中酚醛-木质素残留物的积累[35],这些物质与土壤有效态Cd发生沉淀、螯合作用,部分螯合物还可以与根际游离重金属离子形成稳定的金属螯合物复合体,降低其活性及毒性[36]。另有研究表明,秸秆添加有助于土壤交换性酸降低,并且在秸秆腐解过程中产生的NH4+通过影响环境pH间接影响到土壤Cd的有效性[37]。小麦秸秆还田与土壤有效态Cd之间并不具有指向性的影响,并且由于影响因素众多,呈现出复杂的相互作用。
本研究中随着秸秆还田量的变化,DGT提取的土壤有效态与CaCl2提取的可交换态Cd与稻谷分布呈显著(P<0.05)和极显著(P<0.01)正相关,而EDTA提取的有效态Cd和水稻各组分Cd含量均没有显著的相关性。郑春荣等[38]在研究3种土壤EDTA提取Cd与水稻各部位吸收Cd中发现,两者有极显著相关性,与本研究结果并不一致,这可能是其控制变量为土壤类型,与本文的控制秸秆还田量不同的原因。国外报道在对大田水稻土壤Cd、Zn、Cu、Ni、Pb的研究中发现,DGT测定浓度受土壤性质的影响较小,体现了土壤因素(如pH、有机质等)对重金属有效性的影响,表明DGT是一种更有效的有效性分析方法[39]。而国内亦有研究表明,评价Cd-Zn复合污染土壤中Cd的有效性时,DGT法优于传统的化学提取法[40]。但是也有学者认为,传统化学提取法各自的适用条件亦不相同。例如以CaCl2为代表的中性盐提取的是交换态重金属,EDTA可以提取碳酸盐、铁锰氧化物结合态和部分有机结合态重金属。综上所述,就秸秆还田量变化而言,DGT法较经典的化学提取法能更好地评价土壤Cd的有效性。
4 结论(1)在灌浆期和成熟期,小麦秸秆还田有助于提高水稻根系细胞壁固定及可溶性组分区隔化作用,显著降低水稻茎细胞器组分Cd含量,减少Cd对细胞代谢作用的毒害。
(2)小麦秸秆半量、全量还田均显著降低了水稻中Cd向地上的转运能力和水稻地上部分Cd累积量(P<0.05)。总体而言,全量秸秆还田在全生育期土壤中DGT提取态Cd含量显著低于半量还田,解毒效果更好。
(3)对于评价秸秆还田量变化下土壤Cd的有效性,DGT法与水稻各组分的相关性优于传统的化学提取剂。
| [1] |
庞荣丽, 王瑞萍, 谢汉忠, 等. 农业土壤中镉污染现状及污染途径分析[J]. 天津农业科学, 2016, 22(12): 87-91. PANG Rong-li, WANG Rui-ping, XIE Han-zhong, et al. Analysis of cadmium pollution in agricultural soils and analysis of its way of pollution[J]. Tianjin Agricultural Sciences, 2016, 22(12): 87-91. DOI:10.3969/j.issn.1006-6500.2016.12.023 |
| [2] |
Ying H, Ling Yu, Wang W J, et al. Current status of agricultural soil pollution by heavy metals in China:A meta-analysis[J]. Science of the Total Environment, 2019(651): 3034-3042. |
| [3] |
秦美玲.水稻Cd胁迫的代谢物差异研究[D].杭州: 中国农业科学院, 2018: 1-3. QIN Mei-ling. Study on differences of metabolites in rice under cadmium stress conditions[D]. Hangzhou: Chinese Academy of Agricultural Sciences, 2018: 1-3. |
| [4] |
潘智立, 李军. 硫、硅对水稻体内npt含量及Cd亚细胞分布的影响[J]. 土壤通报, 2016, 47(5): 1253-1258. PAN Zhi-li, LI Jun. The response of non-protein thiols and subcellular distribution of cadmium in rice to the exogenous sulfur and silicon[J]. Chinese Journal of Soil Science, 2016, 47(5): 1253-1258. |
| [5] |
Zhang J, Zhao Q Z, Duan G L, et al. Influence of sulphur on arsenic accumulation and metabolism in rice seedlings[J]. Environmental and Experimental Botany, 2011, 72(1): 34-40. DOI:10.1016/j.envexpbot.2010.05.007 |
| [6] |
刘媛, 魏虹, 马文超, 等. 秋华柳对Cd的积累及其亚细胞分布特征[J]. 林业科学, 2018, 54(8): 48-55. LIU Yuan, WEI Hong, MA Wen-chao, et al. Accumulation and subcellular distribution of cadmium in Salix variegate[J]. Scientia Silvae Sinicae, 2018, 54(8): 48-55. |
| [7] |
Ghoshro Y S, Nadakavukaren M J. Influence of cadmium on the ultrastructure of developing chloroplasts in soybean and corn[J]. Environ Exp Bot, 1990, 30: 187-192. DOI:10.1016/0098-8472(90)90064-B |
| [8] |
Speir T W, Schaik A P V, Percival H J, et al. Heavy metals in soil, plants and groundwater following high-rate sewage sludge application to land[J]. Water, Air, and Soil Pollution, 2003, 150(1/2/3/4): 319-358. |
| [9] |
Jones D L, Prabowo A M, Kochian L V. Aluminium-organic acid interactions in acid soils[J]. Plant and Soil, 1996, 182(2): 229-237. DOI:10.1007/BF00029054 |
| [10] |
Davlson W, Zhang H. In situ speciation measurements of trace components in natural waters using thin-film gels[J]. Nature, 1994, 367(6463): 546-548. DOI:10.1038/367546a0 |
| [11] |
刘小莲, 杜平, 陈娟, 等. 基于梯度扩散薄膜技术评估稻田土壤中Cd的有效性[J]. 农业环境科学学报, 2017, 36(12): 2429-2437. LIU Xiao-lian, DU Ping, CHEN Juan, et al. Evaluation of cadmium bioavailability via diffusive gradients in thin film technology for agricultural soils[J]. Journal of Agro-Environment Science, 2017, 36(12): 2429-2437. DOI:10.11654/jaes.2017-0829 |
| [12] |
宋宁宁, 王芳丽, 沈跃, 等. 梯度薄膜扩散技术(DGT)与传统化学方法评估黑麦草吸收Cd的对比[J]. 环境化学, 2012, 31(12): 1960-1967. SONG Ning-ning, WANG Fang-li, SHEN Yue, et al. Comparison of the method of diffusive gradients in thin films with traditional chemical extraction techniques for evaluating cadmium bioavailability in ryegrass[J]. Environmental Chemistry, 2012, 31(12): 1960-1967. |
| [13] |
张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924. ZHANG Fu-suo, WANG Ji-qing, ZHANG Wei-feng, et al. Nutrient use efficiencies of major cereal crops in China and measures for improvement[J]. Acta Pedologica Sinica, 2008, 45(5): 915-924. DOI:10.3321/j.issn:0564-3929.2008.05.018 |
| [14] |
黄界颍.秸秆还田对铜陵矿区土壤Cd形态及有效性的影响机理[D].合肥: 合肥工业大学, 2013: 111-112. HANG Jie-ying. Impact mechanism of straws returning on cadmium speciation and bioavailability of soils in Tongling mining area[D]. Hefei: Hefei University of Technology, 2013: 111-112. |
| [15] |
丁琼, 杨俊兴, 华珞, 等. 不同钝化剂配施硫酸锌对石灰性土壤中Cd有效性的影响研究[J]. 农业环境科学学报, 2012, 31(2): 312-317. DING Qiong, YANG Jun-xing, HUA Luo, et al. Cadmium phytoavailability to cowpea decreased by rape straw and red mud with zinc sulphate in a calcareous soil[J]. Journal of Agro-Environment Science, 2012, 31(2): 312-317. |
| [16] |
辜小琴, 石军, 吴尚明, 等. 重金属Cd胁迫下秸秆还田对水稻光合特性的影响[J]. 西昌学院学报, 2017, 31(2): 1673-1675. GU Xiao-qin, SHI Jun, WU Shang-ming, et al. Effects of applying crop straw in soil on photosynthetic characteristics of rice under heavy metal stress[J]. Journal of Xichang University, 2017, 31(2): 1673-1675. |
| [17] |
王峰, 黄清辉, 肖宜华. 不同来源溶解有机质与Cd和锑的相互作用[J]. 中国环境科学, 2012, 32(5): 829-836. WANG Feng, HUANG Qing-hui, XIAO Yi-hua, et al. Interaction of cadmium and stibium with dissolved organic matter from different sources[J]. China Environmental Science, 2012, 32(5): 829-836. DOI:10.3969/j.issn.1000-6923.2012.05.009 |
| [18] |
中华人民共和国国家统计局. 中国统计年鉴(2013-2015)[M]. 北京: 中国统计出版社, 2014-2016. National Bureau of Statistics of China. China statistical year book (2013-2015)[M]. Beijing: China Statistic Press, 2014-2016. |
| [19] |
李财, 任明漪, 石丹, 等. 薄膜扩散梯度(DGT)——技术进展及展望[J]. 农业环境科学学报, 2018, 37(12): 2613-2628. LI Cai, REN Ming-yi, SHI Dan, et al. Diffusive gradient in thin films (DGT):Technological progress and prospects[J]. Journal of Agro-Environment Science, 2018, 37(12): 2613-2628. DOI:10.11654/jaes.2018-1403 |
| [20] |
史静, 潘根兴. 外加Cd对水稻Cd吸收、亚细胞分布及非蛋白巯基含量的影响[J]. 生态环境学报, 2015, 24(5): 853-859. SHI Jing, PAN Gen-xing. Effects of Cd-spiking treatment on Cd accumulation, subcellular distribution and content of nonprotein thiols in rice[J]. Ecology and Environmental Sciences, 2015, 24(5): 853-859. |
| [21] |
黄界颍, 伍震威, 徐晓春, 等. 秸秆还田对土壤Cd(Ⅱ)吸附-解吸的影响[J]. 水土保持通报, 2016, 36(2): 129-135. HUANG Jie-ying, WU Zhen-wei, XU Xiao-chun, et al. Effects of straw returning on adsorption-characteristics of Cd(Ⅱ)in soil[J]. Bulletin of Soil and Water Conservation, 2016, 36(2): 129-135. |
| [22] |
朱维, 刘代欢, 戴青云, 等. 秸秆还田对土壤-水稻系统中Cd迁移富集影响研究进展[J]. 中国农学通报, 2018, 34(30): 90-95. ZHU Wei, LIU Dai-huan, DAI Qing-yun, et al. Effect of returning straw on transfer and accumulation of Cd in soil-rice system:Research progress[J]. Chinese Agricultural Science Bulletin, 2018, 34(30): 90-95. DOI:10.11924/j.issn.1000-6850.casb17080032 |
| [23] |
段桂兰, 王芳, 岑况, 等. 秸秆还田对水稻Cd积累及其亚细胞分布的影响[J]. 环境科学, 2017, 38(9): 3927-3936. DUAN Gui-lan, WANG Fang, CEN Kuang, et al. Effects of straw incorporation on cadmium accumulation and subcellular distribution in rice[J]. Environmental Science, 2017, 38(9): 3927-3936. |
| [24] |
Mei J H, Lei Z H, Qiu Z Z, et al. Progresses of plants response to cadmium[J]. Acta Ecologica Sinica, 2001, 12(21): 2126-2130. |
| [25] |
王倩倩, 贾润语, 李虹呈, 等. Cd胁迫水培试验下水稻糙米Cd累积的关键生育时期[J]. 中国农业科学, 2018, 51(23): 33-42. WANG Qian-qian, JIA Run-yu, LI Hong-cheng, et al. Key growth stage of Cd accumulation in brown rice through a hydroponic experiment with Cd stress[J]. Scientia Agricultura Sinica, 2018, 51(23): 33-42. |
| [26] |
Krzeslowska M. The cell wall in plant cell response to trace metals:Polysaccharide remodeling and its role in defense strategy[J]. Acta Physiologiae Plantarum, 2011, 33(1): 35-51. |
| [27] |
王芳, 丁杉, 张春华, 等. 不同Cd耐性水稻非蛋白巯基及Cd的亚细胞和分子分布[J]. 农业环境科学学报, 2010, 29(4): 625-629. WANG Fang, DING Shan, ZHANG Chun-hua, et al. Non-protein thiols, subcellular and molecular distribution of cadmium in two rice cultivars with difference tolerance[J]. Journal of Agro-Environment Science, 2010, 29(4): 625-629. |
| [28] |
陈仕淼, 辛子兵, 陆覃昱, 等. Zn对水稻吸收转运Cd的影响[J]. 农业环境科学学报, 2019, 38(10): 2270-2277. CHEN Shi-miao, XIN Zi-bing, LU Qin-yu, et al. Effects of exogenous zinc on cadmium uptake and transport in rice[J]. Journal of Agro-Environment Science, 2019, 38(10): 2270-2277. DOI:10.11654/jaes.2019-0174 |
| [29] |
Rizwan M, Meunier J D, Davidian J C. Silicon alleviates Cd stress of wheat seedlings(Triticum turgidum L. cv. Claudio)grown in hydroponics[J]. Environmental Science and Pollution Research, 2016, 23(2): 1414-1427. DOI:10.1007/s11356-015-5351-4 |
| [30] |
Liu J G, Qu P, Zhang W, et al. Variations among rice cultivars in subcellular distribution of Cd:The relationship between translocation and grain accumulation[J]. Environmental and Experimental Botany, 2014, 107: 25-31. DOI:10.1016/j.envexpbot.2014.05.004 |
| [31] |
Cao Z Z, Qin M L, Lin X Y. Sulfur supply reduces cadmium uptake and translocation in rice grains(Oryza sativa L.)by enhancing iron plaque formation, cadmium chelation and vacuolar sequestration[J]. Environmental Pollution, 2018, 238: 76-84. DOI:10.1016/j.envpol.2018.02.083 |
| [32] |
Schmoger M E V, Oven M, Grill E. Detoxification of arsenic by phytochelatins in plants[J]. Plant Physiology, 2000, 122(3): 793-802. DOI:10.1104/pp.122.3.793 |
| [33] |
王玉云, Cd胁迫对不同水稻根系分泌有机酸和氨基酸及根系Cd含量的影响[D].雅安: 四川农业大学, 2011: 13-14. WANG Yu-yun. The influence of Cd stress on roots exudation organic acid and Amino acid and Cd content of the different rice[D]. Ya'an: Sichuan Agricultural University, 2011: 13-14. |
| [34] |
杨仁斌, 曾清如, 周细红. 植物根系分泌物对铅锌尾矿污染土壤中重金属的活化效应[J]. 农业环境保护, 2000, 19(3): 152-155. YANG Ren-bin, ZENG Qing-ru, ZHOU Xi-hong. The activated impact of plant root exudates on heavy metals in soils contaminated by tailing of lead-zinc ore[J]. Agro-environmental Protection, 2000, 19(3): 152-155. |
| [35] |
Olk D C. A chemical fractionation for structure-function relations of soil organic matter in nutrient cycling[J]. Soil Science Society of America Journal, 2006, 70(3): 1013. DOI:10.2136/sssaj2005.0108 |
| [36] |
Clemens S. Molecular mechanisms of plant metal tolerance and homeostasis[J]. Planta, 2001, 212(4): 475-486. DOI:10.1007/s004250000458 |
| [37] |
林涵.长期不同施肥对黑土酸度变化的影响[D].长春: 吉林农业大学, 2014. LIN Han. The influence of different fertilization system on soil acidification[D]. Changchun: Jilin Agricultural University, 2014. |
| [38] |
郑春荣, 孙兆海, 周东美, 等. 土壤Pb Cd污染的植物效应Ⅱ——Cd污染对水稻生长和Cd含量的影响[J]. 农业环境科学学报, 2004, 23(5): 872-876. ZHENG Chun-rong, SUN Zhao-hai, ZHOU Dong-mei, et al. Plant responses to soil lead and cadmium pollution Ⅱ:Effects of soil cadmium pollution on wetland rice growth and its uptake of cadmium[J]. Journal of Agro-Environment Science, 2004, 23(5): 872-876. DOI:10.3321/j.issn:1672-2043.2004.05.008 |
| [39] |
Tian Y, Wang X R, Luo J, et al. Evaluation of holistic approaches to predicting the concentrations of metals in field-cultivated rice[J]. Environmental Science & Technology, 2017, 42(20): 7649-7654. |
| [40] |
姚羽, 孙琴, 丁士明, 等. 基于薄膜扩散梯度技术的复合污染土壤Cd的有效性研究[J]. 农业环境科学学报, 2014, 33(7): 1279-1287. YAO Yu, SUN Qin, DING Shi-ming, et al. Diffusive gradients in thin films(DGT)technique for evaluation of cadmium bioavailability in heavy metal co-polluted soils[J]. Journal of Agro-Environment Science, 2014, 33(7): 1279-1287. |
 2020, Vol. 39
2020, Vol. 39