2. 中国科学院大学, 北京 100049;
3. 污染土壤生物-物化协同修复技术国家地方联合工程实验室, 沈阳 110016
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. National-Local Joint Engineering Laboratory of Contaminated Soil Remediation by Bio-physicochemical Synergistic Process, Shenyang 110016, China
电动力学修复有机污染土壤是近年来土壤修复研究的热点之一。在经历了单一电动修复、药剂辅助增强修复后,现已逐步发展到同微生物修复、植物修复等技术联合应用[1-3]。电动-微生物联合技术提高修复效率的成效显著,然而修复过程中电流衰减是该技术的主要限制性因素之一[4]。已有研究报道,电动装置内种植植物可有效维持系统内电流水平[5],这对于有机污染土壤修复效果的提高具有重要指导意义。
电动-微生物耦合植物修复技术提高土壤中有机污染物降解效率的可能机制:首先是电场和植物对微生物的影响,电动作用可作为土壤中电子受体、营养物质、外源功能菌的外源驱动力,提高污染物和土壤微生物间的传质效率,而且适度的电场强度有助于增加微生物的群落多样性[6];植物根际可为土壤微生物提供栖息地以及养分,并改善根区的好氧环境,促进根际微生物的繁殖以及对污染物的分解转化,进而提高修复效率[7]。其次是电场对植物的影响,对模拟及实际污染土壤开展电动-植物联合修复时发现,适当电场刺激下,植物生物量显著提高[8],植物根际的生理学性质及酶活性提高,随之依赖于植物根际微生物和酶活性的有机污染物降解过程将会加速[9]。
本研究以石油污染土壤为试验材料,施加直流电场,电场强度为1 V·cm-1。相关报道表明,在此电场强度作用下,微生物的生长繁殖能够得到促进,菌体数量较大,达到最大菌数所需要的时间较短[10-12]。在污染土壤中种植高羊茅,该植物生长周期短、根系发达且适应性强。已有研究证明其对石油类污染物表现出较好的耐受性[13],对高浓度(约3.5%)石油烃污染土壤具有良好的修复潜力[14]。向系统内添加石油降解菌,通过研究阴阳极切换电场作用下,植物生长60 d中电动-微生物系统耦合植物修复过程中的主要参数变化,为电动-微生物耦合植物修复技术在大规模场地应用中提供理论依据。
1 材料与方法 1.1 试验材料与试验设计供试土壤采自中国科学院沈阳应用生态研究所试验站周边农田表层土,将土壤晾干后除去植物残渣及其他非土壤成分,研磨后过2 mm网筛备用。将取自辽河油田的原油溶于三氯甲烷溶剂,与土壤混合均匀,控制土壤总石油烃含量在3%,每日搅拌2~3次,直到两周后土壤中三氯甲烷挥发完全,储存备用。测得土壤理化性质如表 1所示。
|
|
表 1 供试土壤理化性质 Table 1 The physicochemical properties of soil sample |
土壤中投加的微生物为本实验室前期筛选富集的12种高效石油降解菌。将12种菌悬液按菌量等比例混合,将混合菌悬液均匀喷洒至灭菌后的土壤中并混合均匀,保持土壤含水率在23%左右,土壤中菌体最终浓度为1.0×108 CFU·g-1。
试验所用高羊茅种子购自日出种业。将混入菌液的模拟污染土壤每份称取5.5 kg并分别放入PVC植物培养槽中(280 mm×190 mm×150 mm),每个槽中取出适量土壤备用,后用喷壶在培养槽土壤表面喷水至湿润,将高羊茅种子每盆8.0 g均匀撒播在培养槽内,之后均匀覆盖一层备用土。
实验设置4类处理:(1)添加微生物的电动处理组(EK+BIO);(2)种植高羊茅的电动处理组(EK+P);(3)添加微生物并种植高羊茅的处理组(P+BIO);(4)种植高羊茅并添加微生物的电动处理组(EK+P+ BIO)。每个处理3个平行,实验条件如表 2所示。实验装置如图 1所示,包括土壤室即植物培养槽(280 mm × 190 mm × 150 mm),4根圆柱形石墨电极(160 mm×10 mm),1个实时电流监测仪,1个直流电源和控制系统,供电电压为25 V,通电时间为早上5:00至晚上9:00。其中4根电极分别置于长方形的4个顶点位置。
|
|
表 2 实验设计 Table 2 Design of experiments |

|
图 1 实验装置示意图 Figure 1 Schematic diagram of experimental setup |
各处理每隔3 d浇一次水,每次约200 mL。定时测量各处理中植物的生长高度,记录并取平均值;修复进行60 d后结束实验,收集植物鲜样和土壤样品。收集植物的地上部分测量湿质量,再用去离子水冲洗干净,吸水纸吸干表面水分,105 ℃下杀青2 h,然后在60 ℃下烘干至恒质量,测定干物质质量。
植物的含水率=(湿质量-干质量)/湿质量×100%
1.3 测定方法 1.3.1 pH值和电导率称取5.00 g土样于离心管中,按土水比例1:5,加入25 mL去二氧化碳水振荡1 h,静置30 min。pH计经过pH 4.00(25 ℃)标准缓冲溶液及pH 6.86(25 ℃)标准缓冲溶液标定后,将探头浸入悬浊液直接测量样品pH值,待pH值稳定后,记录数据即可。
同上,静置30 min后,于4 500 r·min-1条件下离心5 min,随后将土壤电导率仪探针浸入上清液,直接测量读数并记录。
1.3.2 可培养细菌数量采用稀释平板法测定土壤中可培养菌数量[15]。取1.00 g新鲜土样,加入装有9 mL无机盐培养液的试管中,振荡30 min,取上清液1 mL,用无菌水进行梯度稀释后,取200 μL稀释后菌液涂平板,30 ℃条件下恒温培养24 h后计数。
1.3.3 土壤脱氢酶活性土壤脱氢酶活性分析采用氯化三苯基四氮唑(TTC)还原法[16],取4.00 g土壤鲜样于50 mL离心管中,分别加入0.5 mL的0.1 mol·L-1葡萄糖溶液,2 mL浓度为1%的Tris-HCl缓冲液,1.5 mL浓度为0.36%的Na2SO3溶液和2 mL蒸馏水,将离心管置于振荡器上180 r·min-1振荡培养5 min,在37 ℃条件下恒温振荡避光培养24 h。然后加入0.5 mL甲醛终止反应,最后加5 mL丙酮振荡10 min,再经过12 000 r·min-1离心5 min,收集上清液于485 nm波长下测定吸光值,根据标准曲线计算生成三苯基甲臜(TF)含量。
1.3.4 总石油烃含量将土样风干后过60目筛,称取4.00 g于50 mL离心管中,加入15 mL三氯甲烷,加盖,轻轻振摇1 min,超声萃取30 min,4 500 r·min-1离心2 min。在漏斗中塞入脱脂棉,上面放置5~6勺已烘干的无水硫酸钠(400 ℃,2~3 h),将上清液进行过滤脱水。沉淀物再用15 mL三氯甲烷以同样的方法浸提两次,合并浸提液。将浸提液通风浓缩至干,采用质量法测定总石油烃含量[17]。
总石油烃的降解率按照以下公式计算:
降解率=(C0-Ct)/C0×100%
式中:C0为污染物初始含量;Ct为降解后的污染物含量。
1.3.5 石油族组分分析饱和烃、芳香烃、胶质、沥青质分析参照岩石可溶性有机物和原油族组分柱层析分析方法[18]。
1.4 数据处理数据处理采用Microsoft Excel 2010软件,采用Origin 8.5软件进行绘图,采用SPSS 11.5统计分析软件对数据进行差异显著性检验。
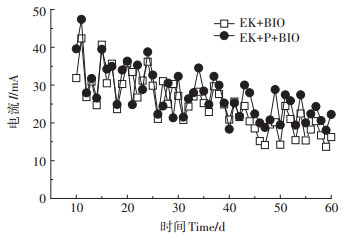
2 结果与讨论 2.1 电流变化电动-微生物修复石油污染土壤时,装置内种植高羊茅对电流变化的影响如图 2所示。开放式电动修复系统,电流数值升降和系统水分补给密切相关,设置3 d为一个周期,每个补水周期开始时,电流均急剧升高,随着系统内各种物理、化学及生物作用(电解、蒸发、生物消耗等)的进行,土壤含水量降低,电渗流减弱,电流逐渐降低,到下一个补水周期开始,电流又恢复到较高水平。图中EK+P+BIO和EK+BIO组电流变化总体趋势相似,电流呈现从高到低递减规律,50 d之后逐渐趋于平缓,实验末期即使继续补水,电流也不再大幅度增加。在整个修复过程中,EK+P+ BIO处理组电流始终比EK+BIO处理组高,修复末期EK+P+BIO处理组电流趋于平缓后的值约为25 mA,而EK+BIO处理组约为20 mA。这可能是由于高羊茅植株根系对土壤离子的附着作用,减缓了离子向阴阳两极迁移,维持了系统电流稳定[5],这一现象与土壤中电导率测定结果相一致。高羊茅对电流衰减趋势的延缓作用,维持了系统的电动力效应,使电动作用对微生物代谢活性形成持续刺激。因此,种植高羊茅强化了电动-微生物对污染土壤的修复过程。
|
图 2 修复过程中电流变化 Figure 2 Changes of current during electrokinetic remediation |
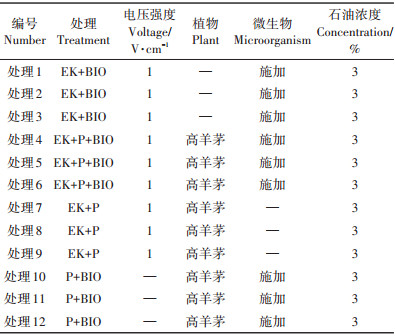
不同处理的pH值和电导率(EC)变化如表 3所示。土壤pH值是电动处理过程中的一个重要参数,pH值变化源于电极区的水解反应。表中所有处理组pH值均在6.99~7.44范围内,变化范围未超过一个单位幅度,处理间无显著差异,可见周期性电极切换阻止了土壤室两端极端pH值产生,这与Reddy等[19]的研究结果一致。施加电场的处理组观察到轻微的土壤酸化,主要是由于电动过程阳极反应产生的H+(2H2O→O2+4H++4e-)与阴极产生的OH-(2e-+2H2O→2OH-+H2)相比具有更快的迁移速率[20]。
|
|
表 3 不同处理时间土壤 pH值和 EC值 Table 3 Soil pH and EC values at different time |
土壤中种植高羊茅延缓了电动修复系统的电流衰减趋势,这也反应在土壤EC值的变化上。土壤EC值与土壤中带电粒子密切相关[21-22]。实验60 d后,施加电场处理的土壤EC值与初始时相比显著降低(P<0.05)。这是由于电动过程导致了土壤中可移动离子向两极聚集,以致非电极区土壤中可移动离子减少。各处理组初始时EC值无显著差异,60 d后,EK+BIO处理组土壤EC值显著低于种植高羊茅的各处理组(P<0.05),说明土壤中是否种植植物对修复后土壤的EC值影响较大,种植植物在一定程度上可以维持土壤EC值水平,这归因于植物根系对土壤中可移动离子的物理化学作用。土壤EC值降低影响土壤内传质过程,从而导致电动修复效率降低[23]。
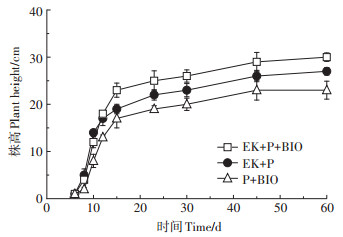
2.3 植物生长及生理特征株高是表现植物生长状况差异最直观的参数之一。不同处理条件下株高随时间变化情况如图 3所示,在0~15 d时间段内高羊茅生长速度较快,15 d后变慢,45 d后植物株高基本保持稳定。施加电场的EK+ P+BIO处理组和EK+P处理组的株高均高于未施加电场的P+BIO处理组。这说明电场对植物的生长发育有明显促进作用,这与已有的研究结果一致[8]。EK+P+ BIO处理组株高整体高于EK+P处理组,说明植物与微生物的协同效应对植株生长具有一定的促进作用。Leyval等[24]研究认为根际菌不仅能增加寄主植物对营养和水分的吸收,提高其抗逆性,而且还能提高土壤肥力。
|
图 3 不同处理条件下高羊茅株高变化 Figure 3 Variation of plant height of tall fescue under different treatment conditions |
修复60 d后各处理高羊茅植株生物量及含水率如图 4所示。施加电场的EK+P+BIO和EK+P处理组干质量基本相当,均高于P+BIO处理组。各处理组含水率无明显差异。整体来看,施加电场对修复植物的生物量有一定促进作用。Cang等[21]研究证实了低电压促进印度芥菜的生长和发育,继续增大电压后植株生物量产量下降。Bi等[25]评估了AC/DC电场对生物量产生的影响,研究得出AC电场促进油菜生物量增加,电场作用增大了间质液的离子通量,刺激了植物的代谢活动,对生物质生产形成有益影响,从而提高植物修复效率。
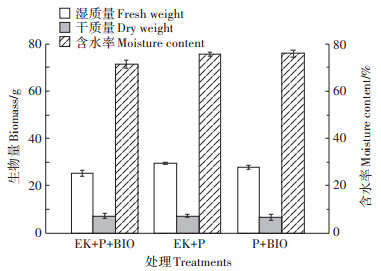
|
图 4 不同处理条件下高羊茅生物量和含水率变化 Figure 4 Variation of biomass and moisture content of tall fescue under different treatment conditions |
EK+BIO、EK+P+BIO和P+BIO处理土壤中可培养细菌数量随时间和空间变化如图 5所示。微生物初始投加量为1.0×108 CFU·g-1,随着修复时间延长,EK+BIO和EK+P+BIO处理中石油降解菌数量呈先增加后减少的趋势。修复15 d时,EK+BIO和EK+P+ BIO处理中可培养细菌数量与初始投加量相比,分别增加了17.78%和22.23%。修复30 d及60 d时,EK+ BIO和EK+P+BIO处理中可培养细菌数量显著减少。主要是在电动初期(15 d内),土壤环境未发生明显改变,且微生物繁殖所需的营养物质充足,电动作用加快了营养物质传输,增强了土壤内传质过程,同时电解作用使氧含量增加,刺激了微生物生长代谢,使微生物数量增加[26]。15~30 d以及30~60 d内微生物数量呈现减少趋势,表明后期外源菌数量不可避免地降低,同时电场作用导致土壤环境变化以及系统内有机质含量减少,这都会影响微生物的生长繁殖及活性。30 d后,EK+BIO处理组与EK+P+BIO处理微生物数量差距加大,归因于15~30 d期间成熟期高羊茅根系对土壤微生物起到维持作用,这与多数植物-微生物修复石油污染土壤的结论一致。可见,植物的根区环境为微生物提供营养物质、创造好氧环境,可促进根际微生物的代谢和繁殖。
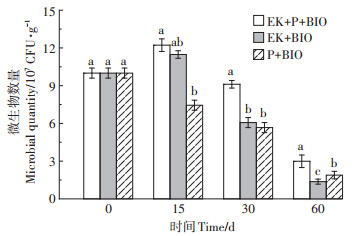
|
不同小写字母表示相同天数不同处理间差异显著(P<0.05) Different lowercase letters indicate significant differences in the same days between different treatments at P < 0.05 level 图 5 不同时间点土壤中可培养细菌数量变化 Figure 5 Quantity change of culturable bacteria in soil at different time points |
未施加电场的P+BIO处理组,土壤中可培养细菌数量一直处于递减状态,其中0~15 d减少了25.56%,15~30 d减少了19.78%,数量减少率降低5.78%,间接说明成熟高羊茅植株的根系环境对土壤中可培养细菌数量有一定的维持作用。处理15 d时,未施加电场的P+BIO处理组土壤中可培养细菌数量为7.44×107 CFU·g-1,施加电场的EK+P+BIO处理土壤中可培养细菌数量为1.22×108 CFU·g-1,是前者的1.64倍。30 d时,虽然各处理微生物数量有所下降,但EK+P+BIO处理组土壤中可培养菌数量仍是P+BIO处理组的1.67倍,施加电场后微生物数量与未施加电场相比有明显增长。因此,适当电场能够有效刺激微生物生长和繁殖,这与黄殿男[27]的研究结果一致,即使有植物存在情况下,微生物变化趋势也明显受到电场作用影响。
2.4.2 土壤脱氢酶活性酶活性是表征微生物活性的一个重要指标,酶活性大小可反映出微生物利用土壤中污染物底物的生化反应强度[28]。本研究选择脱氢酶作为评价土壤微生物活性的指标。实验过程中EK+BIO、EK+P+BIO和P+BIO处理的土壤脱氢酶活性变化如图 6所示。从整个修复周期看,EK+BIO和EK+P+BIO处理中脱氢酶活性均高于P+BIO处理组,这一结果与微生物数量随时间变化特征一致。电动作用中氧化还原条件、营养物质传输等变化是导致微生物活性增加的原因[29-30]。
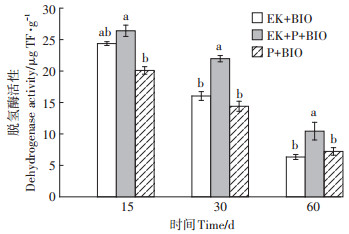
|
不同小写字母表示相同天数不同处理间差异显著(P<0.05) Different lowercase letters indicate significant differences in the same days between different treatments at P < 0.05 level 图 6 不同处理组土壤中脱氢酶活性变化 Figure 6 Changes of dehydrogenase and catalase activities in soil treated with different treatments |
修复15 d时,EK+P+BIO处理组土壤脱氢酶活性较初始值提高了23.36%,修复30 d时,土壤酶活性有所降低,但仍高于初始酶活性,可能是由于试验初期土壤中营养物质较丰富,土壤环境有利于微生物生长,使得前期土壤脱氢酶活性较高。随着营养物质的消耗,细菌数量和脱氢酶活性降低。通过对比EK+ BIO和EK+P+BIO处理组发现,修复15 d时,两者脱氢酶活性相差不大,修复30 d及60 d时两者差距增大,说明成熟期高羊茅植株对土壤微生物活性有一定的促进作用。另外,由于种植植物延缓了电流的下降趋势,后期土壤修复系统中存在的低密度电流在一定程度上也刺激了微生物活性。
2.5 不同处理条件下土壤修复效果各处理在不同时间点土壤中总石油烃含量如图 7所示,修复15 d时,添加微生物处理组EK+P+BIO、EK+BIO和P+BIO的石油烃降解率高于未添加微生物的EK+P处理组,因为在此阶段微生物活性较高,降解作用明显。同时,EK+P+BIO和EK+BIO处理的修复效果在15 d时优于P+BIO组,这是由于电场作用提高了微生物活性,这与15 d时脱氢酶活性的实验结果一致。修复15~30 d内,种植植物的处理组EK+P+ BIO、EK+P和P+BIO总石油烃的去除量明显高于其在0~15 d内的去除量。30~60 d内EK+P+BIO、EK+P和EK+BIO对总石油烃的去除量有所下降,可能是由30~60 d内微生物数量减少,以及电动作用使营养盐在两极富集,微生物可利用养分减少所导致。
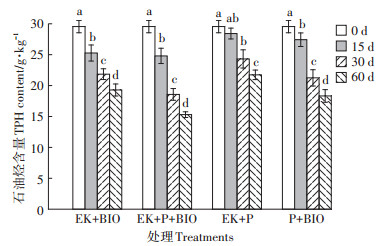
|
不同小写字母表示相同处理不同天数间差异显著(P<0.05) Different lowercase letters indicate significant differences in the same treatment between different days at P < 0.05 level 图 7 不同时间点土壤中总石油烃浓度 Figure 7 Concentration of total petroleum hydrocarbons in soil at different time points |
经过60 d修复,EK+P+BIO处理组的总石油烃降解效果最好,降解率达到48.21%;EK+BIO处理组石油降解情况比较平稳,达到34.73%;P+BIO处理组降解率为41.37%,修复效果优于EK+BIO处理组;EK+P处理组降解率最低,为26.44%,EK+P+BIO处理组的降解率是其1.82倍。Fan等[31]研究表明耦合电动和微生物修复技术通过电场来提高微生物修复效率,实现了微生物与电场的协同修复效应,与单独使用生物和电场相比可增强微生物活性。Anderson等[32]认为植物以多种方式帮助微生物转化,根际在生物降解中起着非常重要的作用。根际可以加速脂肪烃类、多环芳烃类的降解。植物根系微生物密度会增大,多环芳烃的降解也增加。植物为微生物提供生存场所并可转移氧气,使根区的好氧转化作用能够正常进行,这也是植物促进根区微生物矿化作用的机制之一。另外,植物对电流的维持作用在一定程度上也刺激了系统内微生物活性,从而提高了总石油烃去除率。
对EK+P+BIO处理组修复前后的石油族组分含量进行分析,由图 8可看出,EK+P+BIO组实验前后石油组分发生了明显变化,其中烷烃和芳烃都有较高的去除率,与初始含量相比,饱和烃和芳香烃去除率分别为47.96%和75.14%。胶质和沥青质变化不大,去除率分别为17.45%和15.77%。其中,烷烃的去除量高达7.12 g·kg-1,芳烃去除量为5.67 g·kg-1,这是由于烷烃在降解过程中所需能量较低,生物毒性较小[33];此外,在电场作用下,烷烃β-氧化过程得以加速[34]。已有研究表明,在石油烃降解中,微生物倾向于优先选择烷烃成分降解[35-36]。相应地,胶质和沥青质物质由于较高的稳定性和疏水性,使其在土壤环境中去除率一般较低[18],即使是外加电场等强化措施存在,提高这种重组分物质的去除率也相对较难。
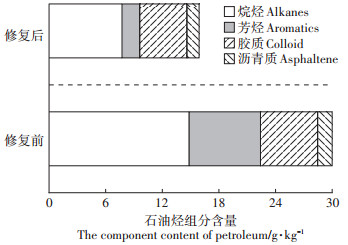
|
图 8 EK+P+BIO组修复前后石油族组分含量变化 Figure 8 Changes of petroleum group component content by EK+ P+BIO treatment |
(1)电动-微生物修复装置内种植高羊茅可有效延缓电流的衰减趋势;成熟期高羊茅植株对系统内微生物的数量及活性有一定的维持作用。电动作用可以有效地刺激微生物的生长和繁殖,并提高微生物的代谢活性。
(2)EK + P + BIO处理组总石油烃降解率高达48.21%,显著高于其他处理。其中饱和烃和芳香烃的去除率分别达到47.96%和75.14%,而胶质和沥青质的去除率相对较低。修复初期微生物数量丰富,活性较高,降解作用明显;修复中期植物对修复效果的贡献加大,可能原因是植物根际改善了土壤环境,为微生物降解提供了有利条件。
| [1] |
Saiche K, Richardi E, Reddy Y, et al. Electrokinetically enhanced remediation of hydrophobic organic compounds in soils:A review[J]. Critical Reviews in Environmental Science & Technology, 2005, 35(2): 115-192. |
| [2] |
Mohan S V, Chandrasekhar K. Self-induced bio-potential and graphite electron accepting conditions enhances petroleum sludge degradation in bio-electrochemical system with simultaneous power generation[J]. Bioresource Technology, 2011, 102(20): 9532-9541. |
| [3] |
方一丰, 郑余阳, 唐娜, 等. EDTA强化电动修复土壤铅污染[J]. 农业环境科学学报, 2008, 27(2): 612-616. FANG Yi-feng, ZHENG Yu-yang, TANG Na, et al. EDTA enhanced electroremediation of lead-contaminated soil[J]. Journal of Agro-Environment Science, 2008, 27(2): 612-616. |
| [4] |
Cheng F L, Guo S H, Li G, et al. The loss of mobile ions and the aggregation of soil colloid:Results of the electrokinetic effect and the cause of process termination[J]. Electrochimica Acta, 2017, 258: 1016-1024. |
| [5] |
Chirakkara R A, Reddy K R, Cameselle C. Electrokinetic amendment in phytoremediation of mixed contaminated soil[J]. Electrochimica Acta, 2015, 181: 179-191. |
| [6] |
沈根祥, 罗启仕, 周海花, 等. 直流电场对根际土壤微生物群落的影响及其机理[J]. 农业环境科学学报, 2008, 27(2): 50-55. SHEN Gen-xiang, LUO Qi-shi, ZHOU Hai-hua, et al. Effects and mechanisms of direct current fields on rhizospheric soil microbial communities[J]. Journal of Agro-Environment Science, 2008, 27(2): 50-55. |
| [7] |
刘鹏, 李大平, 王晓梅, 等. 石油污染土壤的生物修复技术研究[J]. 化工环保, 2006, 26(2): 91-94. LIU Peng, LI Da-ping, WANG Xiao-mei, et al. Study on in-situ bioremediation process of oil-contaminated soil[J]. Environmental Protection of Chemical Industry, 2006, 26(2): 91-94. |
| [8] |
聂斌.外加直流电场对植物吸收镉的影响研究[D].重庆: 重庆大学, 2015. NIE Bin. The study of influence of direct current electrical fields on phytoremediation of Cd[D]. Chongqing: Chongqing University, 2015. |
| [9] |
程国玲, 李培军. 石油污染土壤的植物与微生物修复技术[J]. 环境工程学报, 2007, 1(6): 91-96. CHENG Guo-ling, LI Pei-jun. Phytoremediation and microbial remediation of petroleum contaminated soil[J]. Chinese Journal of Environmental Engineering, 2007, 1(6): 91-96. |
| [10] |
Li T T, Guo S H, Wu B, et al. Effect of polarity-reversal and electrical intensity on the oil removal from soil[J]. Journal of Chemical Technology & Biotechnology, 2015, 90(3): 441-448. |
| [11] |
刘广容, 叶春松, 钱勤, 等. 电动生物修复底泥中电场对微生物活性的影响[J]. 武汉大学学报(理学版), 2011, 57(1): 47-51. LIU Guang-rong, YE Chun-song, QIAN Qin, et al. Effects of electrokinetic bioremediation of electric field on sediment microbial activity[J]. Journal of Wuhan University(Natural Science Edition), 2011, 57(1): 47-51. |
| [12] |
朱欣洁, 孙先锋, 杨波波. 电场作用对微生物降解石油污染土壤的影响研究[J]. 山东化工, 2015, 44(11): 160-162. ZHU Xin-jie, SUN Xian-feng, YANG Bo-bo. The effect of electric field to the microbial degradation of petroleum pollution soil research[J]. Shandong Chemical Industry, 2015, 44(11): 160-162. |
| [13] |
Huang X D, El-Alawi Y, Gurska J, et al. A multi-process phytoremediation system for decontamination of persistent total petroleum hydrocarbons(TPHs)from soils[J]. Microchemical Journal, 2005, 81(1): 139-147. |
| [14] |
Zand A D, Bidhendigr N, Mehrdadi N. Phytoremediation of total petroleum hydrocarbons(TPHs) using plant species in Iran[J]. Turkish Journal of Agriculture and Forestry, 2010, 34(5): 429-438. |
| [15] |
范瑞娟, 郭书海, 李凤梅, 等. 混合烃污染土壤微生物-电动修复中的互补性研究[J]. 农业环境科学学报, 2018, 37(1): 64-71. FAN Rui-juan, GUO Shu-hai, LI Feng-mei, et al. Complementarity of bio-electrokinetics in the remediation of soil contaminated with multiple hydrocarbons[J]. Journal of Agro-Environment Science, 2018, 37(1): 64-71. |
| [16] |
Casida L E J, Klein D A, Santoro T. Soil dehydrogenase activity[J]. Soil Science, 1964, 98(6): 371-376. |
| [17] |
Capelli S M, Busalmen J P, de Sánchez S R. Hydrocarbon bioremediation of a mineral-base contaminated waste from crude oil extraction by indigenous bacteria[J]. International Biodeterioration & Biodegradation, 2001, 47(4): 233-238. |
| [18] |
范瑞娟.石油污染土壤电动: 生物修复过程中的耦合效应[D].北京: 中国科学院大学, 2014. FAN Rui-juan. Coupling effect of bio-electrokinetics in the remediation of petroleum contaminated soil[D]. Beijing: University of Chinese Academy of Sciences, 2014. |
| [19] |
Reddy K R, Cameselle C. Electrochemical remediation technologies for polluted soils, sediments and groundwater[M]. USA: Wiley, Hoboken, NY, 2009: 195-217.
|
| [20] |
O'Connor C S, Lepp N W, Edwards R, et al. The combined use of electrokinetic remediation and phytoremediation to decontaminate metal polluted soils:A laboratory-scale feasibility study[J]. Environmental Monitoring and Assessment, 2003, 84: 141-158. |
| [21] |
Cang L, Wang Q Y, Zhou D M, et al. Effects of electrokinetic-assisted phytoremediation of a multiple-metal contaminated soil on soil metal bioavailability and uptake by Indian mustard[J]. Separation and Purification Technology, 2011, 79(2): 246-253. |
| [22] |
Virkutyte J, Sillanpää M, Latostenmaa P. Electrokinetic soil remediation-critical overview[J]. Science of the Total Environment, 2002, 289(1/2/3): 97-121. |
| [23] |
程凤莲.土壤电动修复过程中离子与微生物的迁移和分布[D].北京: 中国科学院大学, 2018. CHENG Feng-lian. Migration and distribution of ions and microorganisms during soil electrokinetic remediation[D]. Beijing: University of Chinese Academy of Sciences, 2018. |
| [24] |
Leyval C, Binet P. Effect of polyaromatic hydrocarbons in soil on Arbuscular Mycorrhizal plants[J]. Journal of Environmental Quality, 1998, 27(2): 402-407. |
| [25] |
Bi R, Schlaak M, Siefert E, et al. Influence of electrical fields(AC and DC)on phytoremediation of metal polluted soils with rapeseed(Brassica napus)and tobacco(Nicotiana tabacum)[J]. Chemosphere, 2011, 83(3): 318-326. |
| [26] |
李婷婷, 张玲妍, 郭书海, 等. 完全对称电场对电动微生物修复石油污染土壤的影响[J]. 环境科学研究, 2010, 23(10): 1263-1267. LI Ting-ting, ZHANG Ling-yan, GUO Shu-hai, et al. Effects of completely symmetrical electric field on electro-bioremediation of oil contaminated soil[J]. Research of Environmental Sciences, 2010, 23(10): 1263-1267. |
| [27] |
黄殿男.电动作用对多环芳烃污染土壤生物修复的强化效应[D].北京: 中国科学院大学, 2012. HUANG Dian-nan. Enhanced effect of electrokinetic on the bioremediation of polycyclic aromatic hydrocarbons in soils[D]. Beijing: University of Chinese Academy of Sciences, 2012. |
| [28] |
Garcia C, Hernandez T, Costa F. Potential use of dehydrogenase activity as an index of microbial activity in degraded soils[J]. Communications in Soil Science and Plant Analysis, 1997, 28(1/2): 123-134. |
| [29] |
She P, Song B, Xing X H, et al. Electrolytic stimulation of bacteria Enterobacter dissolvens by a direct current[J]. Biochemical EngineeringJournal, 2006, 28(1): 23-29. |
| [30] |
Luo Q S, Zhang X H, Wang H, et al. Mobilization of phenol and dichlorophenol in unsaturated soils by non-uniformm electrokinetics[J]. Chemosphere, 2005, 59(9): 1289-1298. |
| [31] |
Fan R J, Guo S H, Li T T, et al. Contributions of electrokinetics and bioremediation in the treatment of different petroleum components[J]. CLEAN-Soil, Air, Water, 2015, 43(2): 251-259. |
| [32] |
Anderson T A, Guthrie E A, Walton B T. Bioremediation in the rhizophere, plant roots and associated microbes clean contaminated soil[J]. Environmental Science & Technology, 1993, 27: 2630-2636. |
| [33] |
Chandrasekhar K, Mohan S V. Bio-electrochemical remediation of real field petroleum sludge as an electron donor with simultaneous power generation facilitates biotransformation of PAH:Effect of substrate concentration[J]. Bioresource Technology, 2012, 110: 517-525. |
| [34] |
Yuan Y, Guo S H, Li F M, et al. Effect of an electric field on n-hexadecane microbial degradation in contaminated soil[J]. International Biodeterioration & Biodegradation, 2013, 77: 78-84. |
| [35] |
Zhang Z Z, Hou Z W, Yang C Y, et al. Degradation of n-alkanes and polycyclic aromatic hydrocarbons in petroleum by a newly isolated Pseudomonas aeruginosa DQ8[J]. Bioresource Technology, 2011, 102(5): 4111-4116. |
| [36] |
Das K, Mukherjee A K. Crude petroleum-oil biodegradation efficiency of Bacillus subtilis and Pseudomonas aeruginosa strains isolated from a petroleum-oil contaminated soil from north-east India[J]. Bioresource Technology, 2007, 98(7): 1339-1345. |
 2020, Vol. 39
2020, Vol. 39