随着工农业生产的持续发展,越来越多的化学品被释放到环境中。许多研究表明,一些化学品在环境中很难被降解,并可通过食物链在动物和人体组织中累积,引起内分泌干扰效应[1-3]。辛基酚(4-tert-octyl- phenol,4-t-OP)是辛基酚聚氧乙烯醚的降解产物,也是重要的精细化工生产原料,广泛用于生产非离子表面活性剂、石油添加剂、农药、涂料、增塑剂、除锈剂、润滑油抗氧剂等[4-5]。因4-t-OP在生产生活中的广泛使用,水体、土壤和空气介质中都有一定浓度4-t-OP的累积,且其在自然环境中很难降解[6-7]。4-t-OP是一种亲脂性化合物,可快速被生物体吸收并在脂肪组织中累积[8]。因结构类似于雌激素,4-t-OP已被确认为环境内分泌干扰物,显示类雌激素效应[9-10]。
国内外已有4-t-OP影响水生和陆生动物生长发育的毒性效应报道[10-13]。昆虫是动物中物种数量最多、分布最广泛、且对环境变化反应敏感的无脊椎节肢动物。其中鳞翅目昆虫多与农业经济密切相关,研究环境内分泌干扰物对鳞翅目昆虫的影响有十分重要的理论和实践意义。据所查国内外文献,至今未见4-t-OP对昆虫影响的研究报道。家蚕(Bombyx mori L.)是国际无脊椎动物协会确认的模式昆虫,是理想的毒理学、细胞生物学、疾病模型替代动物研究材料之一[14-15]。为此,本文以鳞翅目模式昆虫家蚕为试验对象,研究了4-t-OP对家蚕生长发育的影响,旨在为探讨酚类环境内分泌干扰物对鳞翅目昆虫生长发育的干扰机制研究提供基础资料,同时为昆虫等无脊椎动物生态环境的保护与治理提供依据。
1 材料与方法 1.1 材料实验昆虫为人工饲料摄食性很好的家蚕皓月品种,具有遗传和发育的高度一致性。原种由江苏省蚕种公司提供。4-t-OP(纯度99%)购自Sigma-Aldrich公司。分析纯无水乙醇购自上海生工生物工程有限公司。纯桑叶粉人工饲料购自山东蚕业研究所。
1.2 药物添加方法用无水乙醇配制20 g·L-1的4-t-OP母液,取适量4-t-OP母液与饲料干粉梯级混合法混合,加水充分拌匀,装入保鲜袋后放进饭盒内高温灭菌(120 ℃,20 min),低温冷藏(4 ℃)。根据预试验结果,实验设4-tOP浓度为0(对照)、0.01、0.02、0.04 g·kg-1和0.08 g· kg-1 5个处理,各处理均设3次重复,每次重复饲养50头蚕。
1.3 昆虫饲养蚕卵在22~25 ℃,相对湿度(Relative humidity,RH)75%~85%,24 h光照条件下保护至孵化。家蚕幼虫生长发育经过4眠5个龄期,由卵刚孵化出的幼虫形状似蚂蚁,称蚁蚕。蚁蚕添食后称1龄蚕,第1眠后称2龄蚕,第2眠后称3龄蚕,第3眠后称4龄蚕,第4眠后称5龄蚕,每眠1次蜕皮1次。蚕卵孵化后,置于人工气候培养箱内饲养。家蚕幼虫饲养方法为:1~3龄,27 ℃、RH 80%~85%;4~5龄,25 ℃、RH 75%~ 80%。家蚕全龄(1~5龄)使用实验要求的含一定浓度的4-t-OP人工饲料添食,1龄每3日添食1次,2~4龄每2日添食1次,5龄每日1次更换人工饲料。每次起蚕后4 h左右饷食。逐条蚕适熟上簇(开始吐丝结茧),25 ℃、RH 75%~80%条件下纸盒内单独结茧,保护至成虫羽化。
1.4 生长发育调查收蚁后,调查家蚕24 h疏毛率(刚毛舒展蚕的百分率)、48 h转色率(体色转变个体的百分率)、家蚕发育速度(幼虫期和蛹期发育经过时间)、体质量变化(1~4龄眠蚕和5龄期家蚕1~7日)和蛹期茧层质量。24 h疏毛率和48 h转色率调查每处理3×50头。体质量调查中为了避免家蚕进食的影响,调查各龄(1~4龄)见起时(出现蜕皮蚕)的10头眠蚕体质量。为了解最大生长量变化,分别调查5龄雌雄家蚕每日体质量(各10头)。在上簇后第8 d,调查各处理组蚕茧的全茧量和茧层量,并计算茧层率。
1.5 生命力调查家蚕生命力调查以3龄起蚕绝食生命时数、4龄起蚕结茧率、蚕茧的死笼率(生命力相关的死亡率)和羽化率表示。在25 ℃、RH 75%~80%下每个处理取3×10头3龄起蚕放入消毒培养皿中,逐头记录家蚕饥饿死亡时间,作为3龄起蚕绝食生命时数。每个处理取3×30头4龄起蚕,统计结茧蚕数,计算4龄起蚕结茧率;开始结茧后第8 d,所结蚕茧全部剖开,统计良蛹数量,计算死笼率。羽化率指家蚕正常变态为成虫的蚕蛹占调查蚕蛹数的百分率。
1.6 数据处理数据分析采用SPSS 19.0软件和Excel 2010。
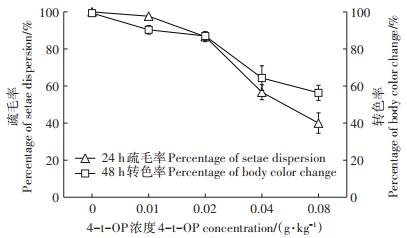
2 结果与讨论 2.1 4-t-OP对家蚕生长发育的影响 2.1.1 4-t-OP对蚁蚕疏毛率和转色率的影响家蚕蚁蚕(1龄幼虫)体表生有较多瘤状突起,其上着生刚毛,开始取食后体表刚毛随着体壁的伸展在表皮散开,呈疏毛症状,不同时间刚毛舒展的程度不同,蚕体色也趋淡,此时通称“疏毛期”[16]。给蚁蚕添食4-t-OP 24 h后调查疏毛率,48 h后调查转色率(图 1)。4-t-OP添食处理对蚁蚕的疏毛率和转色率有浓度效应,0.01 g·kg-1 4-t-OP添食处理,蚁蚕24 h疏毛率和48 h转色率与对照组相比无显著差异(P>0.05);0.02~0.08 g·kg-1 4-t-OP添食组蚁蚕24 h疏毛率和48 h转色率与对照组相比差异显著(P < 0.05),其中0.08 g·kg-1 4-t-OP添食组蚁蚕24 h疏毛率和48 h转色率分别较对照组下降了60.0%和43.3%。
|
图 1 4-t-OP对家蚕1龄幼虫疏毛率和转色率的影响 Figure 1 Effects of 4-t-OP on percentage of setae dispersion and body color change in 1st instar larvae |
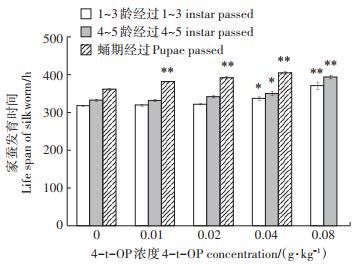
由图 2可见,0.01~0.02 g·kg-1 4-t-OP添食组家蚕幼虫发育经过时间与对照组相比无显著差异(P>0.05),但蛹期发育经过时间比对照组显著延长(P < 0.01);而0.04 g·kg-1 4-t-OP添食组家蚕幼虫发育经过时间和蛹期发育经过时间都比对照组显著延长(P < 0.05和P < 0.01)。0.08 g·kg-1 4-t-OP添食组家蚕的幼虫期与对照组相比有显著差异(P < 0.01),幼虫期整段发育时间比对照组延长了17.7%。0.08 g·kg-1 4-t-OP添食组蚕体质虚弱,蚕体大小出现明显开差,开始吐丝后第8日仍然未化蛹,最后全部成为死笼或不结茧蚕,无法完成整个世代。
|
*P < 0.05;**P < 0.01 图 2 4-t-OP对家蚕生长发育速度的影响 Figure 2 Effects of 4-t-OP on the growth and development velocity of silkworm, Bombyx mori |
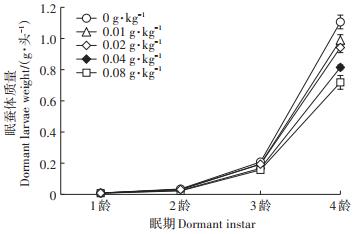
图 3为不同浓度4-t-OP处理家蚕幼虫1~4龄眠蚕体质量的变化。0.01 g·kg-1 4-t-OP添食组1~4龄幼虫眠蚕的体质量与对照组相比无显著差异(P>0.05);0.02 g·kg-1 4-t-OP添食组1~3龄幼虫眠蚕的体质量与对照组相比无显著差异(P>0.05),4龄眠蚕的体质量与对照组相比差异显著(P < 0.05);0.04 g·kg-1 4-t-OP添食组1龄幼虫眠蚕的体质量与对照组相比无显著差异(P>0.05),2~4龄眠蚕的体质量与对照组相比差异显著(P < 0.05或P < 0.01);0.08 g·kg-1 4-t-OP添食组1~4龄幼虫眠蚕的体质量都较对照组体质量低,与对照组相比差异显著(P < 0.05或P < 0.01),0.08 g·kg-1 4-t-OP添食组家蚕至4龄时眠蚕体质量只有对照组的61.6%。从入眠速度看,0.01~0.08 g·kg-1 4-t-OP添食组家蚕从1龄开始家蚕见眠时间都较对照组延长,而且组内个体入眠时间开差大、发育不齐。说明4-t-OP对家蚕稚蚕的生长发育影响相对较小,但至大蚕期4-t-OP的抑制作用逐步显现,并且有浓度效应,4-t-OP添食会影响家蚕的发育整齐度和发育速度,进而影响家蚕个体体质量。
|
图 3 4-t-OP对1~4龄家蚕幼虫眠蚕体质量的影响 Figure 3 Effects of 4-t-OP on the weight of dormant silkworm in the 1st to 4th instar larvae |
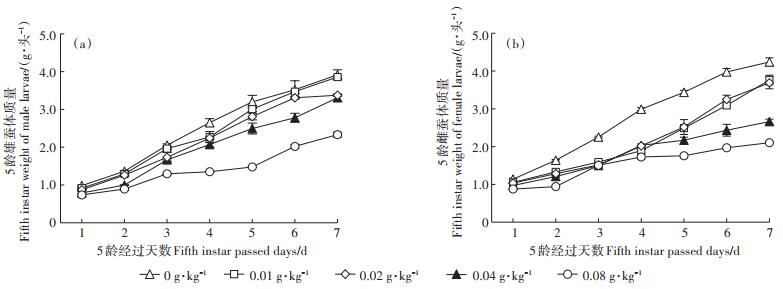
为研究4-t-OP对家蚕最大生长量的影响,进一步调查了5龄期家蚕每日体质量的变化(图 4)。家蚕幼虫期一直添食4-t-OP,0.01~0.08 g·kg-1 4-t-OP添食组5龄雄性和雌性家蚕体质量都分别比对照组雄雌家蚕体质量下降,且4-t-OP对5龄家蚕幼虫体质量增加的抑制作用浓度效应明显。0.01~0.04 g·kg-1 4-t-OP添食组家蚕5龄第1 d雌蚕体质量与对照组雌蚕体质量相比有所降低,但都没有显著差异(P>0.05),0.08 g·kg-1 4-t-OP添食组5龄第1 d雌蚕体质量与对照组雌蚕体质量相比显著降低(P < 0.05);0.01~0.08 g·kg-1 4-t-OP添食组家蚕5龄第2~7 d雌蚕体质量与对照组雌蚕体质量相比都显著降低(P < 0.05或P < 0.01)(图 4b)。0.04~0.08 g·kg-1 4-t-OP添食组家蚕5龄第1~7 d雄蚕体质量与对照组雄蚕体质量相比都显著降低(P < 0.01)(图 4a)。0.08 g·kg-1 4-t-OP添食组5龄雄蚕第7 d体质量比对照组雄蚕体质量降低44.1%,5龄雌蚕第7 d体质量比对照组雌蚕体质量降低52.2%。由图 4可见,4-t-OP添食组雄蚕5龄后期体质量停止增长的时间比对照组雄蚕早,5龄雌蚕也有类似结果,4-t-OP添食组家蚕幼虫比对照组家蚕成熟早。
|
图 4 4-t-OP对5龄家蚕体质量的影响 Figure 4 Effects of 4-t-OP on the weight of silkworm in the fifth instar larvae |
4-t-OP对家蚕幼虫群体发育整齐度和体质量增长的影响在低龄期(1~3龄)不明显,至大蚕期(4~5龄)影响加重,表明4-t-OP在家蚕体内可能有累积作用,对家蚕生长发育的影响具有浓度-时间效应。这同袁红霞等[17]报道的环境激素壬基酚对家蚕生长发育毒性具有浓度-时间效应,钟儒杰等[18]报道的环境激素邻苯二甲酸丁基苄酯对家蚕具有明显的毒害作用,可显著抑制家蚕的体质量和存活率,在蚕体内具有累积效应等结果类似。以上也说明环境内分泌干扰物对家蚕的生长发育毒性可能存在相似性。同时Yuan等[19-20]研究表明壬基酚对家蚕的毒性与家蚕抗氧化保护酶活性和蜕皮激素受体基因表达有关, 壬基酚对家蚕生殖发育具有毒性,但4-t-OP是否也与上述壬基酚一样能影响家蚕酶活性等还有待进一步研究证实。
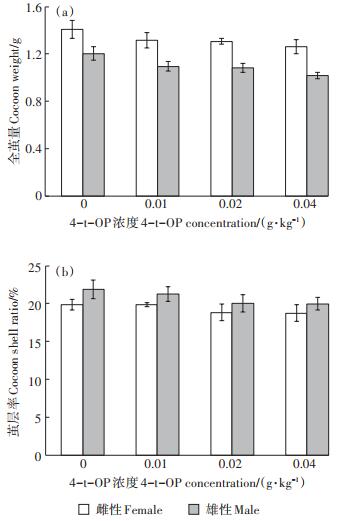
2.1.4 4-t-OP对家蚕全茧量和茧层率的影响在家蚕上蔟后第8 d,分别调查雌蚕与雄蚕全茧量和茧层率(图 5)。0.01~0.04 g·kg-1 4-t-OP添食组雌蚕与雄蚕全茧量均比对照组蚕全茧量低,4-t-OP添食组雌蚕全茧量与对照组雌蚕全茧量相比差异不显著,而0.04 g·kg-1 4-t-OP添食组雄蚕全茧量较对照组雄蚕全茧量显著降低(P < 0.05)(图 5a)。4-t-OP对家蚕全茧量这一重要经济性状的影响主要表现为降低了雄蚕全茧量。0.01~0.04 g·kg-1 4-t-OP添食组雌蚕与雄蚕茧层率均低于对照组,但差异不显著(P>0.05),雄蚕茧层率高于雌蚕茧层率(图 5b)。0.08 g· kg-1 4-t-OP添食组家蚕幼虫期全部不能结茧。
|
图 5 4-t-OP对家蚕全茧量和茧层率的影响 Figure 5 Effects of 4-t-OP on the cocoon weight and the cocoon shell ratio of silkworm, Bombyx mori |
吐丝结茧是家蚕的本能之一,1~5龄期家蚕丝腺细胞会随着蚕体发育和器官快速生长而一起生长。幼虫期摄食4-t-OP的家蚕,随着生长发育被抑制,其吐丝结茧生理功能也受到影响,4-t-OP一定程度阻碍了丝物质的形成和分泌。内分泌的异常容易产生不结茧蚕,在4龄摘除咽侧体,20~30 h后再移植咽侧体,可造成丝腺退化;5龄期用保幼激素添食,由于用量和添食时期不适当,生理功能发生紊乱会造成不结茧蚕[16]。0.08 g·kg-1 4-t-OP添食组家蚕幼虫期全部不能结茧,表明4-t-OP对家蚕正常的吐丝结茧生理功能和行为有毒害作用,因此推测4-t-OP作为一种具有类雌激素效应的内分泌干扰物质,通过干扰家蚕的内分泌,影响生理功能,使其生长发育速度减慢和蚕茧产量下降,严重时不能吐丝结茧并死亡。
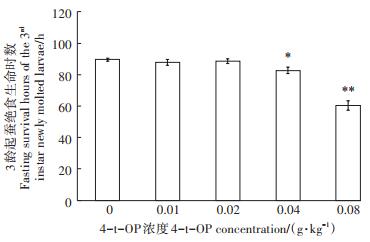
2.2 4-t-OP对家蚕生命力的影响 2.2.1 4-t-OP对家蚕3龄起蚕绝食生命时数的影响食下高浓度4-t-OP会严重削弱1~2龄稚蚕的体质,家蚕幼虫的生命力下降。随着4-t-OP添食浓度的增加,家蚕3龄起蚕绝食生命时数呈现下降趋势,0.04~0.08 g·kg-1 4-t-OP添食组家蚕3龄起蚕绝食生命时数与对照组相比都显著降低(P < 0.05或P < 0.01)。其中0.08 g·kg-1 4-t-OP添食组3龄起蚕绝食生命时数只有对照组的32.5%(图 6)。
|
图 6 4-t-OP对家蚕3龄起蚕绝食生命时数的影响 Figure 6 Effects of 4-t-OP on the fasting survival hours of the newly molted 3rd instar larvae |
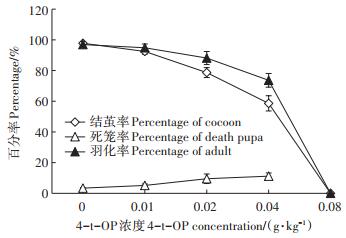
4-t-OP对家蚕4龄起蚕结茧率、死笼率和羽化率有浓度效应(图 7)。0.01 g·kg-1 4-t-OP添食组4龄起蚕结茧率与对照组相比无显著差异(P>0.05),但0.02~0.08 g·kg-1 4-t-OP添食组4龄起蚕结茧率都比对照组极显著降低(P < 0.01),其中0.08 g·kg-1 4-t-OP添食组家蚕幼虫期全部不能结茧。表明0.02 g·kg-1以上浓度4-t-OP对家蚕幼虫吐丝结茧功能有严重不良影响。家蚕4龄起蚕死笼率随4-t-OP处理浓度增加而增加,羽化率随4-t-OP处理浓度增加而降低。表明家蚕整个幼虫期饲料中添加4-t-OP在蚕体内有累积效应,对家蚕蜕皮、结茧、化蛹和羽化等变态发育影响有时间和浓度效应。4-t-OP对家蚕发育的影响在化蛹和羽化的发育变态期更加明显,浓度效应比幼虫期更加明显,这进一步提示4-t-OP对家蚕生长发育的影响具有时间效应,其在家蚕体内可能有累积作用。
|
图 7 4-t-OP对家蚕4龄起蚕结茧率、死笼率和羽化率的影响 Figure 7 Effects of 4-t-OP on the percentage of cocoon, death pupa and adult of the 4th newly molted larvae |
4-t-OP是一种具有类雌激素效应的内分泌干扰物质,在高等动物中与雌激素受体具有一定的亲和力,通过干扰内分泌活动影响动物的生长发育[21]。家蚕的变态发育是形态和生理的转变过程,由脑、前胸腺及咽侧体等内分泌器官所分泌的激素来调控。体内保幼激素(Juvenile hormone,JH)和蜕皮激素(Molt- ing hormone,MH)的有无或高低直接调控了家蚕的生长发育[16]。家蚕结茧后化蛹和羽化困难,死笼率显著升高,羽化率明显下降,4-t-OP是否也通过干扰JH和MH或相关的激素受体合成而影响家蚕由幼虫通过蛹期发育为成虫的变态发育过程仍有待进一步深入研究。
3 结论(1)家蚕幼虫期添食0.01~0.08 g·kg-1 4-t-OP能够严重抑制家蚕的生长发育,对家蚕幼虫生长发育、化蛹和羽化发育变态期影响具有浓度和时间效应。
(2)家蚕幼虫期摄食0.01~0.08 g·kg-1 4-t-OP,幼虫的生命力和吐丝结茧功能下降,4-t-OP阻碍丝物质的形成。0.08 g·kg-1 4-t-OP添食组家蚕幼虫期全部不能结茧。
| [1] |
Futran Fuhrman V, Tal A, Arnon S. Why endocrine disrupting chemicals(EDCs)challenge traditional risk assessment and how to respond[J]. Journal of Hazardous Materials, 2015, 286: 589-611. |
| [2] |
Li Z, Zhang W, Shan B. The effects of urbanization and rainfall on the distribution of, and risks from, phenolic environmental estrogens in river sediment[J]. Environmental Pollution, 2019, 250: 1010-1018. DOI:10.1016/j.envpol.2019.04.108 |
| [3] |
Sheikh I A, Tayubi I A, Ahmad E, et al. Computational insights into the molecular interactions of environmental xenoestrogens 4-tert-octylphenol, 4-nonylphenol, bisphenol A(BPA), and BPA metabolite, 4-methyl-2, 4-bis(4-hydroxyphenyl) pent-1-ene(MBP) with human sex hormone-binding globulin[J]. Ecotoxicology and Environmental Safety, 2017, 135: 284-291. DOI:10.1016/j.ecoenv.2016.10.005 |
| [4] |
Janousek R M, Müller J, Knepper T P. Combined study of source, environmental monitoring and fate of branched alkylphenols:The chain length matters[J]. Chemosphere, 2020. DOI:10.1016/j.chemosphere.2016.124950 |
| [5] |
Tanja Krüger, Long M, Bonefeld-Jørgensen E C. Plastic components affect the activation of the aryl hydrocarbon and the androgen receptor[J]. Toxicology, 2008, 246(2/3): 112-123. |
| [6] |
Gassel M, Rochman C M. The complex issue of chemicals and microplastic pollution:A case study in North Pacific lanternfish[J]. Environmental Pollution, 2019, 248: 1000-1009. |
| [7] |
Olaniyan L W B, Okoh O O, Mkwetshana N T, et al. Environmental water pollution, endocrine interference and ecotoxicity of 4-tert-Octylphenol: A review[C]//de Voogt P. Reviews of environmental contamination and toxicology volume 248. Switzerland: Springer cham, 2018: 81-109.
|
| [8] |
Wu M, Pan C, Yang M, et al. Chemical analysis of fish bile extracts for monitoring endocrine disrupting chemical exposure in water:Bisphenol A, alkylphenols, and norethindrone[J]. Environmental Toxicology and Chemistry, 2016, 35(1): 182-190. |
| [9] |
Kotula-Balak M, Tworzydlo W, Pochec E, et al. Octylphenol induces changes in glycosylation pattern, calcium level and ultrastructure of bank vole spermatozoa in vitro[J]. Toxicology in Vitro, 2015, 29(3): 529-537. DOI:10.1016/j.tiv.2014.12.013 |
| [10] |
Witek P, Grzesiak M, Koziorowski M, et al. Effect of neonatal exposure to endocrine-active compounds on plasma lipid and steroid concentrations, and morphology of luteal tissue in the adult pig[J]. Domestic Animal Endocrinology, 2020, 70: 106381. DOI:10.1016/j.domaniend.2019.07.009 |
| [11] |
Blanco M, Rizzi J, Fernandes D, et al. Assessing the impact of waste water effluents on native fish species from a semi-arid region, NE Spain[J]. Science of the Total Environment, 2019, 654: 218-225. DOI:10.1016/j.scitotenv.2018.11.115 |
| [12] |
Tran T K A, Yu R M K, Islam R, et al. The utility of vitellogenin as a biomarker of estrogenic endocrine disrupting chemicals in molluscs[J]. Environmental Pollution, 2019, 248: 1067-1078. DOI:10.1016/j.envpol.2019.02.056 |
| [13] |
Xie L, Li X Y, Liang K, et al. Octylphenol influence growth and development of Rana chensinensis tadpoles via disrupting thyroid function[J]. Ecotoxicology and Environmental Safety, 2019, 169: 747-755. DOI:10.1016/j.ecoenv.2018.11.083 |
| [14] |
Matsumoto Y, Ishii M, Hasegawa S, et al. Enterococcus faecalis YM0831 suppresses sucrose-induced hyperglycemia in a silkworm model and in humans[J]. Communications Biology, 2019, 2(1): 157. DOI:10.1038/s42003-019-0407-5 |
| [15] |
Ma L, Andoh V, Adjei M O, et al. In vivo toxicity evaluation of boron nitride nanosheets in Bombyx mori silkworm model[J]. Chemosphere, 2020, 247: 125877. DOI:10.1016/j.chemosphere.2020.125877 |
| [16] |
吴载德. 蚕体解剖生理学[M]. 二版. 北京: 农业出版社, 1989. WU Zai-de. Anatomy and physiology of silkworm[M]. 2nd Edition. Beijing: Agriculture Press, 1989. |
| [17] |
袁红霞, 裔洪根, 徐世清. 壬基酚对家蚕(Bombyx mori)生长发育的影响[J]. 农业环境科学学报, 2009, 28(4): 777-782. YUAN Hong-xia, YI Hong-gen, XU Shi-qing. Effects of nonylphenol on the development of silkworm, Bombyx mori[J]. Journal of Agro-Environment Science, 2009, 28(4): 777-782. DOI:10.3321/j.issn:1672-2043.2009.04.025 |
| [18] |
钟儒杰, 鲁兴萌, 屠振力. 环境激素邻苯二甲酸丁基苄酯对家蚕生长发育的影响[J]. 生态毒理学报, 2010, 5(5): 673-678. ZHONG Ru-jie, LU Xing-meng, TU Zhen-li. Effects of environmental hormone Butyl Benzyl Phthalate on the development of silkworm[J]. Asian Journal of Ecotoxicology, 2010, 5(5): 673-678. |
| [19] |
Yuan H X, Xu X, Sima Y H, et al. Changes in malondialdehyde content, antioxidative enzyme activity and their gene expression in gonads during different developmental stages of 4-n-nonylphenol-treated Bombyx mori(Lepidoptera:Bombycidae)[J]. Annals of the Entomological Society of America, 2015, 108(2): 193-200. DOI:10.1093/aesa/sau012 |
| [20] |
Yuan H X, Xu X, Sima Y H, et al. Reproductive toxicity effects of 4-nonylphenol with known endocrine disrupting effects and induction of vitellogenin gene expression in silkworm, Bombyx mori[J]. Chemosphere, 2013, 93(2): 263-268. DOI:10.1016/j.chemosphere.2013.04.075 |
| [21] |
Knapczyk-Stwora K, Grzesiak M, Witek P, et al. Neonatal exposure to agonists and antagonists of sex steroid receptors affects AMH and FSH plasma level and their receptors expression in the adult pig ovary[J]. Animals (Basel), 2019, 10(1): E12. DOI:10.3390/ani10010012 |
 2020, Vol. 39
2020, Vol. 39

