我国锑储量与产量均居世界之首,是一个“锑大国”[1],锑广泛应用于化工、印染和聚酯等领域。锑对人体及生物具有慢性毒性及致癌性[2],由于存在潜在的致癌性,锑被美国环境保护局(1979)和欧洲共同体理事会(1976)列为优先控制污染物[3]。近年来,锑污染愈发严重,太浦河流域多次发生锑浓度超标事件,对太浦河水源地正常运行造成不同程度影响,甚至导致下游水源地取水口关闭[4]。湖南、贵州、云南和广西等锑矿相对集中的南方地区占中国锑总储量的86.1%[5-6],齐翠翠[7]通过对湖南锡矿山锑矿区调查发现,矿区表层土壤中锑含量高达5 949 mg·kg-1,远高于我国土壤锑背景值0.38~2.98 mg·kg-1[8]。伴随着锑的广泛使用,大量锑进入到土壤中,高浓度锑对植物产生毒害作用,给环境带来污染,因而锑污染土壤的治理和修复技术也受到了广泛的关注。周林等[9]报道了锑的富集植物主要有芒、狗牙根、臭椿、大叶黄杨、女贞、蜈蚣草、长叶车前草、大叶井口边草,但这些植物利用度不高,农民没有种植积极性。因此,探索既能修复锑污染又有经济效益的修复植物就显得尤为重要。种植对重金属具有修复功能的非食用性经济植物,是一种切断重金属从污染土壤进入食物链、降低重金属人体健康风险的有效措施[10]。
桑树(Morus alba L.)是一种大生物量低富集性的经济型修复植物[11],具有较好的环境适应能力,在pH 4.5~9.0、土壤含盐量很少的条件下都可以生长[12],大面积种植桑树能提高环境保水、防风、防沙的能力。谭勇壁[11]对广西环江受尾矿污染的桑园调查时发现,桑树能在铅为734 mg·kg-1、锌为1 194 mg· kg-1、砷为53 mg·kg-1的污染土壤上生长且并无明显受胁迫现象。潘雨齐[13]通过对矿区污染土壤中镉在桑树体内迁移与分布的研究发现,桑树植株组织中的镉主要积累在根、茎干,而枝叶的积累量很低,其含量符合国家饲料卫生标准(GB 13078—2001)。桑枝可种食用菌、制作生物炭与活性炭,蚕粪可堆肥或制作生物炭,对修复后含重金属较高的产品可进行梯级开发利用[14]。由此看来,桑树既是良好的修复植物,又能促进农业经济的发展,具有广阔的研究前景。
关于重金属对桑树的胁迫已有许多文献报道,其中涉及的重金属有Cd[15]、Cr[16]、Pb[17]、Co[18]、Cu[19]、Zn[20]、Mn[21],但目前对锑胁迫的研究还较少。本试验以桑树为研究对象,配制不同价态、不同浓度的锑溶液进行盆栽培养,研究不同价态、不同浓度锑胁迫对桑树生理生化指标的影响,测定桑树各部位锑含量以及计算富集转运系数,旨在探索桑树叶片对锑胁迫的响应机制,确定锑元素对桑树生长发育的影响以及锑吸收积累特征,为锑污染土壤的植物修复提供科学依据。
1 材料与方法 1.1 实验材料供试植物:2年生桑树苗,购于美丽农家桑树幼苗批发部,经调查,未受到锑污染。
实验药品:硝酸、高氯酸为分析纯试剂,焦锑酸钾(K2H2Sb2O7 · 4H2O)和酒石酸锑钾(KSbC4H4O7 · 1 / 2 H2O)为分析纯试剂,购于国药集团化学试剂有限公司,各指标测试试剂盒均购于南京建成生物研究所。
实验仪器:752s紫外可见分光光度计(上海棱光科技有限公司),Prodigy型电感耦合等离子体原子发射仪(美国Leeman公司)。
1.2 实验方法采集校园无污染土壤,其理化性质见表 1。土样自然风干后研磨过5 mm筛,装入直径16 cm、高15 cm的PVC盆,每盆2 kg。用酒石酸锑钾和焦锑酸钾配制不同浓度的污染土壤,以不投加重金属的处理为对照(CK),浓度设置见表 2,每个处理设置3次重复,共计45盆,标号A、B、C分别代表Sb3+、Sb5+、Sb3++Sb5+处理,选取生长状况良好的健康桑苗,于阳光充足的条件下培养,每个花盆除了重金属锑的浓度不同,其他条件均一致,定期浇水,种植60 d后进行测定。
|
|
表 1 供试土壤的基本性状 Table 1 Basic properties of tested soil |
|
|
表 2 锑浓度的设置 Table 2 Setting of antimony concentration |
采集新鲜叶片(不含叶脉),用蒸馏水清洗干净、晾干,按照试剂盒测定方法分别测定桑叶的叶绿素含量、丙二醛(MDA)含量、过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)活性和谷胱甘肽(GSH)含量。
叶绿素含量测定:采用分光光度法测定。随机剪取同一处理3株植物颜色、大小一致的叶,去掉叶脉和叶缘部分,剪成0.5 m2左右的叶片,静止于无水乙醇:丙酮(V:V)为1:1的混合提取液中避光浸提24 h,待叶片完全变白,倒出浸提液,采用紫外分光光度计在663、645、440 nm处测定吸光值。叶绿素a、叶绿素b、类胡萝卜素和总叶绿素按Arnon公式计算[22]。
土壤锑含量测定:从每个花盆中取表面向下2~5 cm深的土壤样品,经自然风干后,采用四分法取样,用研钵磨碎后过100目筛,放入样品袋中保存。测定时,每个土壤样品取0.5 g,加入10 mL王水(HCl: HNO3的体积比为3:1)和5 mL HClO4,浸泡过夜,隔天置于电热板上进行消解,设置温度为220 ℃。没消解完全时再加入1~2 mL HClO4,直至溶液无色透明,冷却,然后用蒸馏水定容到25 mL[23],空白加标回收率为80.3%~113%,符合质量控制标准。
桑树各部位锑含量的测定:分别采集新鲜的桑叶、枝条、主茎、主根,用蒸馏水洗净后,放入烘箱105 ℃杀青30 min,然后在65 ℃烘干至恒质量,研磨、过筛备用。取1 g样品(精确至0.000 1 g)于100 mL锥形瓶中,加入5 mL浓硝酸浸泡过夜,消解前补加1 mL浓硝酸。将样品放置在电加热板上,温度控制在120 ℃,煮至液体清亮,冷却至室温。然后加入1 mL高氯酸,继续消解并将温度控制在220 ℃以内,蒸掉大部分高氯酸,看到白烟几乎冒尽,冷却,转入50 mL离心管中用蒸馏水定容至25 mL,混合均匀[24],空白加标回收率为85.3%~120%,符合质量控制标准。
锑元素使用等离子体原子发射仪进行分析,按照感耦等离子体原子发射光谱方法通则(JY/T 015— 1996)测定[25]。所有样品均设置3个重复样和1个空白样,测定过程中用国家标准物质进行定量,采用平均值表示测定结果,重复样品的变异系数在0.2%~ 5.2%之间。
根据桑树地上部与地下部的重金属含量和其对应的土壤中重金属含量,计算富集系数和转运系数,转运系数T1、T2、T3分别表示叶与根、枝与根、茎与根中锑含量的比值。公式如下:
转运系数(T1、T2、T3)=桑树地上部(叶、枝和茎)中锑的平均浓度/桑树根中锑的平均浓度
富集系数(BCF)=桑树地上部(桑叶+桑枝+桑茎)的锑浓度/土壤中锑浓度
1.4 统计与数据处理数据采用Excel 2007和SPSS 22.0进行统计与分析,采用Origin 8.1作图。
2 结果与分析 2.1 锑在桑树内的分布特征由图 1可以看出,随着锑浓度的升高,单一Sb3+胁迫下桑根中的锑含量逐渐增多。A3处理桑茎中的锑含量略高于桑枝,但总体看来,单一Sb3+胁迫下桑树中锑含量分布为根>枝>茎>叶。除B2处理外,单一Sb5+胁迫下桑叶中锑含量没有显著变化,桑枝中的锑含量在B4处理时显著增加,桑根中锑含量随锑浓度增加而呈显著增加的趋势;B1、B3处理桑树锑分布为根>叶>枝>茎,B4中锑含量的分布则与单一Sb3+胁迫时一致。而在Sb3+与Sb5+复合胁迫下,随着锑浓度增大桑茎和桑根中的锑含量显著增大,桑枝中的锑含量在C3处理时大幅升高,桑树锑分布总体呈现为根>茎>叶>枝。

|
图中不同字母表示不同处理之间有显著差异(P<0.05)。下同 Different letters in the figure indicate significant differences between different concentrations(P<0.05). The same below 图 1 桑树叶、枝、茎、根中的锑含量 Figure 1 Content of antimony in mulberry leaves, branches, stems and roots |
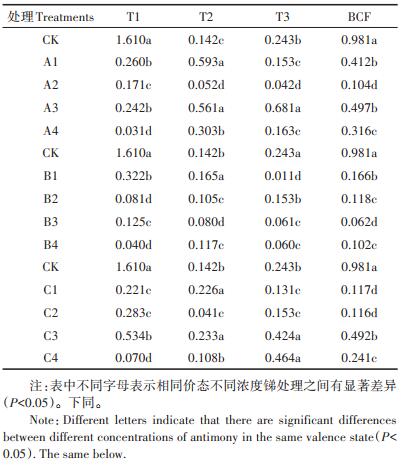
Sb3+、Sb5+单一和复合胁迫下桑树的转运和富集特征如表 3所示。单一Sb3+胁迫下T1、T2、T3分别为0.031~0.260、0.052~0.593、0.042~0.681,单一Sb5+胁迫下T1、T2、T3分别为0.040~0.322、0.080~0.165、0.011~ 0.153,Sb3+和Sb5+复合胁迫下T1、T2、T3分别为0.070~ 0.534、0.041~0.233、0.131~0.464。由此可以看出,单一Sb3+胁迫下桑树对锑的转运系数高于单一Sb5+胁迫和Sb3+、Sb5+复合胁迫,A4、B4、C4处理下T1的值均小于组内其他处理,而且所有锑处理的T1均显著小于对照组T1,各个锑处理的BCF也均小于对照组。
|
|
表 3 Sb3+、Sb5+单一和复合胁迫下桑树的转运和富集特征 Table 3 Transport and enrichment characteristics of mulberry under Sb3+ and Sb5+ single and combined stress |
由表 4可知,叶片总叶绿素含量随锑处理浓度的增加逐渐减少。单一Sb3+胁迫下,随着处理浓度的增加,叶绿素a、叶绿素b及总叶绿素含量均呈先升后降的趋势,其中A2处理组叶绿素含量达到最大值,呈现出低浓度锑对叶绿素合成的促进效应,随着Sb3+浓度继续增加,叶绿素含量逐渐减少。单一Sb5+处理组中,叶绿素a和叶绿素a+b在低浓度锑处理时无显著变化,在中、高锑浓度下显著减少;叶绿素b含量则在中、高浓度下变化不显著;B4处理组中,叶绿素a、叶绿素b及总叶绿素含量较CK下降了25.8%、49.9%及35.5%。Sb3+、Sb5+复合胁迫下,随着胁迫浓度的增加,叶绿素a、叶绿素b及总叶绿素含量均呈逐渐下降趋势,并在重度胁迫C4处理组中达到最小值,抑制效应最明显。桑树叶片的类胡萝卜素含量有相反表现,其含量随锑处理浓度的增加而显著增加,A4、B4及重度胁迫C4处理组中类胡萝卜素含量由CK组的1.02 mg·g-1上升到1.17、1.88 mg·g-1及2.75 mg·g-1。
|
|
表 4 Sb3+、Sb5+单一和复合胁迫对桑树叶片叶绿素含量的影响 Table 4 Effects of single and compound Sb3+ and Sb5+ stress on chlorophyll content of mulberry leaves |
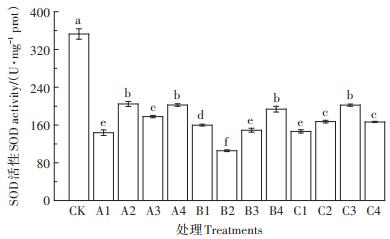
图 2显示,单一Sb3+胁迫下,SOD活性在A1处理组中最小,较对照减少60.6%,差异显著,A2和A4处理中,SOD活性变化不显著,分别较对照减少了44.4%和43.2%。B2处理下,SOD活性降到了最低值,较对照显著减少了71.2%,中高浓度Sb5+胁迫下,桑叶SOD活性逐渐增加。Sb3+、Sb5+复合胁迫下,处理组SOD活性均较CK有所下降,随着复合浓度的增加,SOD活性增加显著,随后在C4处理时有所减小。在各个锑浓度下,SOD活性均低于CK组且差异显著,说明锑处理对桑叶的SOD活性有较大抑制作用。
|
图 2 Sb3+、Sb5+单一及复合胁迫对桑叶SOD活性的影响 Figure 2 Effects of single and compound Sb3+ and Sb5+ stress on SOD activity in mulberry leaves |
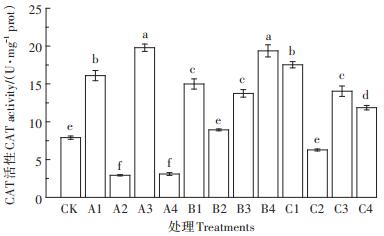
由图 3可知,单一Sb3+在A1、A3处理时,CAT活性较对照组分别增加了52.6%、59.9%,差异显著,A2、A4处理组中,CAT活性显著下降,达到了最低值。而单一Sb5+处理组中,CAT活性除B2处理外,其他处理和CK组差异显著,与单一Sb3+胁迫不同,在Sb5+浓度最大时,CAT活性达到了最大,较CK组增加了57.7%。Sb3+、Sb5+复合胁迫下,C2处理较CK组无显著差异,其他各组CAT活性均高于CK组。总体表明,CAT活性在较低浓度的锑胁迫下显著增加,在较高浓度下又显著降低,最后在高浓度胁迫下逐渐增加。
|
图 3 Sb3+、Sb5+单一及复合胁迫对桑叶CAT活性的影响 Figure 3 Effects of single and compound Sb3+ and Sb5+ stress on CAT activity in mulberry leaves |
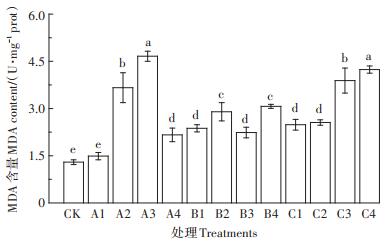
从图 4可看出,桑叶的MDA含量除A1处理外较CK组都有显著增加,说明重金属胁迫使桑树叶片膜质过氧化损伤加重。叶片中MDA含量在A1处理时无显著变化,随着Sb3+浓度的增加,MDA含量呈大幅度增加趋势,在A3处理时达到最大,相比CK组增加了250.0%,随后在A4处理时有所下降,但仍大于CK组。单一Sb5+胁迫下,所有处理组MDA含量变化趋势不显著,但较CK组仍显著增加。复合胁迫下,随着锑浓度的升高,MDA含量持续升高,在C4胁迫下达到最大值,比CK组增加了211.6%。
|
图 4 Sb3+、Sb5+单一及复合胁迫对桑叶MDA含量的影响 Figure 4 Effects of single and compound Sb3+ and Sb5+ stress on MDA content of mulberry leaves |
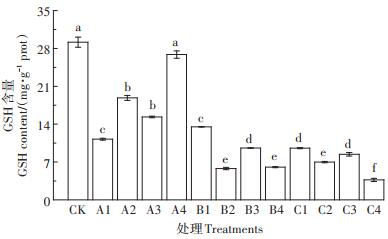
GSH也是植物细胞内一种重要的抗氧化物质,GSH上的巯基易被氧化,能在植物受到逆境胁迫时起到保护作用。不同浓度锑处理对桑树叶片中GSH含量的影响如图 5所示。由图可知,单一Sb3+胁迫下,GSH含量在A4处理时较CK组无显著差异,但显著高于A1处理组。在单一Sb5+胁迫下,B2、B4处理组GSH含量无显著差异,均小于低浓度胁迫,更显著小于CK组。Sb3+、Sb5+复合胁迫下,随着处理浓度的升高,GSH含量在C4处理时降到最低,最低值比CK组减少了87.5%,同时也显著低于单一Sb3+胁迫下的GSH含量。
|
图 5 Sb3+、Sb5+单一及复合胁迫对桑叶GSH含量的影响 Figure 5 Effects of single and compound Sb3+ and Sb5+ stress on GSH content of mulberry leaves |
将锑浓度与桑树的叶绿素a、叶绿素b、总叶绿素、SOD、CAT、MDA和GSH含量做相关性分析,结果如表 5所示。锑浓度与叶绿素a、叶绿素b、总叶绿素和MDA含量极显著相关,与GSH含量显著相关;叶绿素a与叶绿素b、总叶绿素、CAT和GSH含量显著相关;叶绿素b与总叶绿素极显著相关;SOD与GSH含量极显著相关。
|
|
表 5 锑浓度与桑树生理指标之间的相关性分析 Table 5 Correlation analysis between antimony concentration and physiological indexes |
重金属对植物的毒害是因为它被植物吸收并向植株地上部运输[26],研究锑在桑树体内的转运特征有助于探究锑在桑树体内的分布规律,为降低桑树体内锑的毒害提供科学依据。在本实验中,由图 1可发现,单一Sb3+胁迫下在整个桑树植株中,根部锑的平均含量约占总量的55%,茎部和枝部的平均含量约占总量的40%,叶片锑的平均含量相对较少,约占总量的5%。单一Sb5+胁迫下根部锑的平均含量约占总量的60%,茎部和枝部的平均含量约占总量的30%,叶片约占总量的10%。Sb3+、Sb5+复合胁迫下,根部锑的平均含量约占总量的50%,茎部和枝部的平均含量约占总量的30%,叶片约占总量的20%。由此可见锑在桑树中大多聚集在根部,叶片中含量较少,并且不同的锑处理下桑树内锑的迁移路径不同,分布部位也不同。高浓度锑污染下T1均小于组内较低锑浓度,而且所有锑处理的T1均显著小于CK组,可能是锑污染程度的增加抑制了桑根向桑叶运输锑的能力。单一Sb3+胁迫下,锑从桑根转移到桑茎和桑枝的能力最强,转移到桑叶的能力比较小,和锑在桑树中的分布一致,桑叶中累积较少的锑。各个锑处理的BCF均小于CK组,说明锑浓度的增加减小了桑树的富集能力,如图 1所示,桑根中的锑含量明显高于桑树地上部的锑含量。
3.2 锑污染对桑树生理指标的影响 3.2.1 锑污染对桑树叶绿素含量的影响研究表明,重金属进入植物体内以后,与叶绿素合成相关的几种富含-SH的酶肽链形成络合物,抑制了酶的活性,阻碍了叶绿素的合成,同时,重金属胁迫还会使叶绿体膜结构受到破坏,造成叶绿体不可逆损伤,导致叶绿体含量下降[27]。因此叶绿素可作为评价植物受锑胁迫时的一个重要生理指标。本实验结果表明,单一Sb3+浓度为100 mg·kg-1的处理时,叶绿素含量达最大,在Sb3+ 300 mg·kg-1处理时,叶绿素含量最低。单一Sb5+处理组中,叶绿素b含量在较高浓度下变化不显著。Sb3+、Sb5+复合胁迫下叶绿素含量在重度胁迫下值最小,抑制效应最明显。这可能是低浓度的锑刺激叶绿素的合成,而高浓度则抑制,同时可以看出Sb5+对叶绿素b影响较小。
3.2.2 锑污染对桑树抗氧化酶系统的影响植物体内存在两种抗氧化系统,包括SOD、CAT、POD在内的抗氧化酶系统以及小分子抗氧化物质,其中,抗氧化酶系统用来清除逆境胁迫造成的活性氧,SOD与清除活性氧自由基有关,POD、CAT与清除H2O2有关[28]。在正常情况下,植物体内活性氧清除系统能有效地清除体内的活性氧自由基,从而使细胞免受伤害。但在逆境下,植物体内活性氧自由基的产生速度超出了植物清除活性氧的能力,从而引起伤害[29]。本实验中各个锑处理浓度下,SOD活性均小于CK组,可以看出锑胁迫影响了桑叶清除活性氧的能力。Chai等[30]研究发现锑的存在降低了苎麻(Boehmerianivea)中SOD含量,但存在明显的浓度效应,锑浓度40 mg·L-1时显著降低了SOD酶活性,但随着浓度的进一步增加,SOD酶活性又显著增加。本实验不同锑浓度处理下,也出现SOD活性先降低后缓慢升高的现象,可能是植物应对高浓度锑胁迫产生了适应机制,使得SOD的活性在逆境下反而增加。
3.2.3 锑污染对桑树MDA含量的影响MDA作为膜脂过氧化的终产物,也是检验植物受氧化胁迫程度的生理指标之一。MDA可以抑制植物体内抗氧化物酶活并降低抗氧化物含量,引发膜脂过氧化伤害[31]。Feng等[32]研究发现,齿牙毛蕨、鳞盖蕨等蕨类植物在重金属胁迫下MDA含量显著增加,产生氧化胁迫。本试验中,Sb3+、Sb5+单一及复合胁迫中桑树叶片MDA含量除A1处理外较CK组都有显著增加,表明Sb3+、Sb5+单一及复合胁迫增加了脂质过氧化反应,且浓度增加,脂质过氧化反应加重,对叶片生长产生胁迫。根据MDA含量能看出,桑叶受到单一Sb5+的氧化胁迫小于Sb3+和Sb3+、Sb5+复合,说明Sb5+胁迫对桑树的生长影响较小。
3.2.4 锑污染对桑树GSH含量的影响Khan等[33]在添加外源半胱氨酸(Cys)的植物幼苗中证实,GSH在体内的生物合成依赖于S和N的存在。GSH作为一种低分子化合物,具有特殊的生物学功能,可参与植物体内不同的代谢过程,例如,解毒机制和光合作用等,并在氧化平衡和新陈代谢过程中常伴随着化学结构上的改变[34]。本实验中,单一Sb3+胁迫下,GSH含量在A4处理时较CK组无显著差异,但显著高于A1处理。在单一Sb5+胁迫下,B2、B4处理组GSH含量无显著差异,均小于低浓度胁迫,更显著小于CK组。Sb3+、Sb5+复合胁迫下,随着处理浓度的升高,GSH含量在C4处理时降到最低,同时也显著低于单一Sb3+胁迫下的GSH含量。谢华英等[35]研究发现,高温干旱双重胁迫下水稻的抗坏血酸(AsA)、GSH含量下降,这些结果表明,植物在遭受锑胁迫时,自身可通过引发AsA-GSH循环机制,进而改变还原型GSH含量以达到解毒目的。
4 结论(1)单一Sb3+胁迫下桑树中锑分布为根>枝>茎>叶,Sb3+、Sb5+复合胁迫下桑树锑分布为根>茎>叶>枝。锑浓度的增加抑制了桑树根向桑叶运输锑的能力。
(2)锑胁迫在较高浓度会抑制桑叶的叶绿素合成,会使桑树叶片膜质过氧化损伤加重,从而影响桑树的生长发育。
| [1] |
廖炜, 赵运林. 锑胁迫对4种蔬菜种子萌发及幼苗生长的影响[J]. 湖南农业科学, 2008(4): 86-88. LIAO Wei, ZHAO Yun-lin. Effects of Sb stress on the growth of seedlings and seeds germination of four vegetables[J]. Hunan Agricultural Sciences, 2008(4): 86-88. DOI:10.3969/j.issn.1006-060X.2008.04.032 |
| [2] |
殷志遥, 和君强, 刘代欢, 等. 我国土壤锑污染特征研究进展及其富集植物的应用前景初探[J]. 农业资源与环境学报, 2018, 35(3): 199-207. YIN Zhi-yao, HE Jun-qiang, LIU Dai-huan, et al. Research progress on characteristics of soil antimony pollution in China and the preliminary exploration about application prospect of antimony accumulator plants[J]. Journal of Agricultural Resources and Environment, 2018, 35(3): 199-207. |
| [3] |
徐美月, 刘飞. 重金属锑对拟南芥的胁迫[J]. 南方农业, 2018, 12(2): 105-107. XU Mei-yue, LIU Fei. Stress on Arabidopsis thaliana by antimony[J]. South China Agriculture, 2018, 12(2): 105-107. |
| [4] |
马农乐, 李敏, 王元元. 太浦河突发锑污染应对措施[J]. 水利科技与经济, 2018, 24(7): 19-22, 30. MA Nong-le, LI Min, WANG Yuan-yuan. Analysis on response of antimony pollution in Taipu River[J]. Water Conservancy Science and Technology and Economy, 2018, 24(7): 19-22, 30. DOI:10.3969/j.issn.1006-7175.2018.07.005 |
| [5] |
蓝唯源, 宋书巧, 吴浩东, 等. 土壤三价锑污染对甜芥菜生长及品质的影响研究[J]. 环境科学与技术, 2009, 32(2): 20-23. LAN Wei-yuan, SONG Shu-qiao, WU Hao-dong, et al. Effect of soil antimony(Ⅲ)pollution on the growth and quality of sweet mustard[J]. Environmental Science & Technology, 2009, 32(2): 20-23. DOI:10.3969/j.issn.1003-6504.2009.02.006 |
| [6] |
He M, Wang X, Wu F, et al. Antimony pollution in China[J]. Science of the Total Environment, 2012, 421/422(3): 41-50. |
| [7] |
齐翠翠.锑在中国煤及典型矿区中的环境地球化学研究[D].合肥: 中国科学技术大学, 2010. QI Cui-cui. Environmental geochemistry of antimony in Chinese coalsand two typical mines[D]. Hefei: University of Science and Technology of China, 2010. http://d.wanfangdata.com.cn/thesis/Y1706148 |
| [8] |
齐文启, 曹杰山. 锑(Sb)的土壤环境背景值研究[J]. 土壤通报, 1991, 22(5): 209-210. QI Wen-qi, CAO Jie-shan. Study on the soil environmental background values of antimony(Sb)[J]. Chinese Journal of Soil Science, 1991, 22(5): 209-210. |
| [9] |
周林, 梁亚楠, 武艳芳, 等. 重金属富集植物研究进展及其园林应用分析[J]. 长江大学学报:自科版, 2017, 14(2): 52-58. ZHOU Lin, LIANG Ya-nan, WU Yan-fang, et al. Advances in heavy metal enriched plants and analysis of their garden applications[J]. Journal of Yangtze University:Natural Science Edition, 2017, 14(2): 52-58. |
| [10] |
刘冲, 赵玲, 李秀华, 等.苎麻对农田土壤中汞、镉的吸收累积特征研究[J/OL].农业环境科学报: 1-13.http://kns.cnki.net/kcms/detail/12.1347.S.20200303.1252.006.html. LIU Chong, ZHAO Ling, LI Xiu-hua, et al. Accumulation and transfer of mercury and cadmium in ramie from agricultural soils[J/OL].Journal of Agro-Environment Science: 1-13. |
| [11] |
谭勇壁.矿区周边重金属污染农田发展桑树种植产业的可行性研究[D].南宁: 广西大学, 2008. TAN Yong-bi. Possibility of planting mulberry in mining polluted farmland[D]. Nanning: Guangxi University, 2008. http://d.wanfangdata.com.cn/thesis/Y1318962 |
| [12] |
韦朝阳, 陈同斌. 高砷区植物的生态与化学特征[J]. 植物生态学报, 2002, 26(6): 695-700. WEI Chao-yang, CHEN Tong-bin. Ecological and chemical characteristics of plants in high arsenic areas[J]. Journal of Plant Ecology, 2002, 26(6): 695-700. DOI:10.3321/j.issn:1005-264X.2002.06.010 |
| [13] |
潘雨齐.镉在土壤-桑树-蚕体系中的迁移与分布规律研究[D].长沙: 湖南农业大学, 2016. PAN Yu-qi. Migration and distribution of Cd in soil-mulberry-silkworm system[D]. Changsha: Hunan Agriculture University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10537-1017033614.htm |
| [14] |
黎大荣, 杨惟薇, 黎秋君, 等. 蚕沙和赤泥用于铅镉污染土壤改良的研究[J]. 土壤通报, 2015, 46(4): 977-984. LI Da-rong, YANG Wei-wei, LI Qiu-jun, et al. Application of silkworm excrement and red mud for soil remediation contaminated by lead and cadmium[J]. Chinese Journal of Soil Science, 2015, 46(4): 977-984. |
| [15] |
Wang K R. Tolerance of cultivated plants to cadmium and their utilization in polluted farmland soils[J]. Acta Biotechnol, 2002, 22(1/2): 189-198. |
| [16] |
Ashfaq M, Ahmad S, Saqheer M, et al. Bioaccumulation of chromium (Ⅲ)in silkworm(Bombyx mori L.)in relation to mulberry, soil and waste water metal concentrations[J]. The Journal of Animal & Plant Sciences, 2012, 22(3): 627-634. |
| [17] |
Zhou L Y, Zhao Y, Wang S F, et al. Lead in the soil-mulberry(Morus alba L.)-silkworm(Bombyx mori L.)foodchain:Translocation and detoxification[J]. Chemosphere, 2015, 128: 171-177. DOI:10.1016/j.chemosphere.2015.01.031 |
| [18] |
Ashfaq M, Ali S, Hanif M A. Bioaccumulation of cobalt in silkworm (Bombyx mori L.)in relation to mulberry, soil and wastewater metal concentrations[J]. Process Biochem, 2009, 44(10): 1179-1184. DOI:10.1016/j.procbio.2009.05.006 |
| [19] |
Tewari R K, Kumar P, Sharma P N. Antioxidant responses to enhanced generation of superoxide anion radical and hydrogen peroxide in the copper-stressed mulberry plants[J]. Planta, 2006, 223(6): 1145-1153. DOI:10.1007/s00425-005-0160-5 |
| [20] |
Tewari R K, Kumar P, Sharma P N. Morphology and physiology of zinc-stressed mulberry plants[J]. J Plant Nutr Soil Sci, 2008, 171(2): 286-294. DOI:10.1002/jpln.200700222 |
| [21] |
Tewari R K, Kumar P, Sharma P N. Oxidative stress and antioxidant responses of mulberry(Morus alba L.)plants subjected to deficiency and excess of manganese[J]. Acta Physiol Plant, 2013, 35(12): 3345-3356. DOI:10.1007/s11738-013-1367-x |
| [22] |
谌金吾.三叶鬼针草(Bidenspilosa L.)对重金属Cd、Pb胁迫的响应与修复潜能研究[D].重庆: 西南大学, 2013. CHEN Jin-wu. Study on response and potential phytoremediation of Bidenspilosa L.in cadmium and lead stress[D]. Chongqing: Southwest University, 2013. http://d.wanfangdata.com.cn/thesis/Y2309743 |
| [23] |
贾超华, 颜新培, 龚昕, 等. 镉超标耕地蔬菜重金属污染调查与健康风险评价[J]. 中国农学通报, 2016, 32(5): 106-112. JIA Chao-hua, YAN Xin-pei, GONG Xin, et al. Survey of heavy metal pollution and health risk assessment of vegetables with cadmium exceeding the standard[J]. Chinese Agricultural Science Bulletin, 2016, 32(5): 106-112. |
| [24] |
田俊俊.生物炭对镉污染土壤的钝化修复效应研究[D].雅安: 四川农业大学, 2018. TIAN Jun-jun. Study on the passivation and remediation effect of biochar on cadmium contaminated soil[D]. Ya'an: Sichuan Agricultural University, 2018. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1019802282.nh |
| [25] |
田笠卿, 童式国. JY/T 015-1996感耦等离子体原子发射光谱方法通则[S].北京: 国家教育委员会, 1997. TIAN Li-qing, TONG Shi-guo. JY/T 015-1996 General rules for inductivety coupled plasma-atomic emission spectrometry[S]. Beijing: State Education Commission, 1997. |
| [26] |
王晓娟, 王文斌, 杨龙, 等. 重金属镉(Cd)在植物体内的转运途径及其调控机制[J]. 生态学报, 2015, 35(23): 7921-7929. WANG Xiao-juan, WANG Wen-bin, YANG Long, et al. Transportpathways of cadmium(Cd)and its regulatory mechanisms in plant[J]. Acta Ecologica Sinica, 2015, 35(23): 7921-7929. |
| [27] |
Durand T C, Hausman J F, Carpin S, et al. Zinc and cadmium effects on growth and ion distribution in PopulustremuláPopulus alba[J]. Biologial Plantarum, 2010, 54(1): 191-194. DOI:10.1007/s10535-010-0033-z |
| [28] |
Mu X J, Zhang Q. Progress in research on antioxidant bioactive peptides from plant[J]. Forest By-Product and Speciality in China, 2008(3): 90-93. |
| [29] |
叶蓝韩.重金属胁迫下油菜生理指标变化和金属元素快速检测方法研究[D].杭州: 浙江大学, 2018. YE Lan-han. Method research on physiological indices changes and metal element rapid detection of rape under heavy metal stress[D]. Hangzhou: Zhejiang University, 2018. http://d.wanfangdata.com.cn/thesis/Y3398598 |
| [30] |
Chai L Y, Mubarak H, Yang Z H, et al. Growth, photosynthesis, and defense mechanism of antimony(Sb)-contaminated Boehmeria nivea L.[J]. Environmental Science & Pollution Research, 2016, 23(8): 7470-7481. |
| [31] |
Dong J, Wu F, Zhang G. Influence of cadmium on antioxidant capacity and four microelement concentrations in tomato seedlings(Lycopersicon esculentum)[J]. Chemosphere, 2006, 64: 1659-1666. DOI:10.1016/j.chemosphere.2006.01.030 |
| [32] |
Feng R W, Wei C Y, Tu S X, et al. Detoxification of antimony by selenium and their interaction in paddy rice under hydroponic conditions[J]. Microchem Journal, 2011, 97(1): 57-61. DOI:10.1016/j.microc.2010.06.003 |
| [33] |
Khan M I R, Nazir F, Asgher M, et al. Selenium and sulfur influence ethylene formation and alleviate cadmium-induced oxidative stress by improving proline and glutathione productionin wheat[J]. Journal of Plant Physiology, 2015, 173: 9-18. DOI:10.1016/j.jplph.2014.09.011 |
| [34] |
Wang J, Zeng Q, Zhu J, et al. Dissimilarity of ascorbate-glutathione (AsA-GSH)cyclemechanism in two rice(Oryza sativa L.)cultivars under experimental free-air ozone exposure[J]. Agriculture Ecosystems and Environment, 2013, 165: 39-49. DOI:10.1016/j.agee.2012.12.006 |
| [35] |
谢华英, 马均, 代邹, 等. 抽穗期高温干旱胁迫对杂交水稻产量及生理特性的影响[J]. 杂交水稻, 2016, 31(1): 62-69, 79. XIE Huang-ying, MA Jun, DAI Zou, et al. Effects of high temperature and drought stress in heading stage on grain yield and physiological characteristics of hybrid rice[J]. Hybrid Rice, 2016, 31(1): 62-69, 79. |
 2020, Vol. 39
2020, Vol. 39