多环芳烃(Polycyclic aromatic hydrocarbon,PAHs)是环境中广泛存在的一类持久性有毒有害有机污染物,主要由煤、石油、木材、有机高分子化合物等有机物在不完全燃烧或高温(>700 ℃)处理条件下产生[1-2]。2014年《全国土壤污染状况调查公报》指出,我国土壤PAHs总超标率为1.4%,说明我国土壤存在一定的PAHs污染。PAHs的强疏水性和脂溶性导致其容易吸附在土壤等固体颗粒物表面[3-4]。进入土壤中的PAHs易被植物吸收积累,并可通过食物链传递和富集,从而对生态环境和人体健康造成一定的危害[5]。调控植物对土壤中PAHs的吸收作用,进而减低作物PAHs污染风险,对于在PAHs污染区生产安全的农产品意义重大。
研究发现,一些表面活性剂对PAHs有增溶作用,可用于调控植物对PAHs的吸收和积累。Gao等[6]研究显示,添加适量浓度的月桂醇聚氧乙烯醚(Brij35)(≤74 mg·L-1)可提高菲和芘的溶解度,促进植物对菲和芘的吸收;而高浓度的Brij35(≥148 mg· L-1)可与菲和芘产生竞争,并对植物有一定的毒害作用,抑制植物的吸收。Liao等[7]研究指出,向土壤中添加适量表面活性剂可以增加PAHs的解吸率,提高PAHs的生物可利用性,并促进玉米对PAHs的吸收积累。此外,表面活性剂还可以强化微生物-植物联合作用对土壤中PAHs的去除。研究表明,添加生物表面活性剂鼠李糖脂和大豆卵磷脂,不仅可以显著提高根际土壤中微生物数量和总石油烃的生物可利用性,还促进了植物根系对总石油烃的吸收积累和微生物降解[8]。Ni等[9]的研究也表明,与不添加表面活性剂相比,添加表面活性剂Tween 80提高了植物与微生物联合作用对土壤中菲和芘的去除率,分别提高了49.8%和48.1%。
除表面活性剂外,在植物根际或体内定殖功能微生物,也可有效控制植物对PAHs的吸收和积累[10-11]。Sun等[12]从生长于PAHs污染区的健康植物体内分离出一株芘降解内生细菌Staphylococcus sp. BJ06,该菌能良好定殖于植物根际、根内和茎叶内,并可以促进植物生长和芘的代谢;相比不接菌植物,接菌植物根部和茎叶部芘的含量分别降低了31.01%和44.22%。Lenoir等[13]研究表明,丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)在植物根部形成的菌根可以促进植物生长及其对根际PAHs等持久性有机污染物的吸收和去除;此外,AMF还可引起植物根系分泌物浓度和成分的改变,吸引根际微生物在植物根表大量聚集,其中不乏PAHs降解菌[14]。另外,有些AMF自身含有过氧化物酶等酶系[15],可直接降解PAHs等有机污染物。然而,有关表面活性剂对降解细菌在植物体内定殖和分布的影响知之甚少,有关表面活性剂作用下降解细菌的定殖对植物吸收积累PAHs的影响也尚不可知。
基于此,本研究拟以非离子型表面活性剂Tween 80、芘降解细菌Pyr9和三叶草作为供试对象,采用温室土培实验,研究不同剂量Tween 80作用下Pyr9在三叶草根际和体内的定殖与分布情况,并探讨Tween 80作用下Pyr9的定殖对三叶草吸收芘的影响。研究结果有望初步阐明表面活性剂作用下植物来源的降解细菌在植物中的定殖和效能,为在PAHs污染区生产安全的农产品提供理论依据,也为PAHs污染土壤的“边修复边生产”提供技术参考。
1 材料与方法 1.1 供试材料菌株:芘降解细菌Mycobacterium sp. Pyr9,属环境分枝杆菌,具有氨苄青霉素和氯霉素抗性,分离于PAHs污染区植物牛筋草[Eleusine indica(L.)Gaertn.]根表,保存于本实验室-70 ℃冰箱。
植物:三叶草,品种为白车轴草(Trifolium repens L.),其种子购自江苏农科种业研究院有限公司。
芘(Pyrene,纯度≥98%)购自德国Fluka公司,其相对分子量为202.26,25 ℃纯水中溶解度为0.12 mg· L-1,辛醇-水分配系数(log Kow)为5.18,其溶液以丙酮为溶剂配制;甲醇、乙腈和丙酮为色谱纯,购自南京化学试剂股份有限公司;聚氧乙烯(20)失水山梨醇单油脂肪酸(Tween 80),购自国药集团;其他试剂均为分析纯,购自国药集团。
LB培养基:酵母膏5 g·L-1,蛋白胨10 g·L-1,NaCl 10 g·L-1,蒸馏水1 000 mL,pH 7.0。无机盐培养基(MSM):(NH4) 2SO4 1.50 g·L-1,K2HPO4·3H2O 1.91 g· L-1,NaCl 0.5 g·L-1,KH2PO4 0.50 g·L-1,MgSO4·7H2O 0.20 g·L-1,微量元素溶液2 mL,蒸馏水1 000 mL,pH 7.0~7.2。微量元素溶液:CoCl2·6H2O 0.1 g·L-1,MnCl2· 4H2O 0.425 g·L-1,ZnCl2 0.05 g·L-1,NiCl2·6H2O 0.01 g· L-1,CuSO4·5H2O 0.015 g·L-1,Na2MoO4·2H2O 0.01 g· L-1,Na2SeO4·2H2O 0.01 g·L-1。芘降解培养基(PMM):2 g·L-1的芘丙酮溶液过0.22 μm滤膜除菌,取一定量置于灭菌的三角瓶中,待丙酮挥发完全后加入灭菌的MSM,使芘的最终浓度达到50 mg·L-1。若制备固体培养基,则向上述液体培养基中加入18 g·L-1的琼脂。灭菌条件:温度121 ℃,时间20 min。
1.2 细菌Pyr9以芘为碳源的生长与降解曲线测定向无菌的50 mL玻璃三角瓶中加入一定量芘丙酮母液,待丙酮挥发后加入灭菌的20 mL无机盐溶液,使芘的浓度为50 mg·L-1(丙酮含量 < 0.5%),再以2%的接种量加入菌株Pyr9的新鲜菌悬液(OD600nm= 1.0,对照组加等量灭活菌悬液);处理组和对照组皆设置8个取样时间点,每个时间点3个重复,共48个三角瓶,于30 ℃、180 r·min-1条件下摇床恒温培养,培养时间为14 d;期间每2 d同一时间取出每组设置的3个三角瓶,加入2倍体积的甲醇,超声30 min后静置2 h,取适量溶液过0.22 μm孔径的有机相滤膜,装于液相瓶中,保存于-20 ℃冰箱,待测定[12]。同时,在加入甲醇之前,将摇瓶中培养基摇匀后取0.5 mL培养液,采用梯度稀释涂布平板法进行菌落计数[12],并以此计算培养液中细菌Pyr9的数量。
培养液中芘的含量用岛津LC-20AT高效液相色谱仪(HPLC)测定[16],其检测条件为:色谱柱为Φ4.6 mm×250 mm烷基C18反相柱;流动相为甲醇/水(V:V =90:10),流速1 mL·min-1;柱温40 ℃;进样量20 μL;检测时间8 min;检测波长254 nm。
1.3 供试土壤的采集和处理供试土壤取自南京某农田表层土壤(0~20 cm),类型为黄棕壤,其中PAHs未检出。土壤pH 6.03,有机碳含量14.3 g·kg-1。土样采集后,风干,过10目筛;取少量风干土壤添加适量含芘的丙酮溶液,充分混合均匀;待丙酮完全挥发后,将含芘的风干土壤与剩余风干土壤充分混合均匀。其中芘的添加量参考研究组之前调查的长三角地区石化厂周边PAHs重污染区表层土壤中的实际PAHs总含量。称取300 g上述土样于盆钵中,在50%田间持水量下平衡老化60 d后待用。测得土壤中芘的初始含量为7.86 mg·kg-1。
1.4 盆栽实验设置三叶草种子经10%双氧水浸泡消毒5 min后立即用无菌水冲洗[17],在蛭石中催芽至10 cm后移栽至污染土壤中,每盆留苗12株。
实验设置4个处理:空白对照组(CK),污染土壤;种植植物组(CP),污染土壤+三叶草;接菌组(CB),污染土壤+Pyr9;灌根组(CPR),污染土壤+三叶草+Pyr9灌根。CPR是于移栽后取10 mL Pyr9菌悬液(OD600nm =1.0)均匀灌溉于三叶草根部,CP以灭活的菌液做相同处理,CB为同时取10 mL菌悬液均匀灌溉于土壤中。移栽植物3 d后向各处理土壤中施入不同浓度的Tween 80溶液,其终浓度设置为:0、100、250、500、1 000 mg·kg-1干土。每个处理设置3组重复。试验期间设定温度为白天25 ℃,夜晚20 ℃。植物生长过程中定期浇水,每2 d随机交换盆钵的位置。为了及时检测细菌Pyr9在土壤-三叶草中的分布,灌根处理10 d后即采集土壤和三叶草样品,检测其中的芘含量和Pyr9数量。
1.5 三叶草生物量的测定收集培育好的新鲜植物样,用灭菌毛刷轻轻擦去根部土壤,再用无菌水冲洗植株至少3 min,将植株根系和茎叶表面附着物全部冲洗干净后,用吸水纸吸干植株表面水分。将三叶草根和茎叶分开,用万分之一分析天平分别称量其鲜质量,并记录数据。
1.6 根际土壤和三叶草中功能细菌Pyr9的数量测定菌株Pyr9具有氨苄青霉素和氯霉素抗性,且在芘降解平板上可形成降解圈,以这些特征作为标记对定殖在土壤和植物中的菌株Pyr9进行计数。取5.0 g根际土壤,置于装有45 mL无菌水的三角瓶中,内置玻璃珠数颗,于摇床220 r·min-1振荡10 min后,立即吸取土壤悬液梯度稀释并涂布于含有氨苄青霉素(75 mg·L-1)和氯霉素(25 mg·L-1)的芘降解固体培养基上,30 ℃恒温培养7 d,于紫外灯下观察菌株Pyr9生成的降解圈,并对菌株Pyr9进行计数,以计算每克土壤中的细菌Pyr9数量。为防止将其他细菌计入其中,随机挑取平板上生成降解圈的菌株进行16S rRNA基因的PCR扩增和测序[10],确定其为细菌Pyr9。三叶草生物量测定后,将其根和茎叶分开,分别取适量样品置于无菌研钵中,添加无菌水研磨成悬液,按上述方法对定殖于三叶草中的菌株Pyr9进行计数。
1.7 土壤和三叶草中芘含量的测定 1.7.1 土壤中芘含量的测定取一定量冷冻干燥后的土样置于研钵中,充分磨碎后过20目筛,取2 g上述土样于玻璃离心管中,加入10 mL体积比为1:1的二氯甲烷与正己烷的混合液,盖紧盖子后超声萃取1 h,以4 000 r·min-1的速度离心10 min,再取5 mL上清液过2 g-2 g无水硫酸钠-硅胶柱,并用10 mL体积比为1:1的二氯甲烷和正己烷溶液洗脱,将洗脱液收集至旋转蒸发瓶,40 ℃恒温下浓缩至干,用甲醇定容到2 mL,过0.22 μm孔径滤膜后,用HPLC/UV检测分析[18]。
1.7.2 三叶草中芘含量的测定将植物的根和茎叶用剪刀剪断,分装于自封袋中,置于冷冻干燥机中冷冻干燥2~3 d,将冷冻干燥后的植物根和茎叶用研钵充分研磨粉碎,然后称取一定量植物样于30 mL玻璃离心管中,再加入10 mL二氯甲烷和正己烷(V:V=1: 1)的混合溶液超声萃取30 min,重复3次[19]。按照1.7.1的方法进行三叶草中芘含量测定。1.8芘在三叶草中的富集和转移系数计算三叶草中芘富集系数(Plant concentration factor,PCF)的计算方式为[12]:
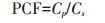
|
式中:Cp表示三叶草中芘的含量,mg·kg-1;Cs表示土壤中芘的含量,mg·kg-1。
三叶草中芘转移系数(Translocation factor,TF)的计算方式为[12]:
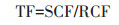
|
式中:SCF表示芘在三叶草茎叶中的富集系数;RCF表示芘在三叶草根中的富集系数。
2 结果与分析 2.1 以芘为碳源的细菌Pyr9生长曲线与芘降解曲线菌株Pyr9的生长和芘降解曲线如图 1所示,经过2 d的适应期后,菌株Pyr9进入快速代谢芘的阶段,同时菌株数量快速增加。当培养至第10 d时,菌株Pyr9对芘的降解率已在95%以上,同时菌株到达稳定期;而相同时间内添加了等量灭活菌株的对照组中芘浓度因非生物因素仅降低了8.64%,这表明细菌Pyr9对芘有良好的降解能力。在10~12 d时,残留的芘进一步被代谢完全,菌株Pyr9则停止增殖,其数量略有下降。
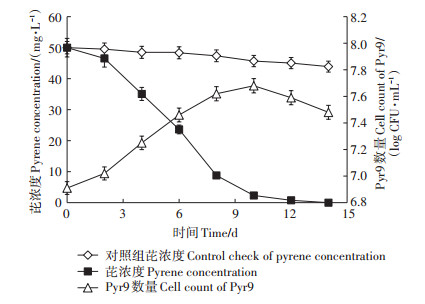
|
图 1 以芘为碳源的芘降解曲线和菌株Pyr9生长曲线 Figure 1 The pyrene-degrading and Pyr9 growth curve of strain Pyr9 with pyrene as the carbon source |
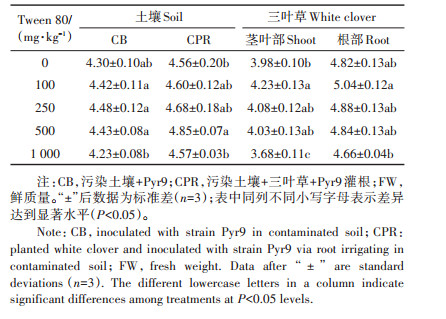
不同添加量Tween 80作用下菌株Pyr9在土壤和三叶草中的数量变化如表 1所示。当Tween 80添加量在100~500 mg·kg-1范围时,CB组和CPR组土壤中Pyr9的数量皆略高于未添加Tween 80处理;而当Tween 80添加量为1 000 mg ·kg-1时,CB组土壤中Pyr9的数量有所下降。随着Tween 80添加量的增长,定殖在三叶草根部和茎叶部的Pyr9数量也呈现先增后减的趋势,其中100 mg·kg-1的Tween 80最有利于菌株Pyr9的定殖和生长。与土壤中类似,当Tween 80添加量为1 000 mg·kg-1时,定殖在三叶草体根部和茎叶部的Pyr9数量开始下降。
|
|
表 1 土壤和三叶草中定殖的菌株Pyr9数量(log CFU·g-1 FW) Table 1 The cell counts of strain Pyr9 colonized in soil and white clover (log CFU·g-1 FW) |
不同剂量Tween 80的添加和细菌Pyr9的定殖对三叶草根部和茎叶部生物量(鲜质量)的影响如图 2所示。在供试Tween 80剂量范围内,CP组和CPR组三叶草根部和茎叶部的生物量随Tween 80含量的增加呈逐渐减少的趋势。如当Tween 80添加量为1 000 mg·kg-1时,CP组三叶草根部和茎叶部的生物量(455 mg和1 353 mg)较不添加Tween 80对照组三叶草根部和茎叶部的生物量(583 mg和1 607 mg)分别减少了22%和16%。菌株Pyr9的定殖在不同Tween 80添加剂量下均可显著提高三叶草的生物量(P < 0.05)。如当Tween 80含量为500 mg·kg-1时,CPR组三叶草根部的生物量(632 mg)比CP组(503 mg)提高了26%,而茎叶部生物量(1 719 mg)则比CP组(1 424 mg)提高了21%。
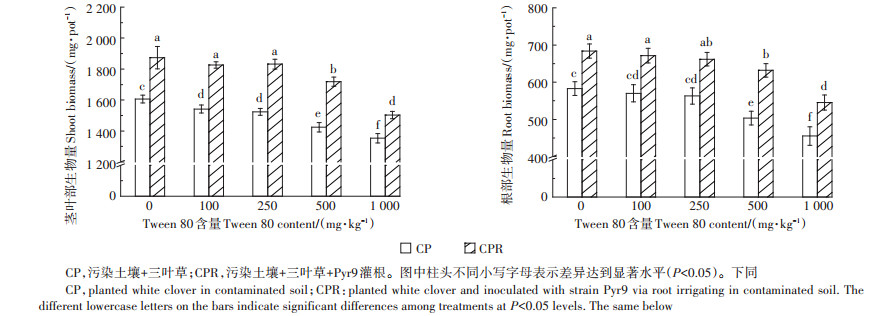
|
图 2 不同Tween 80添加量下三叶草的生物量 Figure 2 The biomass of the white clover under different Tween 80 contents |
不同剂量Tween 80的添加和细菌Pyr9的定殖对三叶草根部和茎叶部吸收积累芘的影响如图 3所示。随着Tween 80添加量的增加,三叶草根部和茎叶部的芘含量整体呈上升趋势。Tween 80含量在0~250 mg·kg-1时,三叶草中的芘含量上升迅速,Tween 80含量在250~1 000 mg·kg-1时,其上升相对平缓。不添加Tween 80时,CP组三叶草根部和茎叶部的芘含量分别为1.99 mg·kg-1和0.84 mg·kg-1,而添加250 mg·kg-1 Tween 80时其根部和茎叶部的芘含量分别为2.52 mg·kg-1和1.13 mg·kg-1,与不添加Tween 80对照组相比分别提高了27%和35%;而当Tween 80含量为1 000 mg·kg-1时,CP组三叶草根部和茎叶部的芘含量分别为2.66 mg·kg-1和1.10 mg·kg-1,与不添加Tween 80对照组相比分别提高了34%和31%。
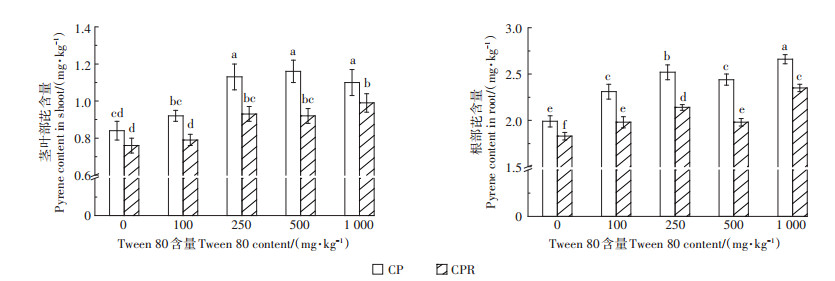
|
图 3 不同Tween 80添加量下三叶草中的芘含量 Figure 3 The contents of pyrene in the white clover under different Tween 80 contents |
菌株Pyr9在三叶草中的定殖能显著降低三叶草体内的芘含量(P < 0.05),且添加Tween 80可增强菌株Pyr9的作用效果。当不添加Tween 80时,CP组和CPR组三叶草根部芘含量分别为1.99 mg·kg-1和1.83 mg·kg-1,茎叶部芘含量分别为0.84 mg·kg-1和0.76 mg·kg-1;与CP组相比,CPR组三叶草根部和茎叶部芘含量分别降低了8.0%和9.5%。在Tween 80添加量为500 mg·kg-1时,CP组三叶草根部和茎叶部芘含量分别为2.44 mg·kg-1和1.16 mg·kg-1,此时CPR组三叶草根部和茎叶部芘含量分别为1.98 mg·kg-1和0.92 mg·kg-1,与CP组相比分别降低了19%和21%。以上结果表明,相较于细菌Pyr9的单独作用,添加适量Tween 80和细菌Pyr9共同作用对于降低植物体内的芘含量效果更为显著(P < 0.05)。
2.5 不同添加量Tween 80作用下细菌Pyr9和三叶草共同作用对根际土壤中芘的去除不同添加量Tween 80处理下土壤中的芘残留含量如图 4所示。从图中可以看出,在0~500 mg·kg-1范围内,随着Tween 80含量的增加,土壤中的芘含量呈逐渐降低的趋势。Tween 80添加量为500 mg·kg-1时,CK组土壤中芘含量为2.78 mg·kg-1,而不添加Tween 80的CK组为4.28 mg·kg-1,前者与后者相比土壤中的芘含量降低了35%。相较之下,Tween 80添加量为1 000 mg·kg-1时,CK组土壤中的芘含量(3.54 mg· kg-1)不再继续减少,反而有所增高,但仍低于不添加Tween 80的CK组(4.28 mg·kg-1)。
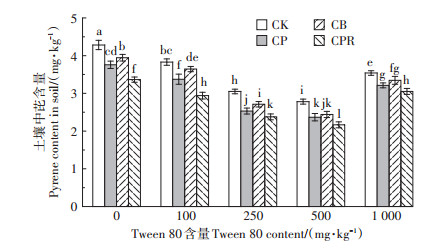
|
图 4 不同Tween 80添加量下土壤中的芘含量 Figure 4 The pyrene residues in soils under different Tween 80 contents |
对相同剂量Tween 80处理下CP组、CB组与CPR组土壤中芘的残留量进行比较发现,CPR组的芘含量要显著低于CP组和CB组(P < 0.05)。如当Tween 80添加量为100 mg·kg-1时,CP组、CB组和CPR组土壤中芘的残留量分别为3.37、3.64、2.94 mg·kg-1,CPR组比CP组和CB组分别降低了13%和19%,这表明相对于三叶草或菌株Pyr9的单独作用,三叶草和菌株Pyr9的共同作用对土壤中芘的去除效果更佳。当Tween 80添加量为500 mg·kg-1时,CPR组土壤中芘的残留量为2.17 mg·kg-1,与不添加Tween 80的CK组(4.28 mg · kg-1)相比降低了49%。综上所述,添加适量Tween 80有助于提高三叶草和菌株Pyr9共同作用下对土壤中芘的去除。
为了及时检测功能细菌Pyr9在根际土壤和三叶草中的分布,盆栽培养10 d后即采样检测了根际土壤和三叶草体内的芘含量,此时Tween 80-细菌Pyr9-三叶草共同作用对土壤中芘的去除并不彻底;若培养时间延长,该体系下的芘污染最终应该会被彻底消除。
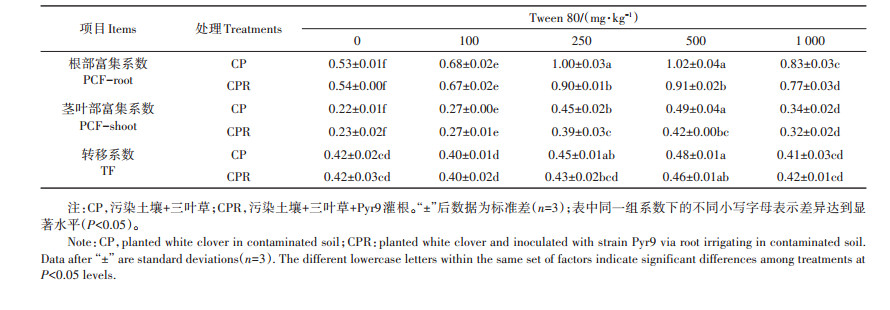
2.6 不同剂量Tween 80-细菌Pyr9共同作用下芘在三叶草中的富集和转移系数进一步计算了不同Tween 80添加量下三叶草对土壤中芘的富集系数以及芘在三叶草中的转移系数,结果如表 2所示。添加不同剂量Tween 80均使三叶草中芘的富集系数显著升高(P < 0.05),说明Tween 80促进了三叶草对土壤中芘的富集作用,增强了其芘污染风险;而接种功能细菌Pyr9可在一定程度上降低这种风险。随着Tween 80添加量的增加,三叶草中的芘富集系数整体呈先升后降的趋势;Tween 80添加量为500 mg·kg-1时,三叶草根部和茎叶部的芘富集系数最高。相较而言,芘在三叶草中的转移系数相对稳定,在Tween 80添加量改变或是否接种功能菌株Pyr9情况下的变化不大,说明芘从三叶草根部向茎叶部的转移受Tween 80或功能细菌Pyr9的影响不大。
|
|
表 2 不同Tween 80添加量下三叶草对土壤中芘的富集系数和转移系数 Table 2 The PCF and TF of pyrene in the white clover under different Tween 80 contents |
相比于阴离子和阳离子型表面活性剂,非离子型表面活性剂具有低毒性、易被生物降解的特点[20];Tween 80作为典型的非离子型表面活性剂,被广泛应用于土壤PAHs的植物-微生物联合修复[21]。本研究发现,中低剂量的Tween 80 (≤500 mg·kg-1)可以促进降解细菌Pyr9在土壤中的定殖和生长,而高剂量的Tween 80 (1 000 mg·kg-1)则会产生抑制作用。这可能是由于低剂量的Tween 80促进了土壤中芘的溶出[22],增加了芘的生物可利用性[23-24],进而促进了Pyr9的增殖[7];而高剂量的Tween 80对Pyr9有毒害作用,抑制了其增殖[25]。定殖于三叶草中的Pyr9的数量变化规律与土壤中类似,Tween 80含量为100 mg·kg-1时其数量最高,在土壤中则是Tween 80含量为500 mg·kg-1时其数量最高。造成这种差异的原因可能是高剂量Tween 80对植物根部有损害[7],不利于菌株Pyr9从三叶草根际向体内的迁移。此外,高剂量的Tween 80(500~1 000 mg·kg-1)显著抑制了三叶草的生长。推测原因,一方面是因为Tween 80对植物根部细胞有毒害作用[26],剂量越高,其对植物的毒害作用越大;另一方面,高剂量Tween 80促进了土壤中芘的溶出,从而增强了芘对植物的胁迫作用。而细菌Pyr9的定殖则使三叶草的生长抑制显著减低,这是由于Pyr9本身具备的产吲哚乙酸(IAA)、产铁载体以及溶磷能力促进了三叶草的生长;同时菌株Pyr9可快速降解三叶草根际和体内的芘,缓解了高浓度芘对三叶草的生长胁迫作用。
添加适量Tween 80可提高土壤中PAHs等有机污染物的溶解性和生物可利用性,使其更容易被植物吸收或被微生物降解[26-27]。在本研究中,添加不同剂量Tween 80均促进了三叶草对芘的吸收,且当Tween 80含量在0~250 mg·kg-1时,三叶草中的芘含量随Tween 80含量增加上升迅速。此外,随着Tween 80含量的增加,土壤中的芘含量先减少后增加,说明高浓度Tween 80(1 000 mg·kg-1)不利于土壤中芘的去除。众多研究也证实[20-21, 28],添加适量的Tween 80能显著提高PAHs的生物降解率;而过量添加Tween 80虽可促进土壤中PAHs的解吸并提高PAHs的溶解性,但会抑制PAHs的生物降解过程。其原因有以下三点:(1) PAHs与Tween 80胶束结合,反而降低了其生物有效性[29];(2)高浓度的Tween 80会破坏细菌细胞膜,导致细菌死亡[30];(3) Tween 80作为碳源和能源优先被微生物利用[31]。
PAHs降解细菌在根际土壤和植物中的定殖能有效减低植物体内的PAHs含量,降低其PAHs污染风险[12]。在本研究中,相比于不接种Pyr9的三叶草,接菌处理的三叶草根部和茎叶部芘含量显著降低,芘富集系数也明显下降。研究表明,植物根际和体内存在数量可观的PAHs降解细菌,可用于植物-微生物联合作用修复PAHs污染[32-33]。在根际微生态环境中,植物根系分泌物(糖类、有机酸和氨基酸等)可为根际细菌提供营养物质,并且吸引根际细菌在植物根表定殖形成聚集体或细菌生物膜。根际细菌则可通过产生促生物质促进植物生长,或是通过降解PAHs等有机污染物提高植物对污染环境的抗逆性[32, 34]。此外,一些定殖在植物根表的PAHs降解细菌还可进入植物体内成为内生细菌,直接降解植物体内的PAHs,或是诱导植物体内的PAHs代谢酶系,加速植物体内PAHs的去除[35]。另外,功能内生细菌也可通过基因水平转移将自身的PAHs降解基因转移给其他植物内生细菌[36],以加速植物体内PAHs的降解,减少PAHs在植物组织中的积累。
目前已有的研究多是关注Tween 80等表面活性剂对植物吸收代谢PAHs或微生物降解PAHs的影响,有关表面活性剂对降解细菌在植物根际和体内的定殖、分布以及效能的影响尚未见报道。本研究通过温室土培实验,研究了0~1 000 mg·kg-1的Tween 80作用下细菌Pyr9在三叶草根部的定殖和分布以及对三叶草吸收累积芘的影响,获得了一些初步的结果,为保障PAHs污染区农产品安全提供了理论依据。但本研究尚有几点不足之处,在此说明,并建议作为后续研究的关注点:(1)盆栽实验所采用的PAHs为单一芘污染,而实际环境中多为多种PAHs复合污染,且浓度差异较大,在这种复杂的环境中应用该技术效果如何尚不可知;(2)为了及时追踪菌株Pyr9在三叶草中的定殖和分布,三叶草植株的整体培养时间较短,后续可开展不同培养时间的连续采样检测,以监测各个指标的动态变化;(3)不同剂量Tween 80对植物根际和体内微生物群落结构以及PAHs代谢酶系活性的影响未做探讨。完成以上几个方面的研究,方可全面深入地阐述Tween 80-植物-微生物-PAHs之间的相互关系。
4 结论(1) 低剂量(100 mg·kg-1)的Tween 80可促进菌株Pyr9在三叶草中的定殖和生长,且对三叶草的生长影响不大。
(2) 高剂量(≥500 mg·kg-1)的Tween 80可抑制三叶草的生长,而菌株Pyr9的定殖则可促进三叶草的生长。
(3) 适当剂量Tween 80 (100~500 mg·kg-1)的施用可有效促进菌株Pyr9降解三叶草中的芘。
| [1] |
Gan S, Lau E V, Ng H K. Remediation of soils contaminated with polycyclic aromatic hydrocarbons(PAHs)[J]. Journal of Hazardous Materials, 2009, 172(2/3): 532-549. |
| [2] |
Falciglia P P, Guidi G D, Catalfo A, et al. Remediation of soils contaminated with PAHs and nitro-PAHs using microwave irradiation[J]. The Chemical Engineering Journal, 2016, 296: 162-172. DOI:10.1016/j.cej.2016.03.099 |
| [3] |
Wang Y, Tian Z, Zhu H, et al. Polycyclic aromatic hydrocarbons (PAHs)in soils and vegetation near an e-waste recycling site in south China:Concentration, distribution, source, and risk assessment[J]. Science of the Total Environment, 2012, 439: 187-193. DOI:10.1016/j.scitotenv.2012.08.018 |
| [4] |
Tang L, Tang X Y, Zhu Y G, et al. Contamination of polycyclic aromatic hydrocarbons(PAHs)in urban soils in Beijing, China[J]. Environment International, 2005, 31(6): 822-828. DOI:10.1016/j.envint.2005.05.031 |
| [5] |
Liu S H, Zeng G M, Niu Q Y, et al. Bioremediation mechanisms of combined pollution of PAHs and heavy metals by bacteria and fungi:A mini review[J]. Bioresource Technology, 2017, 224: 25-33. DOI:10.1016/j.biortech.2016.11.095 |
| [6] |
Gao Y Z, Ling W T, Wong M H. Plant-accelerated dissipation of phenanthrene and pyrene from water in the presence of a nonionic-surfactant[J]. Chemosphere, 2006, 63(9): 1560-1567. DOI:10.1016/j.chemosphere.2005.09.058 |
| [7] |
Liao C, Liang X, Lu G, et al. Effect of surfactant amendment to PAHscontaminated soil for phytoremediation by maize(Zea mays L.)[J]. Ecotoxicology and Environmental Safety, 2015, 112: 1-6. DOI:10.1016/j.ecoenv.2014.10.025 |
| [8] |
Liao C, Xu W, Lu G, et al. Biosurfactant-enhanced phytoremediation of soils contaminated by crude oil using maize(Zea mays L.)[J]. Ecological Engineering, 2016, 92: 10-17. DOI:10.1016/j.ecoleng.2016.03.041 |
| [9] |
Ni H, Zhou W, Zhu L. Enhancing plant-microbe associated bioremediation of phenanthrene and pyrene contaminated soil by SDBS-Tween 80 mixed surfactants[J]. Journal of Environmental Sciences, 2014, 26(5): 1071-1079. |
| [10] |
Ren C G, Kong C C, Bian B, et al. Enhanced phytoremediation of soils contaminated with PAHs by arbuscular mycorrhiza and rhizobium[J]. International Journal of Phytoremediation, 2017, 19(9): 789-797. DOI:10.1080/15226514.2017.1284755 |
| [11] |
Eskandary S, Tahmourespour A, Hoodaji M, et al. The synergistic use of plant and isolated bacteria to clean up polycyclic aromatic hydrocarbons from contaminated soil[J]. Journal of Environmental Health Science and Engineering, 2017, 15(1): 2-8. DOI:10.1186/s40201-016-0265-8 |
| [12] |
Sun K, Liu J, Jin L, et al. Utilizing pyrene-degrading endophytic bacteria to reduce the risk of plant pyrene contamination[J]. Plant and Soil, 2014, 374(1/2): 251-262. |
| [13] |
Lenoir I, Lounes-Hadj Sahraoui A, Fontaine J. Arbuscular mycorrhizal fungal-assisted phytoremediation of soil contaminated with persistent organic pollutants:A review[J]. European Journal of Soil Science, 2016, 67(5): 624-640. DOI:10.1111/ejss.12375 |
| [14] |
Jin J N, Yao J, Zhang Q Y, et al. An integrated approach of bioassay and molecular docking to study the dihydroxylation mechanism of pyrene by naphthalene dioxygenase in Rhodococcus sp. ustb-1[J]. Chemosphere, 2015, 128: 307-313. DOI:10.1016/j.chemosphere.2015.02.012 |
| [15] |
Ingrid L, Sahraoui A L H, Frédéric L, et al. Arbuscular mycorrhizal wheat inoculation promotes alkane and polycyclic aromatic hydrocarbon biodegradation:Microcosm experiment on aged-contaminated soil[J]. Environmental Pollution, 2016, 213: 549-560. DOI:10.1016/j.envpol.2016.02.056 |
| [16] |
刘爽, 刘娟, 高彦征, 等. 一株高效降解菲的植物内生细菌筛选及其生长特性[J]. 中国环境科学, 2013, 33(1): 95-102. LIU Shuang, LIU Juan, GAO Yan-zheng, et al. Isolation and characteristics of an efficient phenanthrene-degrading endophytic bacterium strain from plants[J]. China Environmental Science, 2013, 33(1): 95-102. DOI:10.3969/j.issn.1000-6923.2013.01.014 |
| [17] |
刘鑫, 黄兴如, 张晓霞, 等. 高浓度多环芳烃污染土壤的微生物-植物联合修复技术研究[J]. 南京农业大学学报, 2017, 40(4): 632-640. LIU Xin, HUANG Xing-ru, ZHANG Xiao-xia, et al. Experimental study on plant-microbial remediation of high concentration PAHscontaminated soil[J]. Journal of Nanjing Agricultural University, 2017, 40(4): 632-640. |
| [18] |
高彦征, 朱利中, 凌婉婷, 等. 土壤和植物样品的多环芳烃分析方法研究[J]. 农业环境科学学报, 2005, 24(5): 1003-1006. GAO Yan-zheng, ZHU Li-zhong, LING Wan-ting, et al. Analysis method for polycyclic aromatic hydrocarbons(PAHs)in plant and soil samples[J]. Journal of Agro-Environment Science, 2005, 24(5): 1003-1006. DOI:10.3321/j.issn:1672-2043.2005.05.035 |
| [19] |
Gao Y Z, Zhu L Z. Phytoremediation and its models for organic contaminated soils[J]. Journal of Environmental Sciences, 2003, 15(3): 302-310. |
| [20] |
Zhu H, Aitken M D. Surfactant-enhanced desorption and biodegradation of polycyclic aromatic hydrocarbons in contaminated soil[J]. Environmental Science & Technology, 2010, 44(19): 7260-7265. |
| [21] |
Cheng M, Zeng G, Huang D, et al. Tween 80 surfactant-enhanced bioremediation:Toward a solution to the soil contamination by hydrophobic organic compounds[J]. Critical Reviews in Biotechnology, 2018, 38(1): 17-30. |
| [22] |
Vishnyakov A, Lee M T, Neimark A V. Prediction of the critical micelle concentration of nonionic surfactants by dissipative particle dynamics simulations[J]. The Journal of Physical Chemistry Letters, 2013, 4(5): 797-802. DOI:10.1021/jz400066k |
| [23] |
Bezza F A, Chirwa E M N. Biosurfactant-enhanced bioremediation of aged polycyclic aromatic hydrocarbons(PAHs)in creosote contaminated soil[J]. Chemosphere, 2016, 144: 635-644. DOI:10.1016/j.chemosphere.2015.08.027 |
| [24] |
Lamichhane S, Krishna K C B, Sarukkalige R. Surfactant-enhanced remediation of polycyclic aromatic hydrocarbons:A review[J]. Journal of Environmental Management, 2017, 199: 46-61. |
| [25] |
Zhu R, Zhu L. Thermodynamics of naphthalene sorption to organoclays:Role of surfactant packing density[J]. Journal of Colloid and Interface Science, 2008, 322(1): 27-32. DOI:10.1016/j.jcis.2008.02.026 |
| [26] |
Mao X, Jiang R, Xiao W, et al. Use of surfactants for the remediation of contaminated soils:A review[J]. Journal of Hazardous Materials, 2015, 285: 419-435. DOI:10.1016/j.jhazmat.2014.12.009 |
| [27] |
Zhang D, Zhu L. Effects of Tween 80 on the removal, sorption and biodegradation of pyrene by Klebsiella oxytoca PYR-1[J]. Environmental Pollution, 2012, 164: 169-174. DOI:10.1016/j.envpol.2012.01.036 |
| [28] |
Kim H S, Weber W J. Preferential surfactant utilization by a PAH-degrading strain:Effects on micellar solubilization phenomena[J]. Environmental Science & Technology, 2003, 37(16): 3574-3580. |
| [29] |
Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):A review[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15. |
| [30] |
Cheng M, Zeng G, Huang D, et al. Advantages and challenges of Tween 80 surfactant-enhanced technologies for the remediation of soils contaminated with hydrophobic organic compounds[J]. Chemical Engineering Journal, 2017, 314: 98-113. DOI:10.1016/j.cej.2016.12.135 |
| [31] |
Shoji Y, Igarashi T, Nomura H, et al. Liposome solubilization induced by surfactant molecules in a microchip[J]. Analytical Sciences, 2012, 28(4): 339-343. DOI:10.2116/analsci.28.339 |
| [32] |
Kumari B, Rajput S, Gaur P, et al. Biodegradation of pyrene and phenanthrene by bacterial consortium and evaluation of role of surfactant[J]. Cellular and Molecular Biology(Noisy-le-Grand, France), 2014, 60(5): 22-28. |
| [33] |
Khan S, Afzal M, Iqbal S, et al. Plant-bacteria partnerships for the remediation of hydrocarbon contaminated soils[J]. Chemosphere, 2013, 90(4): 1317-1332. DOI:10.1016/j.chemosphere.2012.09.045 |
| [34] |
Weyens N, Truyens S, Dupae J, et al. Potential of the TCE-degrading endophyte Pseudomonas putida W619-TCE to improve plant growth and reduce TCE phytotoxicity and evapotranspiration in poplar cuttings[J]. Environmental Pollution, 2010, 158(9): 2915-2919. DOI:10.1016/j.envpol.2010.06.004 |
| [35] |
Arslan M, Imran A, Khan Q M, et al. Plant-bacteria partnerships for the remediation of persistent organic pollutants[J]. Environmental Science and Pollution Research, 2017, 24(5): 4322-4336. DOI:10.1007/s11356-015-4935-3 |
| [36] |
Shehzadi M, Afzal M, Khan M U, et al. Enhanced degradation of textile effluent in constructed wetland system using Typha domingensis and textile effluent-degrading endophytic bacteria[J]. Water Research, 2014, 58: 152-159. |
 2020, Vol. 39
2020, Vol. 39