磺胺类药物是使用最广泛的兽用抗生素品种之一[1]。其进入动物体内并不能被动物体吸收代谢完全,约有50%~90%以母体化合物或其代谢产物的形式经由动物粪尿排出体外,再随畜禽粪便的施用进入环境[2]。有报道指出猪粪中磺胺类药物的含量为20~ 40 mg·kg-1[3],Ji等[4]也指出施用过猪粪的农田土壤中磺胺类药物含量范围可高达4.54~24.66 mg·kg-1。磺胺类药物是广谱抑菌抗生素,可抑制叶酸途径中二氢蝶酸合成,进而抑制细菌的繁殖。因此,当磺胺类抗生素进入土壤后,土壤中的微生物种群数量和结构组成都会受到影响[5-6]。目前已有大量文献报道了磺胺二甲嘧啶(SMZ)施入土壤后短期内对土壤微生物活性和群落多样性有抑制作用,如刁晓平等[7]采用室内培养法,研究了10、100 mg·kg-1和500 mg·kg-1磺胺二甲嘧啶培养24 h和48 h后对不同土壤微生物种群数量的影响,结果表明磺胺二甲嘧啶短期培养后对所测的4种土壤中的细菌均具有抑制作用,且这种抑制作用随浓度的降低而出现下降的趋势。张敏等[8]采用Biolog法,研究了磺胺二甲嘧啶对沼气发酵过程中微生物群落的影响,结果表明在沼气发酵第6 d,20、60 mg·kg-1和120 mg·kg-1磺胺二甲嘧啶对微生物群落功能多样性和物种丰富度均有抑制作用,且浓度越高抑制作用越显著。磺胺类抗生素在土壤中的降解是一个先快后慢的过程,在光照条件下磺胺类抗生素在江西红壤中降解半衰期为20~58.5 d,在太湖水稻土和东北黑土中降解半衰期为5.3~16.5 d,90%降解率所需时长均大于180 d[9]。目前关于磺胺二甲嘧啶对土壤微生物影响的研究多围绕其输入后的短期效应,缺乏其输入后对土壤微生物中长期影响的研究,关于磺胺二甲嘧啶降解产物的研究也多集中在水体中,对其在土壤中降解产物的研究较为鲜见。因此,结合磺胺二甲嘧啶在土壤中降解半衰期,有必要开展其对土壤微生物中长期效应的研究。
本课题组前期工作表明在稻田试验中输入30 mg·kg-1磺胺二甲嘧啶47 d和61 d后,磺胺二甲嘧啶对稻田N2O(由硝化或反硝化作用产生)排放仍具有显著促进作用(P < 0.05),但是磺胺二甲嘧啶残留率仅为1.8%~5.2%[10]。该阶段磺胺二甲嘧啶在土壤中的降解转化及其对土壤微生物群落结构的影响值得深入探索,故本文结合HPLC-MS分析和Illumina Miseq测序两种技术研究磺胺二甲嘧啶母体及其降解产物对土壤微生物的影响,以期深入了解磺胺二甲嘧啶输入土壤后的中长期效应,为了解其环境生态风险提供科学依据。
1 材料与方法 1.1 试验设计田间试验位于江苏省南京市江宁区典型稻麦轮作区(118°59′ E,31°57′ N),试验田土壤有机碳含量为29.39 g·kg-1,全氮含量为1.93 g·kg-1,pH为7.67,土壤容重为1.30 g·cm-3。供试抗生素为上海麦克林公司生产的磺胺二甲嘧啶试剂。供试猪粪为经堆置的从未接触过任何抗生素的家猪排泄物,全氮含量为8.82 g·kg-1,有机质为752.03 g·kg-1。试验处理设置为:以猪粪(M)为基肥,尿素为追肥,有无30 mg·kg-1磺胺二甲嘧啶(M和M+SMZ)和以复合肥(F)为基肥,尿素为追肥,有无30 mg·kg-1磺胺二甲嘧啶(F和F+ SMZ)。本试验供试水稻品种为南粳55号,水稻于2017年6月4日播种,2017年11月11日收获。4个处理施氮总量(以N计)均为220 kg·hm-2,按基肥:追肥=1:1比例撒施,磺胺二甲嘧啶随基肥一次性施入,追肥时不再添加。基追肥时间分别为2017年6月4日和2017年7月29日。试验田采用微区设计,小区面积为3 m×2 m,每个处理设置3个重复,随机排列。各小区之间设有80 cm宽、30 cm高的田埂,田埂用塑料薄膜覆盖,且每个小区都有各自独立的灌排水系统,以防止水肥串流。整个水稻生育期N:P2O5:K2O施肥比例为2:1:1。猪粪处理不足的磷钾以过磷酸钙(P2O5,12%)和氯化钾(K2O,60%)补充。除肥料外,试验田按照当地常规措施进行水药管理。采集磺胺二甲嘧啶输入稻田47 d和61 d后的4个处理表层(0~ 20 cm)土壤样品,用于磺胺二甲嘧啶及其降解产物残留测定、DNA的提取和测序分析。
在田间试验结果明确了降解产物为2-氨基-4,6-二甲基嘧啶(ADPD)和4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺(AN)的基础上,为了进一步明确磺胺二甲嘧啶输入土壤47 d和61 d后是否是其降解产物在土壤中起主导作用,本文进行了室内模拟验证培养试验。处理设置同田间试验,将1 mg·kg-1 ADPD(上海麦克林生化科技有限公司,97%)分别与猪粪(M)或复合肥(F)(N,50 mg·kg-1干土)同步添加于土壤中(M+ADPD和F+ADPD),同时做无ADPD对照(M和F),每个处理3个重复,在恒温恒湿(25 ℃、95%水分)条件下进行室内模拟培养。培养48 h后采集土样,进行DNA的提取和测序分析。因无4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺化学纯品销售,故未能进行此降解产物验证试验。
1.2 分析方法 1.2.1 磺胺二甲嘧啶残留和降解产物提取测定用HPLC(美国Agilent)进行磺胺二甲嘧啶残留检测。磺胺二甲嘧啶提取方法参考文献[11],HPLC参数为流动相:0.1%甲酸溶液:乙腈=83:17;紫外检测器:270 nm;柱温:25 ℃;进样量:20 μL;流速0.8 mL·min-1,色谱柱:C18柱。磺胺二甲嘧啶降解产物提取方法同磺胺二甲嘧啶提取方法[11],利用HPLC-MS (美国Agilent,1200-6410B三重串联四极杆液质连用仪)进行降解产物鉴别。流动相:0.1%甲酸溶液:乙腈=83:17;紫外检测器:270 nm;柱温:25 ℃;进样量:10 μL;正离子模式(ESI+);喷雾器压力为30 psi (1 psi=6.895 kPa);拉伸电压:125 V;扫描范围:m/z 50~500。通过外标法利用HPLC-MS对磺胺二甲嘧啶降解产物2-氨基-4,6-二甲基嘧啶进行定量分析,外标物为0.01 mg·mL-1 2-氨基-4,6-二甲基嘧啶标准溶液。由于没有4-[2-亚氨基-4,6-二甲基嘧啶-1 (2H)-基]苯胺标品,所以4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺浓度是其质谱中离子丰度与0.01 mg·mL-1 2-氨基-4,6-二甲基嘧啶离子丰度换算得到的相对值。
1.2.2 土样DNA的提取与检测DNA的提取步骤根据E.Z.N.A.®土壤DNA试剂盒(OMEGA)操作,完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
1.2.3 PCR扩增和测序以土样提取的DNA为模板,使用细菌通用引物341F和806R扩增样品中16S rRNA基因。PCR扩增体系是20 μL:4 μL 5×FastPfu缓冲液、2 μL dNTPs (2.5 mmol·L-1)、0.8 μL Forward Primer(5 μmol·L-1)、0.8 μL Reverse Primer(5 μmol·L-1)、0.4 μL FastPfu聚合酶、10 ng DNA模板,补灭菌水至20 μL。PCR扩增程序为:95 ℃预变性5 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min,每个样本3个重复。将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,用Tris_HCl洗脱,最后再用2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFluorTM- ST蓝色荧光定量系统(Promega公司)进行检测定量,按照每个样本的测序量要求,进行相应比例的混合。之后构建Illumina PE250文库,使用Illumina PE250平台进行高通量测序,测序工作由上海凌恩生物科技有限公司完成。
1.2.4 数据处理Illumina PE250测序序列:根据barcode得到所有样品的有效序列,然后对reads的质量进行质控过滤,再根据PE reads之间的overlap关系,将成对的reads拼接成一条序列,最后按照barcode和引物序列拆分得到每个样本的优质序列,并在过程中根据正反bar⁃ code和引物方向校正序列方向以及去除嵌合体。利用Usearch平台,根据97%相似性对非重复序列进行OTU聚类,采用RDP classifier贝叶斯算法对OTU代表序列进行物种分类分析,比对采用Silva[12]数据库。利用R语言进行Alpha多样性指数分析,Origin软件进行作图分析。
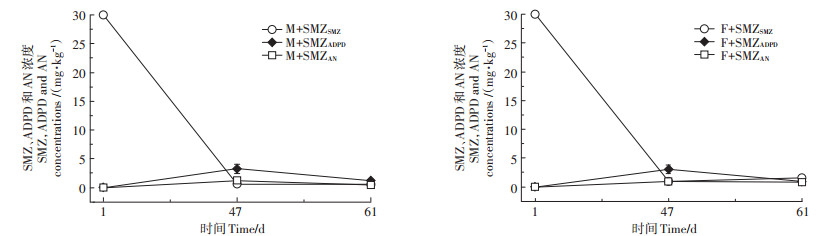
2 结果与分析 2.1 磺胺二甲嘧啶降解产物定性与定量利用HPLC-MS对磺胺二甲嘧啶在土壤中的降解产物进行鉴定,全扫描模式下化合物的总离子流如图 1所示。与对照M或F处理对比,M+SMZ或F+SMZ处理在两个采样时间的m/z 124峰值和m/z 215峰值均有明显增加。由此可知,磺胺二甲嘧啶在土壤中降解产生了m/z 124和m/z 215两种物质。采用MS-MS模式对这两种降解产物的分子结构进行分析,结果与水溶液中磺胺二甲嘧啶降解产物的研究比较,得到这两种降解产物的裂解途径和分子结构(图 2) [13-14]。说明磺胺二甲嘧啶输入稻田47 d和61 d后,均降解产生了2-氨基-4,6-二甲基嘧啶和4-[2-亚氨基-4,6-二甲基嘧啶-1 (2H)-基]苯胺[15-16]。定量分析结果(图 3)表明,磺胺二甲嘧啶含量随输入土壤时间的延长而逐渐降低,2-氨基-4,6-二甲基嘧啶和4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺含量则呈现先增后减趋势,且2-氨基-4,6-二甲基嘧啶是磺胺二甲嘧啶的主要降解产物。

|
图 1 SMZ输入稻田后47 d和61 d的总离子流图 Figure 1 Total ion chromatogram(TIC)of SMZ input into the rice fields after 47 d and 61 d |

|
图 2 TIC图中m/z 124和m/z 215二级质谱图 Figure 2 Mass spectra of the degradation products of m/z 124 and m/z 215 in TIC |
|
图 3 不同处理SMZ、ADPD和AN含量变化 Figure 3 Variation of SMZ, ADPD and AN content in different treatments |
稀释曲线是采用随机抽样的方法,以抽取到的序列数和它们所代表的OTU数目来构建曲线,它可以用来比较各样本间物种的丰富度,也可以用来说明样本的测序数据量是否合理。由图 4可知,当随机抽取的序列数达到30 000条时,稀释曲线增加趋势均趋于平缓,并且样本覆盖度(Coverage)均在95%以上,说明样品测序数据量足够大,能够有效反映样品中绝大多数微生物物种的信息。

|
图 4 不同处理稀释曲线 Figure 4 Dilution curves of different treatments |
基于OUT聚类分析结果,对OUT进行Alpha多样性分析。表 1是各处理Alpha多样性指数,与同种肥源对照相比,除ADPD处理Shannon和ACE指数有显著差异(P < 0.05)外,其他处理OTU、Shannon和ACE指数均差异不显著(P>0.05),表明无论基肥是猪粪还是复合肥,2-氨基-4,6-二甲基嘧啶对土壤微生物群落丰富度和多样性均有显著影响,而磺胺二甲嘧啶对土壤微生物群落丰富度和多样性影响差异不显著。
|
|
表 1 不同处理Alpha多样性指数 Table 1 Alpha diversity index for different treatments |
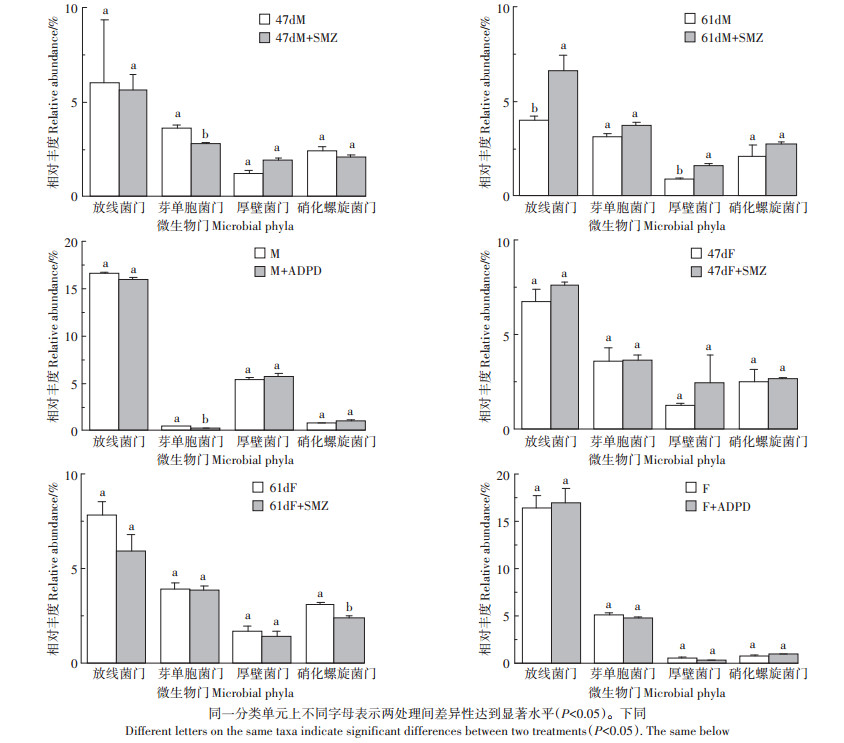
图 5是各处理在门水平上有显著差异变化的优势细菌(放线菌门、芽单胞菌门、厚壁菌门和硝化螺旋菌门)的平均相对丰度。磺胺二甲嘧啶输入稻田47 d后M+SMZ与M处理比较,芽单胞菌门相对丰度显著降低了0.81% (P < 0.05),表明该阶段M+SMZ处理对芽单胞菌门有显著抑制作用。F+SMZ与F处理比较,放线菌门、芽单胞菌门、厚壁菌门和硝化螺旋菌门相对丰度变化均无显著差异(P>0.05)。磺胺二甲嘧啶输入稻田61 d后M+SMZ与M处理对比,放线菌门、芽单胞菌门、厚壁菌门和硝化螺旋菌门相对丰度也均表现出不同程度的增加,其中放线菌门和厚壁菌门显著增加2.66%和0.71%(P < 0.05),表明此时M+SMZ处理对放线菌门和厚壁菌门均有显著促进作用。F+SMZ与F处理相比,4个菌门相对丰度则均呈现出下降的趋势,降幅为0.09%~1.95%,硝化螺旋菌门相对丰度降低达显著水平(P < 0.05)。ADPD培养验证试验结果与磺胺二甲嘧啶输入稻田47 d后的田间试验结果一致,也表明了ADPD与猪粪同步输入土壤后对芽单胞菌门有显著抑制作用(P < 0.05)。
|
图 5 不同处理放线菌门、芽单胞菌门、厚壁菌门和硝化螺旋菌门相对丰度 Figure 5 Relative abundance of Actinobacteria, Gemmatimonadetes, Firmicutes and Nitrospirae of different treatments |
图 6是各处理在属水平上有显著差异变化的优势细菌(Subgroup6_norank、芽单胞菌属、热脱硫杆菌属和伯克氏菌属)的平均相对丰度。磺胺二甲嘧啶输入稻田47 d后M+SMZ和M处理比较,Subgroup6_norank菌属相对丰度显著增加0.54%(P < 0.05),芽单胞菌属、热脱硫杆菌属和伯克氏菌属相对丰度均有所下降,其中芽单胞菌属显著降低0.70%(P < 0.05),表明此时M+SMZ处理对Subgroup6_norank菌属有显著促进作用,对芽单胞菌属起显著抑制作用。F+SMZ和F处理比较,芽单胞菌属和热脱硫杆菌属相对丰度增加0.13%和0.12%,Subgroup6_norank和伯克氏菌属相对丰度则分别下降1.50%和0.04%,增加和降低均不显著(P>0.05)。磺胺二甲嘧啶输入稻田61 d后M+SMZ与M处理相比,伯克氏菌属相对丰度极显著增加0.25% (P < 0.01)。该时段F+SMZ与F处理相比,热脱硫杆菌属相对丰度显著降低0.43%(P < 0.05),表明以猪粪或复合肥为基肥时,磺胺二甲嘧啶对土壤微生物菌属的中长期效应不同。此外,ADPD培养验证试验结果也证实了ADPD与猪粪同步输入土壤后对Subgroup6_norank有显著促进作用(P < 0.05),与复合肥同步输入土壤后与猪粪趋势一致,但未达显著作用水平(P>0.05)。

|
图 6 不同处理Subgroup6_norank、芽单胞菌属、热脱硫杆菌属和伯克氏菌属的相对丰度 Figure 6 Relative abundance of Subgroup6_norank, Gemmatimonadaceae, Thermodesulfovibrionia and Burkholderiaceae of different treatments |
磺胺类抗生素在氧化过程中,其分子结构中的磺酰胺键容易发生断裂生成小分子化合物[17]。在本研究中,磺胺二甲嘧啶磺酰胺键断裂产生了2-氨基-4,6-二甲基嘧啶,且与标准样品进行比较得到了证实,这与水中活性氧作用下磺胺二甲嘧啶的降解产物一致,也与磺胺二甲嘧啶光解过程中的降解产物一致[18-19]。磺胺二甲嘧啶在水中化学降解和光降解得到的产物与土壤中生物降解的相同,说明磺胺二甲嘧啶的非生物降解和生物降解遵循一定的规律[20]。在本研究中,磺胺二甲嘧啶降解还产生了4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺,这与Gao等[21]在紫外光作用下过硫酸盐氧化磺胺二甲嘧啶的研究结果一致。磺胺二甲嘧啶分子上的苯氨基能够转化为苯氨基阳离子,苯胺基阳离子对位遭受分子间嘧啶氮亲核作用而发生分子间重排,导致O=S=O脱除,生成4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺[22-24]。由于缺少4-[2-亚氨基-4,6-二甲基嘧啶-1 (2H)-基]苯胺标准样品,所以本试验未对其进行确切验证和深入研究。磺胺二甲嘧啶另外一个重要的转化途径是其苯胺部分逐步氧化,生成N4-OH-SMZ、4- NO2-SMZ和N-(4,6-二甲基嘧啶-2-基)苯磺酰胺等中间产物,这些中间产物可进一步降解,最终分解为二氧化碳和水[14-15, 25]。目前本研究只鉴定到了2-氨基-4,6-二甲基嘧啶和4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺两种降解产物,磺胺二甲嘧啶其他降解产物还需进一步研究。
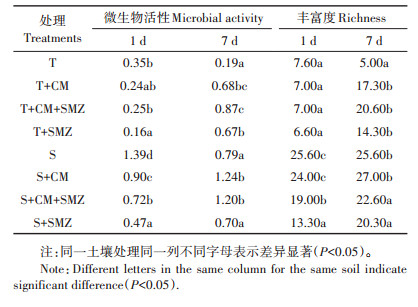
3.2 磺胺二甲嘧啶及其降解产物对土壤微生物的影响磺胺类抗生素的化学结构类似于对氨基苯甲酸,能与对氨基苯甲酸竞争二氢叶酸合成酶,阻断细菌中二氢叶酸的合成,抑制以二氢叶酸为底物的四氢叶酸的合成,进而影响细胞中嘌呤和嘧啶的合成,抑制细菌的正常生长和繁殖[26]。表 2是牛粪(CM)和53.60 mg·kg-1磺胺二甲嘧啶单一和复合添加至T([意大利]图拉)和S([意大利]萨萨里)两种土壤中,短期培养7 d,期间土壤微生物多样性的变化结果[27]。由此可知短期培养期间,磺胺二甲嘧啶对添加牛粪的T土壤处理微生物活性和丰富度有促进作用,对未添加牛粪的T土壤处理微生物活性和丰富度起先抑后促作用;在S土壤中,磺胺二甲嘧啶对各处理微生物活性和丰富度均有抑制作用。这与本文磺胺二甲嘧啶对土壤微生物群落多样性和丰富度的中长期效应结果不一致。究其原因,是在本研究中磺胺二甲嘧啶已经降低至较低水平,此时2-氨基-4,6-二甲基嘧啶和4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺等中间产物在土壤中起主要作用,中间产物结构与母体不同,不具备类似对氨基苯甲酸的化学结构,所以其对微生物的生态毒性要比母体低。Zessel等[28]研究表明磺胺二甲嘧啶光解过程中降解产物对细胞增殖的影响低于母体。GarcÍa-Galán等[29]利用单细胞绿藻检测磺胺二甲嘧啶及其降解产物的毒性,结果证明磺胺二甲嘧啶的中间产物毒性均低于母体。因此,在本研究中磺胺二甲嘧啶及其降解产物对土壤细菌群落影响要小于初期磺胺二甲嘧啶对土壤微生物的影响。抗生素在土壤中的长期残留还会诱导产生大量的抗生素耐药微生物及抗性基因,进一步导致磺胺二甲嘧啶及其降解产物对土壤细菌群落的影响无显著差异,Zhang等[30]研究表明四环素在土壤中长期积累能够促进四环素抗性基因产生和传播,Xi等[31]研究表明水产养殖场沉积泥中微生物群落对抗生素长期残留能够产生适应性。
|
|
表 2 不同土壤牛粪和磺胺二甲嘧啶单一和复合处理培养7 d期间土壤微生物活性和丰富度变化[27] Table 2 Changes of soil microbial activity and richness during 7 d of single and combination treatment of cow manure and SMZ for different soils[27] |
本研究中,放线菌门、厚壁菌门、硝化螺旋菌门(硝化细菌)、Subgroup6_norank和伯克氏菌属均具有一定生物降解作用。Lan等[32]最新研究指出Subgroup6_norank菌属能够将复杂的有机物发酵成为酸,Gu等[33]研究指出厚壁菌门中大部分细菌能够通过发酵作用将多种碳源降解转化为乳酸、丙酮、丁醇和乙醇等小分子物质,蒋悦秋等[34]对农药毒死蜱降解菌研究表明伯克氏菌属CD5和CD7菌株均能高效降解土壤中的毒死蜱,吴凡等[35]的研究表明硝化细菌能够有效促进土壤中碘普罗胺降解。这些具有降解作用的细菌相对丰度显著增加,说明土壤微生物的功能性发生变化,这与磺胺二甲嘧啶在土壤中的降解转化有着密切的联系。而芽单胞菌门能够将各种糖分子转化为维生素,热脱硫杆菌属在土壤中起反硫化作用,两者相对丰度显著降低的原因还有待进一步研究。
本研究中,2-氨基-4,6-二甲基嘧啶对土壤微生物群落丰富度和多样性均有显著影响,而磺胺二甲嘧啶对土壤微生物群落丰富度和多样性影响差异不显著。降解产物2-氨基-4,6-二甲基嘧啶反而比母体磺胺二甲嘧啶对土壤微生物结构与功能的影响更大,其原因有待进一步研究。在磺胺二甲嘧啶输入稻田47 d后,M+SMZ处理对芽单胞菌门有显著抑制作用,对Subgroup6_norank菌属有显著促进作用,这与培养试验中ADPD、猪粪同步输入土壤后,对芽单胞菌门相对丰度有显著抑制作用和对Subgroup6_norank菌属相对丰度有显著促进作用结果一致。此时磺胺二甲嘧啶基本已经降解为2-氨基-4,6-二甲基嘧啶和4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺等中间产物,其中2-氨基-4,6-二甲基嘧啶质谱信号最强,含量最高,且培养验证试验也进一步证实了2-氨基-4,6-二甲基嘧啶在此阶段对土壤微生物起主要影响作用。此外,M+SMZ处理中的放线菌门、厚壁菌门和伯克氏菌属相对丰度变化趋势与M+ADPD处理一致,F+SMZ处理中的放线菌门、硝化螺旋菌门、芽单胞菌属和热脱硫杆菌属相对丰度变化趋势与F+ ADPD处理吻合,也说明了此时2-氨基-4,6-二甲基嘧啶作为磺胺二甲嘧啶的主要降解产物在土壤中对微生物起主要影响作用。而磺胺二甲嘧啶输入稻田61 d后,M+SMZ处理对放线菌门和厚壁菌门有显著促进作用,对伯克氏菌属有极显著促进作用,F+SMZ处理对热脱硫杆菌属有显著抑制作用,各处理间其他细菌相对丰度变化趋势也与ADPD处理不一致。可能是因为2-氨基-4,6-二甲基嘧啶和4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺转化为其他降解产物,其含量降低,新的降解产物在土壤中对微生物起主要作用。Ana等[18]研究表明2-氨基-4,6-二甲基嘧啶可以进一步羟基化为4,6-二甲基-2,5-二氢嘧啶- 2,5-二醇。Fan等[14]研究指出4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基)]苯胺能继续氧化为亚硝基衍生物和羟基化亚硝基衍生物。Dong等[13]研究表明磺胺二甲嘧啶中间降解产物会随时间变化而变化。土壤中磺胺二甲嘧啶降解产物不同,其对土壤微生物的生态毒性也不同。肖华花[19]研究发现磺胺二甲嘧啶光解过程中母体与降解产物对明亮发光杆菌的毒性随反应时间的变化而变化。魏子艳[36]研究发现抗生素对土壤微生物的影响随染毒时间的延长而变化。因此,磺胺二甲嘧啶降解产物的变化及其对微生物的生态效应有待进一步研究。
本文试验结果还表明以猪粪和复合肥作基肥时,磺胺二甲嘧啶对土壤微生物菌属的中长期效应不同。这可能是由于粪肥的添加增加了土壤中有机质含量,有机质中含有大量带负电荷的官能团,这些官能团能够吸附带正电荷的兽用抗生素及其降解产物离子,或通过氢键和富电子基团的亲核加成作用与兽用抗生素及其降解产物结合,进而影响土壤中兽用抗生素及其降解产物的生态毒性[37]。因此,需进一步探明不同施肥处理对兽用抗生素及其降解产物的影响机制,为降低其环境生态风险提供助力。
4 结论无论基肥是猪粪还是复合肥,磺胺二甲嘧啶输入土壤47 d和61 d后都降解产生了2-氨基-4,6-二甲基嘧啶和4-[2-亚氨基-4,6-二甲基嘧啶-1(2H)-基]苯胺,其中2-氨基-4,6-二甲基嘧啶为主要降解产物。在本研究中,磺胺二甲嘧啶对土壤微生物群落多样性和丰富度变化均无显著影响,但在微生物优势群落组成上,磺胺二甲嘧啶与猪粪同步输入土壤47 d后对芽单胞菌门和芽单胞菌属有显著抑制作用,对Subgroup6_norank菌属有显著促进作用,输入土壤61 d后对放线菌门和厚壁菌门有显著促进作用,对伯克氏菌属有极显著促进作用,而磺胺二甲嘧啶与复合肥同步输入土壤仅在61 d后对热脱硫杆菌属有显著抑制作用,原因在于该时段土壤中磺胺二甲嘧啶已降至较低水平,2-氨基-4,6-二甲基嘧啶等中间产物起主要作用。
| [1] |
Sarmah A K, Meyer M T, Boxall A B. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics VAs in the environment[J]. Chemosphere, 2006, 65(5): 725-759. DOI:10.1016/j.chemosphere.2006.03.026 |
| [2] |
Thiele B S. Pharmaceutical antibiotic compounds in soils:A review[J]. Journal of Plant Nutrition and Soil Science, 2003, 166: 145-167. DOI:10.1002/jpln.200390023 |
| [3] |
Burkhardt M, Stoob K, Stamm C, et al. Veterinary antibiotics in animal slurries:A new environmental issue in grassland research[J]. Grassland Science in Europe, 2004, 9: 322-324. |
| [4] |
Ji X L, Shen Q H, Liu F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai, China[J]. Journal of Hazardous Materials, 2012, 235: 178-185. |
| [5] |
Lin H, Jin D F, Freitag T E, et al. A compositional shift in the soil microbiome induced by tetracycline, sulfamonomethoxine and ciprofloxacin entering a plant-soil system[J]. Environmental Pollution, 2016, 212: 440-448. DOI:10.1016/j.envpol.2016.02.043 |
| [6] |
Hammesfahr U, Heuer H, Manzke B, et al. Impact of the antibiotic sulfadiazine and pig manure on the microbial community structure in agricultural soils[J]. Soil Biology & Biochemistry, 2008, 40(7): 1583-1591. |
| [7] |
刁晓平, 孙英健, 孙振钧, 等. 磺胺二甲基嘧啶对土壤微生物活动的影响[J]. 农业环境科学学报, 2005, 24(4): 694-697. DIAO Xiao-ping, SUN Ying-jian, SUN Zhen-jun, et al. Effects of sulfamethazine on microbial activity in different types of soil[J]. Journal of Agro-environmental Science, 2005, 24(4): 694-697. DOI:10.3321/j.issn:1672-2043.2005.04.017 |
| [8] |
张敏, 张俊, 钱金秋, 等. 磺胺二甲嘧啶对沼气发酵过程中酶活性和微生物群落功能多样性的影响[J]. 生态与农村环境学报, 2017, 33(7): 653-659. ZHANG Min, ZHANG Jun, QIAN Jin-qiu, et al. Effects of sulfadimidine on enzyme activity and microbial community functional diversity during biogas fermentation[J]. Journal of Ecology and Rural Environment, 2017, 33(7): 653-659. |
| [9] |
许静, 王娜, 孔德洋, 等. 磺胺类药物在土壤中的降解性[J]. 环境化学, 2013, 32(12): 2349-2356. XU Jing, WANG Na, KONG De-yang, et al. Degradation of sulfa drugs in soil[J]. Environmental Chemistry, 2013, 32(12): 2349-2356. DOI:10.7524/j.issn.0254-6108.2013.12.019 |
| [10] |
吴杰, 李志琳, 徐佳迎, 等. 兽用抗生素磺胺二甲嘧啶对稻田N2O排放的影响及其微生物机制[J]. 环境科学, 2019, 40(6): 2847-2857. WU Jie, LI Zhi-ling, XU Jia-ying, et al. Effects of the veterinary antibiotic sulfadimidine on N2O emission in rice fields and its microbial mechanism[J]. Environmental Science, 2019, 40(6): 2847-2857. |
| [11] |
李彦文, 莫测辉, 赵娜, 等. 高效液相色谱法测定水和土壤中磺胺类抗生素[J]. 分析化学, 2008, 7(36): 954-958. LI Yan-wen, MO Ce-hui, ZHAO Na, et al. Determination of sulfanilamide antibiotics in water and soil by high performance liquid chromatography[J]. Analytical Chemistry, 2008, 7(36): 954-958. |
| [12] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): 590-596. |
| [13] |
Dong F L, Li C, He G L, et al. Kinetics and degradation pathway of sulfamethazine chlorination pilot-scale water distribution systems[J]. Chemical Engineering Journal, 2017, 321: 521-532. DOI:10.1016/j.cej.2017.03.130 |
| [14] |
Fan Y, Ji Y F, Kong D Y, et al. Kinetic and mechanistic investigations of the degradation of sulfamethazine in heat-activated persulfate oxidation process[J]. Journal of Hazardous Materials, 2015, 300: 39-47. DOI:10.1016/j.jhazmat.2015.06.058 |
| [15] |
García-Galán M J, Rodríguez-Rodríguez C E, Vicent T, et al. Biodegradation of sulfamethazine by Trametes versicolor:Removal from sewage sludge and identification of intermediate products by UPLC-QqTOF-MS[J]. Science of the Total Environment, 2011, 409(24): 5505-5512. DOI:10.1016/j.scitotenv.2011.08.022 |
| [16] |
Sleman F, Mahmoud W M M, Schubert R, et al. Photodegradation, photocatalytic and aerobic biodegradation of sulfisomidine and identification of transformation products by LC-UV-MS/MS[J]. Clean:Soil, Air, Water, 2012, 40(11): 1244-1249. DOI:10.1002/clen.201100485 |
| [17] |
Zhang Y, Hu S H, Zhang H C, et al. Degradation kinetics and mechanism of sulfadiazine and sulfamethoxazole in an agricultural soil system with manure application[J]. Science of the Total Environment, 2017, 607/608: 1348-1356. DOI:10.1016/j.scitotenv.2017.07.083 |
| [18] |
Ana P S B, Flavio C C P, Antonio C S C T. The role of reactive oxygen species in sulfamethazine degradation using UV-based technologies and products identification[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2014, 290(1): 77-85. |
| [19] |
肖华花.磺胺二甲嘧啶在水环境中的光化学行为及光催化降解研究[D].广州: 广东工业大学, 2015: 47-48. XIAO Hua-hua. Photochemical behavior and photocatalytic degradation of sulfamethazine in water[D]. Guangzhou: Guangdong University of Technology, 2015: 47-48. |
| [20] |
Cao L J, Zhang J Y, Zhao R X, et al. Genomic characterization, kinetics, and pathways of sulfamethazine biodegradation by Paenarthrobacter sp. A01[J]. Environment International. DOI:10.1016/j.envint.2019.104961 |
| [21] |
Gao Y Q, Gao N Y, Deng Y, et al. Ultraviolet(UV)light-activated persulfate oxidation of sulfamethazine in water[J]. Chemical Engineering Journal, 2012, 195: 248-253. |
| [22] |
Gao J, Hedman C, Liu C, et al. Transformation of sulfamethazine by manganese oxide in aqueous solution[J]. Environmental Science & Technology, 2012, 46(5): 2642-2651. |
| [23] |
Tentscher P R, Eustis S N, McNeil K, et al. Aqueous oxidation of sulfonamide antibiotics:Aromatic nucleophilic substitution of an aniline radical cation[J]. Chemistry, 2013, 19(34): 11216-11223. DOI:10.1002/chem.201204005 |
| [24] |
Xie X F, Zhang Y Q, Huang W L, et al. Degradation kinetics and mechanism of aniline by heat-assisted persulfate oxidation[J]. Journal of Environmental Sciences, 2012, 24(5): 821-826. DOI:10.1016/S1001-0742(11)60844-9 |
| [25] |
Sági G, Csay T, Szabó L, et al. Analytical approaches to the OH radical induced degradation of sulfonamide antibiotics in dilute aqueous solutions[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 106: 52-60. DOI:10.1016/j.jpba.2014.08.028 |
| [26] |
Ola S. Sulfonamide resistance:Mechanisms and trends[J]. Drug Resistance Updates, 2000, 3(3): 155-160. DOI:10.1054/drup.2000.0146 |
| [27] |
Pinna M V, Castaldi P, Deiana P, et al. Sorption behavior of sulfamethazine on unamended and manure-amended soils and short-term impact on soil microbial community[J]. Ecotoxicology and Environmental Safety, 2012, 84: 234-242. DOI:10.1016/j.ecoenv.2012.07.006 |
| [28] |
Zessel K, Mohring S, Hamscher G, et al. Biocompatibility and antibacterial activity of photolytic products of sulfonamides[J]. Chemosphere, 2014, 100: 167-174. DOI:10.1016/j.chemosphere.2013.11.038 |
| [29] |
GarcÍa-Galán M J, Diaz-Cruz M S, Barcelo D. Identification and determination of metabolites and degradation products of sulfonamide antibiotics[J]. Trends in Analytical Chemistry, 2008, 27(11): 1008-1022. DOI:10.1016/j.trac.2008.10.001 |
| [30] |
Zhang M Q, Yuan L, Li Z H, et al. Tetracycline exposure shifted microbial communities and enriched antibiotic resistance genes in the aerobic granular sludge[J]. Environment International. DOI:10.1016/j.envint.2019.06.012 |
| [31] |
Xi X P, Wang M, Chen Y S, et al. Adaption of the microbial community to continuous exposures of multiple residual antibiotics in sediments from a salt-water aquacultural farm[J]. Journal of Hazardous Materials, 2015, 290: 96-105. DOI:10.1016/j.jhazmat.2015.02.059 |
| [32] |
Lan H X, Yang D, Wang X Z, et al. Microbiological evaluation of nano-Fe3O4/GO enhanced the micro-aerobic activate sludge system for the treatment of mid-stage pulping effluent[J]. Applied Nanoscience. DOI:10.1007/s13204-020-01314-0 |
| [33] |
Gu Y, Ding Y, Ren C, et al. Reconstruction of xylose utilization pathway and regulons in Firmicutes[J]. BMC Genomics. DOI:10.1186/1471-2164-11-255 |
| [34] |
蒋悦秋.毒死蜱降解菌的分离, 鉴定以及联合植物促生菌对土壤的改良[D].上海: 上海师范大学, 2015: 7-20. Jiang Yue-qiu. The isolation and identification of chlorpyrifos degrading bacteria and its effect on soil amendment with PGPR[D]. Shanghai: Shanghai Normal University, 2015: 7-20. |
| [35] |
吴凡, 高品, 薛罡, 等. 硝化细菌对碘普罗胺的降解及作用机制[J]. 环境工程学报, 2014, 6: 2225-2230. WU Fan, GAO Pin, XUE Gang, et al. Biodegradation mechanism of iopromide by nitrobacteria[J]. Journal of Environmental Engineering, 2014, 6: 2225-2230. |
| [36] |
魏子艳.土霉素、恩诺沙星、磺胺二甲嘧啶与铜单一及复合污染对土壤微生物的影响[D].泰安: 山东农业大学, 2014: 39-46. WEI Zi-yan. Single and Joint toxicity of oxytetracycline, enrofloxacin, sulfadimidine and Cu on soil microorganism[D]. Taian: Shandong Agricultural University, 2014: 39-46. |
| [37] |
Manuel C C, Gustavo F C, Avelino N D, et al. Competitive adsorption of tetracycline, oxytetracycline and chlortetracycline on soils with different pH value and organic matter content[J]. Environmental Research. DOI:10.1016/j.envres.2019.108669 |
 2020, Vol. 39
2020, Vol. 39