2. 西南科技大学环境与资源学院, 四川 绵阳 621010;
3. 西南科技大学生物质材料教育部工程研究中心, 四川 绵阳 621010
2. College of Environment and Resource, Southwest University of Science and Technology, Mianyang 621010, China;
3. Engineering Research Center of Biomass Materials, Ministry of Education, Southwest University of Science and Technology, Mianyang 621010, China
核电及国防军工对核燃料的需求推动铀矿冶快速发展[1],铀矿冶产生的大量铀废石、铀尾矿中残存的放射性核素及伴生重金属被释放进入环境,对环境造成严重的放射性及重金属双重污染。铀是典型的重金属污染元素,具有半衰期长、辐射强度大、衰变子体多等特点,其毒性效应包括辐射毒性和化学毒性双重效应[2-3]。铀在自然界中主要以化合物形式存在,其可溶态易被生物吸收,并沿着食物链进入人体,对人体造成内辐射,严重危害人体健康[4]。因此,铀矿冶周边环境铀污染的修复与治理已成为亟需解决的问题。
近年来,利用植物根系对铀的提取和固定来修复铀污染的土壤或水体,已受到国内外学者的广泛关注[5-6]。然而,铀作为一种非必需、难转移元素,极易附着、累积在植物根部[7-8],其在植物根部的过量累积,已对植物造成明显的毒害作用,如植物生长缓慢、根系坏死[9],这也严重影响了植物对铀污染的修复效率。因此,研究铀对植物的毒害机理有助于了解植物对铀的耐受性及修复植物的筛选,对利用植物修复铀污染具有重要意义。
蚕豆等豆科植物除了根系能够吸收重金属外,还能改善土壤环境,具有修复土壤重金属污染的潜力[10-11]。据研究报道蚕豆可作为研究重金属对植物毒害作用的一种模式植物[12]。光合作用和呼吸代谢是植物生长发育过程中两个重要的生理代谢过程,受到重金属胁迫的影响[13-17]。已有研究表明,Cd、Pb等重金属胁迫对植物的光合作用会造成一定的影响[13, 18]。例如,赵鲁雪等[8]研究发现铀胁迫下四季豆的净光合速率下降,而大叶菠菜、红圆叶苋的净光合速率上升,说明不同植物对铀胁迫的适应能力存在差异。另外,有研究表明重金属胁迫会影响植物根系的呼吸代谢过程[16, 19-20]。例如,吴恒梅等[15]研究发现丝瓜种子的根系活力在低浓度镉胁迫下有所增强,而在高浓度镉胁迫下会被抑制。尽管已有报道显示重金属胁迫会影响植物的正常生理代谢过程,但关于铀对植物光合作用及呼吸代谢影响的分子机理鲜有报道。
随着转录组测序技术的发展,利用该技术从分子水平上分析植物逆境胁迫下的毒害机理或耐受机制方面的研究备受关注[21-22]。因此,本文采用转录组测序技术分析高浓度铀胁迫下蚕豆幼苗光合作用和呼吸代谢相关基因的差异表达,并结合一些生理生化分析,以系统地阐释铀对蚕豆的毒害机理,对了解蚕豆对铀的耐受性和修复植物的筛选具有参考意义。
1 材料与方法 1.1 植物培养与处理本实验以蚕豆为研究对象,种子购于绵阳丰益河种子有限公司。随机挑选饱满、种皮未破损的蚕豆种子用蒸馏水冲洗3次后,浸种24 h。将种子置于人工培养气候箱(温度25 ℃,湿度80%)中进行发芽。挑选长势一致(胚根长度约2 cm)的发芽种子移植到定植篮中(每个定植篮放3粒种子),再将定植篮放置在含有改良霍格兰营养液的植物组织培养瓶中。每3 d更换1次营养液,直至蚕豆长出两片真叶。改良霍格兰营养液组成如下:101.1 mg·L-1 KNO3、236.15 mg· L-1 Ca(NO3)2·4H2O、98.59 mg·L-1 MgSO4·7H2O、16.01 mg·L-1 NH4NO3、13.61 mg·L-1 KH2PO4、铁盐溶液(1.345 mg·L-1 Na2 - EDTA和1.112 mg·L-1 FeSO4 · 7H2O),以及微量元素(包含:0.569 mg·L-1 H3BO3、0.356 mg·L-1 MnCl2·4H2O、0.043 mg·L-1 ZnSO4·7H2O、0.01 mg·L-1 CuSO4·5H2O和0.018 mg·L-1 H2MoO4 · H2O),pH为5.5。植物生长条件为:白天25 ℃/黑夜18 ℃,白天12 h/黑夜12 h,光照强度为5500 lx。
以硝酸铀酰[238U,UO2(NO3)2·6H2O,分析纯试剂]为铀源,设计铀污染浓度为0(对照)、5、10、15、20、25 μmol·L-1,每组重复3次。本实验采用不含磷的改良霍格兰营养液制备不同浓度的铀溶液,以避免营养液中的磷酸盐与铀酰离子形成不溶性沉淀。随机选择生长状况基本一致的蚕豆幼苗(长至两片真叶阶段),用不同浓度的铀溶液代替营养液,在与植物培养相同的条件下处理72 h。同时,每日在叶片上喷施1次磷溶液(0.1 mmol·L-1 KH2PO4),以避免幼苗缺磷的症状。铀处理72 h后,用蒸馏水冲洗幼苗根系3次,用滤纸吸干多余水分,液氮冷冻,-80 ℃保存,备用。
1.2 实验方法 1.2.1 根系组织切片及透射电镜观察观察铀处理后的蚕豆幼苗的生长状况并进行拍照。选取对照组和高浓度铀处理组(25 μmol·L-1)的幼苗根系,根据Brooks等[23]的方法,制备主根和侧根的石蜡切片(纵切,厚度3~4 μm,番红固绿染色法),用普通光学显微镜分析根系的微观结构。选取对照组和高浓度铀处理组的幼苗根系,将样本用电镜固定液处理后,经树脂包埋-超薄切片-负染等步骤后,制备超薄切片(厚度50~60 nm),用日立120 kV HT7800透射电子显微镜[天美(中国)科学仪器有限公司]观察铀对根系超微结构的影响。
1.2.2 各部分生物量及铀含量的测定样品先105 ℃杀青15 min,然后85 ℃烘干至恒质量。测定各处理组(0、5、10、15、20、25 μmol·L-1)蚕豆幼苗地上部和地下部的生物量。用微型植物粉碎机(上海科恒)将样品粉碎,每个样品取0.100 0 g置于消解罐内,加入8 mL浓硝酸和2 mL 30%过氧化氢,用微波消解仪(意大利Milestone公司)对植物样品进行消解,采用电感耦合等离子体质谱仪Agilent 7700x ICP-MS(美国安捷伦公司)测定铀含量。
1.2.3 叶绿素含量及光合参数的测定叶绿素含量测定采用乙醇-丙酮(3:1,V/V)提取法,称取0.100 0 g植物叶片,加入5 mL色素提取液,快速研磨后浸提5 h,再用紫外分光光度计测定波长在645 nm和663 nm下的吸光值,根据相关公式计算叶绿素含量[24]。用LCpro-SD+全自动便携式光合仪(北京澳作生态仪器有限公司)测定蚕豆幼苗的光合参数,包括:净光合速率(A,μmol·m-2·s-1)、气孔导度(Gs,mmol·m-2·s-1)、胞间CO2浓度(Ci,μmol·mol-1)和蒸腾速率(E,mmol·m-2·s-1),每个处理至少测定9次。
1.2.4 根系活力的测定采用2,3,5-三苯基氯化四氮唑(TTC)比色法测定经不同浓度铀(0、5、10、15、20、25 μmol·L-1)处理后幼苗的根系活力。称取0.500 0 g根,加入4 g·L-1 TTC溶液和0.66 mol·L-1磷酸缓冲液各5 mL,在37 ℃下暗保温2 h,加入1 mol·L-1硫酸2 mL终止反应,取出根系吸干表面水分后,加入乙酸乙酯充分研磨,定容至10 mL,分光光度计测定波长485 nm下的吸光值,再根据标准曲线,求得TTC还原量。
1.3 铀胁迫下蚕豆的转录组分析选取铀处理(0 μmol·L-1和25 μmol·L-1)72 h后的根系样品进行转录组测序,进行3次独立的生物学重复。建库测序及数据分析部分委托上海欧易生物医学科技有限公司完成,将得到的Unigene.fa文件上传到Mercator注释网站(https://www.plabipd.de/portal/mercator-sequence-annotation)以获得蚕豆的Mapping文件。采用MapMan软件(Version 3.6.0RC1)对与光合作用和线粒体电子传递途径相关的差异表达基因进行可视化分析[25]。差异表达基因(DEGs)的筛选条件是基因表达量差异倍数大于1.5,即|log2 FC|>1.5,且P小于0.05。
1.4 数据处理与分析铀的转移系数按下列公式计算:
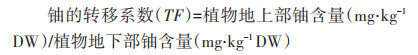
|
式中:DW表示植物干质量。
采用SPSS v.20.0(SPSS Inc., Chicago, IL, USA)软件对数据进行单因素方差分析和LSD多重比较。采用Origin 9.0(Origin Lab. Corporation,Northampton,MA,USA)作图;采用Adobe Illustrator CS6进行图像排版。
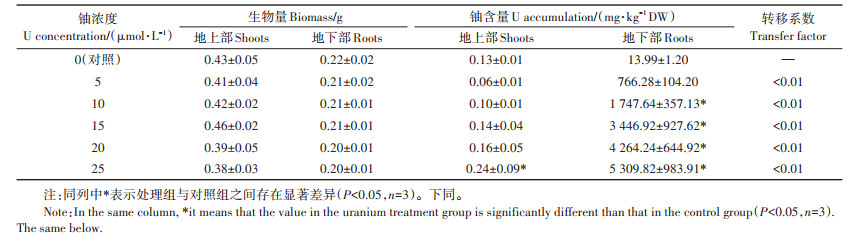
2 结果与分析 2.1 蚕豆幼苗各部分生物量、铀含量及铀转移系数如表 1所示,铀胁迫72 h后,随着铀处理浓度的增加,蚕豆幼苗地上部和地下部生物量呈降低的趋势。当铀浓度为25 μmol·L-1时,与对照组比较,地上部和地下部生物量分别降低了11.63%和9.09%。当铀浓度为5~25 μmol·L-1时,地上部和地下部铀累积量分别为0.06~0.24 mg·kg-1和766.28~5 309.82 mg· kg-1。在不同浓度的铀胁迫下,铀的转移系数均小于0.01。结果表明,铀的主要蓄积器官是根系,且难以易位至地上部。
|
|
表 1 铀对蚕豆各部分生物量和铀含量的影响 Table 1 Effects of U on the growth of Vicia faba L. and its accumulation content in plant |
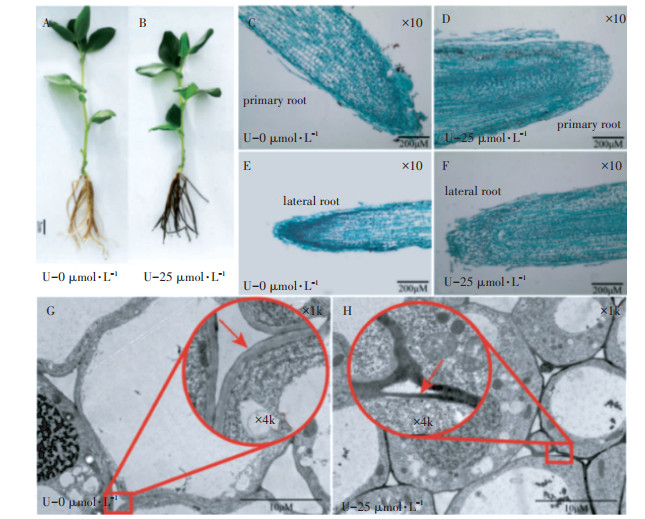
如图 1A和图 1B所示,与对照组相比,U-25 mmol·L-1组的蚕豆幼苗根系出现了黑化现象。如图 1C至图 1F所示,铀毒害明显损伤了蚕豆根系的根冠层,表现为铀处理组蚕豆根系的主根和侧根的根冠层完全脱落。如图 1G和图 1H所示,铀胁迫后的根系细胞壁区域出现明显的铀盐沉积位点。这些结果表明,根系细胞壁是铀的主要分布位点,过量蓄积铀明显损伤了根系结构。
|
A、B为蚕豆幼苗根尖形态,C~F为根尖石蜡切片,G、H为透射电镜下1 000倍观察到的根细胞的超微结构,红色圆圈内的图像为4 000倍观察到的根系超微结构,箭头指向的是细胞壁 A, B refers to the root tip morphology of Vicia faba L. seedlings. C to F refers to the paraffin section of the root tip. G, H refers to the ultrastructure of root cells at 1 000-fold and the image in the red circle represents the ultrastructure of plants observed at 4 000-fold of TEM. The arrow refers to the cell wall 图 1 铀胁迫对蚕豆幼苗生长及微观结构的影响 Figure 1 Effects of U stress on the growth and microstructure of Vicia faba L. seedlings |
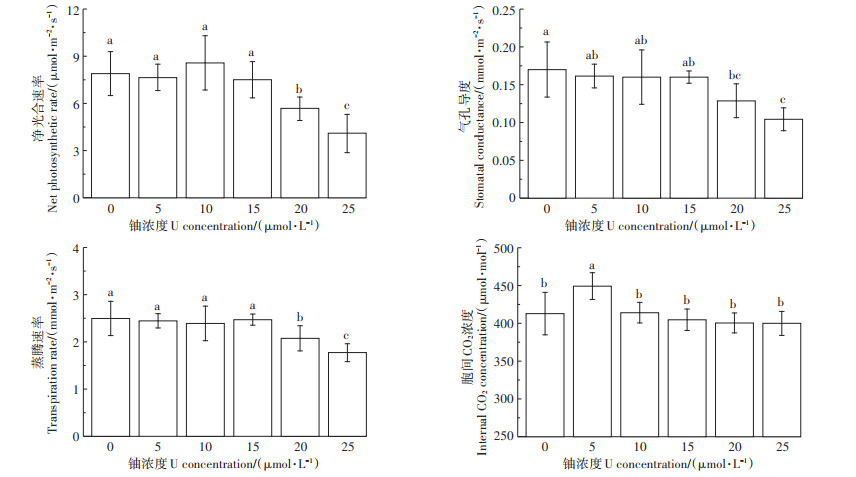
如表 2所示,铀胁迫72 h后,5~25 mmol·L-1组与对照组比较,叶绿素a、b和总叶绿素含量分别降低了4.32%~11.02%、3.9%~7.34%和4.21%~9.84%。随着铀处理浓度的增加,蚕豆幼苗光合作用参数(光合速率、气孔导度和蒸腾速率)均显著降低,但对叶片胞间CO2浓度的影响不明显。当铀浓度为25 mmol·L-1时,与对照组比较,光合速率、气孔导度和蒸腾速率分别降低了47.99%、38.66%和28.91%(图 2)。结果表明,高浓度铀胁迫条件下,根系累积过量铀,诱发植物光合作用异常。
|
|
表 2 铀胁迫对蚕豆幼苗叶绿素含量的影响(mg·g-1) Table 2 Effects of U stress on chlorophyll content of Vicia faba L. (mg·g-1) |
|
不同小写字母表示处理间差异显著(P < 0.05,n=9) The different lowercase letters indicate significant differences among treatments(P < 0.05, n=9) 图 2 铀胁迫对蚕豆幼苗光合参数的影响 Figure 2 Effects of U stress on photosynthetic parameters of of Vicia faba L. seedlings |
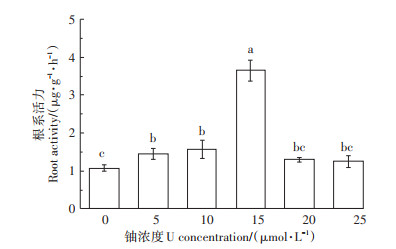
如图 3所示,随着铀处理浓度的增加,蚕豆幼苗根系活力呈先升高后降低的趋势。当铀浓度为15 mmol·L-1时,根系活力达到最大值,比对照组提高了2.4倍。结果表明,铀胁迫下蚕豆幼苗可通过诱导根系增强细胞的呼吸代谢,从而提高对铀的耐受性。
|
不同小写字母表示处理间差异显著(P < 0.05,n=3) The different lowercase letters indicate significant differences among treatments(P < 0.05, n=3) 图 3 铀胁迫对蚕豆根系活力的影响 Figure 3 Effects of U stress on root activity of Vicia faba L. |
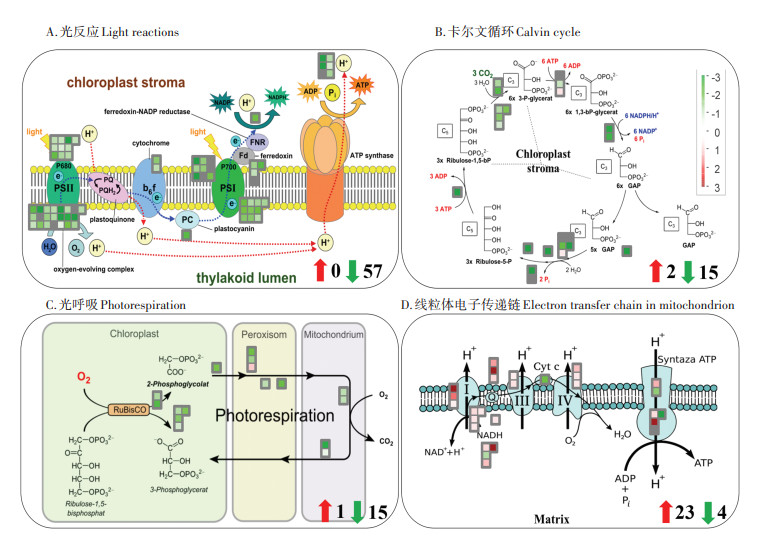
RNA-seq结果显示,铀对光合作用的光反应途径、卡尔文循环途径及光呼吸途径相关基因的表达具有明显的抑制作用(90个DEGs;3个上调,87个下调)(图 4和表 3)。例如,在光反应途径中,高浓度铀显著地抑制了光反应电子传递链途径中相关基因的表达(57个下调)(图 4A和表 3)。在卡尔文循环途径中,多种关键酶的基因也被显著抑制,如transketolase gene(4.91)、aldolase gene(6.27)、triosephosphate isom⁃ erase gene(6.67)(图 4B和表 3)。在光呼吸途径中,高浓度铀也显著抑制了光呼吸代谢途径相关基因的表达(图 4C和表 3)。结果表明,铀胁迫导致蚕豆幼苗光合作用效率降低,其机理是高浓度铀损伤了光反应途径中的电子传递链,抑制了卡尔文循环途径和光呼吸途径。
|
红色方块代表上调基因,绿色方块代表下调基因 Red squares represent up-regulated genes and green squares represent down regulated genes 图 4 铀胁迫下与光合作用和线粒体电子传递链相关的差异表达基因Mapman可视化分析 Figure 4 Mapman visualization analysis of differentially expression gene related to photosynthesis and mitochondrial electron transport under U stress |
|
|
表 3 铀胁迫下与光合作用途径相关的差异表达基因(前3位) Table 3 List of differentially expressed genes(TOP3)related to photosynthesis pathway under U stress |
如图 4D和表 4所示,在高浓度铀胁迫条件下,线粒体呼吸代谢途径相关基因表达量明显增加,共检测到27个差异表达基因,包括23个显著上调基因和4个显著下调基因。例如,铀诱导ATP synthesis. alternative oxidase gene、ATP synthesis. NADH - DH. complex Ⅰ和ATP synthesis. NADH - DH. type Ⅱ. internal matrix gene的表达量分别增加了3.97、3.35倍和3.33倍(表 4),表明植物根系通过加强自身的呼吸代谢,提高植物对铀毒害作用的耐受能力,该结果与根系活力的结果一致。
|
|
表 4 铀胁迫下与线粒体电子传递途径相关的差异表达基因(前3) Table 4 List of differentially expressed genes (TOP3) related to mitochondrial electron transport pathway under U stress |
植物的生物量是反映其生长状况的重要指标[26]。在一定浓度范围内的重金属胁迫下,一般表现为低浓度促进植物生长和高浓度抑制植物生长[27-28]。例如,Misson等[29]的研究表明,在没有磷的情况下,低浓度(2 mmol·L-1)的铀胁迫比对照组(0 mmol·L-1)增加了植物生物量,而高浓度(50 mmol·L-1和500 mmol·L-1)的铀胁迫导致植物生物量分别减少了40%和69%,其地上部分别下降25%和38.5%。本研究发现铀胁迫下蚕豆的生物量略有下降,但差异不显著,推测可能与铀胁迫时间、浓度和植物种类不同有关。
已有研究表明,铀主要在植物根系中积累,而向地上部转移的铀含量极低[7, 30]。我们的研究结果与此类似,与对照组相比,铀胁迫的蚕豆根系中铀的累积量是地上部的数万倍,且传递系数极低。有研究证实,由于根系细胞壁的阻滞作用[31-32],过量的重金属累积在植物根系,以缓解重金属对植物地上部的毒害,但会对根系造成损害。例如,镉会诱导植物根部的边缘细胞脱落;随着镉浓度的增加,根冠边缘的细胞数量也会增加,由此产生的边缘细胞形成黏液层,防止镉进入根部[33]。植物根系对铀酰离子有较高的吸附或积累作用,而铀向茎叶的迁移受细胞壁沉降的限制[34]。与此结果类似的是,我们发现高浓度的铀胁迫会导致植物根部的根冠脱落。与U-0 mmol·L-1组相比,U-25 mmol·L-1组的根尖细胞壁在透射电镜下出现黑色沉淀物。这些结果表明,根系细胞壁阻碍了铀向地上部的转移,这可能是蚕豆耐受铀胁迫的重要原因。付倩等[12]通过研究蚕豆对铯的吸收及其亚细胞分布,也得出了类似的结论。
3.2 铀对蚕豆幼苗光合作用及其相关基因表达的影响光合作用是在植物叶绿体内进行的储能过程,其受叶绿素含量的影响[35]。另外,光合参数能够直接反映光合作用的强弱。研究表明,在高浓度铀(U-25 mmol·L-1)胁迫下,蚕豆幼苗的叶绿素含量有所下降但并不显著,而光合参数(除胞间CO2浓度外)显著降低。前人研究表明,重金属胁迫下,叶绿素含量、净光合速率和蒸腾速率降低,而胞间CO2浓度升高[36-37]。我们推测,高浓度铀胁迫对蚕豆的光合效率有明显的抑制作用,但在短时间(72 h)内叶绿素没有被破坏。植物光合作用的变化受到相关基因的调控。Houot等[38]的研究表明,在镉胁迫下,大量参与光合作用的基因(通常提供ATP和NADPH)表达下调,以适应镉胁迫。我们的研究结果也表明,高浓度的铀胁迫显著抑制了植物光合作用中光反应途径、卡尔文循环途径和光呼吸途径相关基因的表达。
3.3 铀对蚕豆幼苗根系活力和呼吸代谢相关基因表达的影响根系活力可以反映根系吸收水分和养分的能力,甚至与重金属的迁移有关[28, 39-40]。在本研究中,我们发现铀浓度在0~25 mmol·L-1范围内,蚕豆幼苗的根系活力呈现先升高后降低的趋势。我们认为,在低浓度铀胁迫下植物能够通过增强根系活力来维持自身正常的生理代谢,而当铀浓度过高时会对植物结构造成损伤,从而导致根系活力下降。田小霞等[40]在研究镉对马蔺根系活力的影响时也得到了类似的结果。逆境胁迫下,线粒体中与电子传递链相关基因的表达受到影响,其负责控制植物体内ATP的水解和能量释放的过程,释放的能量主要用于抵抗胁迫[41-42]。Irani等[43]的研究发现,在逆境胁迫下,拟南芥茎叶中与线粒体电子传递相关基因的表达有所增强,以提高植物的抗逆性。与此类似,我们的研究结果表明高浓度的铀胁迫诱导了蚕豆幼苗根系的线粒体中呼吸电子传递途径相关基因的高表达。
4 结论(1)在铀胁迫下,蚕豆根系能阻止大部分铀向地上部转移,从而维持植株地上部的正常生长。然而,蚕豆根系中铀的过量累积造成了根系损伤,影响植物的生理代谢活动。
(2)高浓度的铀胁迫降低了蚕豆幼苗的光合效率,抑制了光合作用过程中光反应途径、卡尔文循环途径和光呼吸途径相关基因的表达。在一定的铀浓度范围内,蚕豆幼苗的根系活力呈现出先升高后降低的趋势,高浓度的铀胁迫诱导了根系线粒体中呼吸电子传递途径相关基因的高表达。
(3)在铀胁迫下,蚕豆幼苗的光合作用受到影响,但其根系的呼吸代谢有所增强,从而适应铀胁迫环境。蚕豆对铀具有一定的耐受性,但由于铀主要累积在其根系,因此不能作为铀的富集植物。
| [1] |
陈润羊, 花明. 铀矿资源对我国核电发展战略影响的研究[J]. 矿山机械, 2015, 43(11): 7-11. CHEN Run-yang, HUA Ming. Research on influence of uranium resource on national nuclear power development strategy[J]. Mining & Processing Equipment, 2015, 43(11): 7-11. |
| [2] |
张彪, 张晓文, 李密, 等. 铀尾矿污染特征及综合治理技术研究进展[J]. 中国矿业, 2015, 24(4): 58-62. ZHANG Biao, ZHANG Xiao-wen, LI Mi, et al. The characteristics and research progress of uranium tailings comprehensive treatment technology[J]. China Mining Magazine, 2015, 24(4): 58-62. |
| [3] |
Milja T E, Prathish K P, Rao T P. Synthesis of surface imprinted nanospheres for selective removal of uranium from simulants of Sambhar salt lake and ground water[J]. Journal of Hazardous Materials, 2011, 188(1/2/3): 384-390. |
| [4] |
Neves M O, Abreu M M, Figueiredo V. Uranium in vegetable foodstuffs:Should residents near the Cunha Baixa uranium mine site(Central Northern Portugal)be concerned?[J]. Environmental Geochemistry and Health, 2012, 34(2): 181-189. DOI:10.1007/s10653-011-9428-9 |
| [5] |
王浩, 王艳琴. 铀污染土壤的植物修复技术[J]. 环境与发展, 2019, 31(3): 36-38, 40. WANG Hao, WANG Yan-qin. Phytoremediation for soil contaminated uranium[J]. Environment and Development, 2019, 31(3): 36-38, 40. |
| [6] |
王兴利, 吴晓晨, 王晨野, 等. 水生植物生态修复重金属污染水体研究进展[J]. 环境污染与防治, 2020, 42(1): 107-112. WANG Xing-li, WU Xiao-chen, WANG Chen-ye, et al. Research progress on ecological remediation of heavy metal polluted water by aquatic plants[J]. Environmental Pollution & Control, 2020, 42(1): 107-112. |
| [7] |
陈霞, 唐运来, 周璐璐, 等. 铀在小麦幼苗中的积累分布及其对叶片光系统活性的影响[J]. 西北植物学报, 2012, 32(12): 2457-2463. CHEN Xia, TANG Yun-lai, ZHOU Lu-lu, et al. Accumulation and distribution of uranium in wheat seedlings and the effect of uranium on the photosystem activities[J]. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(12): 2457-2463. |
| [8] |
赵鲁雪, 罗学刚, 唐永金, 等. 铀污染环境下植物的光合生理变化及对铀的吸收转移[J]. 安全与环境学报, 2014, 14(2): 299-304. ZHAO Lu-xue, LUO Xue-gang, TANG Yong-jin, et al. Photosynthetic physiological changes and the uranium accumulation of plants in the uranium contaminated environment[J]. Journal of Safety and Environment, 2014, 14(2): 299-304. |
| [9] |
刘韬.香蒲对低浓度含铀废水处理效果的试验研究[D].衡阳: 南华大学, 2014: 37-43. LIU Tao. Experimental study on the treatment effect of Typha orientalis on low concentration uranium containing wastewater[D]. Hengyang: University of South China, 2014: 37-43. http://d.wanfangdata.com.cn/Thesis/D619552 |
| [10] |
Mathew D C, Ho Y N, Gicana R G, et al. A rhizosphere-associated symbiont, Photobacterium spp. strain MELD1, and its targeted synergistic activity for phytoprotection against mercury[J]. PLoS ONE, 2015, 10(3): e0121178. DOI:10.1371/journal.pone.0121178 |
| [11] |
Alyemeni M N, Almohisen I A. Traffic and industrial activities around Riyadh cause the accumulation of heavy metals in legumes:A case study[J]. Saudi Journal of Biological Sciences, 2014, 21(2): 167-172. DOI:10.1016/j.sjbs.2013.09.007 |
| [12] |
付倩, 杨垒滟, 赖金龙, 等. 蚕豆对铯的吸收蓄积及亚细胞分布研究[J]. 生态毒理学报, 2015, 10(6): 297-304. FU Qian, YANG Lei-yan, LAI Jin-long, et al. Tissue accumulation and subcellular distribution of cesium in Vicia faba[J]. Asian Journal of Ecotoxicology, 2015, 10(6): 297-304. |
| [13] |
张嘉桐, 关颖慧, 司莉青, 等. Pb2+、Cd2+复合胁迫对桑树光合作用的影响[J]. 北京林业大学学报, 2018, 40(4): 16-23. ZHANG Jia-tong, GUAN Ying-hui, SI Li-qing, et al. Effects of Pb2+ and Cd2+ combined stress on photosynthesis of Morus alba[J]. Journal of Beijing Forestry University, 2018, 40(4): 16-23. |
| [14] |
张艳, 王丹, 李黎. 豌豆对U和Cd复合胁迫反应及其积累特征[J]. 辐射研究与辐射工艺学报, 2013, 31(1): 55-59. ZHANG Yan, WANG Dan, LI Li. Response of peas to U and Cd combined stress and their accumulation characteristic[J]. Journal of Radiation Research and Radiation Processing, 2013, 31(1): 55-59. |
| [15] |
吴恒梅, 纪艳, 姜成, 等. 重金属镉对丝瓜种子萌发及根系活力的影响[J]. 北方园艺, 2012(11): 38-40. WU Heng-mei, JI Yan, JIANG Cheng, et al. Effects of heavy metal cadmium on seed germination and root activity of Luffa cylindrica[J]. Northern Horticulture, 2012(11): 38-40. |
| [16] |
江行玉, 赵可夫. 植物重金属伤害及其抗性机理[J]. 应用与环境生物学报, 2001(1): 92-99. JIANG Xing-yu, ZHAO Ke-fu. Mechanism of heavy metal injury and resistance of plants[J]. Chinese Journal of Applied & Environmental Biology, 2001(1): 92-99. |
| [17] |
赵继武, 罗学刚, 王焯, 等. 黑麦草对铀胁迫的光合响应及铀吸收特性研究[J]. 农业环境科学学报, 2019, 38(11): 2456-2464. ZHAO Ji-wu, LUO Xue-gang, WANG Zhuo, et al. Photosynthetic response of ryegrass to uranium stress and the absorption characteristics of enriched uranium[J]. Journal of Agro-Environment Science, 2019, 38(11): 2456-2464. |
| [18] |
徐小逊, 董袁媛, 邓玉兰, 等. 镉胁迫对豨莶生长及光合作用相关参数的影响[J]. 农业环境科学学报, 2016, 35(9): 1672-1679. XU Xiao-xun, DONG Yuan-yuan, DENG Yu-lan, et al. Effects of cadmium stress on growth and photosynthetic parameters of Sigesbeckia orientalis L.[J]. Journal of Agro-Environment Science, 2016, 35(9): 1672-1679. |
| [19] |
龚红梅, 李卫国. 锌对植物的毒害及机理研究进展[J]. 安徽农业科学, 2009, 37(29): 14009-14015. GONG Hong-mei, LI Wei-guo. Research progress on the toxicity of zinc to plants and its mechanism[J]. Journal of Anhui Agricultural Sciences, 2009, 37(29): 14009-14015. |
| [20] |
和淑娟, 王宏镔, 王海娟, 等. 砷胁迫下3-吲哚乙酸对不同砷富集能力植物根系形态和生理的影响[J]. 农业环境科学学报, 2016, 35(5): 878-885. HE Shu-juan, WANG Hong-bin, WANG Hai-juan, et al. Effects of indole-3-acetic acid on morphologic and physiological characteristics of root systems of plants with different arsenic-accumulating abilities under As stress[J]. Journal of Agro-Environment Science, 2016, 35(5): 878-885. |
| [21] |
高慧娟, 吕昕培, 王润娟, 等. 转录组测序在林草植物抗逆性研究中的应用[J]. 草业学报, 2019, 28(12): 184-196. GAO Hui-juan, LÜ Xin-pei, WANG Run-juan, et al. Application of RNA-seq technology in research on herb shrub and stress resistance[J]. Acta Prataculturae Sinica, 2019, 28(12): 184-196. |
| [22] |
张健, 唐露, 张雅洁, 等. 转录组测序技术在植物水淹胁迫研究中的应用[J]. 分子植物育种, 2019, 17(4): 1191-1202. ZHANG Jian, TANG Lu, ZHANG Ya-jie, et al. Application of transcriptome sequencing technique in the study of waterlogging stress in plants[J]. Molecular Plant Breeding, 2019, 17(4): 1191-1202. |
| [23] |
Brooks L, Strable J, Zhang X, et al. Microdissection of shoot meristem functional domains[J]. PLoS Genetics, 2009, 5(5): e1000476. DOI:10.1371/journal.pgen.1000476 |
| [24] |
张志良, 瞿伟菁, 李小方. 植物生理学实验指导四版[M]. 北京: 高等教育出版社, 2009: 88-91. ZHANG Zhi-liang, QU Wei-jing, LI Xiao-fang. Experimental guidance of plant physiology 4th Edition[M]. Beijing: Higher Education Press, 2009: 88-91. |
| [25] |
Dalal M, Sahu S, Tiwari S, et al. Transcriptome analysis reveals interplay between hormones, ROS metabolism and cell wall biosynthesis for drought-induced root growth in wheat[J]. Plant Physiology and Biochemistry, 2018, 130: 482-492. DOI:10.1016/j.plaphy.2018.07.035 |
| [26] |
王艳芳, 悦飞雪, 李冬, 等. 镉胁迫对不同基因型玉米生长和镉吸收分配的影响[J]. 核农学报, 2019, 33(7): 1440-1447. WANG Yan-fang, YUE Fei-xue, LI Dong, et al. Effects of cadmium stress on plant growth, cadmium absorption and distribution of different genotypes of maize[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(7): 1440-1447. |
| [27] |
严明理, 冯涛, 向言词, 等. 铀尾沙对油菜幼苗生长和生理特征的影响[J]. 生态学报, 2009, 29(8): 4215-4222. YAN Ming-li, FENG Tao, XIANG Yan-ci, et al. Effects of uranium tailings on growth and physiological characteristics of Brassica seedlings[J]. Acta Ecologica Sinica, 2009, 29(8): 4215-4222. |
| [28] |
Aibibu N, Liu Y, Zeng G, et al. Cadmium accumulation in vetiveria zizanioides and its effects on growth, physiological and biochemical characters[J]. Bioresource Technology, 2010, 101(16): 6297-6303. DOI:10.1016/j.biortech.2010.03.028 |
| [29] |
Misson J, Henner P, Morello M, et al. Use of phosphate to avoid uranium toxicity in Arabidopsis thaliana leads to alterations of morphological and physiological responses regulated by phosphate availability[J]. Environmental and Experimental Botany, 2009, 67(2): 353-362. DOI:10.1016/j.envexpbot.2009.09.001 |
| [30] |
Saenen E, Horemans N, Vanhoudt N, et al. Oxidative stress responses induced by uranium exposure at low pH in leaves of Arabidopsis thaliana plants[J]. Journal of Environmental Radioactivity, 2015, 150: 36-43. DOI:10.1016/j.jenvrad.2015.07.021 |
| [31] |
刘清泉, 陈亚华, 沈振国, 等. 细胞壁在植物重金属耐性中的作用[J]. 植物生理学报, 2014, 50(5): 605-611. LIU Qing-quan, CHEN Ya-hua, SHEN Zhen-guo, et al. Roles of cell wall in plant heavy metal tolerance[J]. Plant Physiology Journal, 2014, 50(5): 605-611. |
| [32] |
晋海军, 王海霞. 植物对重金属镉的吸收与耐受机制研究进展[J]. 中国农学通报, 2019, 35(24): 52-57. JIN Hai-jun, WANG Hai-xia. Plant absorption and tolerance mechanism to heavy metal cadmium:Research progress[J]. Chinese Agricultural Science Bulletin, 2019, 35(24): 52-57. |
| [33] |
Balestri M, Ceccarini A, Forino L M, et al. Cadmium uptake, localization and stress-induced morphogenic response in the fern Pteris vittata[J]. Planta, 2014, 239(5): 1055-1064. DOI:10.1007/s00425-014-2036-z |
| [34] |
Laurette J, Larue C, Mariet C, et al. Influence of uranium speciation on its accumulation and translocation in three plant species:Oilseed rape, sunflower and wheat[J]. Environmental and Experimental Botany, 2012, 77: 96-107. DOI:10.1016/j.envexpbot.2011.11.007 |
| [35] |
刘柿良, 杨容孑, 马明东, 等. 土壤镉胁迫对龙葵(Solanum nigrum L.)幼苗生长及生理特性的影响[J]. 农业环境科学学报, 2015, 34(2): 240-247. LIU Shi-liang, YANG Rong-jie, MA Ming-dong, et al. Effects of soil cadmium on growth and physiological characteristics of Solanum nigrum L. Plants[J]. Journal of Agro-Environment Science, 2015, 34(2): 240-247. |
| [36] |
Vernay P, Gauthier-Moussard C, Hitmi A. Interaction of bioaccumulation of heavy metal chromium with water relation, mineral nutrition and photosynthesis in developed leaves of Lolium perenne L.[J]. Chemosphere, 2007, 68(8): 1563-1575. DOI:10.1016/j.chemosphere.2007.02.052 |
| [37] |
Wang Q, Li Z, Cheng S, et al. Influence of humic acids on the accumulation of copper and cadmium in Vallisneria spiralis L. from sediment[J]. Environmental Earth Sciences, 2010, 61(6): 1207-1213. DOI:10.1007/s12665-009-0444-3 |
| [38] |
Houot L, Floutier M, Marteyn B, et al. Cadmium triggers an integrated reprogramming of the metabolism of Synechocystis PCC6803, under the control of the Slr1738 regulator[J]. BMC Genomics, 2007, 8: 350. DOI:10.1186/1471-2164-8-350 |
| [39] |
Shahid M, Arshad M, Kaemmerer M, et al. Long-term field metal extraction by pelargonium:Phytoextraction efficiency in relation to plant maturity[J]. International Journal of Phytoremediation, 2012, 14(5): 493-505. DOI:10.1080/15226514.2011.604689 |
| [40] |
田小霞, 毛培春, 郭强, 等. 镉胁迫对马蔺根系活力和矿质营养元素吸收的影响[J]. 西南农业学报, 2019, 32(9): 2090-2096. TIAN Xiao-xia, MAO Pei-chun, GUO Qiang, et al. Effects of cadmium stress on root activity and mineral nutrient absorption of Iris lactea[J]. Southwest China Journal of Agricultural Sciences, 2019, 32(9): 2090-2096. |
| [41] |
Ding Z, Zhang Y, Xiao Y, et al. Transcriptome response of cassava leaves under natural shade[J]. Scientific Reports, 2016, 6: 31673. DOI:10.1038/srep31673 |
| [42] |
Li L, Hu L, Han L P, et al. Expression of turtle riboflavin-binding protein represses mitochondrial electron transport gene expression and promotes flowering in Arabidopsis[J]. BMC Plant Biology, 2014, 14: 381. DOI:10.1186/s12870-014-0381-5 |
| [43] |
Irani S, Trost B, Waldner M, et al. Transcriptome analysis of response to Plasmodiophora brassicae infection in the Arabidopsis shoot and root[J]. BMC Genomics, 2018, 19(1): 23. DOI:10.1186/s12864-017-4426-7 |
 2020, Vol. 39
2020, Vol. 39