2. 济南市环境研究院, 济南 250102
2. Jinan Environmental Research Institute, Jinan 250102, China
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是环境中广泛存在的一类典型持久性有机污染物,大多具有“三致”效应,可通过空气或水进行长、短距离输送,参与全球和各圈层的循环,最终在土壤中累积,并通过土壤-作物系统迁移、积累、转化,进而危及生态系统和人体健康[1]。因此,研究PAHs污染土壤修复对农业安全和环境保护具有重要意义。国内外学者对有机污染土壤修复技术开展了大量研究,植物修复是最具潜力的土壤生物修复技术之一[2-3]。植物的存在能够加快土壤中PAHs的去除,但由于PAHs的高疏水性,植物的直接吸收和积累作用在PAHs污染修复中作用并不大,而是根系分泌物发挥了巨大的作用[4]。
根系分泌物是植物根系在生命活动过程中向外界环境分泌的各种有机化合物的总称,是植物与土壤、水、大气进行物质、能量和信息交换的重要介质。根系分泌物所营造的根际微环境是有机污染物有效性和毒性得以快速消减的重要原因[5]。根系分泌物主要通过3种方式影响土壤中有机污染物的降解[6-7]:根系分泌的酶直接参与有机污染物的降解;根系分泌物通过改变根际微生物数量和活性或提供共代谢基质影响有机污染物的降解;根系分泌物改变土壤有机污染物的生物有效性,从而促进其降解。
在有机物污染胁迫下,植物根系分泌物会产生相应的变化[8]。谢明吉等[9]的研究发现,在菲(PHE)胁迫下,黑麦草根系分泌的低分子有机酸的组成无明显变化,但其含量都比对照有显著增加,且总糖和氨基酸含量均随PHE质量浓度上升呈现先升高后降低的趋势。Toyama等[10]研究表明,芘可导致芦苇(Phragmites australis)根系产生的分泌物中酚类化合物含量上升。万大娟等[11]采用水培方法对1,2,4-三氯苯(1,2,4-TCB)和滴滴涕(pp′-DDT)胁迫下的黑麦草和大豆根系分泌物含量变化进行了研究,结果表明有机物污染胁迫能使植物根系分泌物中的可溶性总糖、有机酸和氨基酸产生变化。根系分泌物的组分和浓度影响其在土壤有机污染修复过程中的作用。因此,有必要探明根系分泌物对有机污染胁迫的响应,这是研究根系分泌物环境效应的前提。
根系分泌物的种类繁多,氨基酸是其中一类重要组分[12]。氨基酸不仅能为植物和土壤微生物提供碳源和氮源,在生态系统碳氮循环中起到关键作用[13-14],还能够参与有机污染土壤修复进程[15-18],或为土壤微生物提供共代谢基质,或影响有机污染物在土壤中的生物有效性,进而促进有机污染物的降解。在有机污染物胁迫下,植物作出适应性响应,其根系代谢发生变化,根系分泌的氨基酸组分和含量可能随之改变,进而影响氨基酸在促进有机污染物降解中的作用,因此有必要针对氨基酸组分研究其对有机污染胁迫的响应特征。黑麦草(Lolium perenne)具有对有机污染物较强的耐受力和在污染土壤中较强的生长能力,因而被作为修复有机污染土壤的模式植物得到广泛应用[19]。本研究选取黑麦草为受试植物,以菲、芘、苯并(a)芘为PAHs代表物,探讨不同种类及浓度PAHs胁迫下黑麦草根系分泌物中氨基酸组分及含量的变化特征,以期补充和完善植物根系分泌物对有机污染胁迫的响应体系,为深入研究黑麦草修复PAHs污染土壤作用机制提供科学依据。
1 材料与方法 1.1 供试材料供试药品菲(Phenanthrene,纯度>98%)、芘(Pyrene,纯度>98%)、苯并(a)芘[benzo(α)pyrene,纯度>96%],均购自Sigma-Aldrich公司(美国)。供试植物为黑麦草(Lolium perenne)。
1.2 水培试验用3%的H2O2溶液对黑麦草种子消毒20 min,取出用无菌水冲洗3次,然后用无菌水浸泡过夜。次日将种子置于无菌培养皿滤纸中催芽。将催芽1 d后的种子嵌入自制聚四氟乙烯搁种板上(图 1)。搁板为杯状,底部直径6 cm,厚度2 mm,均匀分布50个嵌种孔,嵌种孔根据黑麦草种子大小设计直径为1.5 mm。垂直面高1 cm,均匀分布4个挂绳孔。搁板采用聚四氟乙烯材质,以期在进行PAHs胁迫实验和后续根系分泌物收集实验时减少PAHs和根系分泌物组分在板上的吸附损失。将种子整板转移至含170 mL无菌Hoagland′s营养液[20]的1 L量筒中,用聚四氟乙烯细绳控制搁板位置处于营养液液面处(图 2)。将量筒置于光照培养箱(光暗比14 h:10 h,25 ℃)培养15 d。然后将黑麦草苗连同聚四氟乙烯搁板一起转移至含170 mL无菌半量营养液的量筒中,在光照培养箱中培养5 d。无菌半量营养液分别进行如下处理:(1)对照组CK,营养液不添加PAHs。(2)PAHs胁迫组,营养液中添加了PAHs。PAHs胁迫组中,分别设置菲、芘和苯并(a)芘处理,每种PAHs设置低、高两个浓度。菲处理为PHE-L(1.2 mg·L-1)和PHE-H(10 mg·L-1);芘处理为PYR-L(0.4 mg·L-1)和PYR-H(10 mg·L-1);苯并(a)芘处理为BAP-L(2 μg·L-1)和BAP-H(20 μg· L-1)。实验共设置7个处理,每个处理设4个重复。

|
图 1 聚四氟乙烯板 Figure 1 Plate of teflon |

|
图 2 黑麦草的水培 Figure 2 Hydroponics of Lolium perenne |
将聚四氟乙烯搁板及黑麦草整板取出,用无菌水冲洗搁板及黑麦草苗根部,整板放置于含100 mL灭菌水的高型烧杯中,用锡纸包裹烧杯底部避光,如图 3所示。将烧杯放入光照培养箱中培养24 h(培养箱条件同上)。收集的溶液过0.45 μm水系滤膜,即得到黑麦草根系分泌物。对根系分泌物冷冻干燥,保存于-20 ℃冰箱待分析。

|
图 3 黑麦草根系分泌物的收集 Figure 3 Collection of root exudates by Lolium perenne |
黑麦草苗从聚四氟乙烯搁板上取下,分别用自来水、蒸馏水冲洗后,用滤纸吸干,去掉种子壳,测定植株数目。分离茎叶和根,用万分之一天平(德国,赛多利斯BSA224S)分别称其鲜质量。然后105 ℃杀青2 h,在60 ℃下烘至恒质量,称量其干质量。
1.5 氨基酸组分的测定取冻干的根系分泌物样品,用1 mL蒸馏水定容,充分溶解后用日立L-8900型氨基酸分析仪进行氨基酸组分的测定。测定的目标氨基酸为天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、半胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、赖氨酸、组氨酸、精氨酸,其中脯氨酸的检测波长为440 nm,其余为570 nm。泵1(缓冲液)流速0.40 mL · min-1,泵2(茚三酮)流速0.35 mL·min-1,进样量20 μL,分析时间53 min。离子交换柱规格4.6 mm ID× 60 mm,型号#2622PH,柱温57 ℃。氨基酸含量以每克植物干质量分泌的氨基酸组分计,μg·g-1。
1.6 数据处理数据结果以平均值±标准偏差表示。KolmogorovSmirnov法检验实验数据正态性,符合正态分布时采用独立样本T检验对处理组和对照组进行比较,不符合时则进行Mann-Whitney U检验。在采用独立样本T检验时,先运用Levene法检验方差齐性。P < 0.05被认为具有统计学显著意义,P < 0.01为极显著。统计学分析使用软件SPSS 19.0进行。
2 结果与讨论 2.1 PAHs胁迫对黑麦草生物量的影响在PAHs胁迫下,黑麦草生长过程中未表现出受害症状,显示其较强的耐受能力,具体生物量如图 4所示。对照组及各处理组的黑麦草数目在116~135株范围。对照组黑麦草平均干质量为4.4 mg·株-1,不同种类及浓度的PAHs胁迫处理使黑麦草干质量有不同程度的增加。低浓度菲胁迫使黑麦草干质量增加了52.3%(6.7 mg·株-1),高浓度菲使黑麦草干质量略有增加(4.9 mg·株-1),低浓度菲胁迫下黑麦草干质量的增加幅度更大,但统计学分析表明差异均不显著(P>0.05)。谢明吉等[9]做了菲对黑麦草影响的研究,结果表明黑麦草生物量随菲浓度的升高呈现先升高后降低的趋势,1 mg·L-1菲处理的黑麦草生物量最大,8 mg·L-1菲处理的黑麦草生物量与对照组无显著差异,与本实验结果相似。芘胁迫对黑麦草生物量的影响与菲不同。芘胁迫下(PYR-L和PYR-H),黑麦草生物量均为6.2 mg·株-1,相较于对照组有显著增加(40.9%,P < 0.01),芘的浓度水平差异(0.4 mg·L-1和10 mg·L-1)未影响生物量的增加幅度。谢晓梅等[21]研究了浓度为3~9 mg·L-1的芘对黑麦草的胁迫作用,发现该浓度下的芘处理未对黑麦草生物量产生显著影响。苯并(a)芘胁迫下,黑麦草干质量分别为5.4 mg·株-(1 BAP-L)和5.7 mg·株-(1 BAP-H),均高于对照组,即苯并(a)芘刺激了植物的生长,但统计学分析表明低浓度苯并(a)芘处理组与对照组差异显著(P < 0.05),高浓度处理组与对照组差异不显著(P>0.05)。潘声旺等[22-23]研究了同为PAHs污染土壤修复植物的羊茅属植物对芘和苯并(a)芘的胁迫响应,发现轻中度的芘及苯并(a)芘胁迫能刺激羊茅属植物的生长,重度胁迫则抑制了其生长。在本研究中,不同种类及浓度的PAHs胁迫处理使黑麦草生物量有了不同程度的增加。有研究表明[24-25],PAHs胁迫会对植物的生理生态产生影响,如植物生长(株高、根长、根表面积、叶面积等)、形态和组织结构、光合作用、抗氧化系统等,进而影响到最后的生物量,影响程度因污染物种类及浓度不同而异。本研究中,相同浓度(10 mg· L-1)胁迫下,菲对黑麦草生物量无显著影响,芘则显著增加了黑麦草生物量,二者效应不同。这可能源于菲、芘的性质差异(表 1)导致根系对PAHs的吸收量不同。根系对PAHs的吸收有被动吸收和主动吸收[26]。被动吸收可视为分配过程,Kow大的污染物更易分配到植物根系的脂质中。主动吸收需载体协助,有研究报道[27]小麦根系细胞膜上的PAHs转运载体对四环以下PAHs的亲和力与PAHs的Kow值大小顺序一致。因此,黑麦草根系可能对芘的吸收能力更强,PAHs进入根系后会影响复杂的植物生理过程,最终将差异体现于生物量。研究表明,在采用黑麦草修复PAHs污染场地时,PAHs的种类应予以考虑。

|
*表示与对照组比较差异显著,P < 0.05;**表示与对照组比较差异极显著,P < 0.01。下同 * mean significant difference when compared to the control, P < 0.05; ** mean highly significant difference when compared to the control, P < 0.01. The same below 图 4 PAHs胁迫对黑麦草生物量的影响 Figure 4 Effects of PAHs on the biomass of Lolium perenne |
|
|
表 1 3种PAHs的基本理化性质[28] Table 1 Basic physico-chemical property of three PAHs |
各组的根冠比见图 4。对黑麦草生物量有显著促进作用的处理组(PYR-L & H及BAP-L)的根冠比与对照组无显著差异,其他处理组也未产生显著影响,说明PAHs胁迫未改变黑麦草生物量在根和茎叶上的分配比例。根冠比反映了地下部分与地上部分之间光合产物积累的关系,体现了植物对资源的分配策略。与对照组比较,每种PAHs处理的茎叶质量和根质量均存在增加趋势,植物生长没有受到抑制,这可能是植物未表现出显著根冠比调整这一保护机制的原因。
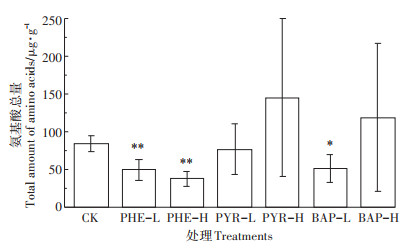
2.2 PAHs胁迫对氨基酸总量的影响PAHs对黑麦草分泌氨基酸总量的影响见图 5。对照组中,黑麦草分泌的氨基酸总量为(84.2±10.3)μg·g-1。在菲的胁迫下,黑麦草分泌的氨基酸总量均低于对照组(P < 0.01),说明菲对黑麦草氨基酸的分泌有抑制作用,且高浓度菲的抑制作用更强。Muratova等[29]研究了高粱对菲的响应。高粱具备PAHs修复潜力,10 mg·kg-1的菲胁迫对高粱分泌的氨基酸总量基本无影响,100 mg·kg-1则使分泌量降低78%。PYR-L使氨基酸总量略有降低,PYR-H使其增加,但与对照组相比均未产生显著差异(P>0.05),说明芘胁迫未显著影响黑麦草分泌的氨基酸总量。许超等[30]研究发现玉米根系分泌的氨基酸总量随着芘胁迫的加强而显著增多,芘对羊茅属植物的胁迫研究也有相似报道。在苯并(a)芘的胁迫下,BAP-L处理黑麦草氨基酸分泌总量低于对照组(P < 0.05),而BAP-H处理氨基酸总量高于对照组(P>0.05),即低浓度苯并(a)芘显著抑制了黑麦草氨基酸的分泌,高浓度苯并(a)芘能促进氨基酸的分泌,但效果不显著。潘声旺等[23]研究苯并(a)芘对不同修复潜力羊茅属植物根系分泌物的影响得到,苯并(a)芘胁迫总体上促进了氨基酸的分泌,胁迫强度越大分泌量越多,这与本研究中黑麦草的表现略有差异。这表明相同胁迫条件下根系分泌物的释放特征还受到植物自身基因型的特异性及其生理状态影响,提示在采用植物修复技术处理PAHs污染土壤时,植物种类是需要考虑的重要因素。本研究设置的PAHs浓度,菲胁迫使黑麦草的氨基酸分泌量显著降低,芘胁迫未产生显著影响,苯并(a)芘在低浓度时表现为抑制效应,高浓度时未表现出显著效应。3类PAHs产生不同的影响可归因于各自的性质和浓度差异。PAHs对植物的胁迫主要通过影响根系吸收和体内代谢实现。PAHs对植物根系吸收过程的影响已在上文讨论,其对植物代谢的影响与环数和浓度密切相关。高曦[31]的研究表明,PAHs能触发蚕豆抗氧化反应,并对蚕豆根尖细胞有DNA损伤效应,随着PAHs环数和分子量的增加,PAHs对根尖细胞DNA的损伤程度减小,随着PAHs浓度的增大,其损伤效应增强。PAHs通过黑麦草根系吸收和体内代谢过程,将其性质和浓度的差异综合作用结果在氨基酸的分泌量上得以表现。
|
图 5 PAHs对黑麦草分泌氨基酸总量的影响 Figure 5 Effects of PAHs on total amino acid excreted by Lolium perenne |
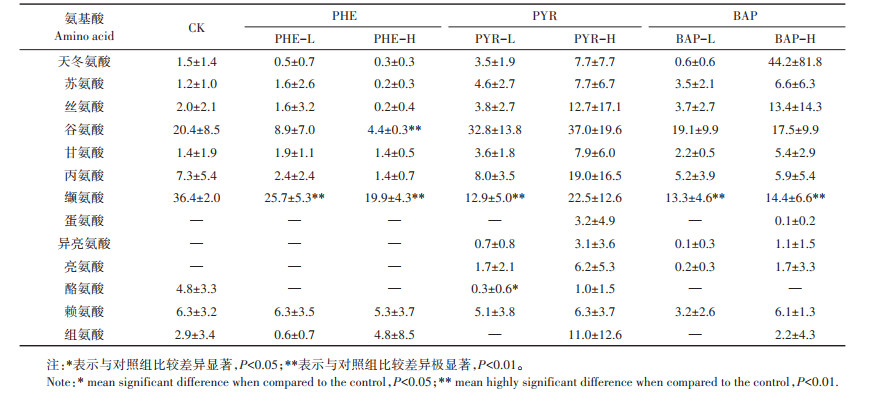
不同种类及浓度的PAHs胁迫下黑麦草分泌的氨基酸组分及含量见表 2。在对照组的黑麦草根系分泌物中检出了10种氨基酸,分别是天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、缬氨酸、酪氨酸、赖氨酸、组氨酸。其中缬氨酸和谷氨酸浓度相对较高,分别为(36.4±2.0)μg·g-1和(20.4±8.5)μg·g-1,占氨基酸总量的43%和24%。半胱氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、精氨酸未被检出。在PAHs胁迫下,黑麦草分泌出一些原本不分泌的氨基酸。芘和苯并(a)芘胁迫均使黑麦草分泌异亮氨酸及亮氨酸;高浓度芘和高浓度苯并(a)芘胁迫则使黑麦草分泌蛋氨酸,低浓度时无此现象。PAHs胁迫也使黑麦草停止分泌一些氨基酸组分。菲和苯并(a)芘胁迫使黑麦草不再分泌酪氨酸;低浓度芘和低浓度苯并(a)芘胁迫使黑麦草不再分泌组氨酸,高浓度时则无此现象。PAHs胁迫前后黑麦草均存在的氨基酸中,处理组与对照组有显著差异的氨基酸有缬氨酸(除高浓度芘外,其他处理均显著降低了其分泌)和谷氨酸(高浓度菲显著降低其分泌)。
|
|
表 2 PAHs胁迫对根系分泌物中氨基酸组分的影响(μg·g-1) Table 2 Effects of PAHs on amino acid composition excreted by Lolium perenne(μg·g-1) |
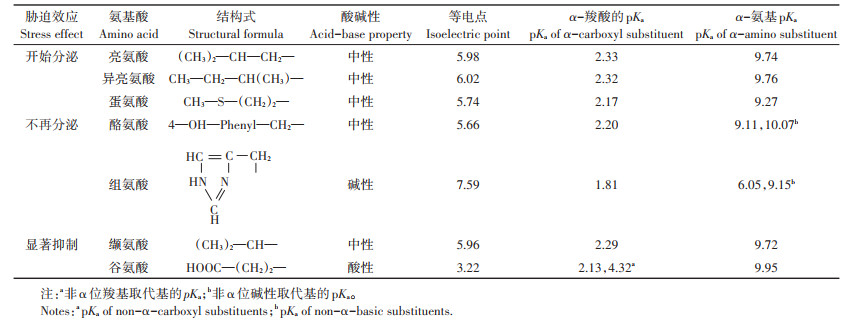
在PAHs胁迫下,浓度水平出现变化的氨基酸的理化性质如表 3所示。亮氨酸、异亮氨酸和缬氨酸在α-碳上都含有分支脂肪烃链,具有相似的化学结构,均属于脂肪族中性氨基酸。PAHs胁迫促使黑麦草分泌异亮氨酸及亮氨酸,抑制分泌缬氨酸,可能是亮氨酸、异亮氨酸与缬氨酸之间作为性质相似的氨基酸,在植物体内存在拮抗作用。目前支链氨基酸之间的拮抗作用及机制在动物体内已有报道[32],但在植物体内的作用了解尚少。根系分泌物中的氨基酸作为植物细胞进程的代谢产物,其组分和水平的变化是生物系统对环境变化的最终反映。王亚男等[33]对萱草修复石油烃污染土壤的根系代谢组学进行了分析,发现石油烃的存在改变了萱草根系的代谢,减少了甘氨酸、脯氨酸等氨基酸组分的含量,认为这是植物对石油烃暴露作出的代谢响应,是一种适应性响应。植物体内的氨基酸参与多条代谢通路的调控,影响植物的许多生理过程[34-36]。Li等[37]研究发现氨基酸代谢是PAHs主要影响的代谢途径,PAHs下调了水稻中谷氨酸等氨基酸的代谢。PAHs胁迫下,PAHs会被植物吸收,在植物体内水解、还原或氧化[38],转化为疏水性中间物,产生氧化胁迫和基因毒性。随后,转化物与氨基酸、糖或谷胱甘肽等发生共轭作用,形成亲水性极强的极性分子。PAHs的转化中间产物能与氨基酸发生共轭,干扰氨基酸的正常代谢,影响氨基酸的组分构成和分泌量。为减少毒害,植物体通过转运蛋白的作用,将形成的可溶性缀合物区室化到液泡或转到细胞壁,以减少它们对细胞正常代谢的影响。PAHs胁迫时,具备修复潜力的植物会表现出较强的环境适应性和生物活性上的可塑性,并体现于根系分泌物的释放特征上,这种释放特征可能是根系组织和细胞为了减轻污染物毒害进行的生理调节,也可能是污染物破坏了根系正常生理活动造成细胞内有机物质渗漏造成的。本研究中,对于受PAHs胁迫发生显著变化的黑麦草根系分泌物中的氨基酸组分,它们的信号通路具体受到了怎样的影响,会影响哪些植物生理过程,PAHs胁迫与氨基酸代谢响应之间有何关联,其中的生化与分子机制有待进一步研究。
|
|
表 3 受PAHs影响的氨基酸理化性质 Table 3 Characteristics of affected amino acids |
氨基酸能够参与有机污染土壤修复过程,并在其中发挥作用。杨传杰等[15]研究发现外源氨基酸对龙葵修复PAHs污染土壤具有强化作用,甘氨酸、谷氨酸及半胱氨酸复合处理(各0.3 mmol·kg-1)效果最佳,对土壤PAHs总量的去除率提高了4.46倍,推断可能源于氨基酸为土壤微生物提供了共代谢基质。Sun等[16-17]以丙氨酸和丝氨酸为例研究了氨基酸对土壤中PAHs吸附、解吸及生物可利用性的影响,发现氨基酸降低了PAHs在土壤上的吸附,低浓度的氨基酸促进PAHs的解吸,高浓度则抑制解吸,随氨基酸浓度增加,丁醇可提取态的PAHs含量增高。Huang等[7]研究了根系分泌物组分对土壤中多溴联苯醚的解吸、生物可利用性、生物可降解性的影响,发现甘氨酸组分能够促进BDE-28和BDE-47的解吸,增加丁醇可提取态的比例,提高了降解率。以上报道的氨基酸在本研究的黑麦草根系分泌物中多有检出。可以预测,在使用黑麦草修复PAHs污染土壤过程中,其根系分泌物中的氨基酸组分能够参与修复过程,并可能会发挥积极作用。各组分氨基酸的分子组成和结构不同,其性质(如其两性离子性、酸碱性、等电点等)也有所差异[39],这种差异可能会影响其参与的化学及生化反应及其在生命代谢过程中所起的作用。宏量氨基酸组分不能替代微量组分,且组分间的不同配比可能会产生不同效应。受PAHs胁迫,黑麦草分泌的氨基酸组分及含量发生了变化,这种变化在根系分泌物参与污染土壤修复过程中会对土著微生物菌群、PAHs的赋存状态及环境行为等方面产生影响,进而影响土壤中PAHs的去除效果。关注PAHs胁迫下黑麦草根系分泌物中氨基酸组分的响应,了解其变化的组分和含量,对于探索植物修复有机污染土壤的作用机制有重要意义。
3 结论(1)无PAHs胁迫时,黑麦草根系分泌物的氨基酸总量为(84.2±10.3)μg·g-1,共检出10种氨基酸,其中缬氨酸和谷氨酸浓度相对较高,各占氨基酸总量的43%和24%。
(2)PAHs胁迫使黑麦草生物量有不同程度的增加,并影响根系分泌氨基酸的总量及组分构成,其胁迫效应因PAHs种类和浓度而异。
(3)对于氨基酸总量,菲和低浓度苯并(a)芘均起抑制作用,且高浓度菲比低浓度抑制效应更强;其他处理无显著影响。
(4)对于氨基酸组分构成,菲使黑麦草不再分泌酪氨酸并抑制了缬氨酸的分泌,高浓度时还对谷氨酸分泌起抑制作用。芘的存在使黑麦草开始分泌异亮氨酸及亮氨酸,高浓度时还可促使蛋氨酸分泌,低浓度时则抑制了缬氨酸的分泌且使黑麦草不再分泌组氨酸。苯并(a)芘使黑麦草开始分泌异亮氨酸、亮氨酸,而不再分泌酪氨酸,并抑制了缬氨酸的分泌,此外,高浓度时还使黑麦草开始分泌蛋氨酸,低浓度时则另使黑麦草不再分泌组氨酸。
| [1] |
Zhang Y, Peng C, Guo Z, et al. Polycyclic aromatic hydrocarbons in urban soils of China:Distribution, influencing factors, health risk and regression prediction[J]. Environmental Pollution, 2019, 254: 1-11. |
| [2] |
周际海, 袁颖红, 朱志保, 等. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报, 2015, 24(2): 343-351. ZHOU Ji-hai, YUAN Ying-hong, ZHU Zhi-bao, et al. A review on bioremediation technologies of organic pollutants contaminated soils[J]. Ecology and Environmental Sciences, 2015, 24(2): 343-351. |
| [3] |
Rostami S, Azhdarpoor A. The application of plant growth regulators to improve phytoremediation of contaminated soils:A review[J]. Chemosphere, 2019, 220: 818-827. DOI:10.1016/j.chemosphere.2018.12.203 |
| [4] |
许超, 夏北成. 土壤多环芳烃污染根际修复研究进展[J]. 生态环境, 2007, 16(1): 216-222. XU Chao, XIA Bei-cheng. Research progress in rhizoremediation on polycyclic aromatic hydrocarbons(PAHs)contaminated soil[J]. Ecology and Environment, 2007, 16(1): 216-222. |
| [5] |
孟梁. 根系分泌物及其在有机污染土壤修复中的作用[J]. 上海农业学报, 2013, 29(2): 90-94. MENG Liang. Root exudates and their effects on remediaton of organic contaminated soils[J]. Acta Agriculturae Shanghai, 2013, 29(2): 90-94. |
| [6] |
Fanny R, Marc S A. Root exudation:The ecological driver of hydrocarbon rhizoremediation[J]. Agronomy, 2016, 6(1): 19-27. DOI:10.3390/agronomy6010019 |
| [7] |
Huang H, Wang S, Lv J, et al. Influences of artificial root exudate components on the behaviors of BDE-28 and BDE-47 in soils:Desorption, availability, and biodegradation[J]. Environmental Science and Pollution Research, 2016, 23(8): 7702-7711. DOI:10.1007/s11356-015-6025-y |
| [8] |
Lapie C, Sterckeman T, Paris C, et al. Impact of phenanthrene on primary metabolite profiling in root exudates and maize mucilage[J]. Environmental Science and Pollution Research, 2020, 27(3): 3124-3142. DOI:10.1007/s11356-019-07298-x |
| [9] |
谢明吉, 严重玲, 叶菁. 菲对黑麦草根系几种低分子量分泌物的影响[J]. 生态环境, 2008, 17(2): 576-579. XIE Ming-ji, YAN Chong-ling, YE Jing. Effect of phenanthrene on the secretion of low molecule weight organic compounds by ryegrass root[J]. Ecology and Environment, 2008, 17(2): 576-579. |
| [10] |
Toyama T, Furukawa T, Maeda N, et al. Accelerated biodegradation of pyrene and benzo[a]pyrene in the Phragmites australis rhizosphere by bacteria-root exudate interactions[J]. Water Research, 2011, 45(4): 1629-1638. DOI:10.1016/j.watres.2010.11.044 |
| [11] |
万大娟, 贾晓珊, 陈娴. 多氯代有机污染物胁迫下植物某些根系分泌物的变化[J]. 中山大学学报(自然科学版), 2007, 46(1): 110-113. WAN Da-juan, JIA Xiao-shan, CHEN Xian. Effects of PCOPs on some root exudates of plants[J]. Acta Scientiarum Naturalium Universitatis Sunyatsen, 2007, 46(1): 110-113. |
| [12] |
Hu L F, Robert C A M, Selma C, et al. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota[J]. Nature Communications, 2018, 9(1): 1-13. DOI:10.1038/s41467-017-02088-w |
| [13] |
Jin Y Q, Zhu H F, Luo S, et al. Role of maize root exudates in promotion of colonization of bacillus velezensis strain S3-1 in rhizosphere soil and root tissue[J]. Current microbiology, 2019, 76(7): 855-862. DOI:10.1007/s00284-019-01699-4 |
| [14] |
Meier I C, Finzi A C, Phillips R P. Root exudates increase N availability by stimulating microbial turnover of fast-cycling N pools[J]. Soil Biology and Biochemistry, 2017, 106: 119-128. DOI:10.1016/j.soilbio.2016.12.004 |
| [15] |
杨传杰, 魏树和, 周启星, 等. 外源氨基酸对龙葵修复Cd-PAHs污染土壤的强化作用[J]. 生态学杂志, 2009, 28(9): 1829-1834. YANG Chuan-jie, WEI Shu-he, ZHOU Qi-xing, et al. Promotion effects of exogenous amino acids on phytoremediation of Cd-PAHs contaminated soils by using hyperaccumulator plant Solanum nigrum[J]. Chinese Journal of Ecology, 2009, 28(9): 1829-1834. |
| [16] |
Sun B, Gao Y, Liu J, et al. The impact of different root exudate components on phenanthrene availability in soil[J]. Soil Science Society of America Journal, 2012, 76(6): 2041-2050. DOI:10.2136/sssaj2011.0417 |
| [17] |
Sun B, Ling W, Wang Y. Can root exudate components influence the availability of pyrene in soil?[J]. Journal of Soils and Sediments, 2013, 13(7): 1161-1169. DOI:10.1007/s11368-013-0712-4 |
| [18] |
Tian W, Zhao J, Zhou Y, et al. Effects of root exudates on gel-beads/reeds combination remediation of high molecular weight polycyclic aromatic hydrocarbons[J]. Ecotoxicology and Environmental Safety, 2017, 135: 158-164. DOI:10.1016/j.ecoenv.2016.09.021 |
| [19] |
Duan J, He S, Feng Y, et al. Floating ryegrass mat for the treatment of low-pollution wastewater[J]. Ecological Engineering, 2017, 108: 172-178. DOI:10.1016/j.ecoleng.2017.07.036 |
| [20] |
刘艳, 彭晓丹, 李洋. 几种水培液对香根草生长情况的影响[J]. 农技服务, 2016, 33(13): 23-25. LIU Yan, PENG Xiao-dan, LI Yang. Effects of several hydroponic solutions on vetiver growth[J]. Agricultural Technology Service, 2016, 33(13): 23-25. |
| [21] |
谢晓梅, 廖敏, 杨静. 芘对黑麦草根系几种低分子量有机分泌物的影响[J]. 生态学报, 2011, 31(24): 243-249. XIE Xiao-mei, LIAO Fan, YANG Jing. Effect of pyrene on low molecule weight organic compounds in the root exudates of ryegrass(Lolium perenne L.)[J]. Acta Ecologica Sinica, 2011, 31(24): 243-249. |
| [22] |
潘声旺, 袁馨, 刘灿, 等. 芘胁迫对5种羊茅属植物根系分泌的几类低分子量有机物的影响[J]. 环境科学, 2016, 37(6): 2368-2375. PAN Sheng-wang, YUAN Xin, LIU Can, et al. Effects of pyrene on low molecule weight organic compounds in the root exudates of five species of festuca[J]. Environmental Science, 2016, 37(6): 2368-2375. |
| [23] |
潘声旺, 袁馨, 刘灿, 等. 苯并[α]芘对不同修复潜力羊茅属植物的根系分泌物中几种低分子量有机物的影响[J]. 植物生态学报, 2016, 40(6): 604-614. PAN Sheng-wang, YUAN Xin, LIU Can, et al. Effects of benzo[α] pyrene on the organic compounds of low molecule weight excreted by root systems in five Festuca species with different remediation potentials[J]. Chinese Journal of Plant Ecology, 2016, 40(6): 604-614. |
| [24] |
徐胜, 王慧, 陈玮, 等. 土壤中多环芳烃污染对植物生理生态的影响[J]. 应用生态学报, 2013, 24(5): 1284-1290. XU Sheng, WANG Hui, CHEN Wei, et al. Effects of soil PAHs pollution on plant ecophysiology[J]. Chinese Journal of Applied Ecology, 2013, 24(5): 1284-1290. |
| [25] |
梁勇生, 黄杏, 龙明华, 等. 多环芳烃胁迫对菜心生长及生理特性的影响[J]. 华南农业大学学报, 2018, 39(6): 54-60. LIANG Yong-sheng, HUANG Xing, LONG Ming-hua, et al. Effects of polycyclic aromatic hydrocarbons stress on growth and physiological characteristics of Brassica parachinensis[J]. Journal of South China Agricultural University, 2018, 39(6): 54-60. |
| [26] |
陆守昆.植物根系吸收疏水性有机污染物的数学模型构建: 以多环芳烃为例[D].南京: 南京农业大学, 2016: 13-15. LU Shou-kun. A mathematical model for hydrophobic organic contaminant uptake by plant roots: A case study with polycyclic aromatic hydrocarbons[D]. Nanjing: Nanjing Agricultural University, 2016: 13-15. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CDFD&dbname=CMFD&filename=1017259742.nh |
| [27] |
易修, 袁嘉韩, 顾锁娣, 等. 小麦根系吸收萘、菲、芘的动力学特征[J]. 环境科学学报, 2013, 33(4): 1135-1140. YI Xiu, YUAN Jia-han, GU Suo-di, et al. Kinetic characteristics of naphthalene, phenanthrene and pyrene uptake by wheat root[J]. Acta Scientiae Circumstantiae, 2013, 33(4): 1135-1140. |
| [28] |
Schwarzenbach R P, Gschwend P M, Imboden D M. Environmental organic chemistry 2th Edition[M]. USA: John Wiley & Sons, 2004: 1199-1200.
|
| [29] |
Muratova A, Golubev S, Wittenmayer L, et al. Effect of the polycyclic aromatic hydrocarbon phenanthrene on root exudation of Sorghum bicolor(L.)Moench[J]. Environmental and Experimental Botany, 2009, 66(3): 514-521. DOI:10.1016/j.envexpbot.2009.03.001 |
| [30] |
许超, 夏北成. 芘对玉米根系分泌氨基酸的影响[J]. 生态环境学报, 2009, 18(1): 172-175. XU Chao, XIA Bei-cheng. Effect of pyrene on amino acid in root exudates of maize(Zea mays L.)[J]. Ecology and Environmental Sciences, 2009, 18(1): 172-175. |
| [31] |
高曦.多环芳烃对植物的基因毒性及氧化胁迫[D].南京: 南京农业大学, 2014: 34-42. GAO Xi. PAHs induced genotoxicity and oxidative stress in cells of plant[D]. Nanjing: Nanjing Agricultural University, 2014: 34-42. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016041863.htm |
| [32] |
代腊, 邹晓庭. 缬氨酸在畜禽生产中的应用[J]. 饲料与畜牧, 2012(12): 20-23. DAI La, ZOU Xiao-ting. Application of valine in livestock and poultry production[J]. Fodder and Livestock, 2012(12): 20-23. |
| [33] |
王亚男, 程立娟, 周启星, 等. 萱草修复石油烃污染土壤的根际机制和根系代谢组学分析[J]. 环境科学, 2016, 37(5): 1978-1985. WANG Ya-nan, CHENG Li-juan, ZHOU Qi-xing, et al. Rhizospheric mechanisms of Hemerocallis middendorfii Trautv. et Mey. remediating petroleum-contaminated soil and metabonomic analyses of the root systems[J]. Environmental Science, 2016, 37(5): 1978-1985. |
| [34] |
杨晴晴, 吴宏玉, 陈思予, 等. 高等植物中赖氨酸代谢调控及其关联效应研究进展[J]. 植物生理学报, 2019, 55(12): 1737-1746. YANG Qing-qing, WU Hong-yu, CHEN Si-yu, et al. Advances in regulation and connection of lysine metabolism in higher plants[J]. Plant Physiology Journal, 2019, 55(12): 1737-1746. |
| [35] |
Galili G, Amir R. Fortifying plants with the essential amino acids lysine and methionine to improve nutritional quality[J]. Plant Biotechnology Journal, 2013, 11(2): 211-222. |
| [36] |
Yang Q Q, Zhao D S, Zhang C Q, et al. A connection between lysine and serotonin metabolism in rice endosperm[J]. Plant Physiology, 2018, 176(3): 1965-1980. DOI:10.1104/pp.17.01283 |
| [37] |
Li X, Mu L, Hu X, et al. Integrating proteomics, metabolomics and typical analysis to investigate the uptake and oxidative stress of graphene oxide and polycyclic aromatic hydrocarbons[J]. Environmental Science:Nano, 2018, 5(1): 115-129. DOI:10.1039/C7EN00803A |
| [38] |
张翼.植物对多环芳烃的代谢作用[D].南京: 南京农业大学, 2009: 17-24. ZHANG Yi. Metabolism of polycyclic aromatic hydrocarbons in plant[D]. Nanjing: Nanjing Agricultural University, 2009: 17-24. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGHY201109003838.htm |
| [39] |
刑其毅, 裴伟伟, 徐瑞秋, 等. 基础有机化学[M]. 4版. 北京: 高等教育出版社, 2017: 978-982. XING Qi-yi, PEI Wei-wei, XU Rui-qiu, et al. Basic organic chemistry[M]. 4th Edition. Beijing: Higer Education Press, 2017: 978-982. |
 2020, Vol. 39
2020, Vol. 39