2. 中国农业科学院新乡农业水土环境野外科学观测试验站, 河南 新乡 453000;
3. 中国农业科学院农产品质量安全重点开放实验室, 河南 新乡 453000
2. Agricultural Water Soil Environmental Field Research Station of Xinxiang, Chinses Academy of Agricultural Sciences, Xinxiang 453000, China;
3. Key Laboratory of High-efficient and Safe Utilization of Agriculture Water Resources, Chinses Academy of Agricultural Sciences, Xinxiang 453000, China
近年来,农田土壤Cd污染严重威胁到食品安全、人畜健康及生态环境可持续发展;Cd在土壤中迁移性差、毒害性大,对土壤物质能量循环、作物生理及结构等诸多方面均会构成潜在威胁和显性危害[1-2]。因此,为保障粮食安全生产和生态环境可持续发展所必需的优质土地资源,对Cd污染土壤的修复研究意义重大。目前修复土壤Cd污染的方法主要有物理修复法、化学修复法、生物修复法、矿物材料修复法等;大部分修复手段局限性较强,如物理修复技术能耗大、成本高,无法实现大面积推广;化学修复技术极易造成土壤二次污染;生物修复技术效果受外界环境影响较大且修复过程缓慢,效果不稳定等[3-4]。相比传统修复手段,利用重金属富集植物修复土壤Cd污染具有可大面积推广、不破坏土壤结构、无二次污染等优点,是一种相对安全、可靠的环境友好型修复技术。因此,在Cd污染土壤修复技术当中最具发展前景[5]。然而,传统富集植物经济产出小,大多缺乏生产价值,因而生物量和经济价值较高的一系列富集植物在修复土壤重金属污染的应用中逐渐受到关注。在治理农田土壤重金属污染时,相比野外的超富集植物,选用一些生物量较大、符合当地种植条件、有较强重金属耐受能力又可以富集重金属的农作物在实际生产和修复潜力上更具优势,在修复重金属污染的同时又能带来一定的经济效益。油葵生长迅速、生物量大、适应能力强且经济附加值高,其根系对Cd的富集能力强,是植物修复Cd污染土壤的理想选择[6]。
植物根系对Cd的吸收能力与土壤中Cd的生物可利用程度共同决定土壤Cd污染的修复效果,根系分泌的小分子有机酸可从多方面诱导土壤Cd修复机制,主要通过改变土壤中Cd的赋存形态,刺激根系对Cd的吸收,从而提高修复效率、加快修复进程[7]。然而,植物根系分泌释放的少量有机酸对重金属污染土壤的修复过程仍十分缓慢。因此,引入外源有机酸是提升重金属污染土壤修复效率的关键[8-9]。外源有机酸与富集植物联合能充分利用定殖到植物体内和土壤的有益微生物,增强植物对环境污染物和其他逆境的耐受性,从而有效增强共生体系对环境的修复能力,也能通过调节土壤pH值、螯合作用等途径刺激土壤中Cd形态发生改变[10],改变Cd在土壤环境中的生物有效性和毒性[11-12],从而影响植物对Cd的吸收[13]。草酸作为典型的天然小分子有机酸,与重金属离子结合能够形成稳定的螯合物[14],改变重金属活性,一定程度上可促进植株地上部对重金属离子的吸收[15]。在植物修复重金属污染土壤的过程中施加草酸可极大增强修复效果。目前,针对有机酸结合植物修复重金属污染土壤的相关研究大多集中于不同种类有机酸、不同品种超富集植物的修复效果对比及筛选,而将油葵作为富集植物,结合外源草酸不同施入时间节点和施加浓度条件下的土壤Cd污染修复效应及土壤环境响应机制的相关研究甚少。为此,本研究从土壤环境改变入手,探索外源草酸不同施入时间和施加浓度对土壤不同形态Cd含量及相关土壤化学指标的影响,以期为重金属污染土壤修复技术的研究提供数据支撑和理论依据。
1 材料与方法 1.1 供试作物与土壤选取“先瑞2号”作为供试油葵品种;试验用土于2011年采自某Cd污染区,后经多次重金属污染试验,土壤中Cd总量达到19.5 mg·kg-1。土壤总N量1.14 g·kg-1,总P量0.63 g·kg-1,K 86 mg·kg-1,土壤有机质质量分数为2.70%,土壤pH值为8.20。
1.2 试验设计试验于中国农业科学院农业水土环境野外科学观测试验站日光温室中进行。试验用土经自然风干、研磨、过5 mm筛分后充分混匀,装入塑料花盆中。试验用花盆上缘直径25 cm,高15 cm,底部直径15 cm,每盆装入风干土3 kg。在2018年10月2日播种,10月6日出苗。分别在油葵出苗后的第20、30、40、50 d时施入外源草酸。草酸设6种浓度水平,分别为1、2、3、4、5、6 mmol·kg-1,以不加草酸为对照(CK),共计25个处理,每个处理重复3次,共计填装花盆75盆。试验过程中,当土壤含水率降低至田间持水量的70%时开始浇水。2019年1月9日收获油葵,试验周期为100 d。收获后将每盆土样全部倒出,充分混匀后取部分土样装入密封袋,带回实验室用于测定土壤Cd总量、不同形态(可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态)Cd含量、土壤pH值、土壤酶活性(过氧化氢酶活性、淀粉酶活性、蔗糖酶活性)。
1.3 指标测定与分析方法土壤Cd总量通过王水-高氯酸消解后,采用原子吸收分光光度计法测定;采用Tessier分级提取法提取不同形态Cd(可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态),提取液中Cd采用TAS-986原子吸收分光光度计测定[16]。土壤Cd去除率为油葵种植前土壤Cd总量与油葵收获后土壤Cd总量之差与油葵种植前土壤Cd总量之比。土壤采集后测定新鲜土样酶活性,土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,土壤过氧化氢酶活性采用高锰酸钾滴定法测定,土壤淀粉酶活性采用3,5-二硝基水杨酸比色法测定[16]。将油葵根和地上部用自来水充分冲洗干净后,再用去离子水冲洗,在105 ℃条件下杀青30 min,然后在75 ℃下烘干直至质量恒定,分别测定油葵根、地上部分干质量。
应用Excel 2010和SAS 9.2对数据进行方差分析;选取95%置信水平,应用最小显著差异法(LSD)进行不同处理间的多重比较。
2 结果与分析 2.1 草酸浓度与施用时间对土壤pH值及酶活性的影响不同处理土壤pH值及酶活性见表 1。在油葵出苗后20、30、40 d及50 d 4个时间点施入不同浓度草酸后的土壤pH值与CK相比均无显著差异(P>0.05)。可见,草酸对土壤pH值影响不明显。
|
|
表 1 草酸不同浓度与施入时间下的土壤酶活性 Table 1 pH and enzyme activity in root soil under different oxalic acid concentrations and application time |
油葵出苗后20 d时,不同浓度草酸施用条件下的土壤过氧化氢酶活性均高于CK,其中1、6 mmol·kg-1浓度下的过氧化氢酶活性提升显著(P < 0.05),相比CK分别提高38.5%和48.4%。出苗后30 d,3、4、5 mmol·kg-1草酸施用浓度下的土壤过氧化氢酶活性显著高于CK(P < 0.05),分别提高44.3%、69.7%和63.1%。出苗后40 d时,1、2、3、4、5、6 mmol·kg-1草酸浓度水平下的土壤过氧化氢酶活性均显著高于CK(P < 0.05),分别提高70.5%、47.5%、45.1%、57.4%、79.5%及84.4%。出苗后50 d时,1、2、3、4 mmol·kg-1草酸浓度水平下的土壤过氧化氢酶活性显著高于CK(P < 0.05),分别提高43.4%、52.5%、45.1%和55.7%。综上,草酸的施入一定程度上提高了土壤过氧化氢酶活性,有利于提升土壤的自净与解毒能力。
出苗后20、30、40 d时,草酸不同浓度水平下的土壤淀粉酶活性均显著低于CK(P < 0.05);而在出苗后50 d时施入草酸,各浓度下的土壤淀粉酶活性与CK相比均无明显差异。前期施加草酸会降低土壤淀粉酶活性,一定程度上不利于根系与土壤环境间有机物质交换;土壤淀粉酶活性随着草酸施入时间的延缓呈先降低后升高趋势;在油葵出苗后40 d时施用草酸,土壤淀粉酶活性最低。
出苗后20 d时,不同浓度草酸土壤蔗糖酶活性均高于CK,其中6 mmol·kg-1浓度下的蔗糖酶活性提高显著(P < 0.05),相比CK提升34.0%。出苗后30 d时,施用2、3 mmol·kg-1浓度草酸,土壤蔗糖酶活性显著高于CK,分别提高102.1%和74.5%。出苗后40 d时,1、2、3、4、5、6 mmol·kg-1浓度下的土壤蔗糖酶活性均高于CK,其中1、2、5、6 mmol·kg-1浓度水平下的蔗糖酶活性提高显著(P < 0.05),相比CK分别提高147%、126%、123%及138%。出苗后50 d时,1、2、3 mmol· kg-1草酸浓度下的土壤蔗糖酶活性显著高于CK(P < 0.05),分别提高82.9%、53.2%和38.3%。可见,施加草酸一定程度上能够刺激土壤蔗糖酶活性的提升,对土壤碳循环转化过程可起到积极的调节作用。
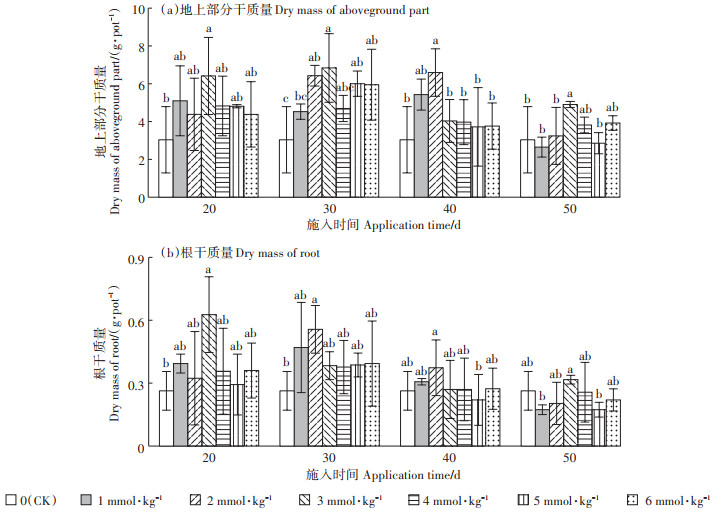
2.2 草酸浓度与施用时间对油葵地上部分及根干质量的影响不同处理油葵地上部分干质量见图 1(a)。与CK相比,油葵出苗后20 d时施用3 mmol·kg-1浓度草酸,地上部分干质量提高了122%,达显著水平(P < 0.05);其他草酸浓度下的油葵地上部分干质量虽高于CK,但差异不显著。出苗后30 d时,施用2、3、5、6 mmol· kg-1浓度草酸,油葵地上部分干质量均显著高于CK(P < 0.05),分别提高112%、126%、98.0%及96.4%。出苗后40 d时,施加1、2、3、4、5、6 mmol·kg-1浓度草酸,油葵地上部分干质量均高于CK,其中2 mmol·kg-1浓度下的地上部分干质量提高显著(P < 0.05),相比CK处理提高117%。出苗后50 d时,3 mmol·kg-1浓度水平下的油葵地上部分干质量显著高于CK(P < 0.05),相比CK提高61.7%。综上,施用草酸能够提升油葵地上部分干质量;地上部分干质量均以3 mmol· kg-1草酸浓度处理为最高(40 d时除外)。此外,3、4、5、6 mmol·kg-1浓度下的油葵地上部分干质量均以出苗后30 d时施用为最高,而1、2 mmol·kg-1浓度下的油葵地上部分干质量则以出苗后40 d时施用为最高。可见,在油葵出苗后30~40 d时施用草酸最有利于提高油葵地上部分干质量。
|
不同小写字母代表相同施入时间下不同草酸浓度处理间差异显著。下同 Different lowercase letters indicate significant differences among different oxalic acid concentration treatments at the same application time. The same below 图 1 草酸浓度与施用时间对油葵生物量的影响 Figure 1 Dry mass of oil sunflower under different oxalic acid concentrations and application time |
不同处理油葵根干质量见图 1(b)。与CK相比,出苗后20 d时施用3 mmol·kg-1浓度草酸,油葵根干质量显著提高(P < 0.05),较CK提高138%。出苗后30 d时施用2 mmol·kg-1浓度草酸,油葵根干质量显著高于CK(P < 0.05),较CK提高117%。出苗后40、50 d时施加不同浓度草酸,油葵根干质量与CK相比均无显著差异。总体来看,在油葵出苗后20~30 d时施用草酸,根干质量均高于CK,可见在出苗后20~30 d施用草酸有利于提高油葵根干质量。相同草酸施入时间下,油葵根干质量以2、3 mmol·kg-1浓度处理为最高;除3 mmol·kg-1浓度处理外,各浓度水平下的油葵根干质量均随着草酸施入时间的延缓呈先升高后降低的趋势;出苗后30 d时施加草酸,油葵根干质量达到最高。
2.3 草酸浓度与施用时间对土壤Cd赋存形态的影响不同处理土壤可交换态Cd含量见图 2(a)。草酸各浓度水平与施入时间下的土壤可交换态Cd含量总体上均低于CK(20 d时2 mmol·kg-1浓度及50 d时1、6 mmol·kg-1浓度处理除外),可见施加草酸一定程度上可降低土壤可交换态Cd含量。出苗后20 d时,6 mmol·kg-1草酸浓度下的土壤可交换态Cd含量显著低于CK(P < 0.05),较之降低19.4%;出苗后30 d时,施用1、2、3 mmol·kg-1浓度草酸,土壤可交换态Cd含量显著低于CK(P < 0.05),较之降低30.2%~44.4%;出苗后40 d时,1、2、3、4、5、6 mmol·kg-1草酸浓度下的土壤可交换态Cd含量均显著低于CK(P < 0.05),较之降低26.3%~35.1%;出苗后50 d时,1 mmol·kg-1草酸浓度下土壤可交换态Cd显著高于CK,其他草酸浓度下的土壤可交换态Cd含量与CK相比均无显著差异。总体来看,在油葵出苗后40 d时施用草酸,土壤可交换态Cd含量最低;相同施用时间下,可交换态Cd含量均以3 mmol·kg-1浓度水平为最低。在油葵出苗后40 d时施用3 mmol·kg-1浓度草酸,土壤可交换态Cd含量最低。

|
图 2 草酸浓度与施用时间对土壤Cd赋存形态的影响 Figure 2 Content of different forms of Cd in root soil under different oxalic acid concentrations and application time |
不同处理土壤碳酸盐结合态Cd含量见图 2(b)。草酸各浓度与施用时间下的土壤碳酸盐结合态Cd含量均高于CK(50 d时2 mmol·kg-1浓度处理除外)。出苗后20 d时,各浓度下的土壤碳酸盐结合态Cd含量相比CK提高6.4%~36.8%,其中4 mmol·kg-1浓度处理与CK相比差异显著(P < 0.05);出苗后30 d时,各草酸浓度下的土壤碳酸盐结合态Cd含量相比CK提升0.9%~45.0%,其中1、5 mmol·kg-1浓度处理显著高于CK(P < 0.05);出苗后40 d时,各草酸浓度下的土壤碳酸盐结合态Cd含量均显著高于CK(P < 0.05),较之提高50.3%~152.2%;出苗后50 d时,除2 mmol·kg-1浓度处理外,其他草酸浓度下的碳酸盐结合态Cd含量均高于CK,但差异不显著。总体来看,草酸不同浓度水平下的土壤碳酸盐结合态Cd含量均在出苗后40 d时达到最高,此时4 mmol·kg-1浓度处理下的油葵土壤碳酸盐结合态Cd含量远高于CK及其他各浓度水平。
不同处理土壤铁锰氧化物结合态Cd含量见图 2(c)。草酸各浓度与施用时间下的土壤铁锰氧化物结合态Cd含量均低于CK(50 d时1 mmol·kg-1浓度处理除外)。出苗后20 d时,各草酸浓度下的土壤铁锰氧化物结合态Cd含量相比CK降低32.4%~57.4%,其中2、3、4、6 mmol·kg-1浓度处理与CK相比差异显著(P < 0.05);出苗后30 d时,各草酸浓度下的土壤铁锰氧化物结合态Cd含量相比CK降低8.6%~61.0%,其中1、2、3、6 mmol·kg-1浓度处理与CK相比差异显著(P < 0.05);出苗后40 d时,各草酸浓度下的土壤铁锰氧化物结合态Cd含量均显著低于CK(5 mmol·kg-1浓度处理除外),相比CK降低22.8%~45.1%;出苗后50 d时,除1 mmol·kg-1浓度处理外,其他草酸浓度下的土壤铁锰氧化物结合态Cd含量均低于CK,但差异不显著。总体来看,草酸各浓度水平下的土壤铁锰氧化物结合态Cd含量均在出苗后30 d时达到最低(4、5 mmol·kg-1浓度除外),40 d时次之。相同施入时间下,土壤铁锰氧化物结合态Cd含量以2、3 mmol·kg-1浓度水平为最低。在油葵出苗后30 d时施加3 mmol· kg-1浓度草酸,土壤铁锰氧化物结合态Cd含量最低。
不同处理土壤有机物结合态Cd含量见图 2(d)。草酸各浓度与施用时间下的土壤有机物结合态Cd含量均低于CK(50 d除外)。出苗后20 d时,各草酸浓度下的土壤有机物结合态Cd含量相比CK降低18.8%~43.8%,除5、6 mmol·kg-1浓度处理外,其他浓度均显著低于CK(P < 0.05);出苗后30 d时,各草酸浓度下的土壤有机物结合态Cd含量相比CK降低8.0%~31.3%,其中6 mmol·kg-1浓度处理与CK相比差异显著(P < 0.05);出苗后40 d时,各草酸浓度下的土壤有机物结合态Cd含量相比CK降低23.5%~30.9%,除5 mmol·kg-1浓度处理外,各浓度均显著低于CK(P < 0.05);出苗后50 d时,各处理间均无显著差异。总体来看,各草酸浓度下的土壤有机物结合态Cd含量均在出苗后40 d时达到最低;相同施入时间下,土壤有机物结合态Cd含量以2~3 mmol·kg-1浓度水平为最低。在油葵出苗后40 d时施用3 mmol·kg-1浓度草酸,土壤有机物结合态Cd含量最低。
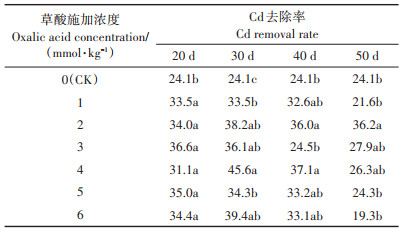
2.4 草酸浓度与施用时间对土壤Cd去除率的影响草酸各浓度与施用时间下每盆土壤Cd去除率见表 2。在油葵出苗后4个时间点施用不同浓度草酸,土壤Cd去除率均高于CK(50 d时1、6 mmol·kg-1浓度处理除外),可见施加草酸可有效提高土壤Cd去除率。出苗后20、30 d时,各草酸浓度处理下的土壤Cd去除率均显著高于CK,相比CK提升29.0%~51.8%和39.0%~89.2%;出苗后40 d时施入2、4 mmol·kg-1浓度草酸,土壤Cd去除率显著高于CK,相比CK提升49.3%和53.9%。综合分析,在油葵出苗后30 d时施入4 mmol·kg-1浓度草酸,土壤Cd去除率最高,相比CK提升89.2%。
|
|
表 2 不同处理每盆土壤Cd去除率(%) Table 2 Cd removal rate in soil under different treatments(%) |
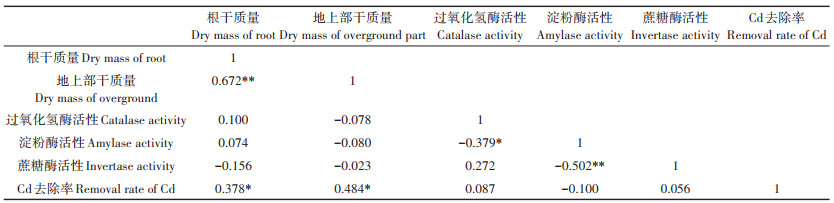
土壤Cd去除率与油葵干质量和土壤酶活性之间的相关性见表 3。土壤Cd去除率与油葵地上部分干质量、根干质量呈显著正相关(P < 0.05),与土壤过氧化氢酶活性、淀粉酶活性、蔗糖酶活性均无显著相关性(P>0.05),可见土壤Cd去除率越高越有利于油葵地上部分干质量及根干质量的提升。
|
|
表 3 油葵干质量、土壤酶活性与Cd去除率相关矩阵 Table 3 Correlation matrix of oil sunflower dry weight, soil enzyme activity and Cd removal rate |
土壤酸碱度的改变对土壤养分循环和作物生理过程均会造成显著影响,土壤酶活性与微生物活性受土壤酸碱度的诱导效应明显[17]。土壤微生物在适度的酸性介质环境下分泌酶的种类最广,产酶速率最高[18];施加有机酸会降低土壤pH,而土壤pH的降低在一定范围内能够提升土壤养分有效性、降低土壤毒性[19]。本研究中,草酸的施入促进了土壤过氧化氢酶和蔗糖酶活性的提升;在不同时间点施加不同浓度草酸虽略微降低了土壤pH值,但差异不显著,与以往研究结果存在一定差异。原因可能是本研究中外源草酸施入时间较早,土壤环境在草酸施入后与油葵收获前经历了较长时间的演变,加上土壤自身具有较强的酸碱度缓冲性能及油葵根系吸收作用[20],使得土壤pH值在收获期并未发生显著改变。而以往研究大多为短期培养试验或依据作物不同生育期施加有机酸,土壤缺乏充分的缓冲时间,从而导致pH值显著降低[21-23]。此外,草酸施入后土壤中过氧化氢酶和蔗糖酶活性均得到了显著提升,表明草酸明显提升了土壤环境的自净与解毒能力及碳循环转化效率,而酶活性诱导土壤养分水平及自净能力的提升也可能是增强土壤酸碱度缓冲性能、规避土壤酸化的重要机制。土壤pH值的降低虽在一定程度上可提升土壤中矿物元素的活化程度及植物根系吸收能力,但过度或长期的土壤酸化反而不利于植物正常生长甚至降低土壤缓冲性能。本研究在油葵苗期施加草酸并未引起收获期土壤pH发生大幅度改变,且在一定程度上提高了土壤过氧化氢酶和蔗糖酶活性,提升了土壤自净、解毒能力及碳循环转化效率,可见在苗期施加有机酸更有利于促进土壤环境的长期稳定发展。
Cd会抑制植物根系对土壤中矿质养分的吸收,扰乱植物及土壤微生物的生化代谢过程,从而抑制植物生长和降低植物生物量[24];而在Cd污染土壤中添加外源有机酸有助于缓解Cd对植物根系生长的抑制作用,提升植物生物量[25-26]。本研究中,草酸提升了油葵地上部及根干质量,且施用2、3 mmol·kg-1浓度草酸最有利于提升油葵地上部分及根干质量。研究表明,低分子量有机酸能够有效促进植物根系对土壤中养分的吸收,但当外源有机酸施入超过一定量时,植物生物量则会显著下降[27];此外,草酸浓度水平偏低时植物生物量较低且对土壤中Cd的活化作用较差[28],与本研究结果相似。原因可能是低浓度有机酸在土壤中极易被土壤有机质及团聚体吸附,而当有机酸输入浓度过高时,又会提高土壤中有机酸根阴离子浓度和质子强度,增加植物根系受酸性介质的胁迫程度,加上与土壤中Cd离子结合所引起的复合效应,不利于植物根系对养分的吸收,表现为生物量下降[29]。本研究中,在油葵出苗后30~40 d时施用草酸最有利于提高油葵地上部分及根干质量。苗期是植物各生育阶段中最脆弱的时期,也是决定植物在Cd胁迫条件下能否维持后续正常生长发育的重要时期;植物苗期的生长状况很大程度上决定其生物量,而在该时期植物对重金属的耐受性最差。早期施入草酸,油葵根系尚不发达,对外界环境较为敏感;而较晚施入草酸,油葵在Cd胁迫条件下经过一段时间的生长后,根系活力和生理功能已明显衰退,因此在出苗后30 d施加草酸最有利于促进油葵根系在Cd胁迫条件下对土壤中养分的吸收,提高其生物量。
有机酸作为植物根系分泌的天然重金属配位体,能够通过与土壤中重金属离子结合形成可溶性络合物,提高重金属的活性和可移动性,降低重金属的毒害效应。有机酸能够有效活化吸附在土壤颗粒表面的固相重金属,提高其液相离子浓度,使固相重金属转化为易被植物根系吸收的有效形态,从而提升重金属的转运效率和扩散能力[30]。本试验条件下,施入草酸提高了油葵修复Cd污染土壤能力,这与以往研究结果相似[31]。原因可能是草酸的施入活化了土壤中的固相Cd,提高了土壤中液相Cd离子浓度,促进了土壤中铁锰氧化物结合态和有机物结合态Cd向可交换态Cd转化,进而增强了油葵根系对土壤中Cd的去除率[32-33]。此外,有机酸对于生物细胞质膜上ATP酶的分泌和激活具有诱导效应,可改变Cd离子转运通道,进而促进油葵根系对Cd离子的吸收和富集[34],从而提高油葵根系对土壤Cd的去除率。外源有机酸对土壤中重金属的影响具有双重性,这主要取决于有机酸的浓度和种类、重金属形态、土壤质量及作用环境[35]。本试验条件下,油葵出苗后30 d时施入4 mmol·kg-1浓度草酸,土壤Cd的去除率最高。从草酸浓度角度分析,低浓度草酸(1、2、3 mmol·kg-1)易被土壤中团聚体及有机质等吸附,对土壤中Cd的活化效果较差;而高浓度草酸(5、6 mmol·kg-1)对油葵根系的刺激性较强,反而会抑制根系对Cd离子的吸收;因此适中浓度的草酸最有利于提升土壤中Cd的活性和生物有效性,促进油葵对Cd的吸收,进而提升土壤Cd去除率。从草酸施加时间角度分析,在出苗后适中时间(30 d)时施入草酸,油葵根系活力和吸收能力最强,对土壤中Cd离子及其络合物的富集能力最强,因此在该时间施入草酸,土壤Cd的去除率最高。另一方面,本试验采用的花盆内径和高度尺度较小,而油葵根系十分密集,根系在有限的空间内对土壤Cd的去除率较高;但野外试验尺度往往较大,且存在降雨、气候等不确定性因素,因此下一步应重点研究田间尺度下的Cd污染土壤修复效果。
4 结论(1)草酸提高了土壤过氧化氢酶和蔗糖酶活性,对土壤pH值无显著影响。
(2)草酸提高了油葵地上部及根干质量。施用2、3 mmol·kg-1浓度草酸,地上部和根干质量较高。出苗后30~40 d时施入草酸,地上部和根干质量较高。
(3)草酸降低了土壤可交换态、铁锰氧化物结合态及有机物结合态Cd含量。施用2、3 mmol·kg-1浓度草酸,土壤可交换态、铁锰氧化物结合态及有机物结合态Cd含量较低,在油葵出苗后30~40 d时施入草酸,土壤可交换态、铁锰氧化物结合态及有机物结合态Cd含量较低。
(4)施入草酸提高了土壤Cd去除效率;在出苗后30 d时施入4 mmol·kg-1浓度草酸,土壤Cd去除率最高,相比CK提升89.2%。
| [1] |
Li Z Y, Ma Z W, Vander T J, et al. A review of soil heavy metal pollution from mines in China:Pollution and health risk assessment[J]. Science of the Total Environment, 2014, 468/469: 843-853. DOI:10.1016/j.scitotenv.2013.08.090 |
| [2] |
韩洋, 李平, 齐学斌, 等. 再生水灌水水平对土壤重金属及致病菌分布的影响[J]. 中国环境科学, 2019, 39(2): 723-731. HAN Yang, LI Ping, QI Xue-bin, et al. Effects of different irrigation levels of reclaimed water on the distribution of soil heavy metals and typical pathogenic bacteria[J]. China Environmental Science, 2019, 39(2): 723-731. |
| [3] |
Sun Y B, Xu Y, Xu Y M, et al. Reliability and stability of immobilization remediation of Cd polluted soils using sepiolite under pot and field trials[J]. Environmental Pollution, 2016, 208(Part B): 739-746. |
| [4] |
Khalid S, Shahid M, Niazi N K, et al. A comparison of technologies for remediation of heavy metal contaminated soils[J]. Journal of Geochemical Exploration, 2016, 86(4): 521-534. |
| [5] |
Evangelou M W H, Papazoglou E G, Robinson B H, et al. Phytomanagement:Phytoremediation and the production of biomass for economic revenue on contaminated land[M]. Switzerland: Springer International Press, 2015: 115-132.
|
| [6] |
马双进, 南忠仁, 臧飞, 等. 油料作物对重金属污染农田土壤修复的研究进展[J]. 中国农学通报, 2019, 35(36): 80-84. MA Shuang-jin, NAN Zhong-ren, ZANG Fei, et al. Oil crops remediate heavy metal-contaminated farmland soil:A review[J]. Chinese Agricultural Science Bulletin, 2019, 35(36): 80-84. |
| [7] |
Antoniadis V, Levizou E, Shaheen S M, et al. Trace elements in the soil-plant interface:Phytoavailability, translocation and phytoremediation-A review[J]. Earth-Science Reviews, 2017, 171: 621-645. DOI:10.1016/j.earscirev.2017.06.005 |
| [8] |
刘孝利, 曾昭霞, 铁柏清, 等. 几种修复措施对Cd淋失及土壤剖面运移影响[J]. 环境科学, 2016, 37(2): 734-739. LIU Xiao-li, ZENG Zhao-xia, TIE Bai-qing, et al. Cd runoff load and soil profile movement after implementation of some typical contaminated agricultural soil remediation strategies[J]. Environmental Science, 2016, 37(2): 734-739. |
| [9] |
Wan X M, Lei M, Chen T B. Cost-benefit calculation of phytoremediation technology for heavy-metal-contaminated soil[J]. Science of the Total Environment, 2016, 563/564: 796-802. DOI:10.1016/j.scitotenv.2015.12.080 |
| [10] |
Schwab A P, Zhu D S, Banks M K. Influence of organic acids on the transport of heavy metals in soil[J]. Chemosphere, 2008, 72: 986-994. DOI:10.1016/j.chemosphere.2008.02.047 |
| [11] |
杨海琳, 廖柏寒. 低分子有机酸去除土壤中重金属条件的研究[J]. 农业环境科学学报, 2010, 29(12): 2330-2337. YANG Hai-lin, LIAO Bo-han. Extraction condition for heavy metals from contaminated soil by using low molecular organic acids[J]. Journal of Agro-Environment Science, 2010, 29(12): 2330-2337. |
| [12] |
陈卫平, 杨阳, 谢天, 等. 中国农田土壤重金属污染防治挑战与对策[J]. 土壤学报, 2018, 55(2): 261-272. CHEN Wei-ping, YANG Yang, XIE Tian, et al. Challenges and countermeasures for heavy metal pollution control in farmlands of China[J]. Acta Pedologica Sinica, 2018, 55(2): 261-272. |
| [13] |
卢豪良, 严重玲. 秋茄[Kandelia candel(L.)]根系分泌低分子量有机酸及其对重金属生物有效性的影响[J]. 生态学报, 2007, 27(10): 4173-4181. LU Hao-liang, YAN Chong-ling. Exudation of low-molecular-weight-organic acids by Kandelia candel (L.)druce roots and implication on heavy metal bioavailability in mangrove sediments[J]. Acta Ecologica Sinica, 2007, 27(10): 4173-4181. |
| [14] |
Xue S, Shi L, Wu C, et al. Cadmium, lead, and arsenic contamination in paddy soils of a mining area and their exposure effects on human HEPG2 and keratinocyte cell-lines[J]. Environmental Research, 2017, 156: 23-30. DOI:10.1016/j.envres.2017.03.014 |
| [15] |
Ash C, Tejnecky V, Boruvka L, et al. Different low-molecular-mass organic acids specifically control leaching of arsenic and lead from contaminated soil[J]. Journal of Contaminant Hydrology, 2016, 187: 18-30. DOI:10.1016/j.jconhyd.2016.01.009 |
| [16] |
陆红飞, 乔冬梅, 齐学斌, 等. 外源有机酸对土壤pH值、酶活性和Cd迁移转化的影响[J]. 农业环境科学学报, 2020, 39(3): 542-553. LU Hong-fei, QIAO Dong-mei, QI Xue-bin, et al. Effects of exogenous organic acids on soil pH, enzyme activity, and cadmium migration and transformation[J]. Journal of Agro-Environment Science, 2020, 39(3): 542-553. |
| [17] |
Ai C, Liang G, Sun J, et al. The alleviation of acid soil stress in rice by inorganic or organic ameliorants is associated with changes in soil enzyme activity and microbial community composition[J]. Biology and Fertility of Soils, 2015, 51(4): 465-477. DOI:10.1007/s00374-015-0994-3 |
| [18] |
Lladó S, Žifčáková L, Větrovský T, et al. Functional screening of abundant bacteria from acidic forest soil indicates the metabolic potential of Acidobacteria subdivision 1 for polysaccharide decomposition[J]. Biology and Fertility of Soils, 2016, 52(2): 251-260. DOI:10.1007/s00374-015-1072-6 |
| [19] |
Behera S K, Shukla A K. Spatial distribution of surface soil acidity, electrical conductivity, soil organic carbon content and exchangeable potassium, calcium and magnesium in some cropped acid soils of India[J]. Land Degradation & Development, 2015, 26(1): 71-79. |
| [20] |
毛伟, 李文西, 高晖, 等. 扬州市耕地土壤pH值30年演变及其驱动因子[J]. 植物营养与肥料学报, 2017, 23(4): 883-893. MAO Wei, LI Wen-xi, GAO Hui, et al. pH variation and the driving factors of farmlands in Yangzhou for 30 years[J]. Journal of Plant Nutrition and Fertilizers, 2017, 23(4): 883-893. |
| [21] |
赵鹏志, 陈祥伟, 杨小燕, 等. 低分子有机酸对东北黑土酶活性与养分关系的影响[J]. 南京林业大学学报(自然科学版), 2018, 42(1): 105-112. ZHAO Peng-zhi, CHEN Xiang-wei, YANG Xiao-yan, et al. Relationship between enzyme activities and nutrients of black soil subjected to low molecular organic acid[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2018, 42(1): 105-112. |
| [22] |
Shi Q, Zhu Z. Effects of exogenous salicylic acid on manganese toxicity, element contents and antioxidative system in cucumber[J]. Environmental and Experimental Botany, 2008, 63(1): 317-326. |
| [23] |
Farid M, Ali S, Rizwan M, et al. Phyto-management of chromium contaminated soils through sunflower under exogenously applied 5-aminolevulinic acid[J]. Ecotoxicology and Environmental Safety, 2018, 151: 255-265. DOI:10.1016/j.ecoenv.2018.01.017 |
| [24] |
薛博晗, 李娜, 宋桂龙, 等. 外源柠檬酸苹果酸和草酸对披碱草镉耐受及富集的影响[J]. 草业学报, 2018, 27(6): 128-136. XUE Bo-han, LI Na, SONG Gui-long, et al. Effects of exogenous citric, malic and oxalic acids on the tolerance and enrichment efficiency of Elymus dahuricus under cadmium-stress[J]. Acta Prataculturae Sinica, 2018, 27(6): 128-136. |
| [25] |
乔冬梅, 庞鸿宾, 齐学斌, 等. 黑麦草分泌有机酸的生物特性对铅污染修复的影响[J]. 农业工程学报, 2011, 27(12): 195-199. QIAO Dong-mei, PANG Hong-bin, QI Xue-bin, et al. Effect of biological nature of organic acid exudation from ryegrass on phytoremediation of lead pollution[J]. Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(12): 195-199. |
| [26] |
Hawrylak-nowak B, Dresler S, Matraszek R. Exogenous malic and acetic acids reduce cadmium phytotoxicity and enhance cadmium accumulation in roots of sunflower plants[J]. Plant Physiology and Biochemistry, 2015, 94: 225-234. DOI:10.1016/j.plaphy.2015.06.012 |
| [27] |
Chen Y T, Wang Y, Yeh K C. Role of root exudates in metal acquisition and tolerance[J]. Current Opinion in Plant Biology, 2017, 39: 66-72. DOI:10.1016/j.pbi.2017.06.004 |
| [28] |
Gao Y Z, He J Z, Ling W T, et al. Effect of organic acids of copper and cadmium desorption from contaminated soils[J]. Environment International, 2003, 29: 613-618. DOI:10.1016/S0160-4120(03)00048-5 |
| [29] |
Montiel-rozas M M, Madejón E, Madejón P. Effect of heavy metals and organic matter on root exudates(low molecular weight organic acids)of herbaceous species:An assessment in sand and soil conditions under different levels of contamination[J]. Environmental Pollution, 2016, 216: 273-281. DOI:10.1016/j.envpol.2016.05.080 |
| [30] |
Passatore L, Rossetti S, Juwarkar A A, et al. Phytoremediation and bioremediation of polychlorinated biphenyls(PCBs):State of knowledge and research perspectives[J]. Journal of Hazardous Materials, 2014, 278: 189-202. DOI:10.1016/j.jhazmat.2014.05.051 |
| [31] |
Schwab A P, ZHU D S, Banks M K. Influence of organic acids on the transport of heavy metals in soil[J]. Chemosphere, 2008, 72: 986-994. DOI:10.1016/j.chemosphere.2008.02.047 |
| [32] |
Xie X, Weiss D J, Weng B, et al. The short-term effect of cadmium on low molecular weight organic acid and amino acid exudation from mangrove(Kandelia obovata(S., L.) Yong) roots[J]. Environmental Science and Pollution Research, 2013, 20(2): 997-1008. DOI:10.1007/s11356-012-1031-9 |
| [33] |
Oliveri G, Hea E. Phytoremediation of contaminated soils by heavy metals and PAHs:A brief review[J]. Environmental Technology and Innovation, 2017, 8: 309-326. DOI:10.1016/j.eti.2017.08.002 |
| [34] |
陈立, 王丹, 龙婵, 等. 3种螯合剂对向日葵修复镉污染土壤的影响[J]. 环境科学与技术, 2017, 40(11): 22-29. CHEN Li, WANG Dan, LONG Chan, et al. Effects of three cheating agents on rehabilitation of Cd-contaminated soil with sunflower[J]. Environmental Science and Technology, 2017, 40(11): 22-29. |
| [35] |
Fernández M A, Soulages O E, Acebal S G, et al. Sorption of Zn(Ⅱ) and Cu(Ⅱ) by four argentinean soils as affected by pH, oxides, organic matter and clay content[J]. Environmental Earth Sciences, 2015, 74(5): 4201-4214. DOI:10.1007/s12665-015-4518-0 |
 2020, Vol. 39
2020, Vol. 39