2. 内蒙古大学生态与环境学院, 呼和浩特 010021
2. School of Ecology and Environment, Inner Mongolia University, Hohhot 010021, China
铁循环和硫循环是地球化学循环的重要组成部分,并且铁与硫的生物地球化学行为紧密耦合。铁和硫均具有较高的氧化还原敏感性,环境中氧化还原条件的改变对铁和硫的生物地球化学行为具有重要影响。研究表明,微生物在铁硫还原过程中起关键控制作用[1-7]。有两大类微生物参与的代谢过程是推动环境中铁循环和硫循环的重要环节,即异化铁还原过程和硫酸盐还原过程,而硫酸盐还原菌和异化铁还原菌则是这两个过程的执行者[8-10]。
异化铁还原和硫酸盐还原在一定程度上共存且存在竞争,但并不完全互斥[11-12]。活性铁是硫循环的重要参与元素,硫化物是氧化铁的重要还原剂及氧化铁还原溶解的关键因素[13]。还原环境中,硫酸盐还原产生的硫化物可与活性铁反应生成过渡产物硫化亚铁,从而限制环境中铁的活性[14-17]。当硫酸盐还原受到抑制时,无机硫化物含量降低,并成为黄铁矿形成的限制因素[18-19]。厌氧条件下,环境中异化铁还原过程和硫酸盐还原过程对碳、氮、磷等生源要素的循环和活性以及重金属等污染物的形态和生物有效性有重要影响[20-27]。
与南方湿润地区相比,北方冰封期普遍长达4~6个月,冰封期可能会切断能量和物质交换,打破体系中原有的动态平衡。寒旱区湖泊溶解氧较低和复氧差等特殊的水文环境特征对铁硫的生物地球化学行为有重要影响。因此冰封期微生物介导的异化铁还原和硫酸盐还原过程对铁硫的环境地球化学行为研究具有重要意义。目前关于微生物对铁硫环境地球化学行为的影响研究虽被广泛关注,但关于冰封期微生物介导的异化还原作用对铁硫生物地球化学行为的影响研究尚有不足。
本文采用室内模拟研究,分别开展了冰封期下异化铁还原菌(DFeRB)和硫酸盐还原菌(SRB)介导的还原过程对铁硫生物地球化学行为的影响机制研究,探讨冰封期微生物作用下铁硫的耦合关系,评估冰封期微生物对铁硫生物地球化学循环的贡献,以期为冰封期下铁硫循环研究提供基础数据和科学依据,丰富不同环境特征下铁硫循环的环境地球化学理论。
1 材料与方法 1.1 试验材料本研究选用的DFeRB和SRB分别为环境中广泛存在且具有代表性的Shewanella putrefaciens和Desul fovibrio desulfuricans subsp. desulfuricans。
试验体系中的SO42-和Fe3+分别为Na2SO4和FeCl3溶液,Na2SO4和FeCl3均为优级纯,营养盐溶液NH4Cl、KCl、CaCl2·2H2O、NaCl、MgCl2·7H2O和NaHCO3为分析纯,乙酸钠为分析纯,试验用水均为超纯水。
试验所用培养基、超纯水、烧杯、枪头等耐高温用具在试验前均于高压灭菌锅中进行灭菌,培养基121 ℃,30 min,其余为121 ℃、20 min。试验所用注射器均为医用无菌一次性使用注射器(带针头),其余不耐高温用具试验前均采用紫外线灭菌法进行灭菌,灭菌24 h以上,以保证灭菌效果。
1.2 试验菌株和培养基 1.2.1 试验菌株Shewanella putrefaciens 和Desulfovibrio desulfuri cans subsp. desulfuricans均购买自北纳生物技术研究院。Shewanella putrefaciens属γ-变形杆菌纲希瓦氏菌属,兼性厌氧菌,易分离培养,生长快,分布广,最佳生长温度30 ℃(中温菌),适宜pH值为中性。Desulfo vibrio desulfuricans subsp. desulfuricans属脱硫弧菌属,严格厌氧菌,是阴性弧性菌,适合生长温度为30~ 37 ℃(中温菌),生长pH范围一般为5~9,适宜pH值为中性。
1.2.2 培养基DFeRB和SRB的菌株为冻干粉,试验前需进行活化富集并制备菌悬液。DFeRB的培养温度为30 ℃,SRB的培养温度为37 ℃。培养一段时间后,观察菌种管内颜色变化,DFeRB培养液由红棕色逐渐变为绿色或白色,表明该菌株具有还原铁的能力。SRB培养至管壁变黑,形成黑色菌落,并伴有臭鸡蛋气味。
(1)DFeRB所用培养基
柠檬酸铁培养基:NaCl 2 g·L-1、CaCl2 1 g·L-1、MgCl2 2 g·L-1、NH4Cl 3 g·L-1、KH2PO4 2 g·L-1、柠檬酸铁5 g·L-1,调节pH为7.2。
LB基础固体培养基:牛肉膏3 g·L-1、蛋白胨10 g· L-1、NaCl 5 g·L-1、琼脂15 g,调节pH为7。
LB基础液体培养基:牛肉膏3 g·L-1、蛋白胨10 g· L-1、NaCl 5 g·L-1,调节pH为7。
(2)SRB所用培养基
哥伦比亚血平板:购买即用型平板,购自环凯微生物有限公司。
富集培养基:NaCl 2 g·L-1、Fe(NH4)2(SO4)2·6H2O 0.5 g、NH4Cl 1 g·L-1、NH4Cl 1 g·L-1、MgSO4·7H2O 2 g· L-1、Na2SO4 0.5 g·L-1、K2HPO4 0.5 g·L-1、乳酸钠(70%)5 mL、酵母膏1 g·L-1,调节pH为7.5。
1.3 试验设计模拟冰封期于4 ℃条件下开展为期30 d的室内模拟试验,试验装置采用100 mL螺口试剂瓶,设置无菌组为试验对照组,分别构建Fe3++ SRB、Fe3++ DFeRB、SO42-+SRB、SO42-+DFeRB、Fe3++SO42-、Fe3++SO42-+ SRB、Fe3++SO42-+DFeRB试验体系。试验用SRB为严格厌氧菌,培养基溶液用无氧水配置,该菌活化及富集过程中均通入氮气以确保厌氧。所有试剂瓶在加入所需溶液后立即密封,所有操作在厌氧手套箱中进行。在培养的第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、17、19、21、23、25、27、30 d时取样,即时测定溶液中生物活性、Fe2+浓度和S2-浓度。
各试验体系中Na2SO4和FeCl3的初始浓度均为10 μmol·L-1。有菌组中,菌液接种量为4%(V/V)(即100 mL体系中添加4 mL菌悬液),添加乙酸钠溶液为碳源,同时添加NH4Cl 0.25 g·L-1、NaCl 1 g·L-1、NaHCO3 2 g · L-1、KCl 0.5 g · L-1、MgCl2 · 7H2O 0.2 g · L-1、CaCl2 · 2H2O 0.14 g·L-1为基础营养盐。
1.4 分析方法(1)Fe2+浓度测定使用邻菲罗啉比色法:样品过0.22 μm滤膜后,取滤液5 mL于比色管中(10 mL),加邻菲罗啉溶液(0.5%,1 mL)和1 mL缓冲溶液,定容摇匀后,用紫外分光光度计于510 nm处测定Fe2+浓度。
(2)S2-浓度测定使用亚甲基蓝分光光度法:样品过0.22 μm滤膜后,取滤液10 mL于比色管中(25 mL),加N,N-二甲基对苯二胺溶液2 mL(2 g·L-1)和硫酸铁铵溶液1 mL(100 g·L-1),定容摇匀后,用紫外分光光度计于665 nm处测定S2-浓度。
(3)生物活性:取样品(1 mL)于磷酸钠缓冲溶液(pH=7.6,25 mL,60 mmol·L-1)中,振荡2 h后,加入荧光素双乙酸盐(FDA)(0.1 mL,2 mg·mL-1),继续振荡2 h后于490 nm下比色,以吸光度值表征生物活性,同时取去离子水同样操作为空白对照。
1.5 数据分析本文中试验数据用Excel 2016、OriginPro 2017进行处理和作图,采用IBM SPSS 25.0进行统计分析。
2 结果与分析 2.1 DFeRB和SRB作用下的铁硫还原Fe3+与DFeRB和SO42-与SRB分别单独存在时,Fe2+的浓度与DFeRB的生物活性及S2-的浓度与SRB的生物活性均存在显著的正相关关系(P < 0.01,P < 0.05)(图 1),表明即使在低温条件下,Fe3+和SO42-的还原仍与微生物的生长耦合在一起。由图 2可知,在Fe3++DFeRB的试验体系中,Fe2+的浓度随培养时间的增加而呈现先增加后逐渐趋于平稳的趋势;在SO42-+ SRB的试验体系中,S2-浓度随培养时间呈波动式变化,并且培养前期的S2-浓度明显高于后期,这可能与SRB的生物活性有关。由此可见,低温下DFeRB和SRB仍具有一定的生物活性,DFeRB对Fe3+的异化还原和SRB对硫酸盐还原仍具有明显的促进作用。
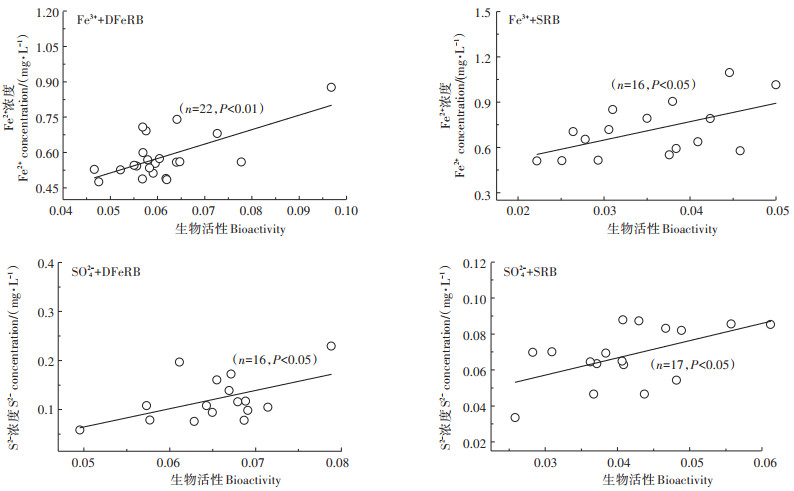
|
图 1 Fe2+和S2-浓度与生物活性相关性 Figure 1 The correlation analysis between Fe2+/S2- concentration and bioactivity |

|
图 2 微生物作用下的Fe3+异化还原和硫酸盐还原以及两者间的相互影响 Figure 2 Fe3+ reduction and sulfate reduction mediated by microbes and interaction between them |
在SO42-+DFeRB和Fe3++SRB的试验体系中,S2-浓度以及Fe2+浓度均随培养时间的增加呈波动式增长(图 2),并且S2-浓度和DFeRB的生物活性在SO42-+ DFeRB体系中呈显著正相关关系(P < 0.05),Fe2+浓度与SRB的生物活性在Fe3++SRB体系中呈显著正相关关系(P < 0.05),表明低温下SO42-和Fe3+也可以分别作为DFeRB和SRB的直接电子受体,无需化学中间产物的介导。
2.2 SO42-/Fe3+的添加对微生物介导的异化铁还原和硫酸盐还原过程的影响研究结果表明,低温条件下,SO42-的存在对Fe3+的异化还原过程有较大影响(图 2)。在培养周期内,Fe3++SO42-+DFeRB体系中的Fe2+浓度普遍略高于Fe3++ DFeRB体系中Fe2+浓度,并且Fe3++SO42-+DFeRB体系中Fe2+的最大累积量明显高于Fe3++DFeRB体系(图 2),表明一定浓度范围内,SO42-的存在可以促进异化铁还原过程中Fe2+的累积。在Fe3++SO42-+DFeRB与Fe3++DFeRB体系中Fe2+的整体浓度基本在1:3~2:3(图 3),这进一步表明Fe3+与SO42-共存时,更有利于Fe3+的异化还原。在Fe3++SO42-+DFeRB体系中Fe2+浓度的变化趋势与S2-浓度的变化趋势大致相反(图 2),表明DFeRB作用下Fe3+的异化还原受到高浓度S2-的抑制,因而在部分培养阶段中,Fe3++SO42-+DFeRB中Fe2+浓度与Fe3++DFeRB体系中Fe2+浓度差异不大。对比Fe3++SO42-+SRB与Fe3++SRB体系中Fe2+浓度(图 2),虽然个别培养时期中Fe3++SO42-+SRB中的Fe2+浓度高于Fe3++SRB体系,但是在培养周期内整体差异较小,并且Fe3++SO42-+SRB体系与Fe3++SRB中的Fe2+浓度基本集中于三元图的中心区域(图 3)。
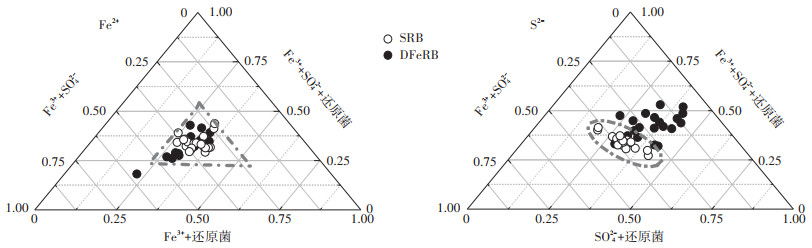
|
图 3 Fe2+及S2-浓度三元图 Figure 3 Ternary diagram of Fe2+ and S2- concentration |
在SO42-+SRB和Fe3++SO42-+SRB体系中,S2-的最大浓度分别出现在培养的第7 d和第8 d(图 2),在培养周期的初始阶段还原产物S2-的生成浓度并未达到最大值。在培养周期内,Fe3++SO42-+DFeRB中的S2-浓度普遍高于SO42-+DFeRB体系,SRB作用下呈现相同规律且更为明显,并且在DFeRB和SRB作用下,有无Fe3+添加的组别中S2-浓度均呈现明显的正相关关系(P < 0.01)。由此可见低温条件下Fe3+的添加明显影响DFeRB和SRB作用下SO42-的还原过程。Fe3++SO42-+ DFeRB/SRB与SO42-+SRB及Fe3++SO42-与SO42-+DFeRB/ SRB体系中的S2-浓度的占比分布情况可以进一步表明Fe3+的添加明显影响还原菌作用下SO42-的还原过程(图 3),并且Fe3++SO42-同时存在时对SO42-还原的促进作用更为明显,整体还原产物S2-浓度是仅外加SRB体系中S2-浓度的2~3倍。此外,Fe3++SO42-+SRB与SO42-+ SRB体系中的S2-浓度占比明显高于Fe3++SO42-+DFeRB与SO42-+DFeRB体系中的浓度比,这可能是由于铁硫共存时DFeRB对铁的影响程度强于SRB。Fe3++SO42-+ DFeRB/SRB体系中的S2-浓度明显高于SO42-+DFeRB/ SRB体系(图 2),表明无论是DFeRB还是SRB,Fe3+和还原菌同时存在时对SO42-还原的促进作用更强。
2.3 铁硫共存体系中异化铁还原和硫酸盐还原的耦合关系研究结果表明,低温条件下,铁硫共存时,还原产物Fe2+和S2-的生成仍然与DFeRB和SRB的生物活性紧密耦合在一起,DFeRB和SRB对Fe3+和SO42-的还原产生重要影响(图 4和图 5)。在只有Fe3+和SO42-存在时,铁硫得电子摩尔浓度矩阵分布较为简单,且在阴影区范围内呈现明显负相关关系(图 6),表明在化学介导还原过程中SO42-的还原可能存在被Fe3+抑制的风险[28]。而微生物存在时铁硫得电子摩尔浓度矩阵分布情况则相对复杂(图 6),这也进一步表明当铁硫共存时,DFeRB和SRB的存在使得体系中铁硫自身的电子传递受到影响,Fe3+和SO42-的还原过程更为复杂[29-30]。

|
图 4 铁硫共存时Fe2+和S2-浓度与生物活性相关性 Figure 4 The correlation analysis between Fe2+/S2- concentration and bioactivity in iron and sulfate coexist system |
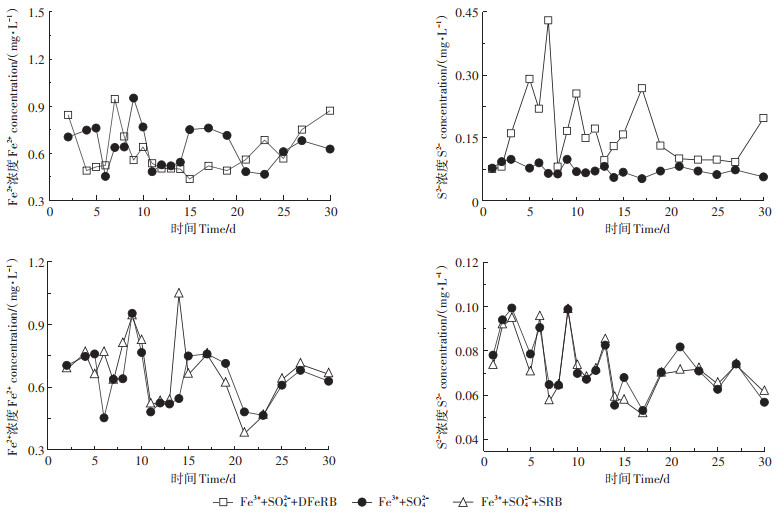
|
图 5 铁硫共存体系中微生物的还原作用 Figure 5 The reduction mediated by microbes in iron and sulfate coexist system |
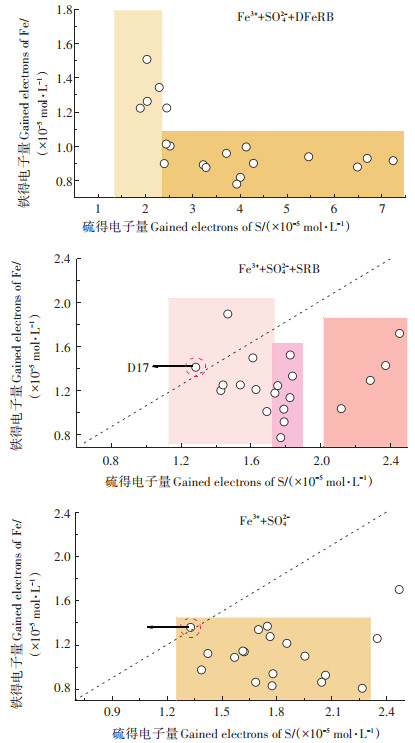
|
图 6 铁硫共存体系中铁硫得电子量相关性 Figure 6 The correlation analysis between gained electrons of Fe and S in iron and sulfate coexist system |
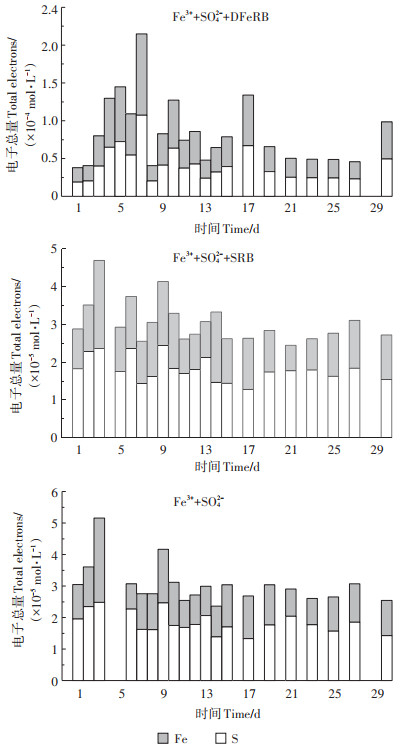
对比Fe3++SO42-+DFeRB与Fe3++SO42-体系(图 5),Fe2+浓度变化规律在培养的不同时段明显不同,这可能与微生物作用下铁硫竞争电子有关,表明即使低温条件下DFeRB对于存在竞争电子关系的Fe-S共存体系中Fe3+和SO42-的还原仍具有不可忽视的影响。具体而言,培养前期个别时段内DFeRB作用下的Fe2+浓度高于无菌组,表明DFeRB作用下的Fe3+还原快于无菌组中Fe3+和SO42-的化学介导还原;培养中期基本呈现为无菌组高于DFeRB组,是由于Fe3+在DFeRB作用下虽可被迅速还原,但随后SO42-还原产生的S2-可与Fe2+反应消耗部分Fe2+。随培养时间的增加,在DFeRB组铁硫争夺电子的过程中,硫的电子总量明显高于铁(图 7),表明在后期有明显的硫酸盐还原反应发生,SO42-还原产生的HS-可间接还原Fe3+,并且无菌组中Fe3+和SO42-及其还原产物不断发生化学吸附-解吸反应,因而在培养后期出现个别时段内DFeRB作用下的Fe2+浓度高于无菌组。就S2-浓度而言,铁硫共存体系中,虽然无菌组中硫的电子量明显高于铁,硫酸盐还原占主导,但DFeRB作用下的S2-浓度明显高于无菌组(图 5和图 7),表明DFeRB的还原作用明显强于化学介导还原。Fe3+和SO42-在无菌组中通过化学介导还原产生的Fe2+和S2-不断发生化学反应产生FeS等沉淀,因而S2-维持在较低浓度水平;而在DFeRB存在时,虽然还原产物Fe2+和S2-也会发生反应,但在DFeRB的异化还原作用下,Fe3+和SO42-不断被还原,还原产物不断生成。
|
图 7 铁硫共存体系中铁和硫的得电子量 Figure 7 The gained electrons of Fe and S in iron and sulfate coexist system |
铁硫共存体系中,SRB作用下硫的得电子总量明显高于铁(图 7),表明Fe3+和SO42-同时存在时,SRB优先还原SO42-。Fe3++SO42-+SRB与Fe3++SO42-体系中,Fe2+浓度在两组间总体差异不大,但SRB作用下的Fe2+最大浓度明显较无菌组高(图 5)。S2-浓度在两组间变化趋势虽基本一致(图 5),但铁硫得电子摩尔浓度矩阵分布情况明显不同,且SRB作用下的电子分布情况更为复杂(图 6)。这在一定程度上说明铁硫共存体系中SRB存在下的铁硫还原的反应过程较为复杂。铁硫的得电子量在S2-浓度小于0.07 mg·L-1时呈明显负相关(图 6),表明在一定浓度范围内,Fe3+的存在会抑制SO42-的还原[28],并且S2-存在下铁会以FeS的形式析出,S2-浓度会因铁的存在而下降。在S2-浓度在0.07~0.075 mg·L-1范围内,Fe2+浓度短时间内得到累积,可能是由于在SRB作用下产生的还原产物一定程度上累积,以Fe3+形式存在的铁易被还原[31]。S2-浓度超过0.075 mg·L-1后,铁硫得电子量呈正相关,表明此时溶解性铁的浓度可能超出了S2-的保护机制[28],且当S2-浓度较高时可能有利于化学还原的发生。
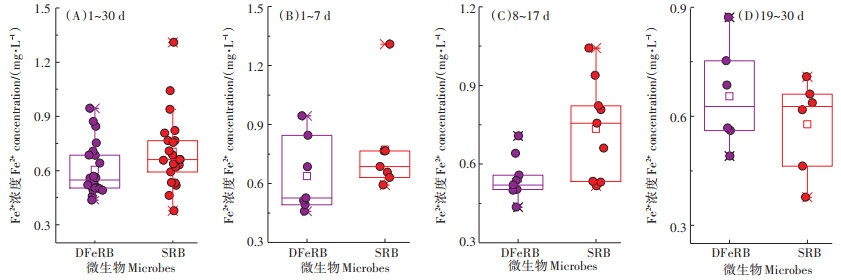
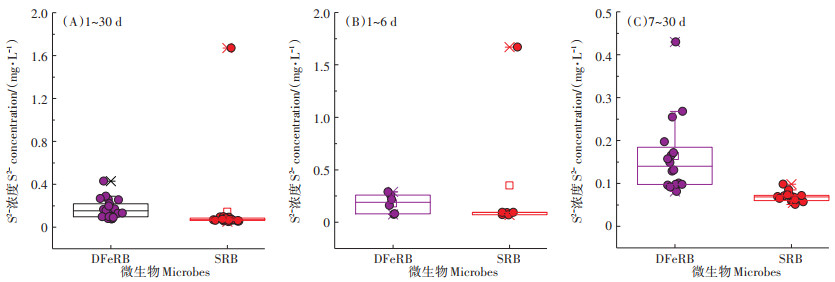
Fe3++SO42-+SRB与Fe3++SO42-+DFeRB中的Fe2+浓度见图 8,整体而言,SRB介导还原生成的Fe2+浓度虽高于DFeRB,但DFeRB作用下铁的得电子总量高于SRB,表明DFeRB更倾向于与Fe3+交换电子,更有利于Fe3+的还原。分阶段来看,反应前期(1~7 d),尤其是1~2 d时,以及反应后期(19~30 d)DFeRB介导还原生成的Fe2+浓度显著高于SRB(P < 0.05),而反应中期(8~17 d)SRB介导还原生成的Fe2+浓度却显著高于DFeRB(P < 0.05)。就S2-浓度而言(图 9),反应前期(1~6 d)SRB介导生成的S2-明显高于DFeRB,而中后期(7~30 d)DFeRB介导生成的S2-却高于SRB(P < 0.01)。这再次证实铁硫共存时,SRB更易与SO42-交换电子,促进SO42-的还原,且SO42-的还原作用优于Fe3+的还原。但中后期SRB作用下的S2-生成浓度低于DFeRB组,可能与铁硫的成矿作用有关,此外有研究表明细胞产量和最大生长率随S2-浓度的升高而降低,因而后期SRB的还原能力也较前期弱。
|
图 8 铁硫共存体系中DFeRB和SRB作用下不同阶段Fe2+浓度 Figure 8 Fe2+ concentration mediated by DFeRB and SRB in iron and sulfate coexist system |
|
图 9 铁硫共存体系中DFeRB和SRB作用下不同阶段S2-浓度 Figure 9 S2- concentration mediated by DFeRB and SRB in iron and sulfate coexist system |
在Fe3+与DFeRB单独存在时,培养前期还原产生的Fe2+浓度较中期高,这是由于在培养初期DFeRB适应试验培养环境后,利用体系中的乙酸钠为电子供体,快速还原Fe3+,Fe2+浓度明显累积,随培养时间的增加,受电子供体和电子受体含量的限制,Fe3+的还原受到抑制,Fe2+的生成速率逐渐减慢,累积量逐渐趋于平稳。本研究结果表明,DFeRB也可直接还原SO42-,并且一定浓度范围内,SO42-的添加可以促进异化铁还原过程中Fe2+的累积,且Fe3+与SO42-共存时,更有利于Fe3+的异化还原。这可能是由于在Fe3+与SO42-同时存在时,Fe3+与SO42-会争夺电子,因而有部分Fe2+可能来源于SO42-还原产生的HS-介导的间接还原产物。同时也有研究发现相当一部分的溶解性Fe2+是HS-介导的间接还原的产物[32],这与本研究的结果一致。但是,DFeRB作用下Fe3+的异化还原也会受到高浓度S2-的抑制,因而本研究部分培养时期内Fe3+、SO42-及DFeRB共存时的Fe2+浓度与Fe3+及DFeRB单独存在时的Fe2+浓度差异不大。Fe3+、SO42-及SRB共存时与不添加SO42-时的Fe2+浓度在培养周期内整体差异较小,这可能是由于尽管低温条件下SRB也可直接还原Fe3+,但在SO42-存在的情况下,SRB优先还原SO42-,因而Fe3+与SO42-共存时,SRB并没有明显促进体系中Fe2+的累积。
本研究中SO42-与SRB单独存在时以及Fe3+、SO42-与SRB共存时的还原产物S2-在培养周期的初始阶段并未达到最大值,可能有两方面原因,一是SRB是严格厌氧菌,SRB由富营养且严格厌氧的培养基转入试验培养体系中会经历短暂的适应期;二是由于SRB还原的最主要生化反应是异化还原,在SRB传递电子给SO42-前,SO42-先在细胞外大量累积,之后才进入细胞膜内[33]。本研究结果表明低温条件下Fe3+的添加明显影响DFeRB和SRB作用下SO42-的还原过程。这可能是由于铁是还原菌细胞中参与SO42-还原的多种功能酶的辅基成分,因而在有低浓度Fe2+存在时可以一定程度上刺激还原菌的活性[34]。但是铁硫共存时,Fe3+和SO42-相互争夺电子,Fe3+可能会对SO42-还原过程产生短暂的负面影响[28],因而本研究中Fe3+、SO42-与DFeRB/SRB共存时的S2-浓度均有个别培养时期内低于未添加Fe3+的对照组。
3.2 铁硫共存体系中异化铁还原和硫酸盐还原过程研究铁硫共存时,两者之间会相互干扰,Fe3+和SO42-不只是电子数量的竞争者,更是微生物细胞内部电子传递途径的竞争者[34]。因而铁硫共存时,DFeRB和SRB的存在使得体系中铁硫自身的电子传递受到影响,Fe3+和SO42-的还原过程更为复杂。本研究结果证明即使低温条件下DFeRB对于存在竞争电子关系的Fe-S共存体系中Fe3+和SO42-的还原仍具有不可忽视的影响。铁硫共存时,DFeRB驱动的Fe3+还原明显快于无菌条件下Fe3+和SO42-的化学介导还原,但同时体系中Fe2+浓度会受到S2-浓度的影响,虽然Fe3+在DFeRB作用下可被迅速还原,但随后SO42-还原产生的S2-可与Fe2+反应消耗部分Fe2+,使得Fe2+浓度降低,但后期由于SO42-的存在有明显的硫酸盐还原反应发生,SO42-还原产生的HS-也可间接还原Fe3+,还原产物Fe2+增多。铁硫共存时,DFeRB作用下的S2-浓度高于无菌组,这也证明DFeRB驱动的还原作用明显强于化学介导还原。有研究表明[35]微生物驱动的铁的还原溶解会降低甚至失去其自身的吸附能力,还原产生的Fe2+可与释放的其他元素比如磷、重金属等竞争环境中的其他吸附位点。这也表明即使低温条件下,DFeRB和SRB驱动的异化还原过程也会对碳、氮、磷等生源要素的循环和活性以及重金属等污染物的形态和生物有效性等产生重要影响。
在Fe3+、SO42-及DFeRB共存时,Fe2+浓度日渐累积而S2-浓度下降的阶段出现可能是因为在DFeRB作用下发生异化铁还原,同时吸附在Fe3+上的复合硫化物与Fe3+之间也可发生电子转移从而导致Fe3+还原[36],这也表明在DFeRB作用下的铁硫共存体系中Fe3+还原的机制不只一种,而是包括以H+作为电子供体的直接微生物还原、通过S2-和HS-作用于Fe3+的间接还原以及以乳酸钠为碳源的直接微生物还原等多种发生机制。同时也有研究表明[37],异化铁还原过程包含多种还原机制,例如通过细胞外膜蛋白与Fe3+接触直接传递电子的直接接触机制、通过产生细胞附属物与Fe3+接触传递电子的导电附属物机制、通过小分子络合物与Fe3+作用的螯合机制以及电子穿梭体机制等。体系中出现Fe2+和S2-浓度同时下降阶段,是因为在DFeRB作用下的铁硫共存体系中,DFeRB会迅速作用于Fe3+,之后SO42-获得电子,S2-得到累积并达到较高浓度,而游离的Fe2+可与S2-生成FeS沉淀。Fe2+浓度降低而S2-相对稳定的阶段可能是由于FeS到FeS2的转化[38],并且FeS2的生成可以减少HS对微生物细胞的毒性,因而此时Fe2+浓度的下降对SO42-的还原起到一定的协同作用[33]。
本研究结果证明Fe3+、SO42-及SRB共存时,SRB优先还原SO42-。SRB作用下的Fe2+浓度较Fe3+与SO42-单独存在时的总体差异不大,但SRB作用下的Fe2+最大浓度明显较高,这是因为Fe3+在SRB还原SO42-后可竞争得到部分电子进而被SRB直接还原,并且SO42-还原产生的HS-也可间接介导Fe2+的生成,但是SRB作用下大量生成的S2-与Fe2+反应[39],一定程度上会限制Fe2+的含量。
在Fe3+、SO42-及DFeRB或SRB共存时,SRB更易与SO42-交换电子,促进SO42-的还原,且SO42-的还原作用优于Fe3+的还原。DFeRB更倾向于与Fe3+交换电子,更有利于Fe3+的还原。培养中后期SRB作用下的S2-生成浓度低于DFeRB组,可能与铁硫的成矿作用有关,此外有研究表明细胞产量和最大生长率随S2-浓度的升高而降低,因而后期SRB的还原能力也较前期弱。反应前期(1~7 d)及后期(19~30 d)DFeRB介导还原生成的Fe2+浓度显著高于SRB,而反应中期(8~17 d)SRB介导还原生成的Fe2+浓度却显著高于DFeRB。这是由于DFeRB可更快地与Fe3+交换电子,诱导Fe3+的还原,到反应中期,除微生物直接还原Fe3+外,虽然DFeRB作用下铁硫共存体系中也可生成SO42-还原产物,但SRB作用下S2-和HS-的累积量更高,间接介导生成的Fe2+更多,因而SRB介导还原生成的Fe2+浓度更高,但到后期SRB组中S2-与Fe2+反应,一定程度上又限制了Fe2+的生成。
4 结论(1)本研究结果表明,即使在冰封期,DFeRB和SRB仍具有一定的生物活性,对铁的异化还原以及硫酸盐还原仍有明显的促进作用,并且SO42-和Fe3+可以分别作为DFeRB和SRB的直接电子受体,无需化学中间产物的介导。
(2)冰封期,SO42-的存在对铁的异化还原过程有较大影响,可以一定程度上促进铁异化还原过程中Fe2+的累积,并且在DFeRB介导的还原过程中,Fe3+与SO42-共存时,更有利于Fe3+的异化还原。Fe3+的存在对DFeRB和SRB介导的SO42-的还原过程有显著影响。
(3)冰封期,铁硫共存时,DFeRB和SRB对Fe3+和SO42-的还原具有重要影响,并且DFeRB和SRB的存在使得体系中铁硫自身的电子传递受到影响,Fe3+和SO42-的还原过程更为复杂。铁硫共存时DFeRB对铁的影响程度强于SRB。无论是DFeRB还是SRB,Fe3+和还原菌同时存在时对SO42-还原的促进作用更强。不同微生物的还原倾向性和生物可利用性存在明显区别,DFeRB更倾向于与Fe3+交换电子,更有利于Fe3+的还原;SRB更易与SO42-交换电子,更能促进SO42-的还原,但是铁硫共存时DFeRB中铁硫得电子量更大。DFeRB和SRB介导下的铁还原和硫还原存在明显的耦合关系,且存在显著的阶段性差异,并且一定程度上SO42-的还原优于Fe3+的还原。
| [1] |
Lovley D R, Coates J D. Novel forms of anaerobic respiration of environmental relevance[J]. Current Opinion in Microbiology, 2000, 3(3): 252-256. DOI:10.1016/S1369-5274(00)00085-0 |
| [2] |
Mejia J, Roden E E, Ginder-Vogel M. Influence of oxygen and nitrate on Fe(hydr)oxide mineral transformation and soil microbial communities during redox cycling[J]. Environmental Science & Technology, 2016, 50(7): 3580-3588. |
| [3] |
Rabus R, Venceslau S S, Woehlbrand L, et al. A post-genomic view of the ecophysiology, catabolism and biotechnological relevance of sulphate-reducing prokaryotes[J]. Advances in Microbial Physiology, 2015, 55-321. |
| [4] |
Raven M R, Fike D A, Gomes M L, et al. Organic carbon burial during OAE2 driven by changes in the locus of organic matter sulfurization[J]. Nature Communications, 2018, 9(1): 3409. DOI:10.1038/s41467-018-05943-6 |
| [5] |
Raven M R, Sessions A L, Fischer W W, et al. Sedimentary pyrite δ34S differs from porewater sulfide in Santa Barbara Basin:Proposed role of organic sulfur[J]. Geochimica et Cosmochimica Acta, 2016, 186: 120-134. DOI:10.1016/j.gca.2016.04.037 |
| [6] |
Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron:Anaerobic microbial iron oxidation and reduction[J]. Nature Reviews Microbiology, 2006, 4(10): 752. DOI:10.1038/nrmicro1490 |
| [7] |
Lovley D R, Phillips E J. Availability of ferric iron for microbial reduction in bottom sediments of the freshwater tidal Potomac River[J]. Appl Environ Microbiol, 1986, 52(4): 751-757. DOI:10.1128/AEM.52.4.751-757.1986 |
| [8] |
Colombo C, Palumbo G, He J Z, et al. Review on iron availability in soil:Interaction of Fe minerals, plants, and microbes[J]. Journal of Soils and Sediments, 2014, 14(3): 538-548. DOI:10.1007/s11368-013-0814-z |
| [9] |
Foti M, Sorokin D Y, Lomans B, et al. Diversity, activity, and abundance of sulfate-reducing bacteria in saline and hypersaline soda lakes[J]. Appl Environ Microbiol, 2007, 73(7): 2093-2100. DOI:10.1128/AEM.02622-06 |
| [10] |
Saalfield S L, Bostick B C. Changes in iron, sulfur, and arsenic speciation associated with bacterial sulfate reduction in ferrihydrite-rich systems[J]. Environmental Science & Technology, 2009, 43(23): 8787-8793. |
| [11] |
朱茂旭, 史晓宁, 杨桂朋, 等. 海洋沉积物中有机质早期成岩矿化路径及其相对贡献[J]. 地球科学进展, 2011, 26(4): 355-364. ZHU Mao-xu, SHI Xiao-ning, YANG Gui-peng, et al. Relative contributions of various early diagenetic pathways to mineralization of organic matter in marine sediments[J]. Advances in Earth Science, 2011, 26(4): 355-364. |
| [12] |
Kwon M J, O'loughlin E J, Boyanov M I, et al. Impact of organic carbon electron donors on microbial community development under ironand sulfate-reducing conditions[J]. PLoS One, 2016, 11(1). |
| [13] |
Klok J B, De Graaff M, Van Den Bosch P L, et al. A physiologically based kinetic model for bacterial sulfide oxidation[J]. Water Research, 2013, 47(2): 483-492. |
| [14] |
Barabanov A A, Bukatov G D, Zakharov V A, et al. Kinetic study of ethylene polymerization over supported bis(imino)pyridine iron(Ⅱ) catalysts[J]. Macromolecular Chemistry and Physics, 2006, 207(15): 1368-1375. DOI:10.1002/macp.200600122 |
| [15] |
He J, Lü C, Fan Q, et al. Distribution of AVS-SEM, transformation mechanism and risk assessment of heavy metals in the Nanhai Lake in China[J]. Environmental Earth Sciences, 2011, 64(8): 2025-2037. DOI:10.1007/s12665-011-1022-z |
| [16] |
Lucotte M, Mucci A, Hillaire-Marcel C, et al. Early diagenetic processes in deep Labrador Sea sediments:Reactive and nonreactive iron and phosphorus[J]. Canadian Journal of Earth Sciences, 1994, 31(1): 14-27. DOI:10.1139/e94-003 |
| [17] |
Simpson S L, Ward D, Strom D, et al. Oxidation of acid-volatile sulfide in surface sediments increases the release and toxicity of copper to the benthic amphipod Melita plumulosa[J]. Chemosphere, 2012, 88(8): 953-961. DOI:10.1016/j.chemosphere.2012.03.026 |
| [18] |
Liu G, Fan C, Zhang L, et al. Environment effects of algae-caused black spots Ⅲ:Impacts on Fe-SP cycle in water-sediment interface[J]. China Environmental Science, 2014, 34(12): 3199-3206. |
| [19] |
Nasr S, Khairy M, Okbah M, et al. AVS-SEM relationships and potential bioavailability of trace metals in sediments from the Southeastern Mediterranean Sea, Egypt[J]. Chemistry and Ecology, 2014, 30(1): 15-28. |
| [20] |
Guo G, Ekama G A, Wang Y, et al. Advances in sulfur conversion-associated enhanced biological phosphorus removal in sulfate-rich wastewater treatment:A review[J]. Bioresource Technology, 2019, 285: 121303. DOI:10.1016/j.biortech.2019.03.142 |
| [21] |
Meng T, Zhu M X, Ma W W, et al. Sulfur, iron, and phosphorus geochemistry in an intertidal mudflat impacted by shellfish aquaculture[J]. Environmental Science and Pollution Research, 2019, 26(7): 6460-6471. DOI:10.1007/s11356-018-04114-w |
| [22] |
Preuss K, Siwoniku A M, Bucur C I, et al. The influence of heteroatom dopants nitrogen, boron, sulfur, and phosphorus on carbon electrocatalysts for the oxygen reduction reaction[J]. Chem Plus Chem, 2019, 84(5): 457-464. |
| [23] |
Tan H, Tang J, Kim J, et al. Rational design and construction of nanoporous iron-and nitrogen-doped carbon electrocatalysts for oxygen reduction reaction[J]. Journal of Materials Chemistry A, 2019, 7(4): 1380-1393. DOI:10.1039/C8TA08870E |
| [24] |
Wu S, Zhao Y, Chen Y, et al. Sulfur cycling in freshwater sediments:A cryptic driving force of iron deposition and phosphorus mobilization[J]. Science of the Total Environment, 2019, 657: 1294-1303. DOI:10.1016/j.scitotenv.2018.12.161 |
| [25] |
Yan Z, Dai C, Lv X, et al. Iron promoted nitrogen doped porous graphite for efficient oxygen reduction reaction in alkaline and acidic media[J]. Journal of Alloys and Compounds, 2019, 773: 819-827. DOI:10.1016/j.jallcom.2018.09.275 |
| [26] |
Yao Z, Wang F, Wang C, et al. Anaerobic ammonium oxidation coupled to ferric iron reduction in the sediment of a eutrophic lake[J]. Environmental Science and Pollution Research, 2019, 26(15): 15084-15094. DOI:10.1007/s11356-019-04907-7 |
| [27] |
Yao Z, Yang L, Song N, et al. Effect of organic matter derived from algae and macrophyte on anaerobic ammonium oxidation coupled to ferric iron reduction in the sediment of a shallow freshwater lake[J]. Environmental Science and Pollution Research, 2019, 27(3): 1-9. |
| [28] |
Gonzalez-Silva B M, Briones-Gallardo R, Razo-Flores E, et al. Inhibition of sulfate reduction by iron, cadmium and sulfide in granular sludge[J]. Journal of Hazardous Materials, 2009, 172(1): 400-407. DOI:10.1016/j.jhazmat.2009.07.022 |
| [29] |
Lovley D R, Phillips E J. Competitive mechanisms for inhibition of sulfate reduction and methane production in the zone of ferric iron reduction in sediments[J]. Appl Environ Microbiol, 1987, 53(11): 2636-2641. DOI:10.1128/AEM.53.11.2636-2641.1987 |
| [30] |
Roden E E, Sobolev D, Glazer B, et al. Potential for microscale bacterial Fe redox cycling at the aerobic-anaerobic interface[J]. Geomicrobiology Journal, 2004, 21(6): 379-391. DOI:10.1080/01490450490485872 |
| [31] |
Rittmann B E, Tularak P, Lee K-C, et al. How adaptation and mass transfer control the biodegradation of linear alkylbenzene sulfonate by activated sludge[J]. Biodegradation, 2001, 12(1): 31-37. DOI:10.1023/A:1011928723070 |
| [32] |
Jacobson M. Chemical and biological mobilization of Fe(Ⅲ)in marsh sediments[J]. Biogeochemistry, 1994, 25(1): 41-60. |
| [33] |
金鑫, 王进, 陈天虎, 等. 铁氧化物对硫酸盐还原菌分解硫酸盐矿物的协同作用[J]. 矿物学报, 2010(3): 343-348. JIN Xin, WANG Jin, CHEN Tian-hu, et al. The synergistic influence of iron oxide on the dissolution of sulfate mineral[J]. Acta Mineralogica Sinica, 2010(3): 343-348. |
| [34] |
王旭刚, 徐晓峰, 孙丽蓉, 等. 厌氧条件下水稻土中铁硫循环与光照的关系[J]. 土壤学报, 2013, 50(4): 712-719. WANG Xu-gang, XU Xiao-feng, SUN Li-rong, et al. Relationships of illumination with iron and sulfur cyclings in paddy soil under anaerobic incubation[J]. Acta Pedologica Sinica, 2013, 50(4): 712-719. |
| [35] |
Borch T, Kretzschmar R, Kappler A, et al. Biogeochemical redox processes and their impact on contaminant dynamics[J]. Environmental Science & Technology, 2010, 44(1): 15-23. |
| [36] |
Poulton S W. Sulfide oxidation and iron dissolution kinetics during the reaction of dissolved sulfide with ferrihydrite[J]. Chemical Geology, 2003, 202(1/2): 79-94. |
| [37] |
黎慧娟, 彭静静. 异化Fe(Ⅲ)还原微生物研究进展[J]. 生态学报, 2012, 32(5): 1633-1642. LI Hui-juan, PENG Jing-jing. Recent advances in studies on dissimilatory Fe(Ⅲ)-reducing microorganisms[J]. Acta Ecologica Sinica, 2012, 32(5): 1633-1642. |
| [38] |
Wilkin R, Barnes H. Pyrite formation by reactions of iron monosulfides with dissolved inorganic and organic sulfur species[J]. Geochimica et Cosmochimica Acta, 1996, 60(21): 4167-4179. DOI:10.1016/S0016-7037(97)81466-4 |
| [39] |
Choi J, Choi K, Lee W. Effects of transition metal and sulfide on the reductive dechlorination of carbon tetrachloride and 1, 1, 1-trichloroethane by FeS[J]. Journal of Hazardous Materials, 2009, 162(2/3): 1151-1158. |
 2020, Vol. 39
2020, Vol. 39


