河岸带是水生生态系统和陆地生态系统之间的生态交错带,其生态系统的稳定对于治理河流及水土污染、调节水量、稳定河岸、提高生物多样性、美化环境等有重要的现实及潜在价值[1-2]。具有特殊生境功能的河岸带可以为各种生物提供良好的栖息地,并具有较高的生物多样性[3]。生物多样性是决定生态系统稳定的关键因素,河岸带植物的物种多样性是生态系统中其他生物多样性的基础,其发展对提高土壤肥力、改善土壤功能、促进土壤发育以及促进土壤微生物多样性的恢复具有重要作用,可以促进整个河流与河岸生态系统结构与功能的恢复和重建[4-5]。
河岸带植被群落可以形成河流缓冲带,它们构成了营养物质和能量流动的关键过渡区,可以为河流生态系统提供养分和能量,在一定条件下可以维护河流生态系统的平衡,是河岸带生态功能的发挥者和维持者,对维护河流及其河岸带的生态健康具有重要意义[6-8]。河岸带的植物还可以对从陆地流向河流的各种有机物、无机物进行过滤和吸收,是控制面源污染及水土流失、改善水体环境的重要因素[9-11]。河岸带的土壤环境是一个复杂的、动态的有机整体。土壤微生物是河岸带生态系统的重要组成部分,可以促进河岸带有机物质的分解、转化及供应,同时在维持河岸带生态系统功能方面具有重要作用[12]。土壤环境和地上生物多样性会直接影响土壤微生物的生存[13]。土壤微生物多样性可以反映土壤的质量水平,是生态系统健康的重要标志[14]。
近年来,由于人类影响导致河流周围河岸带严重退化,对河流的健康发展产生严重威胁,因此退化河岸带的恢复管理至关重要。河岸带的恢复可以增强水体的自净能力、促进生物多样性、保持土壤条件[15-16]。虽然近年来有关河岸带恢复的研究有所增加,但在全球范围内进展有限,尤其国内有关河岸带恢复的研究甚少,因此对于退化河岸带的修复有待探索。辽河是中国第7大河流,随着经济快速发展,辽河流域河岸带退化严重。随着“十二五”水专项辽河项目相关的河道整治综合修复技术、自然封育技术、河岸带生态修复技术的实施,辽河保护区河岸带的生态功能已得到了改善,河岸带呈现出恢复的状态。但近年来辽河保护区内仍存在较多因素影响河岸带的自然恢复进程,因此亟需了解辽河保护区河岸带恢复现状,为今后辽河保护区的治理提供借鉴。河岸带的植被和土壤微生物是影响河岸带功能的主要因素,植物和微生物多样性指数可以反映群落内物种的多少,是衡量一个地区生态系统生物群落组成的重要指标[17-18]。本文通过调查辽河干流河岸带植物和土壤微生物多样性指数,了解河岸带植物及微生物的恢复现状,从而明确阻碍河岸带恢复进程的关键因素,这对辽河保护区生物多样性的认识和保护具有重要意义,同时有助于进一步了解辽河保护区河岸带生态系统恢复的状态,为辽河保护区河岸带退化生态系统修复与重建提供理论依据。
1 材料与方法 1.1 研究区域概况辽河干流全长538 km,始于辽宁昌图福德店,流经沈阳、鞍山、辽阳、盘锦,终止于辽宁盘锦红海滩入海口。随着经济的发展,辽河地区的生态环境受到较多威胁,为解决辽河干流水土流失、人类活动干扰、水质不断恶化等问题,近年来,通过围栏封育和退耕还河等政策的实施,河流的生态环境已得到很大改善[19]。
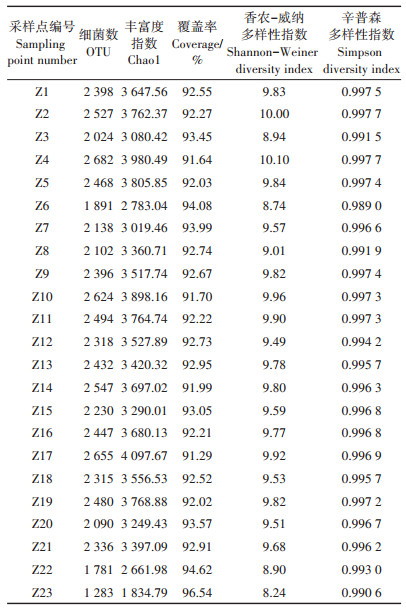
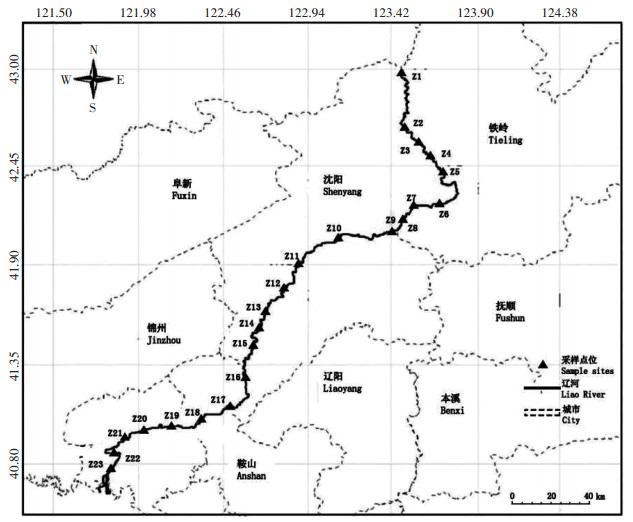
1.2 野外采样方法 1.2.1 采样点分布本次调研自辽河干流上游至下游共选取23个采样点,其分布如图 1所示。
|
图 1 辽河保护区采样点分布图 Figure 1 Distribution of sampling points in Liao River reserve |
植物调查:本次研究的植被调查于2019年6月进行,选择样方法进行植被调研,在每个采样点设置20 m×20 m的样地,在样方的四角和中心设置5个1 m×1 m的草本植被样方,统计每个样方中出现的物种,并记录其株高、株数和盖度[20-21]。
土壤样品的采集:在辽河保护区上游至下游区段选取23个采样点(采样点布设如表 1所示),于2019年6月进行采样;采用5点法取样,样品取自0~20 cm的表层土壤,将土壤样品混合后放入冰箱保存,运回实验室后冷藏保存,进行微生物高通量测序分析。
|
|
表 1 辽河干流河岸带土壤微生物多样性指数 Table 1 Soil microbial diversity index in riparian zone of Liao River main stream |
植物多样性体现了植物群落的发展趋势,反映了植物群落的组织结构、稳定性、生境差异以及各植物物种的数量分布的均匀性[22-23]。本文计算了辽河干流23个采样点的Shannon-Weiner指数、Simpson指数、Pielou均匀度指数以及植被覆盖度,具体的指数计算公式如下:
香农-威纳(Shannon-Weiner)多样性指数(H′):
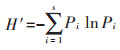
|
(1) |
辛普森(Simpson)多样性指数(D):
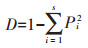
|
(2) |
Pielou均匀度指数(J′)
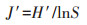
|
(3) |
式中:Pi为物种i的重要值;S为样地中的物种数目。
其中重要值的计算方法:

|
(4) |
式中:Ivsh为草本植物重要值;相对密度=每个物种的密度/所有物种的密度之和×100%;相对盖度=每个物种的盖度/所有物种的盖度之和×100%;相对高度=每个物种的所有个体高度之和/所有物种个体高度之和×100%。
1.3.2 微生物多样性的测定微生物高通量测序分析克服了传统方法检测细菌群落丰度相对较低、范围较小、操作复杂、成本高等缺点,具有通量高、灵敏度好、简单、快速、低成本等优点[24]。因此本研究选择高通量测序分析对辽河保护区河岸带土壤微生物进行测定。具体测序过程为:进行基因组DNA提取,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA;按指定测序区域,合成带有barcode的特异引物,或合成带有错位碱基的融合引物;每个样本进行3次重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,TrisHCl洗脱;用2%的琼脂糖电泳进行检测;构建测序文库;完成上机测序;进行数据处理与分析[25]。
2 结果与分析 2.1 植物多样性对辽河干流河岸带植被调查结果进行分析与计算,得到辽河干流河岸带植物Shannon-Weiner多样性指数(图 2),辽河干流河岸带的植被Shannon - Weiner多样性指数平均值为1.227;其中最高点出现在Z5(后施家堡),该采样点的植物Shannon-Weiner多样性指数为1.786,表明Z5采样点植被多样性高。在该采样点还发现了瘤突苍耳(Xanthium strumarium)、苘麻(Abutilon theophrasti)、加拿大飞蓬(Conyza canadensis L.)等外来入侵植物。该采样点的围封区域内人类活动少,周边无放牧情况,且围封区与农业用地距离远,不会由于面源污染对河岸带植被生长产生影响,因此该采样点植被处于自然生长状态,其多样性明显高于其他采样点。Shannon-Weiner多样性指数的最低点(0.636)出现在Z22(赵圈河),说明该采样点植被多样性偏低,Z23(红海滩入海口)采样点的植物Shannon-Weiner多样性指数也明显低于其他采样点,这两个采样点受人类活动干扰均较少,且均无放牧情况,其多样性偏低的原因可能是这两个采样点受海水环境的影响,河岸带土壤湿润,不适合一些植物生存,因此这两个采样点的河岸带植物物种单一,仅有大量的芦苇等水生植物存在。
|
图 2 辽河干流河岸带植被香农-威纳多样性指数 Figure 2 Shannon-Wiener diversity index of riparian zone vegetation in Liao River main stream |
Simpson多样性指数可以反映植物的物种在植物群落中所占优势的程度,其值越高表明优势度越大。根据野外调查的数据计算得出辽河干流河岸带植物的Simpson多样性指数,如图 3所示,辽河干流23个采样点的Simpson多样性指数在0.153~0.781,平均值为0.558;其中,Simpson多样性指数最高点出现在Z6(双安桥),指数为0.781,表明Z6采样点河岸带植物群落组成丰富,以多个物种为主,优势种明显,这可能与河岸带围封区域外土地利用类型有关,Z6采样点紧邻河岸带的土地利用类型为农业用地,种植的主要作物为玉米,在种植过程中会大量施用化肥,经雨水冲刷通过地表径流扩散至河岸带,从而改变河岸带土壤养分,致使某些物种的优势度偏高。通过图 3可以看出,除Z10(马虎山大桥)外其余22个采样点的河岸带植被群落均以多个物种为主,Z10采样点的Simpson多样性指数明显低于其他采样点,其植物优势度明显偏低,该采样点植被群落以草本植物为主,优势种不明显,主要与该采样点放牧情况有关,严重的放牧导致该采样点河岸土壤结构发生变化,对河岸带植被系统造成严重破坏。

|
图 3 辽河干流河岸带植被辛普森多样性指数 Figure 3 Simpson diversity index of riparian zone vegetation in Liao River main stream |
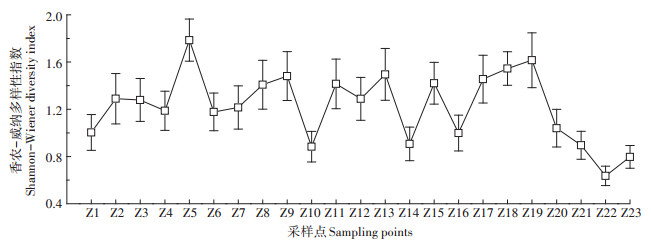
根据调研得出辽河干流河岸带植物Pielou均匀度指数,如图 4所示,23个样地的平均Pielou均匀度指数为0.635,其中Pielou均匀度指数最高点为0.837,出现在Z19(冷东大桥),说明Z19采样点处各物种分配程度较好,植物生长状况高于其他采样点;最低点为0.445,出现在Z23采样点,Z23采样点临近渤海,因此该采样点河岸带土壤湿润,仅有大量的芦苇等水生植被存在。在该采样点,芦苇具有很大竞争优势,影响其他植物的生存与发展,导致该地区群落物种走向单一化,因此该采样点的Shannon-Weiner多样性指数与Pielou均匀度指数均低于其他采样点。
|
图 4 辽河干流河岸带植被均匀度指数 Figure 4 Pielou index of riparian zone vegetation in Liao River main stream |
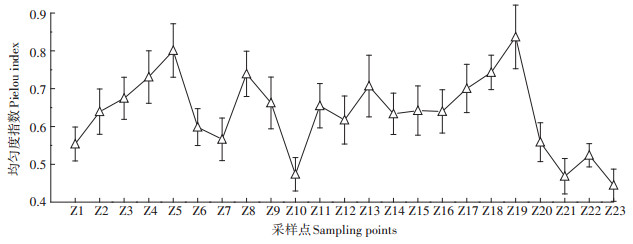
辽河干流河岸带植被覆盖度如图 5所示。辽河干流23个采样点的平均植被覆盖率为74.19%,植被覆盖度最高点出现在Z6采样点,为97.67%,这与Z6采样点河岸带实施了人工强化技术有关,通过种植杞柳等植物促进河岸带植被群落的恢复与重建,现有植被群落以杞柳、刺槐和蒿类杂草为主,目前该采样点已形成乔木、灌木和草本植物相结合的土壤-植被护岸类型;调研过程中发现,该采样点围封区域内人类活动少,且未发现放牧情况,因此其河岸带植被覆盖度高,河岸带的植被群落正逐渐恢复。最低点出现在Z16(红庙子),只有40%,与Z16相近的Z14(老大房)和Z15(满都户)采样点的植被覆盖度也低于其他采样点,其主要原因是这3个采样点的河岸带受人类活动干扰严重,距离河流较近区域有公路,常有机动车等经过,人类活动频繁造成这些采样点植被多样性偏低。可见人类活动、放牧会对河岸带植被恢复产生影响。
|
图 5 辽河干流河岸带植被覆盖度 Figure 5 Vegetation coverage of riparian zone in Liao River main stream |
通过高通量测序分析得到的多样性指数如表 1所示。辽河干流河岸带土壤中,微生物多样性呈波动性变化,OTU(细菌数量)最多的采样点为Z4(西古城子),共含有2 682个细菌,在Z23采样点仅发现1 283个细菌,明显低于其他采样点。在辽河干流23个地点的河岸带土壤中平均Chao 1(菌种丰富度)指数为3 426.19,其中最高的采样点是Z17(大张桥),Chao 1指数为4 097.67,而最低点的Chao 1指数为1 834.79,出现在Z23采样点;河岸带土壤微生物的平均Shannon - Weiner多样性指数为9.55,Z4采样点的Shannon-Weiner多样性指数最高,为10.10,而Z23采样点的Shannon-Weiner多样性指数为8.24,明显低于其他采样点,说明Z23的微生物种类少、多样性偏低。辽河干流河岸带土壤微生物的平均Simpson多样性指数为0.995 5。研究结果表明,Z4采样点的OTU数量、Shannon-Weiner多样性指数均高于其他采样点,说明Z4的河岸带土壤微生物多样性较高,可能原因是该采样点与上游其他采样点相比放牧情况少,河岸带受人类活动干扰也较少,其植被处于自然恢复状态。在辽河干流上游区域Z3(龙王庙)采样点河流两岸均有放牧情况,河岸带植被遭牛羊踩踏,有不同程度破坏,植被覆盖度低于上游其他采样点,导致该采样点的微生物多样性略低于上游其他采样点。可见放牧情况和植被多样性是影响河岸带土壤微生物多样性的重要因素。Z22采样点的微生物Shannon-Weiner多样性指数为8.90、Chao 1指数为2 661.98,略高于Z23采样点,但均低于其他采样点。Z22和Z23采样点的Shannon-Weiner指数和Chao 1指数均较低,表明这两个采样点的细菌种类较少、微生物多样性偏低。Z22和Z23虽未发现放牧情况,但该地区靠近渤海,河岸带土壤会受海水影响,土壤中的盐度较高,土壤温度也低于其他地区,因此细菌存活量偏低。
Z22与Z23采样点均靠近海域,河岸土壤受海水影响大,在辽河干流河岸带土壤中,越靠近海域的样地其微生物多样性越低,分析可能的原因主要有以下3方面:一是受盐度影响,海水的盐度较高,则海岸地区的盐度也偏高,有些微生物的耐盐度不够,不能在该区域内存活,因此微生物多样性和丰富度普遍偏低;二是受温度影响,靠近海水区域的温度相对于其他采样点偏低,低温会抑制一些微生物的活性,可能减少微生物的存活率;三是受植被影响,Z22和Z23采样点的植物多样性低于其他采样点,植物的枯枝落叶量随植物数量的减少而减少,进而使植物枯枝落叶腐烂繁衍出的微生物量减少,同时微生物与植物之间存在协同作用,植物的根际可以为微生物提供营养物质,有利于微生物的发育与繁殖,因此相对其他采样点,此处采样点的微生物数量较少。
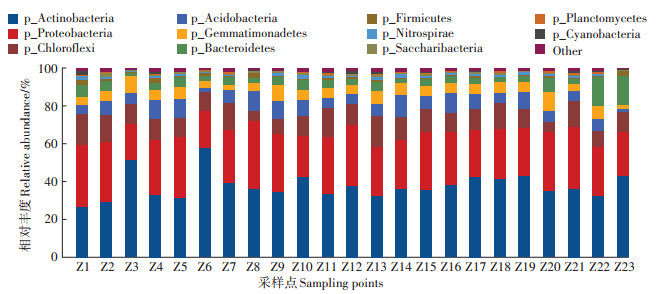
2.2.2 土壤细菌群落结构多样性分析辽河干流土壤中细菌群落在门水平上的分布比例如图 6所示。23个采样点共发现11个门水平的细菌。门水平的细菌第一优势门为Actinobacteria(放线菌门),第二优势门为Proteobacteria(变形菌门),其次为Chloroflexi(绿弯菌门)。Actinobacteria的平均丰度为37.86%,其丰度最高点出现在Z6采样点处,最大丰度为58.12%,最低点出现在Z1(福德店),最小丰度为26.96%。Proteobacteria的平均丰度为27.95%,其最大丰度出现在Z8(朱尔山),为36.05%;最小丰度出现在Z6采样点,为19.18%。Chloroflexi(细弯菌门)的丰度低于Actinobacteria和Proteobacteria,平均为11.33%。另外,在Z22和Z23采样点的Bacteroidetes(拟杆菌门)丰度分别为14.91%和15.75%,明显高于其他采样点,这两个采样点均处于近海区域,近海处的环境温度较低且含盐量偏高,表明Bacteroidetes门的微生物温度和盐度耐受范围较宽。
|
图 6 门水平上的物种组成分析 Figure 6 Species composition analysis at phylum level |
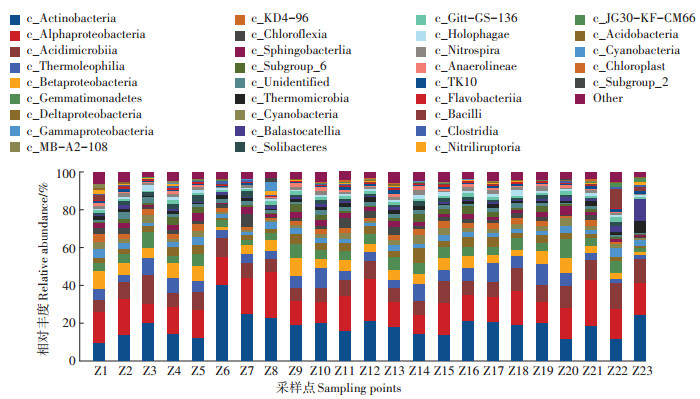
辽河干流河岸带土壤中纲水平的分布比例如图 7所示。23个采样点主要的纲水平上的细菌有32个,其中在所有采样点中优势度较大菌纲依次为Actinobacteria(放线菌纲)、Alphaproteobacteria(α-变形杆菌纲)、Acidimicrobiia(酸微菌纲)、Thermoleophilia(嗜热油菌纲)、Betaproteobacteria(β-变形菌纲)和Gemmatimonadetes(芽单胞菌纲),平均丰度分别为18.65%、16.05%、9.33%、6.11%、5.61%和5.18%。Actinobacteria在各采样地均占有较大优势度,其最大丰度为40.30%,出现在Z6采样点;最小丰度为9.64%,出现在Z1。其次是Alphaproteobacteria,该菌纲的最大丰度出现在Z8,为24.46%,而Z21(曙光公路橡胶坝)采样点的丰度为24.43%,略低于Z8采样点;Alphaproteobacteria的最小丰度为10.22%,出现在Z3采样点。Acidimicrobiia、Thermoleophilia、Betaproteobacteria和Gemmatimonadetes在各采样点所占比例较为均匀;此外,由图 7可以看出,Cytophagia(噬纤维菌纲)在Z22和Z23采样点的优势度明显高于其他采样点,在Z22处的丰度为13.4%,在Z23采样点的丰度为11.55%,表明该菌纲可能更适于在海域周边环境生长。
|
图 7 纲水平上的物种组成分析 Figure 7 Species composition analysis at class level |
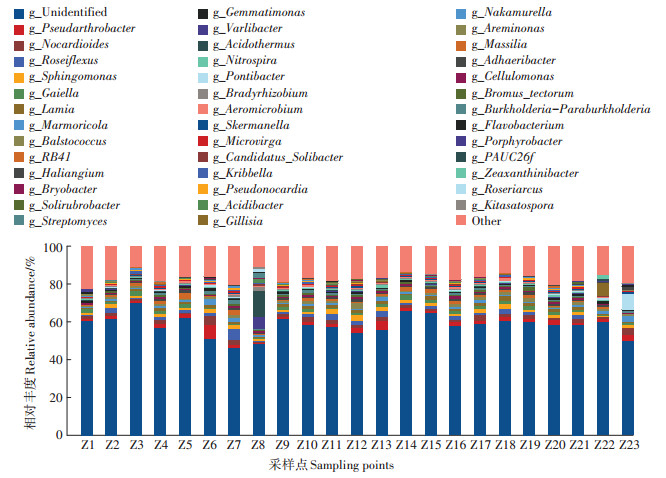
辽河干流河岸带土壤中属水平上的物种组成分布比例如图 8所示,丰度大于1%的菌属有40个,整个流域内未识别的菌属所占比例较高,23个样地的未识别菌属平均丰度为58.19%,表明辽河干流有大量的微生物资源有待进一步研究。在整个流域内,相对丰度较大的属依次为Pseudarthrobacter(假节杆菌属)、Nocardioides(类诺卡氏属)、Roseiflexus(玫瑰弯菌属)和Sphingomonas(鞘氨醇单胞菌属),其相对丰度分别为2.15%、1.87%、1.66%和1.63%。在辽河干流各采样点菌属分布较为均匀,但在Z8采样点的Acidothermus(嗜酸栖热菌属)丰度为13.81%,明显高于该地其他细菌,且该细菌在其他采样点的丰度均偏低,可能与Z8采样点的植被恢复状态有关;在Z23采样点处,Pontibacter(海洋杆菌属)相对丰度为8.09%,明显高于该采样点其他细菌属,该细菌在其他采样点的丰度也明显低于Z23采样点,表明Pontibacter可能更适合在盐度较高、温度较低的近海地区生长。
|
图 8 属水平上的物种组成分析 Figure 8 Species composition analysis at genus level |
植被的Shannon-Weiner多样性指数能够反映植物群落的结构与功能的复杂性[26-27],辽河干流河岸带植被Shannon-Weiner多样性指数在0.636~1.786范围内;物种均匀度指数反映了一个地区各物种个体数目分配的均匀程度,也是反映植物物种和植物生长状况的直接证据[28],辽河干流河岸带23个采样点的植被Pielou均匀度指数在0.445~0.837,其变化趋势与Shannon-Weiner多样性指数基本一致,表明辽河干流河岸带植物种类丰富,除靠近海域的采样点外,其他采样点的植物物种组成以多种草本植物混生为主,而靠近海域的采样点植物物种组成以水生植物(如芦苇)为主,特殊的地理条件导致靠近海域地区物种多样性指数偏低。根据植物Shannon-Weiner多样性指数、Simpson多样性指数、Pielou均匀度指数和植被覆盖度可以得出,处于自然恢复的河岸带受人类活动干扰少,植被在恢复进程中未受到破坏,因此植物物种丰富,均匀度和覆盖度均高;而人类活动干扰多、放牧严重的区域河岸带植被多样性降低;另外,河岸带农田种植所产生的面源污染会对河岸带的植被结构产生直接影响。人类活动干扰、放牧情况以及土地利用类型是影响辽河干流河岸带植被恢复状态的主要因子。
微生物Chao 1指数和Shannon-Wiener多样性指数分别用来表示土壤微生物群落的丰富度和物种多样性,其值越高表明微生物群落物种的丰富度越高、物种越多[29-30]。在野外调查过程中发现,近年来辽河保护区内存在较多放牧情况,在上游区域较为严重,放牧严重的采样点河岸带植被遭牛羊踩踏有不同程度破坏,其河岸带土壤结构发生改变,从而改变了河岸带土壤的微生物群落结构特征,导致土壤中微生物多样性偏低,而受人类活动干扰情况较少且无放牧情况的河岸带植物恢复状态好,由植物的枯枝落叶繁衍产生的微生物多,因此采样点的微生物种类多,微生物多样性指数和丰富度高[31]。在本次研究中发现,受海水环境影响的河岸带土壤湿度和盐度高、温度低,靠近海水的河岸带植物多样性偏低,导致靠近海水区域的土壤中微生物多样性低[32]。通过土壤细菌门、纲、属的物种组成可以看出,不同样地的细菌丰度有显著差异,可能是采样点的植物多样性不同以及向土壤中提供的营养物质存在差异[33]。可见人类活动干扰、放牧情况以及植被多样性会明显改善土壤环境,对河岸带土壤微生物多样性具有重要影响。在本次研究中发现,辽河干流河岸带土壤中有平均58.19%细菌属未被识别,表明辽河干流河岸带土壤中的微生物资源有待探索[34]。
辽河干流生态系统自辽河保护区封育以来得到很大程度的恢复,河岸带的植物及微生物恢复状态良好,生物多样性与封育前相比有明显提高。但目前,流域内仍然存在影响和阻碍植物和微生物持续恢复的不利因素,如人类活动干扰、放牧情况会对保护区内植物的恢复产生干扰,对土壤环境的稳定和性质造成破坏,影响土壤中微生物的正常活动,改变土壤微生物的群落结构;河岸带土地利用类型会直接影响河岸带土壤养分,改变河岸带植物物种多样性,从而导致土壤微生物的物种多样性和丰富度发生变化。因此建议加强辽河保护区河岸带的管理,使河岸带的植物及微生物能够向着良好的自然状态恢复,有助于河岸带功能的正常发挥,同时起到保护河流的作用。
4 结论(1)在辽河干流河岸带中,平均植被ShannonWeiner指数为1.227,植被覆盖度达到74.19%,通过辽河保护区自然封育以及人工强化技术的实施,辽河保护区内的植物处于近自然恢复状态;在调查过程中发现,人类活动干扰、放牧情况以及土地利用类型对河岸带植被多样性具有直接影响。
(2)在辽河干流的23个采样点河岸带土壤中微生物多样性呈波动性变化,优势度大于1%的细菌门水平有11个、纲水平有32个、属水平有40个,不同微生物群落受环境因素影响存在显著性差异。土壤微生物多样性与人类活动干扰、放牧情况、土壤环境以及植被多样性密切相关。
(3)加强辽河干流河岸带围封区域内管理,杜绝放牧情况,减少河岸带植被生长过程的人为干扰,有利于加快辽河保护区河岸带植被和微生物多样性的恢复进程,提高河岸带生态功能的发挥。
| [1] |
韩路, 王海珍, 于军. 河岸带生态学研究进展与展望[J]. 生态环境学报, 2013, 22(5): 879-886. HAN Lu, WANG Hai-zhen, YU Jun. Research progress and prospects on riparian zone ecology[J]. Ecology and Environmental Sciences, 2013, 22(5): 879-886. |
| [2] |
周铭浩, 邱静, 洪昌红, 等. 河岸带功能及其保护修复措施[J]. 黄河水利职业技术学院学报, 2019, 31(4): 6-11. ZHOU Ming-hao, QIU Jing, HONG Chang-hong, et al. Riparian zone function and its protection and remediation measures[J]. Journal of Yellow River Conservancy Technical Institute, 2019, 31(4): 6-11. |
| [3] |
曾艳.不同土地利用类型下河岸带草本植物群落结构及其影响因素[D].南京: 南京大学, 2015. ZENG Yan. The effects of land use on herbaceous community structure in the riparian zone[D]. Nanjing: Nanjing University, 2015. |
| [4] |
李林霞, 王瑞君, 辜彬, 等. 海岛矿区岩质边坡植物群落演替中物种多样性的变化[J]. 生态学杂志, 2014, 33(7): 1741-1747. LI Lin-xia, WANG Rui-jun, GU Bin, et al. Changes in biodiversity during the succession of plant communities on the rocky slopes of mine in islands[J]. Chinese Journal of Ecology, 2014, 33(7): 1741-1747. |
| [5] |
郭二辉.河岸带植被及其空间配置的土壤环境效应与恢复管理对策[D].北京: 中国科学院大学, 2013. GUO Er-hui. Effects of riparian vegetation and its spatial configuration on soil environments and recovery management measures[D]. Beijing: University of Chinese Academy of Sciences, 2013. |
| [6] |
Patryk C, Marcin K D, Jagodziński A M. River regulation drives shifts in urban riparian vegetation over three decades[J]. Urban Forestry & Urban Greening, 2019, 47(2): 1-41. |
| [7] |
曲晓涵, 王雪岩. 大连市河岸带生态恢复与植被重建研究[J]. 科技经济导刊, 2019, 27(20): 113. QU Xiao-han, WANG Xue-yan. Ecological restoration and vegetation reconstruction in Dalian riparian zone[J]. Technology and Economic Guide, 2019, 27(20): 113. |
| [8] |
胡彬, 翟文静, 赵警卫. 河岸带植被对河流生态功能影响研究进展[J]. 福建林业科技, 2015, 42(3): 233-239. HU Bin, ZHAI Wen-jing, ZHAO Jing-wei. Progress in researches on the influence of riparian vegetation on river ecological functions[J]. Journal of Fujian Forestry Science and Technology, 2015, 42(3): 233-239. |
| [9] |
闵梦月, 宗小香, 段一凡, 等. 清潩河(许昌段)流域生物群落特征及其与环境因子的关系[J]. 应用生态学报, 2016, 27(7): 2111-2118. MIN Meng-yue, ZONG Xiao-xiang, DUAN Yi-fan, et al. Community characteristics in Qingyihe River basin of Xuchang section and their relationships with environmental factors[J]. Chinese Journal of Applied Ecology, 2016, 27(7): 2111-2118. |
| [10] |
Dietrich A L, Nilsson C, Jansson R. Restoration effects on germination and survival of plants in the riparian zone:A phytometer study[J]. Plant Ecology, 2015, 216(3): 465-477. |
| [11] |
柴剑雄.清潩河流域河岸带植物群落配置和功能改善研究[D].郑州: 郑州大学, 2019. CHAI Jian-xiong. Study on plant community allocation and functional improvement in the riparian zone of the Qingyi River basin[D]. Zhengzhou: Zhengzhou University, 2019. |
| [12] |
Wang Y C, Lei B, Yang C H, et al. Heavy metal contamination from sediment and soil in the riparian zone of the Three Gorges Reservoir, China[J]. Applied Mechanics and Materials, 2014, 675/677: 371-376. DOI:10.4028/www.scientific.net/AMM.675-677.371 |
| [13] |
张群, 刘春阳, 于晓丹, 等. 辽河保护区土壤可培养真菌多样性分析[J]. 辽宁林业科技, 2014(6): 7-13. ZHANG Qun, LIU Chun-yang, YU Xiao-dan, et al. Study on the diversity of soil-cultured fungi in Liaohe reserve[J]. Liaoning Forestry Science and Technology, 2014(6): 7-13. |
| [14] |
李金融, 侯湖平, 王琛, 等. 基于高通量测序的复垦土壤细菌多样性研究[J]. 环境科学与技术, 2018, 41(12): 148-157. LI Jin-rong, HOU Hu-ping, WANG Chen, et al. Soil bacteria diversity of reclaimed soil based on high throughput sequencing[J]. Environmental Science & Technology, 2018, 41(12): 148-157. |
| [15] |
Wise M J. A field investigation into the effects of anthropogenic disturbances on biodiversity and alien invasions of plant communities[J]. Bioscene, 2017, 43(2): 3-14. |
| [16] |
Chen F, Lu S, Hu X, et al. Multi-dimensional habitat vegetation restoration mode for lake riparian zone, Taihu, China[J]. Ecological Engineering, 2019, 134: 56-64. DOI:10.1016/j.ecoleng.2019.05.002 |
| [17] |
杨美玲, 张霞, 王绍明, 等. 基于高通量测序的裕民红花根际土壤细菌群落特征分析[J]. 微生物学通报, 2018, 45(11): 2429-2438. YANG Mei-ling, ZHANG Xia, WANG Shao-ming, et al. High throughput sequencing analysis of bacterial communities in Yumin safflower[J]. Microbiology China, 2018, 45(11): 2429-2438. |
| [18] |
Zhou W P, Xiang D, Hu Y J, et al. Influences of long-term enclosure on the restoration of plant and AM fungal communities on grassland under different grazing intensities[J]. Acta Ecologica Sinica, 2013, 33(33): 3383-3393. |
| [19] |
曹丽娟.辽河保护区生境恢复成效评估研究[D].大连: 大连海洋大学, 2018. CAO Li-juan. Evaluation of habitat restoration in Liao River reserve[D]. Dalian: Dalian Ocean University, 2018. |
| [20] |
刘林馨, 王健, 杨晓杰, 等. 大兴安岭不同森林群落植被多样性对土壤有机碳密度的影响[J]. 生态环境学报, 2018, 27(9): 1610-1616. LIU Lin-xin, WANG Jian, YANG Xiao-jie, et al. Forest plant community and organic carbon density in Da Xing'an Mountains[J]. Ecology and Environmental Sciences, 2018, 27(9): 1610-1616. |
| [21] |
吴芮欣, 马会强, 支天一, 等. 两种幼龄乔木修复林下土壤改良及植被多样性研究[J]. 生态科学, 2019, 38(3): 71-79. WU Rui-xin, MA Hui-qiang, ZHI Tian-yi, et al. Study on soil improvement and vegetation diversity of two kinds of young trees under remediation[J]. Ecological Science, 2019, 38(3): 71-79. |
| [22] |
罗建虎.近自然生态修复下河岸带植被、蝶类多样性分析及生态综合评价[D].长春: 东北师范大学, 2014. LUO Jian-hu. The diversity analysis of riparian vegetation, butterflies and ecological comprehensive evaluation under the near-natural ecological restoration[D]. Changchun: Northeast Normal University, 2014. |
| [23] |
杨晶. 清河流域植被评价及结果分析[J]. 新农业, 2018(13): 4-6. YANG Jing. Vegetation evaluation and result analysis in Qinghe River basin[J]. New Agriculture, 2018(13): 4-6. |
| [24] |
杨浩, 张国珍, 杨晓妮, 等. 16S rRNA高通量测序研究集雨窖水中微生物群落结构及多样性[J]. 环境科学, 2017, 38(4): 1704-1716. YANG Hao, ZHANG Guo-zhen, YANG Xiao-ni, et al. Microbial community structure and diversity in cellar water by 16S rRNA highthroughput sequencing[J]. Environmental Science, 2017, 38(4): 1704-1716. |
| [25] |
李娅芸.宁南山区典型植物根系分解特征及其对土壤养分和微生物多样性的影响[D].杨凌: 西北农林科技大学, 2016. LI Ya-yun. Effects of typical plant roots decomposition on soil nutrients and soil microbial diversity of southern area in Ningxia[D]. Yangling: Northwest A & F University, 2016. |
| [26] |
何松.嘉陵江中下游河岸植被及植物多样性研究[D].重庆: 西南大学, 2019. HE Song. Study on vegetation and plant diversity of riparian in the middle and lower reaches of the Jialing River[D]. Chongqing: Southwest University, 2019. |
| [27] |
孔庆仙, 信忠保, 夏晓平. 北京怀九河河岸带植物多样性及影响因子分析[J]. 科技导报, 2017, 35(24): 57-65. KONG Qing-xian, XIN Zhong-bao, XIA Xiao-ping. Riparian vegetation diversity and its influencing factors of Huaijiu River in Beijing[J]. Science & Technology Review, 2017, 35(24): 57-65. |
| [28] |
何聪, 吴世祥, 胡翠华, 等. 元谋干热河谷冲沟土壤墒情与植物多样性的关系研究[J]. 亚热带水土保持, 2019, 31(1): 26-31. HE Cong, WU Shi-xiang, HU Cui-hua, et al. Study on the relationship between soil moisture content and plant diversity in the gully of the Yuanmou dry-hot valley[J]. Subtropical Soil and Water Sonservation, 2019, 31(1): 26-31. |
| [29] |
Bates S T, Clemente J C, Flores G E, et al. Global biogeography of highly diverse protistan communities in soil[J]. The ISME Journal, 2013, 7(3): 652-659. DOI:10.1038/ismej.2012.147 |
| [30] |
Schloss P D, Gevers D, Westcott S L. Reducing the effects of PCR amplification and sequencing artifacts on 16SrRNA-based studies[J]. PLoS One, 2011, 6(12): e27310. DOI:10.1371/journal.pone.0027310 |
| [31] |
郭娜, 孙丽娜, 孟越, 等. 辽河保护区河岸带土壤微生物群落结构特征[J]. 沈阳大学学报(自然科学版), 2016, 28(6): 457-463. GUO Na, SUN Li-na, MENG Yue, et al. Soil microbial community structure characteristics of riparian zone in Liaohe River conservation area[J]. Journal of Shenyang University(Natural Science Edition), 2016, 28(6): 457-463. |
| [32] |
武亚婷, 杜木英, 何欢欢, 等. 基于高通量测序技术分析新疆不同地区自然发酵辣椒酱微生物群落多样性[J]. 食品与发酵工业, 2019, 45(21): 221-228. WU Ya-ting, DU Mu-ying, HE Huan-huan, et al. Microbial diversity analysis of natural fermented chili sauce from different regions in Xinjiang by high-throughput sequencing[J]. Food and Fermentation Industries, 2019, 45(21): 221-228. |
| [33] |
陈孟立, 曾全超, 黄懿梅, 等. 黄土丘陵区退耕还林还草对土壤细菌群落结构的影响[J]. 环境科学, 2018, 39(4): 1824-1832. CHEN Meng-li, ZENG Quan-chao, HUANG Yi-mei, et al. Effects of the farmland-to-forest/grassland conversion program on the soil bacterial community in the loess hilly region[J]. Environmental Science, 2018, 39(4): 1824-1832. |
| [34] |
朱琳, 曾椿淋, 李雨青, 等. 基于高通量测序的大豆连作土壤细菌群落多样性分析[J]. 大豆科学, 2017, 36(3): 419-424. ZHU Lin, ZENG Chun-lin, LI Yu-qing, et al. The characteristic of bacterial community diversity in soybean field with continuous cropping based on the high-throughput sequencing[J]. Soybean Science, 2017, 36(3): 419-424. |
 2020, Vol. 39
2020, Vol. 39