2. 农业农村部环境保护科研监测所, 天津 300191;
3. 中国农业大学农学院, 北京 100193
2. Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin 300191, China;
3. College of Agronomy and Biotechnology, China Agricultural University, Beijing 100193, China
大豆是美国、巴西、中国和阿根廷等许多国家重要的粮食来源[1],2018年国家统计局数据显示,我国大豆种植面积高达8 413万hm2,产量为1 596万t。大豆收获后会产生大量秸秆及豆荚壳,目前只有少量秸秆被用作生活能源及动物饲料,大部分秸秆被直接丢弃或就地焚烧,不仅污染了环境,也极大地浪费了资源[2]。厌氧消化技术是实现有机固体废物资源化利用和满足可再生能源需求的重要措施[3]。
秸秆等木质纤维素原料因其结构致密复杂、抗微生物及酶分解能力强,导致秸秆水解效率差、甲烷产量低,严重限制了秸秆沼气的产业化发展。预处理技术是提高秸秆等木质纤维素原料甲烷转化效率的有效手段[4-5],常见的预处理方式包括物理预处理、化学预处理及生物预处理等。物理预处理主要是通过减小秸秆粒径、提高比表面积,从而增加纤维素与微生物或酶的接触几率[6],如Dai等[7]将水稻秸秆粒径从20 mm减小到0.075 mm,累积甲烷产量提高了84%。化学预处理是利用化学试剂去除木质素等难降解物质,以提高纤维素的酶解效率[8],如Xiong等[2]利用热化学方法预处理大豆秸秆,甲烷产量提高了62%。生物预处理是利用具有木质纤维素降解能力的功能微生物或酶,促进秸秆的生物降解,提高秸秆的转化效率[4]。与其他预处理方式相比,生物预处理具有能耗低、环境友好和能提高产甲烷菌活性等优点,备受研究者青睐。Yan等[9]利用复合菌系BYND-5预处理水稻秸秆,甲烷产量提高了20%;Deng等[10]利用木霉菌RUTC30预处理大豆及水稻秸秆混合物,累积甲烷产量提高了807%。
微生物复合系MC1是一组能够有效降解秸秆木质纤维素的复合菌群[11-14]。玉米、水稻、小麦等多种农作物秸秆,经其预处理水解作用后,原料厌氧消化产甲烷性能得到有效提高[15-17]。但MC1对木质化程度较高的大豆秸秆预处理能力及产甲烷效率仍未可知,且预处理过程中杂菌对MC1菌群功能的影响仍不清楚。针对大豆秸秆木质化程度高、能源转化效率低等问题,本研究利用复合菌系MC1对灭菌大豆秸秆(SS)及未灭菌大豆秸秆(NSS)进行12 d微生物预处理,分析大豆秸秆的水解特性及规律,揭示MC1预处理对其产甲烷性能的影响,从而为大豆秸秆的高效资源化利用提供依据。
1 材料与方法 1.1 试验材料复合菌系MC1由中国农业大学农学院废弃物资源利用研究室提供[18]。大豆秸秆取自山西农业大学实验站,秸秆自然风干后粉碎至5 mm左右。厌氧发酵接种污泥取自实验室以牛粪为原料长期稳定运行的厌氧发酵反应器,秸秆及接种物性质见表 1。
|
|
表 1 秸秆及接种物性质 Table 1 Characteristics of the soybean straw and inoculum used in experiment |
MC1预处理大豆秸秆试验:向500 mL蓝盖瓶中加入200 mL PCS培养基和6 g大豆秸秆,(1)SS处理组为将含有大豆秸秆的培养基置于121 ℃下灭菌20 min,然后接种MC1活化菌;(2)NSS处理组为直接接种MC1活化菌。接种量均为10% V/V,接种后置于50 ℃培养箱静置培养。以不添加复合菌系的SS和NSS为对照,进行为期12 d的微生物预处理试验。每个处理重复3次,分别于预处理1、3、5、7、9、12 d取样,测定大豆秸秆减质量、木质纤维素含量和预处理体系pH值、挥发性有机酸(VFAs)及溶解性化学需氧量(sCOD)含量。
预处理体系厌氧发酵试验:以预处理体系VFAs产量和秸秆减质量为依据,获得最佳MC1预处理时间。MC1预处理大豆秸秆试验表明预处理3 d和7 d VFAs产量最高,预处理12 d秸秆减质量最多。因此将大豆秸秆按上述步骤进行3、7 d及12 d的预处理,然后向预处理体系分别加入100 mL接种污泥,并添加去离子水补至发酵体积300 mL,混匀后充氮气3 min,确保发酵体系达到厌氧条件,置于(35±2)℃培养箱发酵。以不添加底物的接种污泥处理为空白,以未接种复合菌系的SS和NSS处理为对照,进行大豆秸秆及其预处理体系的产甲烷性能评价,每个处理重复3次,发酵过程中每日测定沼气总产气量及甲烷含量,发酵周期为23 d。
1.3 MC1预处理指标测定MC1预处理过程中的残余秸秆于60 ℃烘干至恒质量后称量质量,计算秸秆总减质量。烘干后的秸秆粉碎过1 mm筛,称取0.5 g至F57专用袋中,用ANK⁃ OM220型纤维分析仪测定纤维素、半纤维素及木质素含量,方法参照仪器操作手册。
预处理体系经8 000 r·min-1离心10 min后测定相关指标。采用pH计(日本Horiba B-212)测定pH值,采用高效液相色谱仪(岛津LC-20A,日本)测定挥发性有机酸[19],采用COD快速检测仪(Lovibond E799718,德国)测定sCOD[20]。
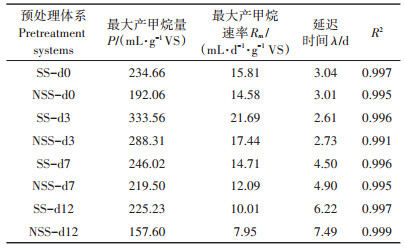
1.4 气体指标测定及产甲烷动力学分析试验采用BMP-Test系统(WAL-BMP-Testsys⁃ tem 3150,德国)测定厌氧发酵瓶中压力,根据压力差计算日产沼气量;利用气相色谱(岛津GC-2014,日本)测定沼气中甲烷含量[21]。采用动力学模型Modi⁃ fied Gompertz方程对各处理产甲烷数据进行拟合[22],公式如下:
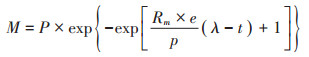
|
式中:M为t时刻的累积甲烷产量,mL·g-1 VS;P为最大甲烷产量,mL·g-1 VS;Rm为最大产甲烷速率,mL· g-1 VS·d-1;λ为延滞期,d;P、Rm和λ均通过批式厌氧发酵试验数据拟合获得。
1.5 数据处理试验中数据处理及统计分析使用软件Microsoft Excel 2010、Origin 9.1和SPSS 22.0。方差分析使用Duncan的多范围检验,P < 0.05为差异显著。
2 结果与分析 2.1 MC1预处理过程中大豆秸秆的减质量分析MC1预处理过程中大豆秸秆减质量如图 1A所示。秸秆经过12 d的降解,SS和NSS总减质量率分别为39.08%和34.29%,SS减质量显著高于NSS(P < 0.05)。秸秆木质纤维素成分变化如图 1B所示,大豆秸秆纤维素、半纤维素和木质素含量分别为47.20%、16.31%和22.48%,灭菌后略有下降,分别为42.60%、15.89%和21.72%,与灭菌前相比无显著变化,说明灭菌对秸秆木质纤维素成分的影响较小。12 d预处理结束后,NSS和SS的纤维素、半纤维素、木质素降解率分别为30.1%、41.6%、17.2%和41.7%、38.5%、29.9%,表明MC1在杂菌存在的条件下仍能有效降解大豆秸秆。
|
图 1 复合菌系MC1预处理过程中大豆秸秆的减质量及木质纤维质量变化 Figure 1 Weight loss of soybean straw and weight of linocellulose composition during pretreatment by MC1 |
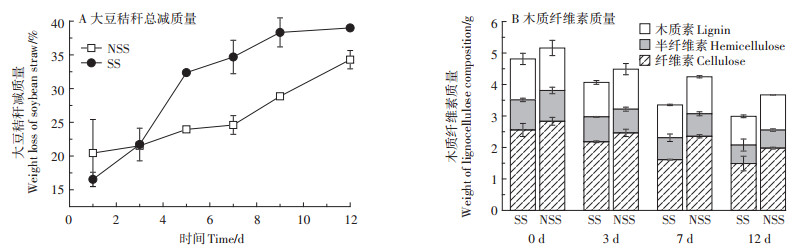
大豆秸秆预处理体系pH及sCOD变化如图 2所示,pH呈先下降后升高的趋势,其中SS预处理体系pH低于NSS(7 d除外),并在整个预处理过程中pH均维持在7.45以下。预处理3 d,SS与NSS体系sCOD的浓度均达到最大值,分别为5.87 g·L-1及5.39 g·L-1。预处理12 d,SS的sCOD浓度为4.51 g·L-1,显著高于NSS(P < 0.05),可能与MC1对SS纤维素降解效果显著高于NSS有关(图 1B)。
|
图 2 大豆秸秆预处理过程中水解液pH与sCOD的变化 Figure 2 The changes of pH and sCOD during straw pretreatment |
MC1预处理大豆秸秆过程中产生的主要挥发性有机酸变化如图 3所示。预处理体系有机酸总量整体呈先升高后降低的趋势,其中预处理12 d含量最低,说明预处理时间越长有机酸损失越大,这与预处理后期秸秆降解速率减慢,有机酸产生量低于微生物消耗量有关。

|
图 3 秸秆预处理体系挥发性有机酸的变化 Figure 3 Changes of VFAs antent of hydrolysate during straw pretreatment |
SS预处理体系中总有机酸含量出现两个峰值,分别是预处理第3 d(2.18 g·L-1)及第7 d(1.77 g·L-1),呈现出M型走势。SS水解产物以乙酸为主,占VFAs总量的72.4%~93.5%,预处理3 d浓度最高为1.89 g· L-1,预处理体系中未检测到丁酸。
NSS预处理体系VFAs总量在预处理第7 d达到最高,其中乙酸占比最大,但乙酸含量比SS预处理体系低23.1%~90.0%。由此可知,杂菌会影响MC1对大豆秸秆的降解速率及降解功能的稳定,并减少了预处理体系中VFAs的积累。与SS不同,NSS预处理体系中丁酸占VFAs总量的5.7%~20.7%,可能与秸秆自身携带的杂菌有关。
2.4 大豆秸秆厌氧发酵产气特征由于大豆秸秆减质量在预处理12 d最高,秸秆预处理体系VFAs产量在第3 d及第7 d达到最大,试验选用预处理3、7 d及12 d的预处理体系(分别记为d3、d7及d12)作为发酵底物,对大豆秸秆厌氧发酵性能进行评价。如图 4A、图 4B所示,预处理时间相同的情况下,经过23 d的发酵,SS预处理体系累积产气量均显著大于NSS(P < 0.05)。与未处理组(d0)相比,MC1 3 d预处理组累积产沼气量及累积产甲烷量分别提高了34.13%及36.86%(SS)、20.65%及34.27%(NSS),其中SS-d3预处理体系获得最大累积沼气产量(499.09 mL·g-1 VS)及累积甲烷产量(304.90 mL· g-1 VS)。由此可见,MC1预处理能有效提高秸秆的产气效率。
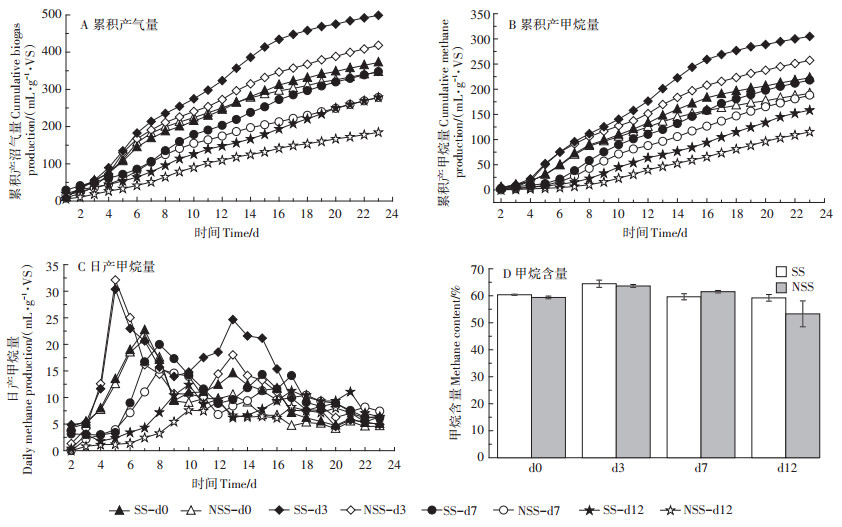
|
图 4 厌氧发酵产气结果 Figure 4 Biogas production during anerobic fermentation |
不同预处理体系日产甲烷量如图 4C所示。在厌氧发酵第5 d,MC1预处理体系SS-d3及NSS-d3日产甲烷量率先达到峰值,分别为30.37 mL·g-1 VS和32.12 mL·g-1 VS。未经MC1处理的对照组SS-d0和NSS-d0,在厌氧发酵第7 d达到峰值,分别为22.66 mL·g-1 VS及20.96 mL·g-1 VS,显著低于秸秆3 d预处理体系。由此可见,MC1预处理在提高大豆秸秆累积甲烷产量的同时,加快了甲烷转化进程。另外,12 d预处理体系日产甲烷量始终较低,可能是长时间预处理过程中VFAs大量损失及产甲烷菌可利用底物减少所致。图 4D为大豆秸秆厌氧发酵过程中平均甲烷含量,除了NSS-d12预处理体系外,其他预处理体系的甲烷含量与对照组没有显著差异(P > 0.05),均值为59.4%~64.4%。综上,MC1预处理3 d能有效提高大豆秸秆产甲烷性能。
2.5 产甲烷动力学分析表 2描述了大豆秸秆MC1预处理体系产甲烷动力学特性。Modified Gompertz模型较好地拟合了不同预处理体系的产甲烷特征(R2为0.991~0.999),大豆秸秆经MC1预处理后,其产气潜力提高了14.29%~ 73.67%(NSS-d12除外)。3 d预处理体系的最大产甲烷量(P)和最大产甲烷速率(Rm)数值最高,表明无论是否有杂菌的存在,复合菌系MC1都能有效提高大豆秸秆产甲烷率。但当预处理时间超过7 d后酸化体系产甲烷的延迟时间(λ)延长,且高于对照处理组。因此,本研究MC1预处理大豆秸秆的时间不宜超过3 d。
|
|
表 2 不同预处理体系大豆秸秆产甲烷动力学参数 Table 2 Kinetic parameters of pretreated soybean straw during AD process |
大豆秸秆富含木质纤维素,其结构致密复杂,在能源转化过程中效率较低。李家威等[23]以6种杂粮秸秆为原料进行产甲烷试验,发现大豆秸秆累积产气量最低。微生物预处理能够有效提高木质纤维素原料的产甲烷效率,但杂菌对主要功能菌的繁殖代谢具有一定的影响。经过12 d MC1预处理,灭菌及非灭菌大豆秸秆总质量分别减少了39.08%和34.29%,且SS半纤维素降解率低于NSS,预示MC1能够在非灭菌条件下保持生长优势,进而有效降解大豆秸秆。Hua等[24]的报道也证实了MC1在不灭菌的复杂环境中对秸秆具有较高的降解效率,而Yu等[14]的研究进一步发现MC1能够在非灭菌环境中促进玉米秸秆的半纤维素分解。
灭菌环境中MC1大豆秸秆预处理体系的有机酸产量呈现M型走势,乙酸含量最高且无丁酸产生,这与前人的研究结果较为一致[11, 24-25]。同时,本研究在非灭菌预处理体系中检测到了丁酸,进一步证实了秸秆水解过程中产生的有机酸种类、浓度与微生物种类、温度及有机物种类等因素相关[26-27]。Yan等[9]利用BYND-5预处理水稻秸秆发现水解液中丁酸含量最高,其次为丙酸和乙酸。Zhang等[28]利用高温复合菌群预处理木薯渣发现前36 h水解液中丁酸产量最高,随后乙酸浓度迅速增加。
大豆秸秆经MC1预处理3 d,灭菌和非灭菌预处理体系比未处理的对照组累积产甲烷量分别提高了36.86%和34.27%,表明MC1菌群预处理有效提高了大豆秸秆的产气效率。分析原因主要包括以下两点:一是菌群预处理增加了秸秆中纤维素成分的水解,提高了发酵体系VFAs含量和底物利用率;二是菌群预处理提高了厌氧发酵过程中产甲烷菌的活性,Zhao等[29]发现灭菌玉米秸秆经复合菌群预处理后,厌氧发酵过程中甲烷鬃毛菌的活性明显提高,该菌可直接利用乙酸生成甲烷。但增加预处理时间会降低产气效率,Yuan等[11]的研究证实延长预处理时间不利于有机酸积累及甲烷生产,并且工程实际应用中延长酸化时间也不利于厌氧发酵的高效运行[30]。
4 结论(1)MC1能有效降解大豆秸秆,对灭菌秸秆纤维素及木质素的降解量显著高于未灭菌秸秆(P < 0.05)。MC1预处理过程中,灭菌大豆秸秆预处理体系VFAs总量高于未灭菌大豆秸秆预处理体系,其中乙酸含量最高,占比72.4%以上。由于杂菌的影响,未灭菌大豆秸秆预处理体系VFAs累积速率减缓,乙酸组分占比减少,且有丁酸产生。
(2)灭菌大豆秸秆预处理体系累积产甲烷量显著高于未灭菌大豆秸秆预处理体系,随着MC1预处理时间增加,甲烷产量降低。经过3 d的微生物预处理作用,灭菌大豆秸秆预处理体系和未灭菌大豆秸秆预处理体系获得最高甲烷产量,分别为304.90 mL·g-1 VS及257.41 mL·g-1 VS,分别比未经处理的灭菌秸秆和非灭菌秸秆提高了36.86%和34.27%。
(3)产甲烷动力学分析表明大豆秸秆3 d预处理体系的最大甲烷产量和最大产甲烷速率均高于秸秆未处理对照组和其他秸秆预处理组,推荐MC1微生物菌群对大豆秸秆的最佳预处理时间为3 d。
| [1] |
Cabrera E, Muñoz M J, Martín R, et al. Comparison of industrially viable pretreatments to enhance soybean straw biodegradability[J]. Bioresource Technology, 2015, 194: 1-6. DOI:10.1016/j.biortech.2015.06.090 |
| [2] |
Xiong J D, Hassan M, Wang W X, et al. Methane enhancement by the co-digestion of soybean straw and farm wastewater under different thermo-chemical pretreatments[J]. Renewable Energy, 2020, 145: 116-123. DOI:10.1016/j.renene.2019.05.102 |
| [3] |
Amin F R, Khalid H, Zhang H, et al. Pretreatment methods of lignocellulosic biomass for anaerobic digestion[J]. Amb Express, 2017, 7(1): 72. DOI:10.1186/s13568-017-0375-4 |
| [4] |
Paudel S R, Banjara S P, Choi O K, et al. Pretreatment of agricultural biomass for anaerobic digestion:Current state and challenges[J]. Bioresource Technology, 2017, 245: 1194-1205. DOI:10.1016/j.biortech.2017.08.182 |
| [5] |
Himmel M E, Ding S Y, Johnson D K, et al. Biomass recalcitrance:Engineering plants and enzymes for biofuels production[J]. Science, 2007, 315(5813): 804-807. DOI:10.1126/science.1137016 |
| [6] |
Kataria R, Mol A, Schulten E, et al. Bench scale steam explosion pretreatment of acid impregnated elephant grass biomass and its impacts on biomass composition, structure and hydrolysis[J]. Industrial Crops and Products, 2017, 106: 48-58. DOI:10.1016/j.indcrop.2016.08.050 |
| [7] |
Dai X H, Hua Y, Dai L L, et al. Particle size reduction of rice straw enhances methane production under anaerobic digestion[J]. Bioresource Technology, 2019, 293: 122043. DOI:10.1016/j.biortech.2019.122043 |
| [8] |
Gu Y, Zhang Y L, Zhou X F. Effect of Ca(OH)2 pretreatment on extruded rice straw anaerobic digestion[J]. Bioresource Technology, 2015, 196: 116-122. DOI:10.1016/j.biortech.2015.07.004 |
| [9] |
Yan L, Gao Y M, Wang Y J, et al. Diversity of a mesophilic lignocellulolytic microbial consortium which is useful for enhancement of biogas production[J]. Bioresource Technology, 2012, 111: 49-54. DOI:10.1016/j.biortech.2012.01.173 |
| [10] |
Deng Y F, Dai B L, Xu J X, et al. Anaerobic co-digestion of rice straw and soybean straw to increase biogas production by pretreatment with Trichoderma reesei RUT C30[J]. Environmental Progress & Sustainable Energy, 2018, 37(3): 1050-1057. |
| [11] |
Yuan X F, Ma L, Wen B T, et al. Enhancing anaerobic digestion of cotton stalk by pretreatment with a microbial consortium(MC1)[J]. Bioresource Technology, 2016, 207: 293-301. DOI:10.1016/j.biortech.2016.02.037 |
| [12] |
Yuan X F, Cao Y Z, Li J J, et al. Effect of pretreatment by a microbial consortium on methane production of waste paper and cardboard[J]. Bioresource Technology, 2012, 118: 281-288. DOI:10.1016/j.biortech.2012.05.058 |
| [13] |
Wen B T, Yuan X F, Li Q X, et al. Comparison and evaluation of concurrent saccharification and anaerobic digestion of napier grass after pretreatment by three microbial consortia[J]. Bioresource Technology, 2015, 175: 102-111. DOI:10.1016/j.biortech.2014.10.043 |
| [14] |
Yu J D, Zhao Y, Liu B, et al. Accelerated acidification by inoculation with a microbial consortia in a complex open environment[J]. Bioresource Technology, 2016, 216: 294-301. DOI:10.1016/j.biortech.2016.05.093 |
| [15] |
黄开明, 赵立欣, 冯晶, 等. 复合微生物预处理玉米秸秆提高其厌氧消化产甲烷性能[J]. 农业工程学报, 2018, 34(16): 184-189. HUANG Kai-ming, ZHAO Li-xin, FENG Jing, et al. Pretreatment of corn stalk by composite microbial strain improving its methane production performance by anaerobic digestion[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(16): 184-189. |
| [16] |
Tapadia-Maheshwari S, Pore S, Engineer A, et al. Illustration of the microbial community selected by optimized process and nutritional parameters resulting in enhanced biomethanation of rice straw without thermo-chemical pretreatment[J]. Bioresource Technology, 2019, 289: 121639. DOI:10.1016/j.biortech.2019.121639 |
| [17] |
Kong X P, Du J, Ye X M, et al. Enhanced methane production from wheat straw with the assistance of lignocellulolytic microbial consortium TC-5[J]. Bioresource Technology, 2018, 263: 33-39. DOI:10.1016/j.biortech.2018.04.079 |
| [18] |
崔宗均, 李美丹, 朴哲, 等. 一组高效稳定纤维素分解菌复合系MC1的筛选及功能[J]. 环境科学, 2002, 23(3): 36-39. CUI Zong-jun, LI Mei-dan, PIAO Zhe, et al. Selection of a composite microbial system MC1 with efficient and stability cellulose degradation bacteria and its function[J]. Chinese Journal of Environmental Science, 2002, 23(3): 36-39. |
| [19] |
曹燕篆, 张建伟, 闫双堆. MC1对碱处理及未处理谷子秸秆的分解特性比较[J]. 山西农业大学学报(自然科学版), 2018, 38(9): 66-70. CAO Yan-zhuan, ZHANG Jian-wei, YAN Shuang-dui. The difference of degradation rate between alkali treated and untreated millet straw by the composite microbial system of MC1[J]. Journal of Shanxi Agricultural University, 2018, 38(9): 66-70. |
| [20] |
Chandra R, Takeuchi H, Hasegawa T, et al. Improving biodegradability and biogas production of wheat straw substrates using sodium hydroxide and hydrothermal pretreatments[J]. Energy, 2012, 43(1): 273-282. |
| [21] |
赵肖玲, 郑泽慧, 蔡亚凡, 等. 哈茨木霉和黑曲霉粗酶液预处理改善秸秆产甲烷性能[J]. 农业工程学报, 2018, 34(3): 219-226. ZHAO Xiao-ling, ZHENG Ze-hui, CAI Ya-fan, et al. Pretreatment by crude enzymatic liquid from Trichoderma harzianum and Aspergillus sp. improving methane production performance during anaerobic digestion of straw[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(3): 219-226. |
| [22] |
Nopharatana A, Pullammanappallil P C, Clarke W P. Kinetics and dynamic modelling of batch anaerobic digestion of municipal solid waste in a stirred reactor[J]. Waste Management, 2007, 27(5): 595-603. DOI:10.1016/j.wasman.2006.04.010 |
| [23] |
李家威, 赵一全, 王海鹏, 等. 不同杂粮作物秸秆厌氧发酵产气特性研究[J]. 中国沼气, 2018, 36(5): 47-53. LI Jia-wei, ZHAO Yi-quan, WANG Hai-peng, et al. Biogas production characteristics of various grain crop straw[J]. China Biogas, 2018, 36(5): 47-53. |
| [24] |
Hua B B, Dai J L, Liu B, et al. Pretreatment of non-sterile, rotted silage maize straw by the microbial community MC1 increases biogas production[J]. Bioresource Technology, 2016, 216: 699-705. DOI:10.1016/j.biortech.2016.06.001 |
| [25] |
Hua B B, Lv Y C, Wang J G, et al. Dynamic changes in the composite microbial system MC1 during and following its rapid degradation of lignocellulose[J]. Applied Biochemistry and Biotechnology, 2014, 172(2): 951-962. DOI:10.1007/s12010-013-0566-7 |
| [26] |
Kandylis P, Bekatorou A, Pissaridi K, et al. Acidogenesis of cellulosic hydrolysates for new generation biofuels[J]. Biomass and Bioenergy, 2016, 91: 210-216. DOI:10.1016/j.biombioe.2016.05.006 |
| [27] |
Yu Y, Park B, Hwang S. Co-digestion of lignocellulosics with glucose using thermophilic acidogens[J]. Biochemical Engineering Journal, 2004, 18(3): 225-229. DOI:10.1016/S1369-703X(03)00127-X |
| [28] |
Zhang Q H, He J, Tian M, et al. Enhancement of methane production from cassava residues by biological pretreatment using a constructed microbial consortium[J]. Bioresource Technology, 2011, 102(19): 8899-8906. DOI:10.1016/j.biortech.2011.06.061 |
| [29] |
Zhao Y Q, Xu C F, Ai S Q, et al. Biological pretreatment enhances the activity of functional microorganisms and the ability of methanogenesis during anaerobic digestion[J]. Bioresource Technology, 2019, 290: 121660. DOI:10.1016/j.biortech.2019.121660 |
| [30] |
Demirel B, Yenigün O. Two-phase anaerobic digestion processes:A review[J]. Journal of Chemical Technology & Biotechnology, 2002, 77(7): 743-755. |
 2020, Vol. 39
2020, Vol. 39