随着经济社会快速发展,人为释放到环境中的重金属量急剧增加,土壤重金属污染问题十分严峻[1-3]。据2014年公布的《全国土壤污染状况调查公报》 [4]显示,Cd污染已成为我国土壤最重要和最典型的重金属污染。因Cd对生物的严重危害而使其受到广泛关注[5]。植物修复技术被公认为是成本低且对环境无二次污染的友好型治理技术,其具有物理、化学修复技术不可比拟的优点:成本低、环保、经济,拥有广阔的市场前景[6]。
经典的超富集植物理论定义:在Cd污染条件下正常生长,地上部分Cd含量达到100 mg·kg-1 DW的临界值,富集系数(植物地上部金属元素含量/土壤金属元素含量)BCF>1且转运系数TF>1的植物为Cd的超富集植物[7]。植物体内重金属含量会随土壤重金属含量升高而增加,当土壤重金属浓度达到一定浓度时非超富集植物体内重金属含量也可能达到临界值,故富集系数是超富集植物筛选的关键标准之一。龙葵和少花龙葵均为1~2年生草本,都具有生物量大、无性繁殖、适于刈割的特点,对Cd具有较强耐性,是实施土壤重金属修复及棕地改造的优良选择[8-9]。
研究表明,Cd胁迫能够降低植物蒸腾速率,导致气孔关闭,抑制“钙信号”传递[10],影响光合速率[11],抑制植物叶片中叶绿素的生物合成,减少叶绿体数量,使基粒类囊体排列紊乱,影响植物的原初光化学反应和PSⅡ[11-13],从而引起植物体内一系列生理代谢过程紊乱[14],最终影响植物生长发育的整个生命过程[15-16];因此研究Cd对植物光合生理的影响十分重要。同时,由于植物种类、胁迫浓度和胁迫时间的差异,不同植物响应重金属胁迫的过程并不一致。此外,关于限制植物响应Cd胁迫的光合生理关键因素的原因尚不甚清楚。目前,同时围绕同科属龙葵和少花龙葵的Cd响应研究较少。鉴于此,本试验以龙葵和少花龙葵为研究材料,在水培条件下研究其生长、叶绿素含量、气体交换参数及叶绿素荧光参数等指标对不同浓度Cd胁迫的响应,探讨和比较两种龙葵对Cd胁迫的光合生理及叶绿素荧光特性的差异,以期为Cd污染土壤的修复植物选择提供科学依据。
1 材料与方法 1.1 试验材料研究发现龙葵(S. nigrum)在土壤Cd浓度为25 mg·kg-1时,地上部分茎、叶Cd含量分别为103、125 mg·kg-1,其生长不受Cd影响且对Cd具有超积累特性,是Cd的超富集植物[8];少花龙葵(S. americanum)在土壤Cd浓度为60 mg·kg-1时,地上部分茎、叶Cd含量高达215、251 mg·kg-1,但在高于此浓度时其气孔导度和蒸腾速率受到显著抑制,是潜在的Cd超富集植物[9]。故本试验选用两者为供试材料,同时进行相同水平的胁迫处理,供试种子购于园艺公司。
1.2 试验设计2018年3月用ω=0.5% NaClO溶液浸泡种子,消毒20 min后用蒸馏水冲洗干净,漂除瘪谷。消毒后的种子,每100粒均匀排列于垫有单层滤纸的直径为9 cm的培养皿中催芽,培养皿置于气候箱中,设置环境温度光照/黑暗为23 ℃/18 ℃,光照/黑暗时间为14 h/ 10 h,相对湿度55%~65%,根据培养皿失水情况适当补充蒸馏水,使种子经常处于湿润状态。待植株长出两片子叶时点播至装有完全Hoagland营养液的水培箱内(塑料盆钵6个,每盆4~6株),置于四川农业大学温室大棚中预培养5周,待植株长出四片真叶时进行间苗,每盆保留3株生长健壮一致、有足量白根的植株。预培养阶段,为保证植株每日营养,营养液每7 d更换1次,营养液连续通气防止烂根,每天用1 mol·L-1 HCl或者1 mol·L-1 NaOH调pH至6.2~6.3,经常补充塑料盆钵内由于蒸发和植物蒸腾造成的水分损失。
2018年5月在温室大棚内正式进行Cd胁迫试验。向水培箱中加入固体CdCl2·2.5H2O,使营养液中Cd浓度分别为20、80、320 µmol·L-1(分别记为T1、T2、T3),以不加Cd为对照CK。试验期间,白天均温(25.0±4.0)℃,夜间(18.0±2.0)℃;相对湿度白天为(50.2±10.3)%,夜间(55.1±6.2)%。营养液每隔3 d更换一次,保证Cd浓度不变,其他日常管理同预培养阶段一致。
1.3 分析测定方法 1.3.1 生长指标的测定Cd胁迫2周后,分别收取龙葵和少花龙葵在所有Cd浓度下的植物材料,每处理3次重复,混合取样。用游标卡尺测量主根长、株高并计算单株总叶片数。用蒸馏水将附着于收获植物表面的杂质洗净,然后将根浸入10 mmol·L-1 EDTA溶液中交换20 min以去除根系表面吸附的Cd,再用去离子水冲洗3次,最后用吸水纸将其表面水分吸干。将植物分为根、茎、叶3部分,在105 ℃烘箱内杀青30 min,然后在65 ℃下烘干至恒质量,称量并计算单株生物量。
1.3.2 气体交换参数的测定采用Li-6400型便携式光合作用测定仪(LICOR,Inc,USA)于Cd胁迫2周后的晴天上午9:00— 11:00测定植株顶端倒数第5片功能叶的净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)。测定时设定CO2浓度为350 μmol·mol-1,光照强度为1 000 μmol·m-2·s-1,温度28 ℃。为消除观测时间误差对光合测定造成的影响,熟练采取轮回交替的方式测定样本,对龙葵和少花龙葵的4个Cd处理组依次交替完成第一、第二和第三重复测定,每重复记录6个观测值,取其平均值作为测定值。
1.3.3 叶绿素含量的测定采用分光光度法测定龙葵和少花龙葵叶片的叶绿素a和叶绿素b含量,并计算叶绿素总量及叶绿素a/b。称取两种龙葵鲜叶各0.100 0 g,每处理3次重复,混合取样。用95%的乙醇和丙酮混合液(V/V=1: 2)浸泡过夜(避光、密封),提取液参照Arnon的方法[17]计算叶绿素含量,计算公式如下:
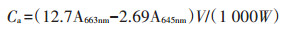
|

|
式中:Ca、Cb分别表示叶绿素a、叶绿素b的含量,mg· g-1 FW;V为提取液体积;W为样品鲜质量。
1.3.4 叶绿素荧光参数的测定用Li-6400型便携式光合作用测定仪(LI-COR,Inc,USA)荧光叶室测定各处理的叶绿素荧光参数。每个处理选择有代表性的植物幼苗6株,将功能叶充分暗适应30 min后测定初始荧光(Fo)、可变荧光(Fv)、最大荧光(Fm)、PSⅡ最大光能转换效率(Fv/ Fm)和PSⅡ潜在活性(Fv/Fo)。
1.4 数据处理采用SPSS 19.0软件对试验数据进行显著性及Pearson相关性分析,单因素方差分析(One-way ANO⁃ VA)进行不同Cd胁迫差异分析,Duncan法进行多重比较,显著性检验α=0.05,Excel 2007制表做图。
2 结果与分析 2.1 Cd胁迫对两种龙葵生长的影响研究发现在20 µmol·L-1 Cd胁迫时,龙葵叶片数目、株高及根长较CK略有增加,但差异不显著(P>0.05);而少花龙葵各项生长指标均显著降低(P<0.05)。随着Cd胁迫浓度增大,两种龙葵均出现叶片脱落、植株矮小、根长变短的情况,两种龙葵的各项生长指标均呈下降趋势。与CK相比,Cd胁迫下龙葵叶片数、株高、根长和生物量降低范围分别为10.38%~ 30.38%、13.59%~23.60%、9.94%~23.91%和45.22%~ 60.11%,而少花龙葵叶片数、株高、根长和生物量则分别降低22.43%~68.24%、17.55%~47.36%、16.46%~ 32.11%和56.90%~76.09%,龙葵各项生理指标降低范围显著小于少花龙葵(P<0.05)。
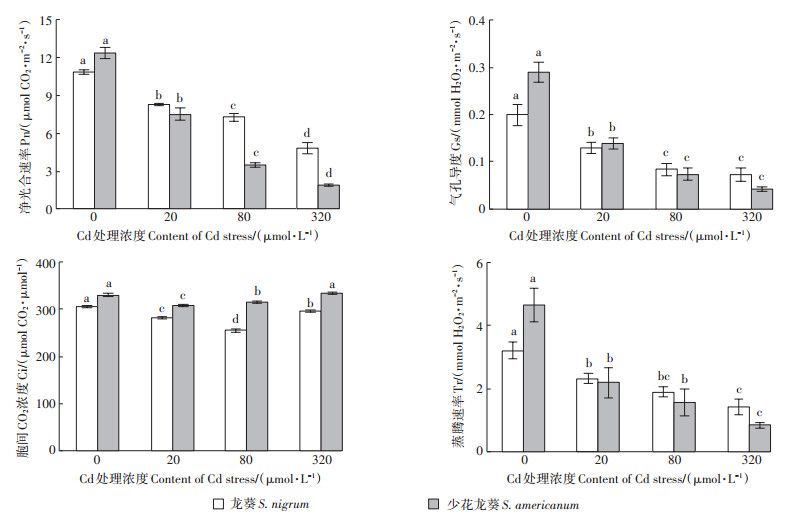
2.2 Cd胁迫对两种龙葵气体交换参数的影响与CK相比,随着Cd胁迫浓度的增加,龙葵和少花龙葵的Pn、Gs、Tr均呈下降趋势,且均显著低于各自CK(P<0.05);与CK相比,龙葵Pn值在20、80、320 μmol·L-1的Cd浓度下分别减少了23.73%、32.96%、55.49%,少花龙葵则分别减少了39.39%、71.99%、84.58%,少花龙葵下降幅度明显高于龙葵。在20 µmol·L-1 Cd浓度下,龙葵的Gs和Tr值与CK相比分别降低了35.59%和27.98%,少花龙葵降低了52.20%、53.08%。Cd胁迫下,两种龙葵的Ci与其他3组气体交换参数的变化不同,呈现先降后升的趋势,少花龙葵在20 μmol·L-1 Cd胁迫时Ci降低,在中高浓度Cd处理时(80、320 μmol·L-1)Ci升高,而龙葵仅在320 μmol·L-1 Cd处理时升高,且少花龙葵的Ci值始终高于龙葵;少花龙葵的Ci值对Cd胁迫较为敏感,Cd浓度为20 µmol·L-1时少花龙葵有最低Ci值,龙葵则在80 µmol·L-1时有最低Ci值(图 1)。
|
|
表 1 不同浓度Cd胁迫对龙葵和少花龙葵生长指标的影响 Table 1 Effects of different Cd content on growth indexes of S. nigrum and S. americanum |
|
图 1 不同浓度Cd胁迫对龙葵和少花龙葵气体交换参数的影响 Figure 1 Effects of different Cd stress on gas exchange parameters of S. nigrum and S. americanum |
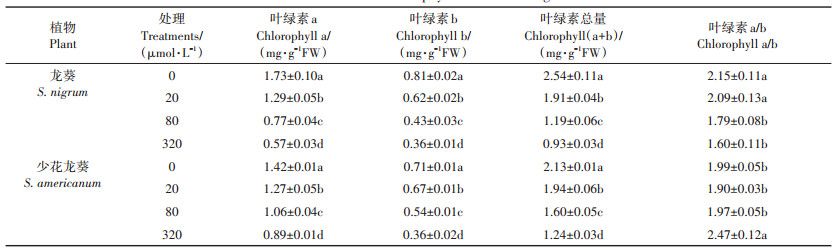
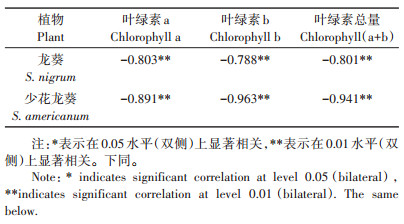
由表 2可知,随Cd胁迫浓度的增加,龙葵和少花龙葵叶片中叶绿素含量变化呈显著下降的趋势(P<0.05),且均在320 μmol·L-1处理有最低值。但龙葵和少花龙葵的叶绿素a/b值变化趋势不同,仅在Cd≥320 μmol·L-1时,少花龙葵的叶绿素a/b与CK相比有增加趋势(P<0.05)。Pearson相关性分析表明,两种龙葵的叶绿素a、叶绿素b及总叶绿素含量与Cd浓度均呈极显著负相关(P < 0.01,表 3),两者的叶绿素合成均受到严重抑制。
|
|
表 2 不同浓度Cd胁迫对龙葵和少花龙葵叶绿素含量的影响 Table 2 Effects of different Cd stress on chlorophyll content of S. nigrum and S. americanum |
|
|
表 3 龙葵和少花龙葵叶绿素含量与Cd浓度的Pearson相关性分析 Table 3 Pearson correlation between pigment content and Cd content in S. nigrum and S. americanum |
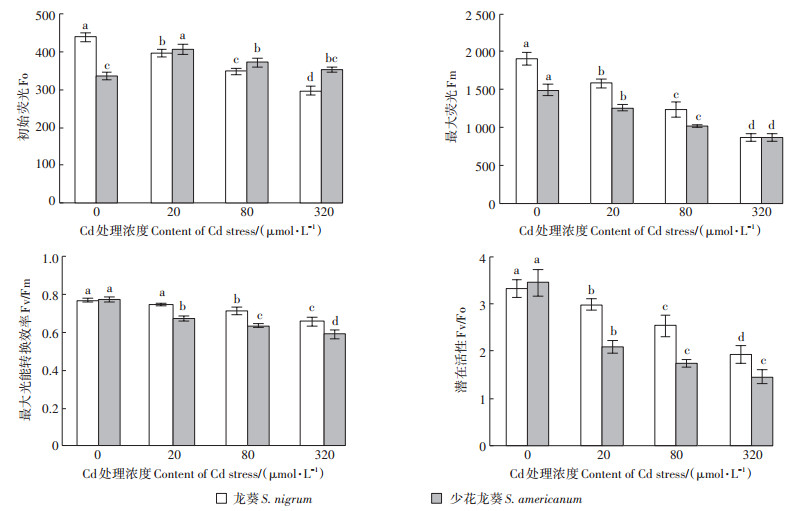
与CK相比,龙葵的Fo随Cd胁迫浓度的增加显著降低(P<0.05),而少花龙葵的Fo在Cd胁迫下均高于CK(图 2)。两种龙葵的Fm都随Cd浓度增加呈显著下降趋势(P<0.05)(图 2)。在Cd胁迫下,Fv/Fm、Fv/Fo与Fm变化趋势一致,均呈随Cd胁迫浓度增大而下降的趋势,且在同一Cd浓度下,龙葵的Fm、Fv/ Fm、Fv/Fo均高于少花龙葵(图 2)。此外,两种龙葵Fv/Fo的降低幅度均大于Fv/Fm。相关性分析(表 4)表明,龙葵的Fo、Fm、Fv/Fm及Fv/Fo之间都呈极显著正相关关系(P < 0.01),说明其在龙葵应对Cd胁迫中具有相同的适应性;而少花龙葵的Fo与Fm、Fv/Fm、Fv/Fo之间相关性不显著(P>0.05)。
|
图 2 不同浓度Cd胁迫对龙葵和少花龙葵叶绿素荧光参数的影响 Figure 2 Effects of different Cd content on chlorophyll fluorescence parameters of S. nigrum and S. americanum |
|
|
表 4 龙葵和少花龙葵叶绿素荧光参数间的相关性 Table 4 Correlation between chlorophyll fluorescence parameters of S. nigrum and S. americanum |
生物量是反映植物生长状况最直观的表现,Cd胁迫组与CK组生物量的比较可以一定程度反应植物对Cd的耐受性,超富集植物能耐受一定程度高浓度重金属胁迫且不表现明显毒害现象[7]。研究表明,不同浓度Cd胁迫(0、5、20 mg·L-1)对Cd超富集植物忍冬生物量的积累无显著影响[18],但高浓度Cd(Cd≥150 mg·kg-1)会抑制小报春的生物积累[3]。本试验中龙葵和少花龙葵的总生物量在Cd胁迫下均显著下降(P<0.05,表 1),物种和试验条件是造成差异的主要原因。同一胁迫浓度下Cd对少花龙葵生物量的抑制作用较龙葵更强,说明在生物量积累方面龙葵更耐受Cd胁迫。这可能是受根系活性的影响[19]:根系是植物最早接触土壤重金属污染的器官,重金属胁迫能影响植物的主根伸长和侧根发生,胁迫效果与重金属浓度和植物种类相关[20-21],如研究表明Cd胁迫会抑制小麦根细胞的分裂及伸长[22]。本研究中少花龙葵形态指标表明,在Cd浓度为20 μmol·L-1时其生长已经受到抑制,而此时龙葵生长较CK有所增加;Cd浓度为80、320 μmol·L-1时,两种龙葵均出现株高、根长降低的情况;Cd对龙葵和少花龙葵根系的毒害可能是主要原因。20 μmol·L-1 Cd对龙葵生长并未产生显著影响(P>0.05),表明龙葵对Cd的耐性强于少花龙葵。植物根长的降低将直接导致养分吸收不足,间接影响植物地上部的生长(表 1)。脱落酸(ABA)除促进叶片掉落外还能响应逆境胁迫,研究发现ABA的增加能够减轻Cd胁迫对胡杨的毒害[23];本试验中Cd胁迫导致两种龙葵都出现叶片大量脱落的情况,少花龙葵的叶片数目比龙葵下降幅度大(表 1),这可能是由于少花龙葵合成了更多的ABA以减轻Cd胁迫造成的伤害。在整个胁迫过程中,龙葵各形态指标受抑制情况均小于少花龙葵,说明在生长方面,龙葵对Cd胁迫的耐受强度高于少花龙葵。
3.2 Cd胁迫对龙葵和少花龙葵气体交换参数的影响一般认为,导致光合作用降低的因子包括气孔限制和非气孔限制,Ci的大小是评判气孔限制和非气孔限制的依据[24]。当Pn、Gs和Ci值三者同时降低时,光合作用受气孔限制影响;当叶片Pn的降低伴随着Ci值的升高,则可认为光合作用受非气孔限制的影响[3]。对不同植物的研究发现其限制因子并不一致:如Cd胁迫下富集植物小报春和黄麻的光合速率下降受非气孔限制[25];超富集植物圆叶锦葵的光合速率则受气孔和非气孔复合限制[1, 13]。本试验中,随Cd胁迫浓度的增加,龙葵和少花龙葵的Pn和Gs均呈降低趋势,Ci值则呈先降后升的趋势(图 1):说明20 μmol· L-1 Cd胁迫下Gs的降低是引起两种龙葵光合作用减弱的主要原因;随Cd胁迫浓度增大,Ci反而升高,这说明此时主要是非气孔因素(扩散限制或生化限制)阻碍光合[26],其限制部位可能主要位于叶肉细胞[24]。以上结果表明Cd胁迫对两种龙葵光合作用的限制因素与Cd胁迫浓度有关,是受气孔和非气孔复合限制;但唐星林等[27]认为Cd胁迫下非气孔限制是影响龙葵光合的主要因素,Cd浓度设置及胁迫时长可能是造成研究差异的主要原因。此外,Gs和Tr均与植物组织的水分状况有关,受气孔开闭的影响和制约。本试验中,不同浓度Cd胁迫后,两种龙葵的叶片Tr均减小,Gs、Pn与Tr表现出相同受抑制趋势,这说明水分可能是影响两种龙葵在Cd胁迫下叶Gs下降的主要原因,也可能是由于Cd引起叶片ABA水平增加而导致了气孔关闭[23]。即使在较低浓度(20 μmol·L-1)Cd胁迫下,少花龙葵的Gs和Tr的降幅也大于龙葵(图 1),说明少花龙葵在气体交换参数方面对Cd胁迫的反应较龙葵更敏感。
3.3 Cd胁迫对植物叶绿素和叶绿素荧光特性的影响叶绿素是植物进行光合作用的物质基础[13]。研究表明Cd胁迫会影响植物叶片中叶绿素的合成,并降低其含量[12]。研究表明多种超富集植物如东南景天[28]、天蓝遏蓝菜[29]等在Cd胁迫下均出现叶绿素合成受抑、叶绿素含量降低的情况。本试验中,两种龙葵的叶绿素a、叶绿素b、叶绿素总量均与Cd胁迫浓度呈极显著负相关(P<0.01)(表 3),这与对超富集植物圆锥南芥[30]和圆叶锦葵[15]的研究结果一致。Cd胁迫下植物叶绿素含量明显减少可能有两个原因:其一,由于Cd与叶绿体中多种酶的巯基(—SH)结合,导致叶绿体的结构和功能受到破坏,加速叶绿体解体,致使叶绿素降解[12]。其二,Cd胁迫抑制了第二信使Ca2+的非生物逆境信号转导[31];在外界环境胁迫刺激下,Ca2+积极响应胁迫信号,通过钙离子通道和钙载体蛋白的转运使胞质Ca2++浓度增加,以与钙调蛋白(CAM)结合的方式等将外界刺激转化为植物感知信号,启动下游蛋白质磷酸化或去磷酸化的响应,调节包括光合作用、光形态建成和氧化应激等系列生理过程;当逆境信号传导过程完成后,通过跨膜运输系统(如Ca2++- ATPase和Ca2++/H+反向传递体等)将胞质内过量的Ca2++排出或在贮Ca2++体中存储,以维持胞质Ca2++稳态[10, 32]。但由于Cd2+和Ca2++的相似性,Cd2+会与Ca2++竞争离子通道和载体蛋白[33],影响胞质Ca2++的输入输出,而植物胞质Ca2++浓度的改变是钙信使传导过程的中心环节,故Cd胁迫会阻碍Ca2++信号传递,影响氧化应激和叶绿素合成,从而影响光合;此外由于过量的Ca2++和Cd2+积累于胞质,渗透调节作用使得叶绿体等结构肿胀破裂而失去生理功能[34]。Woolhouse[35]认为,随着叶片的衰老,叶绿素a会比叶绿素b下降得更快,叶绿素a/b可作为叶片衰老的指标。本试验中,Cd胁迫下龙葵叶片中叶绿素a/b随Cd浓度增大逐渐降低,说明Cd胁迫加速了龙葵叶片的老化;少花龙葵在320 µmol· L-1 Cd处理时其叶绿素a / b值较CK显著提高(P<0.05),这可能是重金属破坏了少花龙葵叶绿体结构,说明少花龙葵叶片中叶绿素b对Cd胁迫更加敏感(表 2)。
叶绿素荧光参数是评价植物生理变化和光能利用的一种较好检测方法[10, 36]。Fo可以反映PSⅡ的受损程度,Fm则可反映电子的传递情况,Fv/Fm可以反映PSⅡ光能转换效率,Fv/Fo值反映PSⅡ捕获激发能的传能效率。研究发现,Cd胁迫下银牙柳Fv/Fm下降的主要原因是热耗散的增加和最大光能转换效率的降低,热耗散又将导致Fo的降低[37]。本试验中,龙葵的Fo随Cd浓度降低可能就是热耗散增加所致(图 2)。但植物体内光能过剩会使PSⅡ反应中心受到破坏,Fo反而升高,这可能是试验中少花龙葵Fo高于CK的原因;此外,少花龙葵叶绿素荧光参数间的相关性不显著也进一步表明其PSⅡ反应中心可能受到了破坏失活(表 4),这与Cd胁迫下苎麻[25]的研究结果一致。本研究中,Cd胁迫下龙葵和少花龙葵的Fv/Fo与Fv/Fm都显著下降,且Fv/Fo的下降幅度更大,这说明两者叶片PSⅡ的最大光化学效率和从天线色素到PS Ⅱ反应中心的传能效率均明显受到Cd胁迫的影响,且Cd胁迫对其传能效率的抑制更明显,这与高桂青等[38]对马来眼子菜的研究相似;Cd很有可能通过影响水裂解端的电子流而影响了PSⅡ的活性,从而导致光抑制现象。研究结果进一步说明,龙葵在应对Cd胁迫对光合作用伤害能力方面要优于少花龙葵。
4 结论(1)龙葵和少花龙葵对Cd的耐受性存在差异。Cd胁迫显著抑制两种龙葵形态生长、光合生理和叶绿素荧光指标,但是龙葵受抑制程度均小于少花龙葵。说明龙葵在光合生理和叶绿素荧光特性方面对Cd胁迫有更强的耐受性。
(2)受不同Cd浓度影响,两种龙葵光合作用的降低是气孔限制和非气孔限制综合作用的结果。
| [1] |
Wu M, Luo Q, Liu S, et al. Screening ornamental plants to identify potential Cd hyperaccumulators for bioremediation[J]. Ecotoxicology and Environmental Safety, 2018, 162: 35-41. DOI:10.1016/j.ecoenv.2018.06.049 |
| [2] |
赵胤, 龙月, 潘远智, 等. 蜀葵-胶质芽孢杆菌联合修复土壤镉污染[J]. 农业环境科学学报, 2020, 39(5): 1026-1033. ZHAO Yin, LONG Yue, PAN Yuan-zhi, et al. Remediation of cadmium contamination in soil by Althaea rosea-Bacillus mucilaginosus[J]. Journal of Agro-Environment Science, 2020, 39(5): 1026-1033. |
| [3] |
贾茵, 刘才磊, 兰晓悦, 等. 镉胁迫对小报春幼苗生长及生理特性的影响[J]. 西北植物学报, 2020, 40(3): 454-462. JIA Yin, LIU Cailei, LAN Xiao-yue, et al. Effects of cadmium stress on the growth and physiological characteristics of Primula forbesii seedlings[J]. Acta Botanica Boreali-Occidentalia Sinica, 2020, 40(3): 454-462. |
| [4] |
中华人民共和国环境保护部, 国土资源部.全国土壤污染状况调查公报[R].北京: 中华人民共和国环境保护部, 中华人民共和国国土资源部, 2014. Ministry of Environmental Protection of PRC, Ministry of Land and Resources of PRC. Bulletin of national survey on soil pollution[R].Beijing: Ministry of Environmental Protection of PRC, Ministry of Land and Resources of PRC, 2014. |
| [5] |
Carvalho M, Castro P, Azevedo R, et al. Hormesis in plants under Cd exposure:From toxic to beneficial element?[J]. Journal of Hazardous Materials, 2020, 384: 121434. DOI:10.1016/j.jhazmat.2019.121434 |
| [6] |
Ali H, Khan E, Sajad M. Phytoremediation of heavy metals-concepts and applications[J]. Chemosphere, 2013, 91(7): 869-881. DOI:10.1016/j.chemosphere.2013.01.075 |
| [7] |
Baker A, Brooks R, Pease A, et al. Studies on copper and cobalt tolerance in three closely related taxa within the genus Silene L.(Caryophyllaceae)from zaïre[J]. Plant and Soil, 1983, 73(3): 377-385. DOI:10.1007/BF02184314 |
| [8] |
魏树和, 周启星, 王新, 等. 一种新发现的镉超积累植物龙葵(Solanum nigrum L.)[J]. 科学通报, 2004, 49(24): 2568-2573. WEI Shuhe, ZHOU Qi-xing, WANG Xin, et al. A newly discovered cadmium hyperaccumulator Solanum nigrum L[J]. Chinese Science Bulletin, 2004, 49(24): 2568-2573. DOI:10.3321/j.issn:0023-074X.2004.24.013 |
| [9] |
Zhang X, Xia H, Zhuang P, et al. Identification of a new potential Cdhyperaccumulator Solanum photeinocarpum by soil seed bank-metal concentration gradient method[J]. Journal of Hazardous Materials, 2011, 189(1/2): 414-419. |
| [10] |
Wilkins K, Matthus E, Swarbreck S, et al. Calcium-mediated abiotic stress signaling in roots[J]. Frontiers in Plant Science, 2016, 7(8): 1296-1313. |
| [11] |
铁得祥, 胡红玲, 喻秀艳, 等. 桢楠幼树光合特性对镉胁迫的响应[J]. 生态学报, 2020, 40(11): 3738-3746. TIE De-xiang, HU Hong-ling, YU Xiu-yan, et al. Responses of photosynthetic characteristics and chlorophyll fluorescence parameters of Phoebe zhennan saplings to cadmium stress[J]. Acta Ecologica Sinica, 2020, 40(11): 3738-3746. |
| [12] |
张帆, 万雪琴, 翟晶. 镉处理下增施氮对杨树叶绿素合成和叶绿体超微结构的影响[J]. 核农学报, 2014, 28(3): 485-491. ZHANG Fan, WAN Xue-qin, ZHAI Jing. Effects of nitrogen supplement on chlorophyll synthesis and chloroplast ultrastructure of poplar plants under cadmium stress[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(3): 485-491. |
| [13] |
罗巧, 邬梦晞, 龙月, 等. 圆叶锦葵对Cd处理的光合生理响应及Cd富集特征[J]. 核农学报, 2019, 33(7): 1415-1422. LUO Qiao, WU Meng-xi, LONG Yue, et al. Changes in photosynthesis and Cd accumulation characteristic of Malva pusilla Smith under different concentrations of Cd[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(7): 1415-1422. |
| [14] |
Rui H, Chen C, Zhang X, et al. Cd-induced oxidative stress and lignification in the roots of two Vicia sativa L.varieties with different Cd tolerances[J]. Journal of Hazardous Materials, 2016, 301(1): 304-313. |
| [15] |
Wu M, Luo Q, Zhao Y, et al. Physiological and biochemical mechanisms preventing Cd toxicity in the new hyperaccumulator Abelmoschus manihot[J]. Journal of Plant Growth Regulation, 2018, 37(3): 709-718. DOI:10.1007/s00344-017-9765-8 |
| [16] |
顾翠花, 王懿祥, 白尚斌, 等. 四种园林植物对土壤镉污染的耐受性[J]. 生态学报, 2015, 35(8): 2536-2544. GU Cui-hua, WANG Yi-xiang, BAI Shang-bin, et al. Tolerance and accumulation of four ornamental species to contamination[J]. Acta Ecologica Sinica, 2015, 35(8): 2536-2544. |
| [17] |
Arnon D. Copper enzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris[J]. Plant Physiology, 1949, 24(1): 1-15. DOI:10.1104/pp.24.1.1 |
| [18] |
刘周莉, 何兴元, 陈玮. 忍冬——一种新发现的镉超富集植物[J]. 生态环境学报, 2013, 22(4): 666-670. LIU Zhou-li, HE Xingyuan, CHEN Wei. Lonicera japonica Thunb.:A newly discovered Cd hyper-accumulator[J]. Ecology and Enviromental Sciences, 2013, 22(4): 666-670. DOI:10.3969/j.issn.1674-5906.2013.04.020 |
| [19] |
刘俊, 廖柏寒, 周航, 等. 镉胁迫下大豆生长发育的生理生态特征[J]. 生态学报, 2010, 30(2): 333-340. LIU Jun, LIAO Bo-han, ZHOU Hang, et al. Main characteristics of physiological-ecological dynamics of soybean during the growth cycle under Cd stress[J]. Acta Ecologica Sinica, 2010, 30(2): 333-340. |
| [20] |
冯汉青, 杜变变, 王庆文, 等. 镉胁迫下活性炭对小麦幼根的保护作用[J]. 生态学报, 2016, 36(10): 2962-2968. FENG Han-qing, DU Bian-bian, WANG Qing-wen, et al. The role of activated carbon in protecting the roots of wheat seedlings under cadmium stress[J]. Acta Ecologica Sinica, 2016, 36(10): 2962-2968. |
| [21] |
刘媛, 马文超, 张雯, 等. 镉胁迫对秋华柳根系活力及其Ca, Mg, Mn, Zn, Fe积累的影响[J]. 应用生态学报, 2016, 27(4): 1109-1115. LIU Yuan, MA Wen-chao, ZHANG Wen, et al. Effect of cadmium stress on root vigor and accumulation of elements Ca, Mg, Mn, Zn, Fe in Salix variegate[J]. Chinese Journal of Applied Ecology, 2016, 27(4): 1109-1115. |
| [22] |
何俊瑜, 任艳芳, 王阳阳, 等. 不同耐性水稻幼苗根系对Cd胁迫的形态及生理响应[J]. 生态学报, 2011, 31(2): 522-528. HE Junyu, REN Yan-fang, WANG Yang-yang, et al. Root morphological and physiological responses of rice seedlings with different tolerance to cadmium stress[J]. Acta Ecologica Sinica, 2011, 31(2): 522-528. |
| [23] |
Han Y, Wang S, Zhao N, et al. Exogenous abscisic acid alleviates cadmium toxicity by restricting Cd2+ influx in Populus euphratica cells[J]. Journal of Plant Growth Regulation, 2016, 35(3): 827-837. DOI:10.1007/s00344-016-9585-2 |
| [24] |
高会玲, 刘金隆, 郑青松, 等. 外源油菜素内酯对镉胁迫下菊芋幼苗光合作用及镉富集的调控效应[J]. 生态学报, 2013, 33(6): 1935-1943. GAO Hui-ling, LIU Jin-long, ZHENG Qing-song, et al. Regulation of exogenous brassinosteroid on growth and photosynthesis of Helianthus tuberosus seedlings and cadmium biological enrichment under cadmium stress[J]. Acta Ecology Sinica, 2013, 33(6): 1935-1943. |
| [25] |
董袁媛, 孙竹, 杨洋, 等. 镉胁迫对黄麻光合作用及镉积累的影响[J]. 核农学报, 2017, 31(8): 1640-1646. DONG Yuan-yuan, SUN Zhu, YANG Yang, et al. Effect of cadmium of photosynthesis and Cd accumulation of Corchorus capsularis L[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(8): 1640-1646. |
| [26] |
简敏菲, 杨叶萍, 余厚平, 等. 不同浓度Cd2+胁迫对苎麻叶绿素及其光合荧光特性的影响[J]. 植物生理学报, 2015, 51(8): 1331-1338. JIAN Min-fei, YANG Ye-ping, YU Hou-ping, et al. Influences of different cadmium concentration stress on chlorophyll and its photosynthetic fluorescence characteristics of ramie (Boehmeria nivea)[J]. Plant Physiolology Journal, 2015, 51(8): 1331-1338. |
| [27] |
唐星林, 金洪平, 周晨, 等. 镉胁迫对龙葵叶绿素荧光和光合生化特性的影响[J]. 中南林业科技大学学报, 2019, 39(9): 102-108. TANG Xing-lin, JIN Hong-ping, ZHOU Chen, et al. Effects of cadmium stress on chlorophyll fluorescence and photosynthetic biochemical characteristics in leaves of Solanum nigrum[J]. Journal of Central South University of Forestry & Technology, 2019, 39(9): 102-108. |
| [28] |
Li T Q, QI T, Di Z Z, et al. Effect of elevated CO2 concentration on photosynthetic characteristics of hyperaccumulator Sedum alfredii under cadmium stress[J]. Journal of Integrative Plant Biology, 2015, 57(7): 653-660. DOI:10.1111/jipb.12307 |
| [29] |
Bayçu G, Gevrek K, Moustaka J, et al. Cadmium-zinc accumulation and photosystem Ⅱ responses of Noccaea caerulescens to Cd and Zn exposure[J]. Environmental Science and Pollution Research, 2017, 24(3): 2840-2850. DOI:10.1007/s11356-016-8048-4 |
| [30] |
于方明, 汤叶涛, 仇荣亮, 等. Cd胁迫下超富集植物圆锥南芥抗氧化机理[J]. 环境科学学报, 2010, 30(2): 409-414. YU Fang-ming, TANG Ye-tao, QIU Rong-liang, et al. Antioxidative responses to cadmium stress in the hyperaccumulator Arabis paniculata Franch[J]. Acta Scientiae Circumstantiae, 2010, 30(2): 409-414. |
| [31] |
Thor K. Calcium:Nutrient and messenger[J]. Frontiers in Plant Science, 2019, 10(4): 440-447. |
| [32] |
贾如, 雷梦琦, 徐佳妮, 等. 植物细胞中钙通道的分布及其在植物抗逆机制中作用的研究进展[J]. 植物生理学报, 2014, 50(12): 1791-1800. JIA Ru, LEI Meng-qi, XU Jia-ni, et al. Research progress of Ca2+ channel and the effect of Ca2+ on plant resistance mechanism in plant cells[J]. Plant Physiology Journal, 2014, 50(12): 1791-1800. |
| [33] |
Sarwar N, Malhi S, Zia M, et al. Role of mineral nutrition in minimizing cadmium accumulation by plants[J]. Journal of the Science of Food and Agriculture, 2010, 90(6): 925-937. DOI:10.1002/jsfa.3916 |
| [34] |
李春烨, 丁国华, 刘保东. 重金属影响植物细胞超微结构和功能的研究进展[J]. 中国农学通报, 2013, 29(18): 114-118. LI Chunhua, DING Guo-hua, LIU Bao-dong. Research progress of heavy metal affecting plant cell ultrastructure and function[J]. Chinese Agricultural Science Bulletin, 2013, 29(18): 114-118. DOI:10.11924/j.issn.1000-6850.2012-3332 |
| [35] |
Woolhouse N. Longevity and senescence in plants[J]. Science Progress, 1974, 61(241): 123-147. |
| [36] |
崔倩, 夏江宝, 刘京涛, 等. 生物炭和EM菌对黄河三角洲盐碱地田菁生长和光合特性的影响[J]. 应用生态学报, 2020, 31(9): 3101-3110. CUI Qian, XIA Jiang-bao, LIU Jing-tao, et al. Effects of biochar and EM application on growth and photosynthetic characteristics of Sesbania cannabina in saline-alkali soil of the Yellow River Delta, China[J]. Chinese Journal of Applied Ecology, 2020, 31(9): 3101-3110. |
| [37] |
钱永强, 周晓星, 韩蕾, 等. Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报, 2011, 31(20): 6134-6142. QIAN Yong-qiang, ZHOU Xiao-xing, HAN Lei, et al. Rapid light-response curves of PSⅡ chlorophyll fluorescence parameters in leaves of Salix leucoputhecia subjected to cadmium-ion[J]. Acta Ecologica Sinica, 2011, 31(20): 6134-6142. |
| [38] |
高桂青, 简敏菲, 卢龙, 等. Cu2+、Cd2+胁迫对马来眼子菜光合色素及光合荧光特性的影响[J]. 应用与环境生物学报, 2019, 25(3): 517-523. GAO Gui-qing, JIAN Min-fei, LU Long, et al. Effects of Cu2+ or Cd2+ stress on photosynthetic pigment and photosynthetic fluorescence characteristics of Potamogeton malaianus[J]. Chinese Journal of Applied and Environmental Biology, 2019, 25(3): 517-523. |
 2021, Vol. 40
2021, Vol. 40