2. 农业农村部农业生态与资源保护总站, 北京 100125;
3. 中国农业科学院农业环境与可持续发展研究所, 北京 100081
2. Rural Energy & Environment Agency, Ministry of Agriculture and Rural Affairs, Beijing 100125, China;
3. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences, Beijing 100081, China
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是指两个或两个以上的芳环构成的化合物,主要存在于大气、水体、土壤中,是环境中普遍存在的一类持久性有机污染物[1]。PAHs主要是由矿物燃料(如煤、石油、天然气等)、木材、纸张等碳氢化合物不完全燃烧或还原条件下热结形成的。由于多数PAHs有强的致癌性、致突变性以及致畸性,对全球环境和人类健康造成了极大的威胁[2]。苯并[a]芘(BaP)是一种具有5环结构的强致癌性PAHs,是需要优先控制的持久性污染物[3]。
常见的降解多环芳烃的方法有物理方法、化学方法以及生物方法。物理、化学法成本高,易产生二次污染[4]。利用生物法去除PAHs具有经济、安全、残留少等优势,被广泛应用[5]。由于低环PAHs分子结构简单、水溶性高,降解低环PAHs的微生物较多。而4环及4环以上的PAHs分子结构复杂、电子云密度高、热稳定性强、水溶性差,降解微生物较少。因此,获得能够降解PAHs的微生物是修复成功的前提。目前很多能够降解PAHs的微生物已经被分离出来,并用于土壤修复[6]。Zhu等[7]分离了一株能在7 d内降解76% BaP的菌株Brevibacillus brevis。但生物法降解PAHs过程受到PAHs的种类、微生物的降解能力和种类及环境条件等的影响。有研究发现,微生物菌群对土壤中总PAHs的降解效果高于单一菌株,对高环PAHs的效果更明显[8]。但是,到目前为止,对能降解高环PAHs的微生物菌群研究较少。
微生物修复从技术原理方面可分为生物刺激和生物强化两大类型[2]。生物刺激是通过添加营养物质等刺激土著微生物降解活性来修复污染的方法。生物强化是利用实验室分离的微生物或经污染物富集的微生物修复污染。Villaverde等[9]利用泥浆反应器修复芘污染的土壤,添加A. xylosoxidans后,芘的降解率提高了57.5%。Lu等[10]利用污染土壤富集的土著菌群修复PAHs污染的土壤,35 d后,土壤中16 PAHs的含量从95.23 mg·kg-1降低到23.41 mg·kg-1。
基于此,本试验富集了一个可以降解BaP的菌群,并对降解条件及其性能进行研究,为BaP的生物降解提供参考。
1 材料与方法 1.1 药品与试剂BaP(96%)、芘(97%)、萘(99%)、菲(97%)、荧蒽(98%)均购于Sigma Aldrich公司,其他试剂购于国药集团化学试剂有限公司。
配制5 g·L-1BaP的丙酮溶液,并用0.22 μm有机滤膜过滤除菌。
无机盐培养基:Na2SO(4 2.0 g·L-1)、NH4Cl(0.3 g· L-1)、CaCl(2 0.1 g·L-1)、KH2PO(4 2.0 g·L-1)、KCl(0.5 g· L-1)、NaCl(1.0 g·L-1)、MgCl2·6H2O(0.6 g·L-1),定容至1 000 mL,调节pH为7.0,并取100 mL分别装到250 mL锥形瓶内,封口,用121 ℃高压蒸汽灭菌20 min,备用。
菌群的富集[11]:使用微量注射器加入一定体积的Bap溶液,在超净工作台中挥发丙酮溶液。取5 g石油污染土壤添加到100 mL含有BaP(初始浓度为3 mg·L-1)的培养基,在30 ℃、180 r·min-1条件下培养。每2周取10 mL上清液于新鲜培养基(芘浓度增加3 mg·L-1)作为下一代菌群培养,连续富集10次,至培养基的BaP浓度为30 mg·L-1,并以此为储备菌液。
1.2 菌株对PAHs的降解试验将储备液按照10%的比例接种到含有BaP(初始浓度为30 mg·L-1)和80 mg·L-1酵母粉的50 mL无机盐培养液中,30 ℃、180 r·min-1下避光振荡培养10 d获得初始接种菌。无菌条件下,将初始菌悬液按照10%的比例接种到含有不同PAHs和80 mg·L-1酵母粉的10 mL无机盐培养液中,BaP、芘、荧蒽、菲的初始浓度分别为30、60、60、100 mg·L-1。培养条件同上。定时取样测定生物量和剩余PAHs含量。同时设灭活菌作对照,每个处理各3个重复。
1.3 生物量的测定在30 ℃、140 r·min-1条件下分别从反应体系中取4 mL菌液,用紫外分光光度计在600 nm处测量吸光度[12]。菌群的OD600采用下式计算:
菌群OD600=样品OD600-样品上清液OD600-样品BaP OD600
式中:样品OD600指所取菌液的OD600,样品上清液OD600指菌液在12 000 r·min-1离心2 min后上清液的OD600。
1.4 降解率的测定将全部培养液用等体积二氯甲烷振荡萃取3次,用玻璃注射器萃取液,通过0.45 μm滤膜过滤至进样瓶中。PAHs分析用Agilent-1200高效液相色谱仪测定[13],生物量用紫外检测器(G1314B)测定,测定过程柱温30 ℃,进样量10 μL,流速1 mL·min-1,流动相乙腈:水=9:1,参考《水质多环芳烃的测定液液萃取和固相萃取高效液相色谱法》(HJ 478—2009),分别采用菲、芘、荧蒽和BaP的检测波长251、240、232 nm和290 nm,外标法定量。
1.5 盐度、酵母粉和pH对降解的影响按照NaCl:MgCl2·6H2O为20:3配制不同盐度、酵母粉浓度和不同pH的培养基。灭菌后加BaP,使其初始浓度为30 mg·L-1。置于恒温振荡培养箱中振荡,待丙酮挥发完,按照10%的比例接种菌液,30 ℃避光振荡培养,15 d后测量BaP含量。
1.6 微生物群落结构分析使用MOBIO公司的PowerSoil® DNA Isolation Kit DNA试剂提取盒提取DNA,采用细菌通用引物515F和907R进行PCR扩增,采用Illumina MiSeq测序平台进行(上海美吉),并根据相关文献报道对测序结果进行统计和生物信息学分析[14]。
2 结果与讨论 2.1 菌群的富集和群落结构微生物降解PAHs主要集中在3~4环,5环PAHs极难降解且具有高毒性,因此对BaP降解的研究已经成为PAHs降解研究的热点。本研究通过富集的方法,获得了一个可以降解BaP的微生物菌群。将该菌群接种到30 mg·L-1 BaP的培养基中,研究其降解和生长情况(图 1)。菌群第3 d对BaP的降解率为7.3%,在第15 d达到最高值,为33.34%。在第15~18 d,该菌群对BaP的降解无明显变化,可能是中间产物积累,抑制了菌群的降解[15]。Zhu等[16]以BaP为唯一碳源和能源,从下水道沉积物中分离、筛选出4株BaP耐受菌株,其中一株Acinetobacter sp. Bap30能在20 d内将40 mg·L-1的BaP降解28.7%。从生长曲线可以看出,菌群在BaP存在时生长缓慢,在第12 d达到稳定期,可能是中间代谢产物或者产生的有机酸抑制了菌体生长[17]。
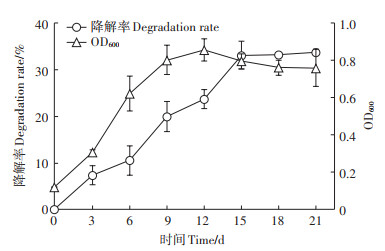
|
图 1 菌群对BaP的降解及菌群生长情况 Figure 1 Degradation of BaP and growth of the bacterial consortium |
高通量测序结果(图 2)表明,该菌群主要由Bacillus、Zobellella、Gordonia、Rheinheimera等组成,它们所占比例分别是79.74%、5.92%、8.62%、1.05%。许多细菌、真菌及藻类都具有降解多环芳烃的能力[1]。Zhu等[7]发现Brevibacillus可以在7 d降解76%的BaP,并产生1-萘酚和2-萘酚。Guevara等[18]分离了一株可以降解BaP的嗜热菌Bacillus licheniformis M2-7,该菌可以表达邻苯二酚双加氧酶。Zobellella可以降解PAHs[19],Gordonia可以降解芘、菲等[20],但到目前为止,还没发现Zobellella、Gordonia降解BaP的报道。截止到目前,共22株Rheinheimera被分离出来[21],但还没有该菌参与PAH降解的报道。在本研究中,Bacillus是主要降解BaP的菌属,Zobellella、Gordonia主要降解BaP的中间产物。

|
图 2 微生物菌群的群落结构 Figure 2 Bacterial community structure of the bacterial consortium |
PAHs是一类难降解污染物,分子量越大越难降解。共代谢是促进微生物降解PAHs的重要途径[17]。有研究发现,添加微量酵母粉可提高PAHs的生物可降解性[22]。将富集出来的菌群接种到含30 mg·L-1 BaP的培养基中,研究酵母粉对菌群降解BaP的影响。从图 3可以看出,在酵母提取物浓度小于80 mg· L-1的时候,BaP的降解率随着酵母提取物浓度上升而上升,可能是因为营养物质的增加提高了菌群的生物量,从而使得菌群对BaP的降解率提高;也可能是酵母提取物提供了甜菜碱等相容性溶质,提高了PAHs的生物可利用度[23]。当酵母浓度为100 mg·L-1时,菌群对BaP的降解率减少,可能是因为共代谢底物浓度过高,与目标污染物之间产生竞争抑制作用[24];或者酵母粉浓度过高抑制微生物合成降解PHAs的酶[25]。有研究发现乳糖浓度过高抑制蒽降解,主要是因为微生物过度利用乳糖[26]。
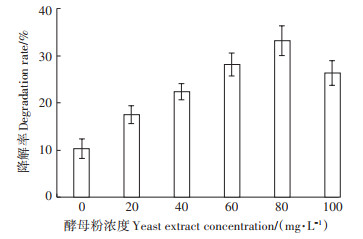
|
图 3 酵母粉对BaP降解的影响 Figure 3 Effect of yeast extract on the degradation by the bacterial consortium |
pH影响微生物的生长和酶活性,有研究发现,当pH大于9时,微生物的活性降低,使其生物修复效率明显降低[2]。为了确定该菌群降解BaP的最佳pH,本研究测定了不同pH下菌群15 d后的BaP降解率。由图 4可以看出,pH对于菌群的影响显著,菌群更适宜在pH=7的条件下生存,对BaP的降解率为32.28%,在pH大于7或小于7时,菌群对BaP的降解率有明显的下降趋势。总体来说,该菌群更适合于在碱性条件下生存,在pH=10的条件下菌群对于BaP的降解率只有15.82%,酸性条件下抑制效果更强,在pH=4时降解率只有9.09%。这可能是因为BaP降解会产生有机酸等中间产物,其在碱性环境中被中和,更利于微生物的生长和降解[17]。但是在强酸强碱环境中,pH会影响污染物的转运跨膜,菌群的降解功能受到严重抑制,影响BaP的降解。
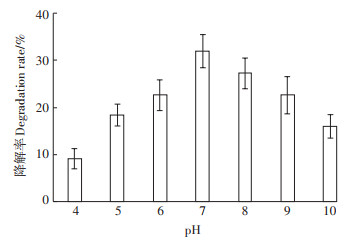
|
图 4 pH对微生物菌群降解BaP的影响 Figure 4 Effect of pH on the degradation by the bacterial consortium |
该菌群除能降解BaP外,还对其他的PAHs有不同的降解能力。本试验研究了菌群对不同PAHs降解广谱性,由于不同PAHs的毒性不同,本试验对不同PAHs设置了不同浓度,BaP初始浓度为30 mg·L-1,芘初始浓度为60 mg·L-1,荧蒽初始浓度为60 mg·L-1,菲初始浓度为100 mg·L-1。从图 5可以看出,该菌群对荧蒽的降解十分明显,降解率达到了99.8%。菌群对芘的降解效率达到了55.72%,但15 d后菲只降解了38.51%。一般情况下,PAHs的分子量越大,微生物越难降解。本研究中,该菌群对4环的PAHs降解效果最好,对荧蒽的降解达到99.8%,可能是萘羟基化双加氧酶的活性“口袋”(活性中心)更适合4环PAHs,BaP分子量过大,不利于底物和活性中心内的活性位点结合[27]。活性中心是柔性的凹状“口袋”,具有一定的大小和形状,和活性中心大小相近的PAHs才能进入,分子量过大和过小都会降低酶的催化效率[27-28]。王慧等[22]分离出的Thalassospira sp. strain TSL5-2,可以降解菲、芘、荧蒽(20 mg·L-1)、苯并蒽(初始质量浓度为8 mg·L-1),但不能降解苯并芘。本研究富集的微生物菌群,可以降解3~5环的PAHs,尤其对荧蒽的降解效果最好,适用于PAHs污染的修复。

|
图 5 微生物菌群对不同PAHs的降解 Figure 5 Degradation of different PAHs by microbial consortium |
盐度是影响PAHs降解能力的关键因素之一[29]。本试验研究了盐度对该菌群降解BaP的影响。从图 6可以看出,该菌群在1%~8%盐度下都能降解BaP,在对照和1%盐度下对BaP的降解效果十分明显,达到了33.10%。但是随着盐度的升高,该菌群对BaP的降解率逐渐降低,菌群的生物量也相应降低,MinaiTehran等[30]研究生物降解在石油污染土壤中的处理效果时发现,盐度控制在0~1%的范围内,盐度不会影响生物降解PAHs,但是当超过这一限度时,菌群对于PAHs的降解率随着盐度的升高而降低。生物量也随着盐度的升高而降低,高盐导致蛋白质变性、酶活性降低[31],也导致渗透压升高,破坏蛋白质结构,并引起代谢产物发生改变,诱导产生更多的渗透调剂物质,导致降解率下降[32]。
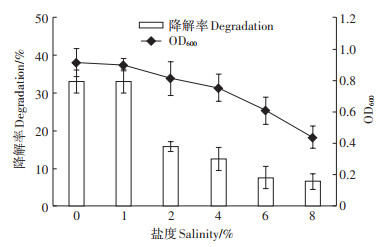
|
图 6 盐度对微生物降解BaP的影响 Figure 6 Effect of salinity on the degradation by the bacterial consortium |
本文以BaP为碳源在无机盐培养基中富集出来的降解菌群具有下列特性:
(1)该菌群主要由Bacillus、Zobellella、Gordonia、Rheinheimera等组成,其中Bacillus是主要的降解菌。
(2)在酵母提取物浓度为80 mg·L-1、pH=7、低盐度下该菌群对BaP的降解效果最好。
(3)该菌群可以降解多种PAHs,其中对荧蒽的降解效果最好。
| [1] |
Pino-Herrera D O, Pechaud Y, Huguenot D, et al. Removal mechanisms in aerobic slurry bioreactors for remediation of soils and sediments polluted with hydrophobic organic compounds:An overview[J]. Journal of Hazardous Materials, 2017, 339(Supplement C): 427-449. |
| [2] |
Vaidehi K, Kulkarni S D. Microbial remediation of polycyclic aromatic hydrocarbons:An overview[J]. Research Journal of Chemistry and Environment, 2012, 16(4): 200-212. |
| [3] |
Zhu F, Storey S, Ashaari M M, et al. Benzo(a) pyrene degradation and microbial community responses in composted soil[J]. Environmental Science and Pollution Research, 2016, 1-11. |
| [4] |
Kuppusamy S, Thavamani P, Venkateswarlu K, et al. Remediation approaches for polycyclic aromatic hydrocarbons(PAHs) contaminated soils:Technological constraints, emerging trends and future directions[J]. Chemosphere, 2017, 168: 944-968. DOI:10.1016/j.chemosphere.2016.10.115 |
| [5] |
Gupta G, Kumar V, Pal A K. Microbial degradation of high molecular weight polycyclic aromatic hydrocarbons with emphasis on pyrene[J]. Polycyclic Aromatic Compounds, 2017, 1-13. |
| [6] |
李岩, 李成, 张小雪, 等. 番茄秸秆固定化芽孢杆菌M1对3环PAHs污染老化土壤修复效果[J]. 农业资源与环境学报, 2019, 36(6): 806-813. LI Yan, LI Cheng, ZHANG Xiao-xue, et al. Remediation effects of 3-ring PAH-contaminated soil by immobilized Bacillus sp. M1 with tomato straw in coal mining area[J]. Journal of Agricultural Resources and Environment, 2019, 36(6): 806-813. |
| [7] |
Zhu Y, Chen K, Ding Y, et al. Metabolic and proteomic mechanism of benzo[a]pyrene degradation by Brevibacillus brevis[J]. Ecotoxicology and Environmental Safety, 2019, 172: 1-10. DOI:10.1016/j.ecoenv.2019.01.044 |
| [8] |
李政, 赵朝成, 张云波, 等. 16种EPA-PAHs复合污染土壤的菌群修复[J]. 中国石油大学学报(自然科学版), 2012, 36(1): 175-181. LI Zheng, ZHAO Chao-cheng, ZHANG Yun-bo, et al. Bioremediation of 16 EPA-PAHs combined contaminated-soil with microbial consortium[J]. Journal of China University of Petroleum, 2012, 36(1): 175-181. DOI:10.3969/j.issn.1673-5005.2012.01.032 |
| [9] |
Villaverde J, Láiz L, Lara-Moreno A, et al. Bioaugmentation of PAHcontaminated soils with novel specific degrader strains isolated from a contaminated industrial site. Effect of hydroxypropyl-β-cyclodextrin as PAH bioavailability enhancer[J]. Frontiers in Microbiology, 2019, 10: 2588. DOI:10.3389/fmicb.2019.02588 |
| [10] |
Lu C, Hong Y, Liu J, et al. A PAH-degrading bacterial community enriched with contaminated agricultural soil and its utility for microbial bioremediation[J]. Environmental Pollution, 2019, 251: 773-782. DOI:10.1016/j.envpol.2019.05.044 |
| [11] |
李康, 范文玉, 郭光, 等. 盐环境下降解菌群对芘的降解特性研究[J]. 环境污染与防治, 2018, 40(7): 755-759. LI Kang, FAN Wenyu, GUO Guang, et al. Degradation characteristics of pyrene by bacteria consortium in saline environment[J]. Environmental Pollution & Control, 2018, 40(7): 755-759. |
| [12] |
何芬, 王立华, 宁大亮, 等. 嗜盐菌群对菲的降解及萘双加氧酶基因的表达规律[J]. 中国环境科学, 2012(9): 1662-1669. HE Fen, WANG Li-hua, NING Da-liang, et al. Phenanthrene biodegradation and dynamic change of expression of naphthalene dioxygenase(ndo) genes in a halophilic bacteria consortium[J]. China Environmental Science, 2012(9): 1662-1669. DOI:10.3969/j.issn.1000-6923.2012.09.018 |
| [13] |
Tian F, Guo G, Ding K, et al. Effect of bioaugmentation by bacterial consortium and methyl-β-cyclodextrin on soil functional diversity and removal of polycyclic aromatic hydrocarbons[J]. Polycyclic Aromatic Compounds, 2019, 39(4): 353-362. DOI:10.1080/10406638.2017.1326952 |
| [14] |
Guo G, Li X, Tian F, et al. Azo dye decolorization by a halotolerant consortium under microaerophilic conditions[J]. Chemosphere, 2020, 244: 125510. DOI:10.1016/j.chemosphere.2019.125510 |
| [15] |
卫昆, 陈烁娜, 尹华, 等. 蜡状芽胞杆菌对芘的降解特性及降解酶研究[J]. 环境科学学报, 2016, 36(2): 506-512. WEI Kun, CHEN Shuo-na, YIN Hua, et al. The biodegradation characteristics of pyrene Bacillus cereus and its enzyme[J]. Acta Scientiae Circumstantiae, 2016, 36(2): 506-512. |
| [16] |
Zhu T T, Ni J R, Peng S H. Isolation, identification, and biodegradation characteristics of a benzo[a]pyrene-degrading bacterium Acinetobacter sp. Bap30[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2018, 54(1): 189-196. |
| [17] |
顾平, 周启星, 王鑫, 等. 一株土著B[J]. 农业环境科学学报, 2018, 37(5): 926-932. GU Ping, ZHOU Qi-xing, WANG Xin, et al. The screening-out and degradation character of an indigenous benzo[J]. Journal of Agro-Environment Science, 2018, 37(5): 926-932. |
| [18] |
Guevara L J, Alvarez F P, Ríos L E, et al. Biotransformation of benzo[a]pyrene by the thermophilic bacterium Bacillus licheniformis M2-7[J]. World Journal of Microbiology and Biotechnology, 2018, 34(7): 88. DOI:10.1007/s11274-018-2469-9 |
| [19] |
Lee D W, Lee H, Kwon B O, et al. Zobellella maritima sp. nov., a polycyclic aromatic hydrocarbon-degrading bacterium, isolated from beach sediment[J]. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(7): 2279-2284. DOI:10.1099/ijsem.0.002825 |
| [20] |
Sowani H, Kulkarni M, Zinjarde S. Harnessing the catabolic versatility of Gordonia species for detoxifying pollutants[J]. Biotechnology Advances, 2019, 37(3): 382-402. DOI:10.1016/j.biotechadv.2019.02.004 |
| [21] |
Yu Q, Qi Y, Zhang H, et al. Rheinheimera sediminis sp. nov., a marine bacterium isolated from coastal sediment[J]. International Journal of Systematic and Evolutionary Microbiology, 2019, 70(2): 1282-1287. |
| [22] |
王慧, 周海燕, 黄勇, 等. 一株高环多环芳烃降解嗜盐菌Thalassospira sp.的分离及降解特性[J]. 清华大学学报(自然科学版), 2015, 55(1): 87-92. WANG Hui, ZHOU Hai-yan, HUANG Yong, et al. Isolation and degradation characteristics of a HMW PAHs degrading halophilic strain Thalassospira sp.[J]. Journal Tsinghua Unibirsity (Sci and Technology), 2015, 55(1): 87-92. |
| [23] |
McGenity T J, Gramain A. Cultivation of halophilic hydrocarbon degraders[M]//Timmis K N. Handbook of hydrocarbon and lipid microbiology. Berlin: Springer Berlin Heidelberg, 2010: 3847-3854.
|
| [24] |
张银萍, 王芳, 杨兴伦, 等. 土壤中高环多环芳烃微生物降解的研究进展[J]. 微生物学通报, 2010(2): 280-288. ZHANG Yin-ping, WANG Fang, YANG Xing-lun, et al. Recent advances in biodegradation of high-molecular weight PAHs in soil[J]. Microbiology China, 2010(2): 280-288. |
| [25] |
Wong J W C, Lai K M, Wan C K, et al. Isolation and optimization of PAH-degradative bacteria from contaminated soil for PAHs bioremediation[J]. Water, Air, and Soil Pollution, 2002, 139(1): 1-13. |
| [26] |
Ye J S, Yin H, Qiang J, et al. Biodegradation of anthracene by Aspergillus fumigatus[J]. Journal of Hazardous Materials, 2011, 185(1): 174-181. DOI:10.1016/j.jhazmat.2010.09.015 |
| [27] |
Seo J, Kang S I, Kim M, et al. Flavonoids biotransformation by bacterial non-heme dioxygenases, biphenyl and naphthalene dioxygenase[J]. Applied Microbiology and Biotechnology, 2011, 91(2): 219-228. DOI:10.1007/s00253-011-3334-z |
| [28] |
Zhang C, Anderson A J. Multiplicity of genes for aromatic ring-hydroxylating dioxygenases in Mycobacterium isolate KMS and their regulation[J]. Biodegradation, 2012, 23(4): 585-596. DOI:10.1007/s10532-012-9535-z |
| [29] |
Wang C, Guo G, Huang Y, et al. Salt adaptation and evolutionary implication of a Nah-related PAHs dioxygenase cloned from a halophilic phenanthrene degrading consortium[J]. Scientific Reports, 2017, 7(1): 12525. DOI:10.1038/s41598-017-12979-z |
| [30] |
Minai-Tehrani D, Minoui S, Herfatmanesh A. Effect of salinity on biodegradation of polycyclic aromatic hydrocarbons(PAHs) of heavy crude oil in soil[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(2): 179-184. DOI:10.1007/s00128-008-9548-9 |
| [31] |
范瑞娟, 刘雅琴, 张琇. 嗜盐碱高环PAHs降解菌的分离及其降解特性研究[J]. 农业环境科学学报, 2019, 38(6): 1280-1287. FAN Rui-juan, LIU Ya-qin, ZHANG Xiu. Isolation and degradation characteristics of haloalkaliphilic high molecular-weight polycyclic aromatic hydrocarbon-degrading bacteria[J]. Journal of Agro-Environment Science, 2019, 38(6): 1280-1287. |
| [32] |
He H, Chen Y, Li X, et al. Influence of salinity on microorganisms in activated sludge processes:A review[J]. International Biodeterioration & Biodegradation, 2017, 119: 520-527. |
 2021, Vol. 40
2021, Vol. 40


