2. 成都理工大学地质灾害防治与地质环境保护国家重点实验室, 成都 610059
2. State Key Laboratory of Geohazard Prevention and Geoenvironment Protection, Chengdu University of Technology, Chengdu 610059, China
众所周知,过量的磷排入自然水体会导致水体富营养化[1]。目前,对水体中磷的去除方法主要有化学沉淀法、生物修复法和吸附法等[2]。其中,吸附法被认为是一种操作简单的高效除磷技术[3]。但吸附除磷后的吸附剂含有大量的磷和有机物等物质,若将其作为固体废物进行处理,将额外增加处理成本,因此亟需寻找一种资源化利用方式对吸附除磷后的废弃材料进行妥善处理。
生物炭是植物或动物生物质热解产物,具有表面积大、孔隙结构发达、阳离子交换能力强、官能团丰富[4]等特点。生物炭可与土壤发生交互作用,改善土壤理化性质和微生物生长条件以及保持土壤肥力,已被广泛研究应用于环境修复和土壤改良[5-7]。由于生物炭呈负电性且缺乏金属阳离子,导致其对磷酸盐阴离子的吸附能力有限[8-9]。近年来,将各种金属阳离子改性后的生物炭用于污水除磷,都表现出了良好的去除性能[10-11],但将吸附除磷后的改性生物炭作为土壤改良剂进行资源化利用却鲜有报道。本研究将吸附除磷后的载镁橘皮生物炭(KMg-BC/P)用于土壤改良试验,考察其对土壤理化性质、各种形态磷含量、微生物群落结构、酶活性以及植物生长的影响,以期为吸附除磷后吸附剂的资源化和无害化利用提供科学依据。
1 材料与方法 1.1 试验材料 1.1.1 试验试剂本试验所使用的氨水、乙二胺四乙酸二钠、无水乙醇、浓硫酸、抗坏血酸、酒石酸锑钾、钼酸铵、氟化钠、乙酸铵、氟化铵、柠檬酸钠、硼酸、高氯酸、硝酸、连二亚硫酸钠、四硼酸钠、氯化钠、甲苯、硫酸铝、苯酚等试剂均为分析纯。
1.1.2 试验土壤及植物试验土壤采自四川省成都市郊区某荒废农田的表层土(0~20 cm),将土壤样品自然风干研碎过100目筛后,按照《土壤农化分析》[12]中的方法测定其基础理化性质。
盆栽试验植物选用大豆,因其具有发芽快、养护简单、对磷元素敏感性强等特点。
1.2 试验方法 1.2.1 KMg-BC/P的获取首先,将橘皮切成约1 cm×1 cm的小块,用去离子水洗净烘干;然后准确称取10 g橘皮到250 mL锥形瓶中,并置于温度为25 ℃、转速为200 r·min-1的振荡器中,依次用100 mL质量分数2.5%的KOH溶液和100 mL 0.012 5 mol·L-1的MgCl2溶液对其进行2 h的浸渍改性;随后滤出置于烘箱中在60 ℃下烘干12 h;最后转入坩埚,置于马弗炉中,以10 ℃·min-1的速率升温至600 ℃恒温烧制2 h,冷却后研磨过80目筛制得碱活化载镁橘皮生物炭(KMg-BC)。然后将一定量的KMg-BC投加至体积为150 mL的血清瓶中,随后加入100 mL含磷废水(来源于磷化工企业经前期处理后的生产废水,其中主要污染物为磷和氨氮,含量分别约为1 000 mg·L-1和60 mg·L-1),将其放入温度为25 ℃、转速为200 r·min-1的水浴恒温振荡器中振荡1 h,反应结束后,滤出材料置于烘箱中在60 ℃下烘干12 h获得KMg-BC/P。
|
|
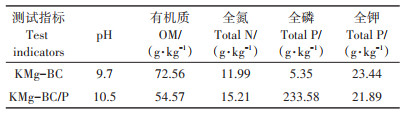
表 1 试验材料基本理化性质特征 Table 1 The basic properities of the experimental material |
采用直径12 cm、高12 cm聚乙烯塑料盆,每盆装土200 g,然后按照10 g·kg-1比例分别加入KMg-BC和KMg-BC/P并与土壤充分混合,保持土壤含水率于22%左右,随后按照每盆5颗大豆的播种量将培育发芽的大豆种入土壤。为方便同时研究KMg-BC/P改良土壤后对土壤和植物的影响,一共设置3个试验组,分别为土壤组(对照组)、土壤+KMg-BC组、土壤+ KMg-BC/P组,每组设置4个样盆,一个样盆对应一个培养时间。所有盆栽放于阳光充足的温室中进行培养,培养周期设置为60 d,每15 d收集相应培养时间样盆中土壤和植物的数据,所有试验设置3次重复。
1.3 分析方法土壤基本理化性质测定参考《土壤农化分析》[12],土壤中不同形态无机磷含量的测定采用顾益初等[13]提出的石灰性土壤无机磷分级方法,土壤中不同活性有机磷含量的测定参照Bowman-Cole法[14],土壤微生物数量测定采用梯度稀释平板涂布法[15],土壤酶活性测定参照关松荫等[16]的方法。
1.4 数据处理数据处理采用Microsoft Excel 2010软件,采用Origin 8.5软件进行绘图,采用SPSS 11.5统计分析软件对数据进行差异显著性检验。
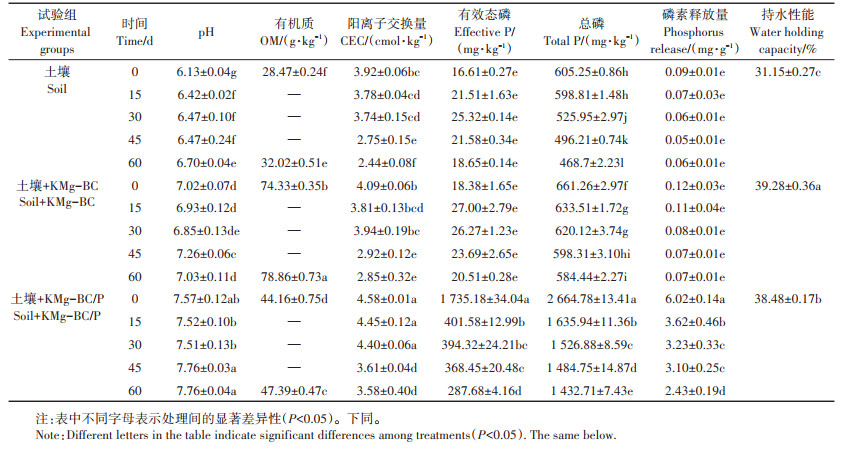
2 结果与讨论 2.1 KMg-BC/P对土壤理化性质的影响由表 2可得,加入KMg-BC和KMg-BC/P后土壤的pH、有机质含量、阳离子交换量、有效磷含量、总磷含量、磷素释放量以及持水能力显著增加;且随培养时间的增加3个试验组土壤的阳离子交换量、有效磷、总磷和磷素释放量呈不断减小的趋势,这可能是在没有外来离子补充的情况下,大豆植株不断消耗土壤中养分所致。土壤pH常被看作土壤的主要变量,由表 2可知,KMg-BC和KMg-BC/P的加入将土壤由弱酸性调节到中性和弱碱性,改善了土壤pH值状况,这与Zhao等[17]研究结果一致。因为KMg-BC和KMgBC/P本身碱性较强,并且还可以通过提高土壤碱基饱和、降低可交换铝水平和消耗土壤质子等作用提高土壤pH值。土壤阳离子交换量的大小是评价土壤保肥能力、改良土壤和合理施肥的重要依据[15],加入KMg-BC和KMg-BC/P改善了土壤可变电荷状况,增加了土壤的阳离子交换量,主要是因为生物炭本身具有负电荷表面和一定的阴离子官能团[16];而KMg-BC/ P不仅具有生物炭带负电的特点,且还含有大量的磷酸盐,其会在土壤中释放出大量的含磷阴离子,使得土壤胶体吸附各种阳离子的总量增大[18-20]。土壤磷是植物生长不可缺少的营养元素,由表 2可看出,加入KMg-BC后土壤的有效磷、总磷和磷素释放量略有增加,与未添加物质的土壤相比分别增加了10.66%、9.25%和33.33%,主要是由于制备的KMg-BC有大量的可溶性磷酸盐残留且KMg-BC稳定的理化性质及强的抗分解、抗氧化能力保证了长效的磷素供应,因此向土壤中添加KMg-BC必然会造成磷素的累积,提升土壤磷素的释放能力[21];而加入KMg-BC/P后土壤总磷、有效磷和磷素释放量增加幅度较大,与未添加物质的土壤相比分别增加了10 346.59%、340.28%和6 588.89%,这主要是因为KMg-BC/P不仅具有KMgBC的特性,同时还吸附了废水中大量磷酸盐,将其施入土壤会比KMg-BC更加显著地增加土壤磷素的累积和提升磷素释放能力。KMg-BC和KMg-BC/P加入土壤有效地提高了土壤有机质含量和持水能力,这与张旭辉等[22]研究结果一致。因为KMg-BC和KMgBC/P本身含有一定量的有机质,且具有丰富的孔隙。
|
|
表 2 不同处理对土壤理化性质的影响 Table 2 Effects of different treatments on soil physical and chemical properties |
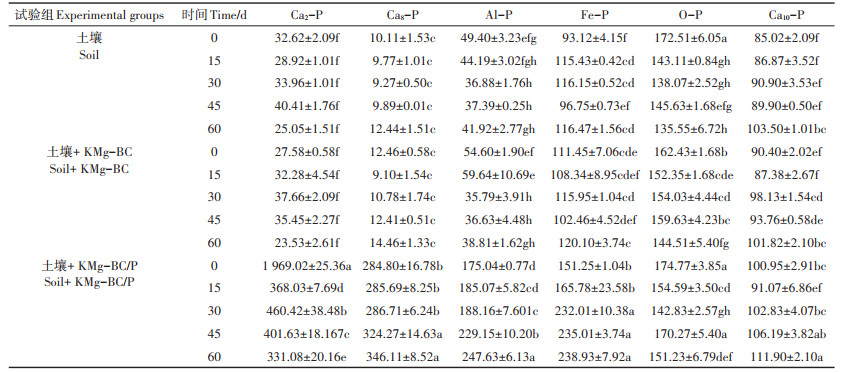
由表 3可知,向土壤中添加KMg-BC后,在60 d的培养期内,土壤中各形态无机磷含量变化不大,即KMg-BC的添加并未显著增加土壤中各种无机磷的含量,也未显著促进各形态无机磷的相互转化,这可能是由于添加生物炭量较少且培养时间较短。向土壤中添加KMg-BC/P培养60 d后,土壤中的Ca2-P、Ca8-P、Al-P和Fe-P含量都有显著提高,分别是自然土壤的13.22、27.82、5.91倍和2.05倍,是添加KMgBC后土壤的14.07、23.94、6.38倍和1.99倍,这主要是由于KMg-BC/P中吸附了大量的磷,与土壤进行混合后KMg-BC/P中吸附的磷大量释放进入土壤并在较短时间内快速转化成了Ca2-P、Ca8-P、Al-P和Fe-P,从而显著增加了土壤中高效磷源(Ca2-P)和缓效磷源(Ca8-P、Al-P和Fe-P)的含量。而添加KMg-BC/P培养60 d后,土壤中的O-P和Ca10-P的含量与其他两组相比未发生明显的变化,这可能是由于各种活性磷被植物快速吸收,且培养时间较短,其他形态的磷未转化成稳定的O-P和Ca10-P。添加KMg-BC/P的土壤在0~60 d培养过程中高活性的Ca2-P含量有逐渐降低的趋势,而Ca8-P、Fe-P和Al-P的含量都有逐渐升高的趋势,这是因为高活性的Ca2-P在培养过程中会逐渐转化成相对稳定的Ca8-P、Fe-P和Al-P。
|
|
表 3 不同处理对土壤理化性质的影响 (mg·kg-1) Table 3 Effects of different treatments on soil physical and chemical properties (mg·kg-1) |
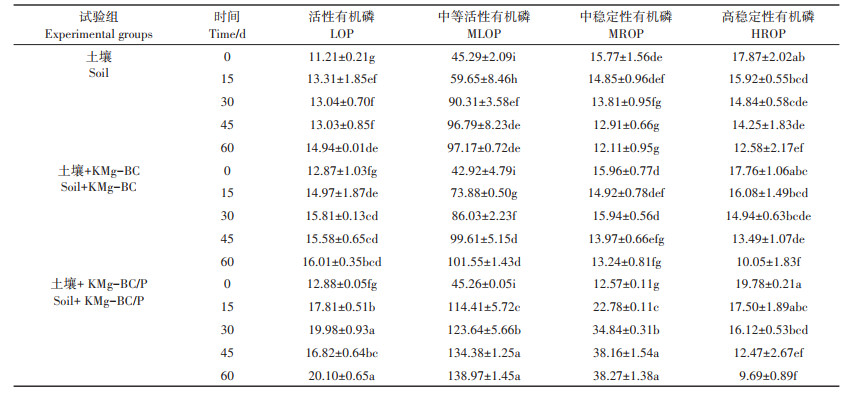
由表 4可知,随着培养时间的增加,3个试验组的活性有机磷(LOP)和中等活性有机磷(MLOP)含量均有一定增加,而高稳定性有机磷(HROP)有一定减少。与起始时间相比,培养60 d后,土壤组、土壤+ KMg-BC组和土壤+KMg-BC/P组中的LOP分别增加了33.27%、24.40%和56.06%,MLOP分别增加了114.55%、136.60%和207.05%,HROP分别减少了29.60%、43.41%和51.01%。这是由于植物中的磷主要以酯类或焦磷酸盐等有机形态存在,而这些形态的磷素是LOP的主要组分,在低温热解炭化过程中植物体内的磷素形态不易发生变化,因此添加KMg-BC和KMg-BC/P可直接提高土壤中LOP含量;KMg-BC和KMg-BC/P中含有丰富的钙、镁元素,其在土壤中以盐基离子的形态存在,它们会与腐植酸络合进而促进MLOP的积累[21]。此外随着培养时间的增加,土壤微生物数量增加、大豆根系生长以及磷酸酶活性增强,矿化作用加强,进而将稳定的HROP转化为活性更高的LOP和MLOP[23-24],以供大豆幼苗和微生物生长所需。加入KMg-BC/P后,土壤中LOP和MLOP的含量大于其他两组,这可能是因为KMg-BC/P本身含有的大量无机磷可以部分转化为LOP和MLOP[25]。加入KMg-BC和KMg-BC/P后的土壤HROP减少量大于未添加材料的土壤,这主要是由于KMg-BC和KMg-BC/ P能促进微生物和植物根系的生长从而加强对HROP的矿化作用。在培养时间内,土壤组和土壤+KMgBC组的中稳定性有机磷(MROP)含量呈减少趋势,这可能是因为两对照组中土壤微生物和大豆根系的矿化作用会使MROP不断转化为活性较强的有机磷[21]。而土壤+KMg-BC/P组MROP含量逐渐增加,主要是由于添加KMg-BC/P的土壤中无机磷转化成MROP的速率大于土壤微生物和大豆根系对MROP的矿化作用,从而造成MROP的累积。
|
|
表 4 各处理土壤不同形态有机磷含量(mg·kg-1) Table 4 Variation of soil organic phosphorus fraction contents in each treatment(mg·kg-1) |
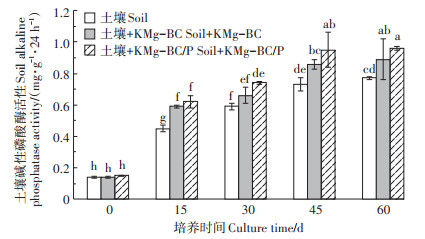
土壤碱性磷酸酶活性的强弱一定程度上反应了土壤磷素状况的好坏[26]。如图 1所示,KMg-BC/P的加入可有效提高土壤碱性磷酸酶活性。3个试验组中碱性磷酸酶活性随着培养时间的增加而不断增强,主要是因为随着培养时间的增加,土壤微生物和大豆根系不断生长,进而产生了大量的碱性磷酸酶[24]。土壤+KMg-BC/P和土壤+KMg-BC组碱性磷酸酶活性显著强于土壤组,这可能是由于KMg-BC和KMg-BC/P施入土壤进一步改善了土壤微生物生存环境,提高了土壤微生物数量,从而使得碱性磷酸酶的活性不断增加[27-29]。
|
不同小写字母表示处理间差异显著(P < 0.05) Different lowercase letters indicate significant differences among treatments(P < 0.05) 图 1 各处理土壤中碱性磷酸酶活性的变化 Figure 1 Effects of different treatments on soil alkaline phosphatase activity |
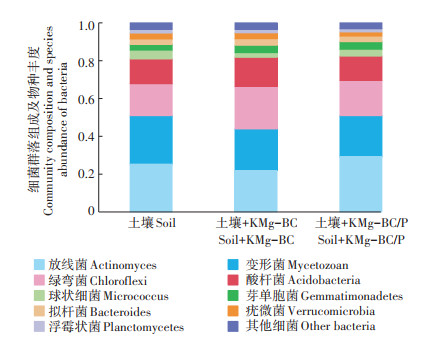
如图 2所示,培养60 d后3个试验组土壤中细菌和真菌数量有一定变化。与土壤组相比,土壤+KMgBC/P和土壤+KMg-BC组中细菌分别增加了6.93%和13.47%;对真菌而言,土壤+ KMg - BC /P组减少了8.41%,土壤+KMg-BC组增加了5.07%。结果表明,加入KMg-BC能同时促进土壤中细菌和真菌的生长繁殖;而加入KMg-BC/P虽能促进土壤细菌的生长繁殖,但却会抑制真菌的生长繁殖,这主要是因为KMg-BC/P本身碱性略强,加入土壤后将土壤pH调节成了弱碱性,在一定程度上抑制了真菌的生长繁殖,从而使土壤微生物的群落结构向以细菌为主的方向转变[30]。培养60 d后3个试验组土壤细菌的群落组成及物种丰度如图 3所示。3个试验组中细菌以放线菌、变形菌、绿弯菌、酸杆菌为主,其他细菌所占比例较少,即3个试验组细菌种类没有明显变化。但结合土壤中各种细菌丰度分析发现,加入KMg-BC后各细菌所占比例未发生明显变化,而加入KMg-BC/P后放线菌的丰度明显增大,主要是由于KMg-BC/P提供了大量的无机养分,促进了放线菌的生长繁殖[31]。培养60 d后3个试验组土壤中真菌的群落组成及物种丰度如图 4所示。3个试验组中,真菌以子囊菌为主,其他真菌所占比例较少,这可能是因为子囊菌门中部分真菌能促进大豆根系生长[32];3个试验组真菌多样性差别较大,加入KMg-BC后真菌的数量和部分真菌(担子菌、毛霉菌等)的丰度增加,主要是由于生物炭能促进真菌的生长繁殖[31];加入KMg-BC/P后土壤中真菌的多样性和除子囊菌外其他种类真菌丰度降低,这可能是因为KMg-BC/P改良土壤后的弱碱性土壤环境不适合除子囊菌外其他真菌的生长。

|
图 2 培养60 d后土壤微生物的数量变化 Figure 2 Changes in the number of soil microorganisms after culture for 60 days |
|
图 3 培养60 d后土壤细菌的群落组成及物种丰度 Figure 3 Community composition and species abundance of soil bacteria after culture for 60 days |

|
图 4 培养60 d后土壤真菌的群落组成及物种丰度 Figure 4 Community composition and species abundance of soil fungi after culture for 60 days |
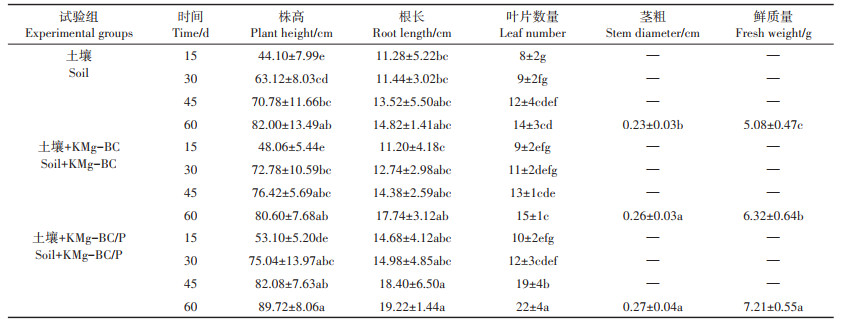
不同试验组中大豆的发芽率如图 5所示。3个试验组每个盆栽均播种5颗大豆种子,经培育7 d后观察发现,土壤组、土壤+KMg-BC组和土壤+KMg-BC/P组的平均发芽率分别为80.00%、93.33%和100.00%,表明KMg-BC和KMg-BC/P可有效促进大豆种子的发芽。由表 5可知,3个试验组中大豆的植株高度、根长、叶片数均随着培养时间的增加而不断增加,培养60 d后不同处理中以KMg-BC/P处理组大豆的生长状况最佳,与土壤组相比,株高增加9.41%、根长增加29.69%、叶片数增加57.14%、径粗增加17.39%、鲜质量增加41.93%;与土壤+KMg-BC组相比,株高增加11.32%、根长增加8.34%、叶片数增加46.67%、径粗增加3.85%、鲜质量增加14.08%。由此可见,KMg-BC/P的加入可有效促进大豆的生长,这主要是由于KMgBC/P上吸附了废水中大量的磷元素,将其施入土壤显著提高了土壤中Ca2-P、Ca8-P和Al-P等活性较强的无机磷含量,同时KMg-BC/P还促进了高稳定有机磷和中稳定有机磷转化为活性有机磷和中活性有机磷,从而增加了土壤中可被作物直接利用的营养元素的含量。此外KMg-BC/P还具有很大的内表面积,为养分吸附、保持水分和微生物群落生存提供了较大空间,从而改善了土壤理化性状和微生物群落、土壤酶活性等环境条件,促进了作物的生长[33]。

|
a-土壤组(a-1、a-2和a-3互为平行样,b、c组同理);b-土壤+KMg-BC组;c-土壤+KMg-BC/P组 a-soil (a-1, a-2 and a-3 are parallel samples, and the same is true for group b and c); b-soil+KMg-BC; c-soil+KMg-BC/P 图 5 不同试验组中大豆的发芽率 Figure 5 Germination rate of soybean in different experimental groups |
|
|
表 5 不同处理对大豆生长的影响 Table 5 Effects of different treatments on soybean growth |
(1)KMg-BC/P改良土壤能提高土壤的pH值、有机质含量、阳离子交换量、有效磷含量、总磷含量、磷素的释放量以及持水性能;同时显著增加土壤中高效磷源和缓效磷源的含量,提高土壤碱性磷酸酶活性,促进无机磷和低活性有机磷向高活性有机磷转化;此外,其还能促进土壤中细菌的生长繁殖,降低真菌的多样性,使土壤微生物群落向以细菌为主的方向转变。
(2)在盆栽试验中,用KMg-BC/P改良过的土壤种植大豆能显著促进大豆的生长,使大豆的发芽率、植株高度、根长、叶片数量、大豆植株鲜质量和茎粗均优于对照组。因此,KMg-BC/P具有作为土壤改良剂的潜力。
| [1] |
林建伟, 王虹, 詹艳慧, 等. 氢氧化镧-天然沸石复合材料对水中低浓度磷酸盐的吸附作用[J]. 环境科学, 2016, 37(1): 208-219. LIN Jian-wei, WANG Hong, ZHAN Yan-hui, et al. Adsorption of phosphate by lanthanum hydroxide/natural zeolite composites from low concentration phosphate solution[J]. Environmental Science, 2016, 37(1): 208-219. |
| [2] |
Rittmann B E, Mayer B, Westerhoff P, et al. Capturing the lost phosphorus[J]. Chemosphere, 2011, 84(6): 846-853. DOI:10.1016/j.chemosphere.2011.02.001 |
| [3] |
Haghseresht F, Wang S B, Dod D. A novel lanthanum-modified bentonite, phoslock, for phosphate removal from wastewaters[J]. Applied Clay Science, 2009, 46(4): 369-375. DOI:10.1016/j.clay.2009.09.009 |
| [4] |
Mukherjee A, Zimmerman A R, Harris W G. Surface chemistry variations among a series of laboratory-produced biochars[J]. Geoderma, 2011, 163: 247-255. DOI:10.1016/j.geoderma.2011.04.021 |
| [5] |
Uchimiya M, Lima I M, Klasson K T, et al. Contaminant immobilization and nutrient release by biochar soil amendment:Roles of natural organic matter[J]. Chemosphere, 2010, 80: 935. DOI:10.1016/j.chemosphere.2010.05.020 |
| [6] |
Yao Y, Gao B, Inyang M, et al. Biochar derived from anaerobically digested sugar beet tailings:characterization and phosphate removal potential[J]. Bioresour Technol, 2011, 102: 6273-6278. DOI:10.1016/j.biortech.2011.03.006 |
| [7] |
Yao Y, Gao B, Zhang M, et al. Effect of biochar amendmenton sorption and leaching of nitrate, ammonium, and phosphate in a sandy soil[J]. Chemosphere, 2012, 89: 1467-1471. DOI:10.1016/j.chemosphere.2012.06.002 |
| [8] |
Chen B, Chen Z, Lv S. A novel magnetic biochar efficiently sorbs organic pollutants and phosphate[J]. Bioresource Technology, 2011, 102(2): 716-723. DOI:10.1016/j.biortech.2010.08.067 |
| [9] |
Li R, Wang J J, Gaston L A, et al. An overview of carbothermal synthesis of metal-biochar composites for the removal of oxyanion contaminants from aqueous solution[J]. Carbon, 2018, 129: 674-687. DOI:10.1016/j.carbon.2017.12.070 |
| [10] |
Liu S, Tan X, Liu Y, et al. Production of biochars from Ca impregnated ramie biomass[Boehmeria nivea(L.)Gaud.] and their phosphate removal potential[J]. RSC Advance, 2016, 6: 5871-5880. DOI:10.1039/C5RA22142K |
| [11] |
Fang C, Zhang T, Li P, et al. Application of magnesium modified corn biochar for phosphorus removal and recovery from swine wastewater[J]. International Journal of Environmental Research and Public Health, 2014, 11(9): 9217-9237. DOI:10.3390/ijerph110909217 |
| [12] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2008. BAO Shi-dan. Soil agricultural chemistry analysis[M]. Beijing: China Agriculture Press, 2008. |
| [13] |
顾益初, 蒋柏藩. 石灰性土壤无机磷分级的测定方法[J]. 土壤, 1990, 22(2): 101-102, 110. GU Yi-chu, JIANG Bai-fan. Determination of inorganic phosphorus fractionation in calcareous soils[J]. Soil, 1990, 22(2): 101-102, 110. |
| [14] |
Bowman R A, Cole C V. Transformations of organic phosphorus substrates in soils as evaluated by NaHCO3 extraction[J]. Soil Science, 1978, 125(1): 49-54. DOI:10.1097/00010694-197801000-00008 |
| [15] |
李阜棣, 喻子牛, 何绍江. 农业微生物学实验技术[M]. 北京: 中国农业出版社, 1996: 305-306. LI Fu-di, YU Zi-niu, HE Shaojiang. Agro-microbiology experiment technology[M]. Beijing: China Agriculture Press, 1996: 305-306. |
| [16] |
关松荫, 张德生, 张志明. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 260-339. GUAN Song-yin, ZHANG De-sheng, ZHANG Zhi-ming. Soil enzyme and its research method[M]. Beijing: Agriculture Press, 1986: 260-339. |
| [17] |
Zhao R D, Jiang D W, Neil C, et al. Effects of biochar on the acidity of a loamy clay soil under different incubation conditions[J]. Soils Sediments, 2015, 15(9): 1919-1926. DOI:10.1007/s11368-015-1143-1 |
| [18] |
张琪, 方海兰, 黄懿珍, 等. 土壤阳离子交换量在上海城市土壤质量评价中的应用[J]. 土壤, 2005, 37(6): 679-682. ZHANG Qi, FANG Hai-lan, HUANG Yi-zhen, et al. Application of soil CEC to evaluation of soil quality in Shanghai[J]. Soils, 2005, 37(6): 679-682. DOI:10.3321/j.issn:0253-9829.2005.06.020 |
| [19] |
Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresour Technol, 2011, 102(3): 3488-3497. DOI:10.1016/j.biortech.2010.11.018 |
| [20] |
Alghashm S, Qian S, Hua Y, et al. Properties of biochar from anaerobically digested food waste and its potential use in phosphorus recovery and soil amendment[J]. Sustainability, 2018, 10(12): 4692-4703. DOI:10.3390/su10124692 |
| [21] |
高天一, 李娜, 彭靖, 等. 连续施用生物炭对棕壤磷素形态及有效性的影响[J]. 植物营养与肥料学报, 2019, 25(9): 1451-1460. GAO Tian-yi, LI Na, PENG Jing, et al. Effect of consecutive application of biochar on phosphate morphology and availability in brown soil[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(9): 1451-1460. |
| [22] |
张旭辉, 李治玲, 李勇, 等. 施用生物炭对西南地区紫色土和黄壤的作用效果[J]. 草业学报, 2017, 26(4): 63-72. ZHANG Xu-hui, LI Zhi-ling, LI Yong, et al. Effect of biochar amendment on purple and yellow soil[J]. Acta Prataculturae Sinica, 2017, 26(4): 63-72. |
| [23] |
Jiang J, Yuan M, Xu R, et al. Mobilization of phosphate in variablecharge soils amended with biochars derived from crop straws[J]. Soil and Tillage Research, 2015, 146: 139-147. DOI:10.1016/j.still.2014.10.009 |
| [24] |
Rajkovich S, Enders A, Hanley K, et al. Corn growth and nitrogen nutrition after additions of biochars with varying properties to a temperate soil[J]. Biology and Fertility of Soils, 2012, 48(3): 271-284. DOI:10.1007/s00374-011-0624-7 |
| [25] |
Simon K. Effectiveness of biochar use for nitrogen and phosphorus recovery from liquid anaerobic digestate and potential land application[D].Beijing: China Agricultural University, 2017: 10-13.
|
| [26] |
曲博.湿地土壤磷酸酶活性对土壤有机磷形态转化的影响研究[D].北京: 北京林业大学, 2015: 25-27. QU Bo. Researches for influence of phosphatase activity on transformation of soil organic phosphorus in wetland soil[D].Beijing: Beijing Forestry University, 2015: 25-27. |
| [27] |
石文静. 土壤有机磷的研究进展[J]. 安徽农业科学, 2014, 42(33): 11697-11701, 11703. SHI Wen-jing. Research advance in soil organic phosphorus[J]. Journal of Anhui Agricultural Sciences, 2014, 42(33): 11697-11701, 11703. DOI:10.3969/j.issn.0517-6611.2014.33.032 |
| [28] |
和文祥, 谭向平, 王旭东, 等. 土壤总体酶活性指标的初步研究[J]. 土壤学报, 2010, 47(6): 1232-1236. HE Wen-xiang, TAN Xiangping, WANG Xu-dong, et al. Study on total enzyme activity index in soils[J]. Acta Pedologica Sinica, 2010, 47(6): 1232-1236. |
| [29] |
郑慧芬, 吴红慧, 翁伯琦, 等. 施用生物炭提高酸性红壤茶园土壤的微生物特征及酶活性[J]. 中国土壤与肥料, 2019, 280(2): 74-80. ZHENG Hui-fen, WU Hong-hui, WENG Bo-qi, et al. Improved soil microbial characteristics and enzyme activities with wheat straw biochar addition to an acid tea plantation in red soil[J]. Soil and Fertilizer Sciences in China, 2019, 280(2): 74-80. |
| [30] |
Si G, Deluca T H. Wood biochar impacts soil phosphorus dynamics and microbial communities in organically-managed croplands[J]. Soil Biology and Biochemistry, 2018, 126: 144-150. DOI:10.1016/j.soilbio.2018.09.002 |
| [31] |
Akmal M, Gondal T A, Khan K S, et al. Impact of biochar prepared from leaves of populous euphratica on soil microbial activity and mung bean(Vigna radiata)growth[J]. Arabian Journal of Geosciences, 2019, 12(18): 591-599. DOI:10.1007/s12517-019-4724-2 |
| [32] |
李发虎, 李明, 刘金泉, 等. 生物炭对温室黄瓜根际土壤真菌丰度和根系生长的影响[J]. 农业机械学报, 2017, 48(4): 265-270, 341. LI Fa-hu, LI Ming, LIU Jin-quan, et al. Effect of biochar on fungal abundance of rhizosphere soil and cucumber root growth in greenhouse[J]. Transactions of the Chinese Society of Agricultural Machinery, 2017, 48(4): 265-270, 341. |
| [33] |
Liu W, Wang S T, Zhang J, et al. Biochar influences the microbial community structure during tomato stalk composting with chicken manure[J]. Bioresource Technology, 2014, 154(2): 148-154. |
 2021, Vol. 40
2021, Vol. 40