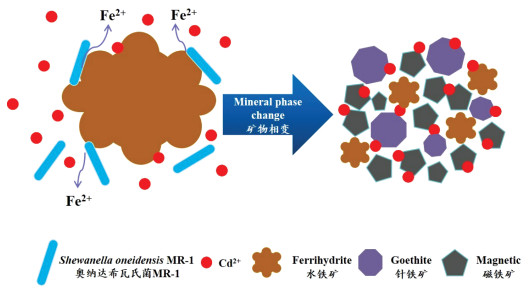
重金属镉(Cd)是环境中常见的污染元素,其可通过植物富集后最终在人体内积累,从而造成人体骨质疏松、脊椎变形等疾病,日本的“痛痛病”事件,就是由于土壤Cd污染造成稻米中重金属大量累积,从而危害人体健康[1-2]。传统的土壤重金属污染修复方法,通常成本昂贵,操作也较为复杂,对大面积低浓度重金属污染的适用性较低,而且大多化学药剂的使用会对土壤造成二次污染。随着微生物学、地球化学、环境科学等学科的交叉研究及不断发展,微生物诱导的矿化技术被逐步应用[3-6],与传统修复方法相比其具有更高的环境友好性与更好的修复效果。
微生物还原铁矿物是诱导次生矿物的主要驱动力,重金属在沉积物和地下水系统中的迁移受到铁氧化物的影响[7]。铁还原菌广泛存在于自然环境中,微生物异化铁还原过程指铁还原菌利用各类有机物为电子供体,以胞外Fe3+为电子受体进行微生物代谢活动,将Fe3+还原成Fe2+的过程。这一过程会加速铁的晶型结构转变形成次生铁矿,如磁铁矿能被Shewanella putrefaciens介导产生绿锈[8];水铁矿会被Shewanella putrefaciens CN32生物矿化转化为针铁矿、磁铁矿及少量绿锈[9];Shewanella oneidensis MR-1在含磷酸盐条件下能将铁氧化物转化为蓝铁矿[10],生物转化产生的次生铁矿与非生物转化来源的铁矿相比,具有更高的比表面积,重金属固定化及其他污染物原位控制效果也更好[11-13]。因此通过添加含Fe3+电子受体的铁矿物刺激铁还原菌的生长活性,促使铁矿晶体结构改变的同时稳定结合重金属,建立一种生物、物理化学技术相互穿插的耦合技术,对有效降低土壤重金属污染,提高污染场地生态恢复能力有重要意义。
尽管对异化铁还原过程已有较多研究,但铁还原微生物对铁矿物结构转化及其产生的次生铁矿对重金属的固定效果、矿化产物的特征及各类影响因素尚未完全揭示。基于此,本研究采用典型铁还原菌S. oneidensis MR-1为供试菌株,研究异化铁还原诱导次生矿物对Cd2+的固定化效果,考察不同影响因素(pH、富里酸、生物炭)对反应体系中铁矿结构转化及对重金属滞-固特性的影响,从而更好地实现Cd2+的增强固定,为重金属污染修复提供新的理论和现实依据。
1 材料与方法 1.1 供试材料药品:氯化镉(CdCl2)纯度99%,购自阿拉丁试剂(上海)有限公司;富里酸(Fulvic acid,FA)纯度95%,购自上海麦克林生化科技有限公司。
水铁矿:Fe(OH)3,40 g Fe(NO)3·9H2O溶于500 mL去离子水中,加入330 mL 1 mol·L-1的KOH,最后20 mL逐滴加入,调节pH为7~8,然后快速搅拌,迅速离心,洗涤除去其电解质,在常温下晾干备用。
赤铁矿:Fe2O3,采集于河北某铁矿区,纯度60%~ 70%。
生物炭:木炭,购自上海海诺炭业有限公司,粒径 < 0.7 mm,孔径15~30 μm。
试验菌种:奥纳达希瓦氏菌MR-1(Shewanella oneidensis MR-1),由中国海洋微生物菌种保存管理中心提供。
菌悬液制备:将S. oneidensis MR-1接种至LB培养基(牛肉膏5.0 g·L-1、蛋白胨10.0 g·L-1、NaCl 5.0 g· L-1),30 ℃、150 r·min-1培养24 h,离心收集菌体,菌体用生理盐水重悬得到菌悬液,菌体浓度为108 CFU· mL-1,备用。
生物炭负载菌剂:将S. oneidensis MR-1接种至LB培养基(牛肉膏5.0 g·L-1、蛋白胨10.0 g·L-1、NaCl 5.0 g·L-1),在30 ℃、150 r·min-1条件下将菌体浓度培养至108 CFU·mL-1,按1∶3的比例(m/V,g/mL)投入灭菌后的生物炭,培养8 h后离心,得到生物炭负载菌剂。
1.2 试验方法试验均在250 mL顶空瓶中进行,200 mL LB培养基121 ℃灭菌20 min,试验接菌量为2 mL,体系中初始菌体浓度为106 CFU·mL-1,充N2后用丁基硅胶盖封口,以保证厌氧环境不受外界干扰,30 ℃、150 r·min-1恒温振荡培养。取样时摇匀样品,用无菌注射器取出部分样品,测定Fe2+与Cd2+浓度。
以培养液在600 nm处的吸收值(OD600)表示S. oneidensis MR-1在不同Cd2+浓度下的生长特征,并转化为细胞数,调节Cd2+浓度为0、1、3、5、10、20 mg· L-1。设置初始Cd2+浓度为5 mg·L-1,铁矿添加量2 g,采用水铁矿与赤铁矿进行微生物转化Cd2+稳定化试验,试验材料均在121 ℃灭菌20 min,同时设置纯铁矿吸附为对照。
影响因素设置:采用0.1 mol·L-1 HCl溶液调节初始pH,由于碱性条件下Cd2+会发生化学沉淀,因此未设置碱性初始pH。设置初始pH为4.0、5.0、6.0、7.0;富里酸(FA)添加浓度为10、20 mg·L-1。
电化学循环伏安法对水铁矿在微生物还原作用下的电子得失能力进行表征,对试验固相进行X射线衍射(XRD)和X射线光电子能谱(XPS)分析。
1.3 分析测定方法Fe2+测定:邻菲罗啉分光光度法测定,样品经4 000 r·min-1离心10 min后过0.22 μm滤膜得到滤液,吸取1 mL滤液与9 mL去离子水置于比色管中,依次加入pH 5.0缓冲溶液5 mL、0.2 mol·L-1邻菲罗啉显色剂1 mL,摇匀放置5 min,吸收波长510 nm处测定(723PC紫外分光光度计,上海菁华科技仪器有限公司)。
Cd2+测定:样品经4 000 r·min-1离心10 min后过0.22 μm滤膜得到滤液,0.5 mol·L-1 HNO3稀释定容后用电感耦合等离子体光谱仪测定(电感耦合等离子体光谱仪iCAP6300,美国Thermo Fisher),测定波长228.8 nm。
铁矿物电子传递能力测试:样品滤液快速移至杯中,在N2保护下采用传统电化学三电极体系进行CV扫描(CHI-660E型电化学工作站,上海辰华仪器有限公司)。工作电极为碳毡电极,对电极为铂丝电极,参比电极为饱和甘汞电极。扫描范围为-0.8~0.8 V,扫描速率为20 mV·s-1。
XPS测试:样品溶液经8 000 r·min-1离心10 min得到沉淀,将沉淀用去离子水清洗3次后进行真空冷冻干燥得到固体粉末,粉末压实后上机测定(XPS Thermo Fisher ESCALAB250),X射线激发源为单色AI Ka(hν= 1 486.6 eV),功率150 W,X射线数斑500 μm。
XRD测试:XRD TTR-Ⅲ(日本理学),工作波长为CuKa线(λ=0.154 17 nm),工作电压40 kV,工作电流200 mA,扫描速度8 °·min-1。
1.4 数据处理试验均重复3次,处理结果均以平均值±标准差表示,相关数据分析采用Excel和Origin 9.0软件处理。
2 结果与分析 2.1 S. oneidensis MR-1生长特性及其对Cd2+的耐受性S. oneidensis MR-1在不同初始Cd2+浓度下的生长曲线如图 1所示。未添加Cd2+的情况下,菌种12 h后进入快速生长期,12~48 h为其对数生长期,48 h菌体浓度达到1.0×108 CFU·mL-1,持续培养144 h后稳定在1.68×108 CFU·mL-1。添加不同初始浓度Cd2+进入体系后,细菌生长受到一定程度的抑制,单位毫升的细菌个数呈现不同程度的降低,受抑制程度与添加的Cd2+浓度成正比。初始Cd2+浓度为20 mg·L-1的体系中,持续培养144 h后菌体浓度亦能达到1.0×108 CFU·mL-1以上。

|
图 1 不同Cd2+浓度下S. oneidensis MR-1的生长曲线 Figure 1 Growth curves of S. oneidensis MR-1 at different concentrations of Cd2+ |
S. oneidensis MR-1在20 mg·L-1 Cd2+浓度范围内耐受性良好,随着Cd2+浓度增加,其进入对数生长期的时间会略有延迟。
2.2 S. oneidensis MR-1还原铁矿物诱导次生矿物对Cd2+的固定微生物还原水铁矿过程中Fe2+与Cd2+浓度的变化如图 2所示。未接种S. oneidensis MR-1的矿物体系中,矿物自身对Cd2+的吸附相对较少,溶液中Cd2+浓度较高,为2.84 mg·L-1,24 h后基本稳定在2.71 mg· L-1;接种S. oneidensis MR-1后,溶液中Cd2+浓度在12 h后逐渐下降,144 h后逐渐稳定在0.86 mg·L-1。对体系中的Fe2+测定发现,在未接种S. oneidensis MR-1的矿物体系中,由于水铁矿不溶于水,试验过程中Fe2+浓度均低于检出限;接种S. oneidensis MR-1后,Fe2+浓度随时间变化不断增加,在0~36 h缓慢上升达到3.36 mg·L-1,36~48 h增长最快,在288 h达到37.6 mg· L-1,这与微生物生长特性相似,表明S. oneidensis MR-1可以使水铁矿发生溶解并被还原。

|
图 2 S. oneidensis MR-1还原水铁矿过程中Cd2+及Fe2+浓度变化 Figure 2 Concentration changes of Cd2+ and Fe2+ during S. oneidensis MR-1 reduction of ferrihydrite |
微生物还原赤铁矿过程中Fe2+与Cd2+浓度变化如图 3所示。未接种S. oneidensis MR-1的矿物体系中,赤铁矿自身对Cd2+的吸附较少,溶液中Cd2+浓度较高,12 h时为3.27 mg·L-1,48 h后稳定在2.23 mg·L-1;加入S. oneidensis MR-1后,溶液中Cd2+浓度在24 h后逐渐下降,96 h时为0.18 mg·L-1,288 h后溶液中Cd2+浓度仅为0.03 mg·L-1。未接种S. oneidensis MR-1的矿物体系中Fe2+浓度均低于检出限,加入S. oneidensis MR-1后,Fe2+浓度随时间变化不断增加,在0~24 h缓慢上升达到2.35 mg·L-1,24~36 h增长最快,在288 h达到23.86 mg·L-1,这与在水铁矿试验中的研究结果相似,表明S. oneidensis MR-1也可以使赤铁矿发生溶解并被还原。

|
图 3 S. oneidensis MR-1还原水铁矿过程中Cd2+及Fe2+浓度变化 Figure 3 Concentration changes of Cd2+ and Fe2+ during S. oneidensis MR-1 reduction of ferrihydrite |
在水铁矿与赤铁矿的微生物还原试验中,Fe2+与Cd2+浓度呈显著负相关,表明S. oneidensis MR-1可能通过促进铁矿物还原过程中的晶型结构转化,从而增强其对Cd2+的吸附固定。
2.3 初始pH对S. oneidensis MR-1还原铁矿物介导Cd2+固定的影响初始pH对S. oneidensis MR-1还原铁矿物介导Cd2+固定影响的试验中Fe2+与Cd2+浓度的变化如图 4所示。酸性条件下Cd2+吸附固定量相对较多,在初始pH 5.0的接种处理中Cd2+固定效果最好,在24~60 h内快速下降,120 h后溶液中Cd2+浓度低于检出限,但初始pH 4.0时矿物对Cd2+固定量较少,288 h时溶液中Cd2+浓度为1.93 mg·L-1。水铁矿在酸性条件下的溶出使溶液中Fe2+浓度迅速增加,12 h内Fe2+浓度便达到7.05 mg·L-1左右,初始pH 5.0时,试验体系中Fe2+浓度在288 h后积累到70.9 mg·L-1,而初始pH为6.0时,试验体系中Fe2+浓度最终达到59.3 mg·L-1,均高于初始pH 7.0体系中的Fe2+浓度(37.6 mg·L-1),表明酸性条件更利于S. oneidensis MR-1对铁矿物的还原,但初始pH 4.0时Fe2+浓度在288 h时仅为11.6 mg· L-1。酸性条件下Fe2+浓度增长符合S. oneidensis MR-1生长及铁还原特性。

|
图 4 不同初始pH条件下S. oneidensis MR-1还原水铁矿过程中Cd2+及Fe2+浓度变化 Figure 4 Concentration changes of Cd2+ and Fe2+ during S. oneidensis MR-1 reduction of ferrihydrite under different initial pH |
初始pH为5.0时Fe2+还原溶解速率略快于pH为6.0时,这与Cd2+浓度下降速率相一致,证明酸性条件下S. oneidensis MR-1促进了水铁矿的晶型结构转化,进而增强其对Cd2+的固定,但较低pH值抑制了S. oneidensis MR-1的生长,导致矿物对Cd2+的固定量减少。
2.4 FA对S. oneidensis MR-1还原铁矿诱导次生矿物固定Cd2+的影响添加不同浓度FA时,S. oneidensis MR-1诱导次生矿物固定Cd2+试验中Fe2+与Cd2+浓度变化如图 5所示。随着FA添加浓度的增加,试验体系中Cd2+浓度在反应初期下降缓慢,可能是过高的FA抑制了铁矿物对Cd2+的吸附。随着试验进行,Cd2+浓度下降速率加快,最终Cd2+固定量相较无FA试验体系略有提升,288 h后初始FA为10 mg·L-1和20 mg·L-1溶液中的Cd2+浓度分别为0.65 mg·L-1和0.60 mg·L-1。添加FA后Fe3+还原过程明显增强,尤其在0~48 h增速明显变快,添加10 mg·L-1 FA的处理中,12 h后Fe2+浓度达到4.75 mg·L-1,添加20 mg·L-1 FA的处理中12 h后Fe2+浓度达到7.67 mg·L-1,48 h时达到了24.39 mg·L-1,而水铁矿+20 mg·L-1 FA处理中Fe2+浓度仅在12 h时检测为1.07 mg·L-1,其余时间均低于检出限,表明该试验中FA在S. oneidensis MR-1还原铁矿物时主要作为电子穿梭体,S. oneidensis MR-1可通过其将电子传递给胞外的不可溶性Fe3+进行还原,从而加快了电子传递速率。

|
图 5 不同浓度富里酸作用下S. oneidensis MR-1还原水铁矿过程中Cd2+及Fe2+浓度变化 Figure 5 Concentration changes of Cd2+ and Fe2+ during S. oneidensis MR-1 reduction of ferrihydrite under different concentrations of fulvic acid |
FA作为电子穿梭体,能促进微生物对水铁矿的还原,但效果不显著,溶液中Fe2+浓度增加较少,诱导次生矿物固定Cd2+的效果不明显。
2.5 生物炭对S. oneidensis MR-1还原铁矿诱导次生矿物固定Cd2+的影响生物炭负载S. oneidensis MR-1诱导次生矿物固定Cd2+试验中Fe2+与Cd2+浓度变化如图 6所示。生物炭负载MR-1吸附Cd2+对照体系中,Cd2+浓度在24 h后稳定在2.21 mg·L-1,而生物炭负载MR-1+水铁矿体系中Cd2+浓度持续下降,216 h后逐渐稳定在0.58 mg·L-1,比单一生物炭负载MR-1或水铁矿体系的Cd2+固定效果提高。生物炭负载MR-1反应体系中Fe2+浓度均低于检出限,生物炭负载MR-1+水铁矿体系的溶液中Fe2+浓度在0~60 h内先增后减,60 h之后Fe2+浓度低于检测限。

|
图 6 生物炭负载S. oneidensis MR-1还原水铁矿过程中Cd2+及Fe2+浓度变化 Figure 6 Concentration changes of Cd2+ and Fe2+ during S. oneidensis MR-1 reduction of ferrihydrite under bacteria inoculated biochar |
生物炭是一种富碳的多孔材料,其孔隙结构适合微生物居住,负载在生物炭上的S. oneidensis MR-1生长旺盛,铁还原活性强,相比微生物直接诱导次生矿物有更好的Cd2+固定效果,但溶液中Fe2+浓度较低。
2.6 S. oneidensis MR-1还原铁矿物诱导次生矿物固定Cd2+的XRD分析微生物还原铁氧化物矿物诱导次生铁矿物固定Cd2+的XRD图谱如图 7a和图 7b。水铁矿是一种弱结晶的铁氢氧化物,晶型较差,其XRD图谱峰少且宽,反应后产物固相在26.7°、14.1°、27.0°等处检测出更明显的衍射峰,经过Jade物相检索与相关文献比对[14],确定衍射峰对应的物质为针铁矿和磁铁矿。随着试验进行,悬浮液的颜色变深,最终部分铁矿粉末也能被磁铁吸引,且颜色为黑色,可能是磁铁矿。赤铁矿反应后在26.7°的衍射峰增强,对应物质为正方针铁矿,68.2°产生了磁铁矿衍射峰,且33.1°的赤铁矿峰变强,可能是部分赤铁矿结构转化的重结晶导致,表明铁矿物还原的过程中产生了晶型较好的次生矿物。

|
磁:磁铁矿 针:针铁矿 赤:赤铁矿 图 7 S. oneidensis MR-1还原铁矿物前后(0 h和288 h)的固相XRD图 Figure 7 XRD patterns of S. oneidensis MR-1 reduction of ferrihydrite solid sample taken at 0 h and 288 h |
添加20 mg·L-1 FA对MR-1还原铁介导的水铁矿晶型结构转化通过XRD表征,如图 7c所示。反应前的水铁矿XRD图中没有其他衍射峰,而反应288 h后在33.1°产生了赤铁矿峰,在35.6°和62.2°产生了磁铁矿峰;相对未添加FA的微生物介导铁转化试验而言没有产生针铁矿,而产生了赤铁矿,且磁铁矿峰比未添加FA生物铁转化试验更强,表明添加FA产生的磁铁矿含量、纯度和结晶度更高,进一步增强了Cd2+的固定。
为了进一步验证生物炭负载MR-1对水铁矿晶型结构转化的影响,体系中矿物的结晶状态通过XRD表征,如图 7d所示。图谱峰经过Jade物相检索表明,在多个位置检测出CaCO3峰,说明此生物炭内富含CaCO3,反应后在26.7°与39.2°处检测出针铁矿峰,反应产物也能被磁铁吸引,表明产生了次生铁矿——针铁矿与磁铁矿。
2.7 S. oneidensis MR-1还原铁矿物诱导次生矿物固定Cd2+的电化学及XPS分析利用电化学循环伏安法表征铁矿物的氧化还原特性及S. oneidensis MR-1不同生长时期对铁氧化物矿物的还原能力,结果如图 8a所示。反应0 h时未发现氧化还原峰,12 h之后在0.10 V和-0.26 V左右出现Fe2+和Fe3+氧化还原峰,48 h时其氧化还原峰最大,表明此时铁氧化还原速率相对较快,这与S. oneidensis MR-1菌株生长特性相符。S. oneidensis MR-1对铁矿物有还原作用,铁矿物结构中氧化态铁作为电子受体被还原得到Fe2+生成物,水铁矿体现出较好的氧化还原活性。

|
图 8 S. oneidensis MR-1还原水铁矿的循环伏安曲线及固相产物的XPS分析 Figure 8 Cyclic voltammetry curves of S. oneidensis MR-1 reduction of ferrihydrite and XPS analysis of solid phase |
微生物还原水铁矿诱导次生矿物试验中固相产物XPS全谱结果如图 8b所示。反应前后的XPS结果表明(图 8c),固相产物O1s轨道峰Me—O峰面积比明显增加,这可能是由于生成磁铁矿及针铁矿产生了更多的Fe—O键,以及Cd2+在次生铁矿成矿过程中取代Fe形成了Cd—O键[15];且288 h时固相Cd3d轨道峰中Cd—O峰面积比较高(图 8d),表明与矿物的表面吸附Cd2+相比,形成Cd—O键固定才是固相产物中Cd2+的主要固定方式。一方面S. oneidensis MR-1菌体表面丰富的官能团可以形成Cd—O键,另一方面体系中产生的次生铁矿——针铁矿,其表面产生的大量羟基点位,也是Cd—O键的主要来源[12, 16]。上述结果表明,次生铁矿晶型结构转化提供了更多的吸附点位,从而增强了Cd2+的固定,微生物诱导次生铁矿的形成在Cd2+固定中发挥了重要作用。
3 讨论铁氧化物是环境中重金属的主要汇聚处,铁的生物转化与循环是土壤中一个重要的循环过程,利用异化铁还原过程加以引导,诱导产生次生矿物吸附重金属能更有效降低其生物有效性。YUAN等[14]的研究表明,在微生物还原铁的过程中,可以通过次生铁氧化物和微生物细胞的吸附来固定较低浓度的Cd2+。MENG等[17]探究得出针铁矿与S. oneidensis MR-1及电子穿梭体AQDS的协同作用能有效降低铬的生物有效性,从而更好地控制铬在地下环境中的迁移和固定。BURTON等[18]发现微生物还原Fe3+以及随后生成Fe2+可以诱导形成次生铁矿,这可能会改变Sb的形态和分配,导致其掺入新形成的次生铁矿中。在此基础上,本研究深入探讨了铁矿物和S. oneidensis MR-1体系中Cd2+的增强固定机理,由于Cd2+对微生物细胞的毒性[19-20],使细菌生长受到一定程度抑制;采用的铁矿为不溶性铁矿,但在添加S. oneidensis MR-1条件下,发现铁矿能被异化铁还原作用还原溶解出Fe2+,这与此前的研究结果一致[21],最终异化铁还原诱导产生次生铁矿对Cd2+进行固定;与铁氧化物表面吸附相比,次生铁矿晶型结构转化提供了更多的吸附点位,具备更强的固定效果,这与大多数重金属及各类元素地球化学和铁矿物学之间的耦合作用相似[22]。
环境pH以及各类腐殖质影响着自然界中铁矿物的演化,从而导致金属络合和吸附到矿物表面的能力发生变化[23]。本研究发现在酸性环境中,微生物还原铁的动力学特性及产生次生铁矿的晶型结构均有所变化,这是由于生物铁还原过程是一个质子消耗过程[24-25],较低pH也对S. oneidensis MR-1菌种的细胞特性(如细菌生长、胞外电子转移等)有一定影响[26],进而影响Cd2+的固定效率。FA对铁矿生物转化过程有重要影响,本研究中添加FA促进了Fe3+还原过程并加强了Cd2+的固定,这可能是由于FA主要作为电子穿梭体,并且其在成矿过程中可调控铁还原菌铁转运相关基因的表达,从而促进次生矿物成矿效率[27-28]。生物炭作为一种重金属修复剂,具有吸附重金属的能力,且可以降低土壤中重金属的迁移率和生物可利用性,此外,生物炭负载微生物已被证明是有效的环境修复手段[29-30],可作为微生物的“定殖场所” [31]。本试验中生物炭改变了铁还原菌在试验体系中的生长环境,虽然微生物还原水铁矿产生的Fe2+被生物炭强吸附[32],游离到溶液中极少,但较微生物直接诱导次生矿物有更好的Cd2+固定效果。值得注意的是,铁还原的时间、速率以及环境中有机质等不稳定的各类物质,这些特殊因素相互影响,对次生铁矿的形成过程起主要作用。
本研究利用电化学方法对微生物还原条件下铁矿物氧化还原特性进行表征,发现铁矿能接受铁还原菌的电子转移,这是铁矿物可以被微生物还原的电化学基础[33],且氧化还原性质与铁还原菌生长特性一致。近期研究表明[34],促进铁还原菌与铁矿物之间的电子转移会强化次生矿物的结晶。试验通过XRD与XPS表征铁矿物的晶型结构发现,次生矿物更高的含量和结晶度能增强重金属的固定,这为揭示微生物矿化菌与钝化材料的耦合作用及更好地实现土壤重金属的固定提供了科学依据。
4 结论(1)菌株S. oneidensis MR-1能还原铁矿物诱导产生次生矿物固定Cd2+,与铁矿自身吸附相比,次生铁矿有更好的Cd2+固定效果。
(2)酸性条件(pH≥5.0)、添加富里酸及使用生物炭负载微生物均能促进菌株S. oneidensis MR-1对铁矿物的转化,进而增强Cd2+的固定。
(3)铁氧化物矿物作为电子受体接受S. oneidensis MR-1的电子传递而被还原,铁矿物的晶型结构转变提供了更多的吸附点位,增强了Cd2+的固定。
| [1] |
LUO J S, HUANG J, ZENG D L, et al. A defensin-like protein drives cadmium efflux and allocation in rice[J]. Nature Communications, 2018, 9(1): 1-28. DOI:10.1038/s41467-017-02088-w |
| [2] |
周建军, 周桔, 冯仁国. 我国土壤重金属污染现状及治理战略[J]. 中国科学院院刊, 2014, 29(3): 315-320, 350. ZHOU J J, ZHOU J, FENG R G. Status of China's heavy metal contamination in soil and its remediation strategy[J]. Bulletin of Chinese Academy of Sciences, 2014, 29(3): 315-320, 350. |
| [3] |
ZHANG J, KUMARI D, FANG C, et al. Combining the microbial calcite precipitation process with biochar in order to improve nickel remediation[J]. Applied Geochemistry, 2019, 103: 68-71. DOI:10.1016/j.apgeochem.2019.02.011 |
| [4] |
WANG Q, WEI Z, YI X, et al. Biogenic iron mineralization of polyferric sulfate by dissimilatory iron reducing bacteria: Effects of medium composition and electric field stimulation[J]. Science of the Total Environment, 2019, 684: 466-475. DOI:10.1016/j.scitotenv.2019.05.322 |
| [5] |
LIU R, LIAN B. Immobilisation of Cd(Ⅱ)on biogenic and abiotic calcium carbonate[J]. Journal of Hazardous Materials, 2019, 378: 120707. DOI:10.1016/j.jhazmat.2019.05.100 |
| [6] |
党政, 代群威, 赵玉连, 等. 生物矿化在重金属污染治理领域的研究进展[J]. 环境科学研究, 2018, 31(7): 1182-1192. DANG Z, DAI Q W, ZHAO Y L, et al. Research progress of biomineralization in the treatment of heavy metal contamination[J]. Research of Environmental Sciences, 2018, 31(7): 1182-1192. |
| [7] |
LOVLEY D R, HOLMES D E, NEVIN K P, et al. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ)reduction[J]. Advances in Microbial Physiology, 2004, 49: 219-286. |
| [8] |
ETIQUE M, JORAND F P A, RUBY C. Magnetite as a precursor for green rust through the hydrogenotrophic activity of the iron-reducing bacteria Shewanella putrefaciens[J]. Geobiology, 2016, 14(3): 237-254. DOI:10.1111/gbi.12170 |
| [9] |
HANSEL C M, BENNER S G, NEISS J, et al. Secondary mineralization pathways induced by dissimilatory iron reduction of ferrihydrite under advective flow[J]. Geochimica et Cosmochimica Acta, 2003, 67(16): 2977-2992. DOI:10.1016/S0016-7037(03)00276-X |
| [10] |
MUEHE E M, MORIN G, SCHEER L, et al. Arsenic(Ⅴ)incorporation in vivianite during microbial reduction of arsenic(Ⅴ)-bearing biogenic Fe(Ⅲ)(oxyhydr)oxides[J]. Environmental Science & Technology, 2016, 50(5): 2281-2291. |
| [11] |
MUEHE E M, SCHEER L, DAUS B, et al. Fate of arsenic during microbial reduction of biogenic versus a biogenic As-Fe(Ⅲ)-mineral coprecipitates[J]. Environmental Science & Technology, 2013, 47(15): 8297-8307. |
| [12] |
LI C C, YI X, DANG Z, et al. Fate of Fe and Cd upon microbial reduction of Cd-loaded polyferric flocs by Shewanella oneidensis MR-1[J]. Chemosphere, 2016, 144: 2065-2072. DOI:10.1016/j.chemosphere.2015.10.095 |
| [13] |
SUN J L, WEI L, YIN R, et al. Microbial iron reduction enhances insitu control of biogenic hydrogen sulfide by FeOOH granules in sediments of polluted urban waters[J]. Water Research, 2020, 171: 115453. DOI:10.1016/j.watres.2019.115453 |
| [14] |
YUAN C, LIU T, LI F, et al. Microbial iron reduction as a method for immobilization of a low concentration of dissolved cadmium[J]. Journal of Environmental Management, 2018, 217: 747-753. DOI:10.1016/j.jenvman.2018.04.023 |
| [15] |
BALTRUSAITIS J, CWIERTNY D M, GRASSIAN V H. Adsorption of sulfur dioxide on hematite and goethite particle surfaces[J]. Physical Chemistry Chemical Physics, 2007, 9(41): 5542-5554. DOI:10.1039/b709167b |
| [16] |
WEBER K A, ACHENBACH L A, COATES J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction[J]. Nature Reviews Microbiology, 2006, 4(10): 752-764. |
| [17] |
MENG Y, ZHAO Z, BURGOS W D, et al. Iron(Ⅲ)minerals and anthraquinone-2, 6-disulfonate(AQDS)synergistically enhance bioreduction of hexavalent chromium by Shewanella oneidensis MR-1[J]. Science of the Total Environment, 2018, 640/641: 591-598. DOI:10.1016/j.scitotenv.2018.05.331 |
| [18] |
BURTON E D, HOCKMANN K, KARIMIAN N, et al. Antimony mobility in reducing environments: The effect of microbial iron(Ⅲ) -reduction and associated secondary mineralization[J]. Geochimica et Cosmochimica Acta, 2019, 245: 278-289. DOI:10.1016/j.gca.2018.11.005 |
| [19] |
司友斌, 王娟. 异化铁还原对土壤中重金属形态转化及其有效性影响[J]. 环境科学, 2015, 36(9): 3533-3542. SI Y B, WANG J. Influence of dissimilatory iron reduction on the speciation and bioavailability of heavy metals in soil[J]. Environmental Sciences, 2015, 36(9): 3533-3542. |
| [20] |
JEONG S, MOON H S, SHIN D, et al. Survival of introduced phosphate-solubilizing bacteria(PSB)and their impact on microbial community structure during the phytoextraction of Cd-contaminated soil[J]. Journal of Hazardous Materials, 2013, 263: 441-449. DOI:10.1016/j.jhazmat.2013.09.062 |
| [21] |
司友斌, 孙林, 王卉. Shewanella oneidensis MR-1对针铁矿的还原与汞的生物甲基化[J]. 环境科学, 2015, 36(6): 2252-2258. SI Y B, SUN L, WANG H. Effects of dissimilatory reduction of goethite on mercury methylation by Shewanella oneidensis MR-1[J]. Environmental Sciences, 2015, 36(6): 2252-2258. |
| [22] |
TAO L, ZHU Z K, LI F B, et al. Fe(Ⅱ) /Cu(Ⅱ)interaction on goethite stimulated by an iron-reducing bacteria Aeromonas Hydrophila HS01 under anaerobic conditions[J]. Chemosphere, 2017, 187: 43-51. DOI:10.1016/j.chemosphere.2017.08.075 |
| [23] |
LIU D, ZHANG Q, WU L, et al. Humic acid-enhanced illite and talc formation associated with microbial reduction of Fe(Ⅲ)in nontronite[J]. Chemical Geology, 2016, 447: 199-207. DOI:10.1016/j.chemgeo.2016.11.013 |
| [24] |
FROMMICHEN R, WENDT-POTTHOFF K, FRIESE K, et al. Microcosm studies for neutralization of hypolimnic acid mine pit lake water (pH 2.6)[J]. Environmental Science & Technology, 2004, 38(6): 1877-1887. |
| [25] |
BENNER S G, HANSEL C M, WIELINGA B W, et al. Reductive dissolution and biomineralization of iron hydroxide under dynamic flow conditions[J]. Environmental Science & Technology, 2002, 36(8): 1705-1711. |
| [26] |
YANG C Y, ZHAO C, YANG Y Y, et al. Increase of riboflavin biosynthesis underlies enhancement of extracellular electron transfer of Shewanella in alkaline microbial fuel cells[J]. Bioresource Technology, 2013, 130(2): 763-768. |
| [27] |
KULKARNI H V, MLADENOV N, MCKNIGHT D M, et al. Dissolved fulvic acids from a high arsenic aquifer shuttle electrons to enhance microbial iron reduction[J]. Science of the Total Environment, 2018, 615: 1390-1395. DOI:10.1016/j.scitotenv.2017.09.164 |
| [28] |
WANG S, WU Y, AN J, et al. Geobacter autogenically secretes fulvic acid to facilitate the dissimilated iron reduction and vivianite recovery[J]. Environmental Science and Technology, 2020, 54(17): 10850-10858. DOI:10.1021/acs.est.0c01404 |
| [29] |
CHEN H, TANG L, WANG Z, et al. Evaluating the protection of bacteria from extreme Cd(Ⅱ)stress by P-enriched biochar[J]. Environmental Pollution, 2020, 263: 114483. DOI:10.1016/j.envpol.2020.114483 |
| [30] |
WU C, AN W, LIU Z, et al. The effects of biochar as the electron shuttle on the ferrihydrite reduction and related arsenic(As)fate[J]. Journal of Hazardous Materials, 2019, 390: 121391. |
| [31] |
CHEN T, JING W, FENG G, et al. Biochar and bacteria inoculated biochar enhanced Cd and Cu immobilization and enzymatic activity in a polluted soil[J]. Environment International, 2020, 137: 105576. DOI:10.1016/j.envint.2020.105576 |
| [32] |
张又弛, 李会丹. 生物炭对土壤中铁生物还原作用和重金属分布的影响[J]. 环境污染与防治, 2019, 41(4): 377-381. ZHANG Y C, LI H D. Effects of biochar on biological iron reduction and metal distribution in soils[J]. Environmental Pollution & Control, 2019, 41(4): 377-381. |
| [33] |
丁竑瑞, 李艳, 王鑫, 等. 微生物还原铁氧化物矿物的电化学研究[J]. 矿物岩石地球化学通报, 2011, 30(3): 299-303, 310. DING H R, LI Y, WANG X, et al. Electrochemical research on iron oxide minerals reduction by microorganisms[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2011, 30(3): 299-303, 310. DOI:10.3969/j.issn.1007-2802.2011.03.009 |
| [34] |
WU Y, WANG C, WANG S, et al. Graphite accelerate dissimilatory iron reduction and vivianite crystal enlargement[J]. Water Research, 2021, 189: 116663. DOI:10.1016/j.watres.2020.116663 |
 2021, Vol. 40
2021, Vol. 40


